Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une technique simplifiée pour
Dans cet article
Résumé
Le document décrit une technique simplifiée pour la cornée d'accise et d'éviscérer les tissus rétiniens du globe oculaire de l'homme donneurs cadavériques. La technique décrite ici aidera à accises tissus de bonne qualité pour être utilisés aux fins de transplantation, la chirurgie ou de recherche sans endommager les autres tissus du globe oculaire.
Résumé
Énucléation est le processus de récupération du globe oculaire à partir d'un donneur décédé en laissant le reste du globe non perturbé. Excision se réfère à la récupération des tissus oculaires, en particulier la cornée, en le coupant distinct du globe oculaire. L'éviscération est le processus d'élimination des organes internes visés ici que la rétine. Le globe oculaire est constitué de la cornée, la sclère, le corps vitré, la lentille, l'iris, la rétine, la choroïde, etc muscles (figure Suppl. 1). Quand un patient souffre de lésions de la cornée, la cornée doit être retiré et une saine doit être transplanté par des cabinets de kératoplastique. Troubles génétiques ou des malformations dans la fonction rétinienne peut compromettre la vision. Globes oculaires de l'homme peut être utilisé pour diverses procédures chirurgicales telles que la banque des yeux, la transplantation de la cornée humaine ou de la sclérotique et de la recherche sur les tissus oculaires. Cependant, il ya peu d'informations disponibles sur l'excision de la cornée et la rétine humaine, probablement due à la ll'accessibilité imited aux tissus humains. La plupart des études décrivant les procédures similaires sont effectuées sur des modèles animaux. Les chercheurs comptent sur la disponibilité des tissus oculaires bien disséquées et très bien conservée afin d'étendre les connaissances sur le développement œil humain, l'homéostasie et de la fonction. Comme nous recevons grande quantité de globes oculaires dont environ 40% (tableau 1) d'entre eux sont utilisés à des fins de recherche, nous sommes en mesure d'effectuer énorme quantité d'expériences sur ces tissus, la définition des techniques à l'accise et de les préserver régulièrement.
La cornée est un tissu avasculaire qui permet la transmission de la lumière sur la rétine et à cette fin devrait toujours maintenir un bon degré de transparence. Dans la cornée, la région du limbe, qui est un réservoir de cellules souches, aide à la reconstruction des cellules épithéliales et limite la prolifération de la conjonctive maintien de la transparence de la cornée et la clarté. La taille et la e ickness de la cornée sont essentiels pour une vision claire, des changements dans l'un d'eux pourrait conduire à distraire, vision floue. La cornée est composée de 5 couches; a) l'épithélium, b) la couche de Bowman, c) stroma, d) la membrane de Descemet et e) l'endothélium. Toutes les couches doivent fonctionner correctement pour assurer une vision claire 4,5,6. La choroïde est la tunique intermédiaire entre la sclérotique et la rétine, délimitée à l'intérieur par la membrane de Bruch et est responsable de la circulation sanguine dans l'œil. La choroïde contribue également à réguler la température la nourriture et des fournitures pour les couches externes de la rétine 5,6. La rétine est une couche de tissu nerveux qui couvre le dos du globe oculaire (Figure Suppl. 1) et se compose de deux parties: une partie photoréceptrice et une partie non-réceptifs. La rétine permet de recevoir la lumière de la cornée et le cristallin et le convertit en énergie chimique éventuellement transmis au cerveau avec l'aide du nerf optique 5,6. ove_content "> Le but de ce document est de fournir un protocole pour la dissection des tissus de la cornée et la rétine de globes oculaires de l'homme. Éviter la contamination croisée avec des tissus adjacents et en préservant l'intégrité ARN est d'une importance fondamentale que ces tissus sont indispensables à des fins de recherche visant à (i) la caractérisation du transcriptome des tissus oculaires, (ii) l'isolement de cellules souches pour des projets de médecine régénérative, et (iii) l'évaluation des différences histologiques entre les tissus normaux de / touchée sujets. Dans cet article, nous décrivons la technique que nous utilisons actuellement pour éliminer la cornée, la choroïde et la rétine des tissus à partir d'un globe oculaire. Ici nous fournissons un protocole détaillé pour la dissection du globe oculaire humaine et l'excision des tissus de la cornée et la rétine. La vidéo d'accompagnement aidera les chercheurs à en apprendre une technique appropriée pour la récupération de précieux tissus humains, qui sont difficiles à trouver régulièrement.
Protocole
1. Dans excision in situ de la cornée à partir de globes oculaires
- Allumez la hotte à flux laminaire de l'air environ 15 minutes avant utilisation. Nettoyer la hotte à flux laminaire en utilisant 70% d'alcool isopropylique. Mettre des vêtements de protection individuelle tels que bonnet de chirurgien et le masque. Frotter les mains et les avant-bras et sécher avec une serviette stérile. Porter des gants stériles et une blouse ou des manchons en utilisant une technique aseptique.
- Mettre en place le champ stérile en plaçant un plateau instrument stérile de façon aseptique. Vérifiez que les instruments sont stériles. Ouvrez l'emballage stérile des instruments et retourner sur le champ stérile en évitant toute contamination.
- Placez tous les matériaux et des instruments stériles (tableau 2) ainsi que des bouteilles (pots oculaires) contenant globes oculaires afin qu'ils soient à proximité du bord du champ stérile pour la facilité d'utilisation.
- Étiquetez les bouteilles avec la préservation préalablement préparé / support de stockage comme indiqué dans le tableau 3 et placez lem sur la surface de la hotte à écoulement laminaire d'air le long d'I-PVP (polyvinylpyrrolidone iodée-), le thiosulfate de sodium et une solution saline stérile PBS (solution saline de tampon phosphate).
- Autoriser les tissus oculaires et des solutions pour atteindre la température ambiante normale car ils sont conservés dans des réfrigérateurs à 4 ° C. Eviter de multiplier les réchauffement / refroidissement des cycles. Gardez les couvercles de la solution et les bocaux avec les yeux face intérieure tournée vers le haut à côté de leurs pots respectifs.
- Retirer gazes et les éponges de la jarre œil en utilisant des pinces stériles. Plongez dans le monde stérile I-PVP 0,5% pendant 2 minutes pour décontaminer les globes oculaires. Placer les deux pinces sur le couvercle du bac stérile, en dehors du champ stérile. Transfert du globe en thiosulfate de sodium 0,1% pendant 1 minute en utilisant une autre paire de pinces stériles. En utilisant les mêmes pinces, transférer le globe à la bouteille contenant une solution saline stérile (PBS) et le laisser jusqu'à ce qu'il soit exploité. Répétez la même procédure pour le globe oculaire d'autres à partir de til même donneur.
- De travail sous la hotte à flux laminaire de l'air, envelopper le monde entier en utilisant une gaze stérile (bandages), laissant la cornée et d'environ 5 mm sclérotique de la cornée à découvert. L'ampoule œil pouvait être simplement tenu à la main en maintenant la pression adéquate. Le tissu doit être maintenue humide durant toute l'opération.
- Les forceps sont utilisés avec des ciseaux pour enlever tous les restes éventuels de la conjonctive. Gardez les instruments utilisés pour l'opération ci-dessus séparée des autres instruments. Utilisation d'une lame de scalpel pour effectuer une incision sclérale de 3-4 mm de la région limbe, puis l'incision s'étend de 360 °, en évitant de perforer le tissu sous-jacent ou uvéal provoquer une déformation de courbure normale de la cornée. Couper quatre incisions de grandes lacunes en laissant quatre petites en évitant la sécrétion du corps vitré. Tous les quatre lacunes sont coupés assurer aucun enlèvement de tout autre tissu.
- Présence de petites plaques sclérales peuvent entraver la coupe, alors assurez-vous complete l'excision scléral avec des ciseaux de microchirurgie. Cette opération doit être réalisée sans endommager le corps choroïde, la rétine et du vitré.
- Inspecter l'incision afin de s'assurer qu'elle est complète. Si l'incision a été effectuée correctement, la cornéo-sclérales adhère à la jante des corps ciliaires seulement au point de correspondance avec la cornée.
- Réglez le globe oculaire vers le bas enveloppé près du centre du champ stérile. Terminez le retrait cornée en utilisant une pince pour tenir la jante scléral stationnaire et la main utilisée pour l'excision de tirer le corps ciliaire-choroïde vers le bas et en dehors du bouton cornéo-scléral.
- Séparez délicatement les adhérences restantes à partir du bouton cornéo-scléral. Ni tirez la jante cornéoscléral d'une manière qui pourrait causer des croix-cornéen tension ni lui permettre de redescendre sur la chambre antérieure.
- La densité des cellules endothéliales de la cornée est vérifiée en utilisant une solution hypotonique, et la mortalité des cellules est vérifiée en utilisant un trypune coloration bleue pendant environ 1 min et les cellules sont ensuite comptées sous un microscope optique et mesurée en tant que cellules / mm 2. La chambre antérieure doit faire face le couvercle tandis que le postérieur doit faire face le fond de la boîte de Pétri. La densité des cellules endothéliales pouvaient être comptés manuellement à l'aide d'une grille dans l'objectif sous un grossissement de 100X. Le nombre de cellules minimale acceptée pour la transplantation en Italie est de 2200 cellules endothéliales / mm 2.
- Transfert de la jante cornéoscléral utilisant une griffe cornée à support de stockage préalablement préparé la cornée conserve à température ambiante (température ambiante), comme indiqué dans le tableau 3.
- Examiner la chambre postérieure d'un cristallin naturel. Si la sclérotique est préparé, enlever tous les résidus de l'uvée et l'humeur vitrée du globe. Soigneusement déballer et retourner le segment restant postérieure à son bocal oeil respectif, en utilisant une technique aseptique. Répétez la procédure pour le monde d'autres à l'aide de nouveaux instruments. Fixer l'esprit la cornéeh griffe cornée et de préserver dans les supports de stockage (culture de l'orgue) à 31 ° C. La cornée excisée, comme le montre la figure 1a, peut alors être utilisé pour kératoplastie ou de recherche.
- Éliminer les matériaux inutiles et bio-déchets dangereux dans les poubelles appropriées. Nettoyer la zone de travail une fois que le travail est terminé en utilisant 70% de pulvérisation d'alcool isopropylique.
- Si, après 28 jours de la cornée conserve tous les paramètres d'évaluation [tels que la morphologie, la numération des cellules, la transparence, l'épaisseur et les tests de microbiologie - bactérienne et fongique en utilisant l'instrument Bactec 9240 (Becton Dickinson, Milan, Italie)], il peut alors être transporté à les hôpitaux en utilisant le moyen de transport indiqué dans le tableau 4. La cornée doit être retiré et placé dans le stockage pour le transport de fluide sous hotte à flux laminaire de l'air.
- Comme, pendant le stockage, la cornée devient plus épaisse que sa taille habituelle nécessaire pour la transplantation, les banques oculaires utiliser de l'enflure des agents pour réduire l'épaisseur. Nousutiliser 6% de dextrane T500 pour obtenir la cornée à sa taille normale en milieu de transport. Bien que 4-8% de dextran T500 pourrait être utilisé, 6% qui a le mieux servi pour nous. Cela rend plus facile pour les chirurgiens de transplantation de la cornée dès qu'ils le reçoivent.
2. L'éviscération de Retina du Globe oculaire après la suppression des Cornea
- Après excision, la cornée est sélectionné pour la transplantation ou à la recherche sur la base de la morphologie et la densité des cellules endothéliales et est placé dans l'espace de stockage ou de conservation à 31 ° C. Le reste du globe oculaire est ensuite traitée pour une utilisation ultérieure comme l'isolement sclère à des fins chirurgicales, de la rétine pour la recherche, etc
- Avant l'excision de la rétine, assurez-vous que le globe oculaire est intact et que seul la cornée avec une partie de la sclérotique est retiré. Si le corps vitré est gélatineuse sécrétant des, il devient difficile de retirer un tissu rétinien.
- Si le donneur est en dessous de 65 ans, la sclérotique estconservés sous PBS stérile à des fins chirurgicales après des tests sérologiques. Dans ce cas, la sclérotique n'est pas coupé, seul le corps vitré est enlevé et la sclérotique entier est conservé.
- Pour l'excision de la rétine, commencer avec une petite coupure ou de l'incision de la cornée côté de la sclérotique se déplaçant vers le nerf optique à l'aide de pinces stériles et des ciseaux. Tenez la partie de la sclérotique aide de pinces et couper avec les ciseaux en ligne droite vers le nerf optique de coupe de part en part en évitant d'endommager le corps vitré.
- Choroïdiens plaques doit être séparée de la sclérotique qu'ils sont collés ensemble. Couper la sclérotique ensemble pour exposer le tissu choroïde. Une fois la sclérotique est complètement coupé, séparer la sclère avec le reste du corps vitré en le coupant près du nerf optique. Une boule entière de corps vitré recouvert de la choroïde sera visible comme le montre la figure 2a.
- L'utilisation de deux pinces stériles enlever la couche choroïde doucement par le ramasser avec unpaire de forceps et le retirer de l'autre. Alternativement, la couche choroïde peut être enlevé avec des ciseaux, mais cela devrait idéalement être évitée car elle peut causer des dommages à la rétine. Retirer la couche de la choroïde et la couper partiellement pour faciliter le transfert.
- Une fois la couche choroïde est retiré, une couche transparente de la rétine va être perçu clairement comme le montre la Figure 2b. La couche choroïde a membrane de Bruch une intérieure, qui pourraient également être supprimées, mais il est difficile de l'identifier à l'oeil nu.
- De même, utiliser deux pinces pour enlever la couche de rétine comme le montre la figure 2c. Il est facile d'isoler le montant élevé de la rétine si excisé près du nerf optique. Toutes les couches de l'œil pourrait être désormais considérée comme le montre la figure 2d.
- Une fois le tissu rétinien a été enlevé, il pourrait être utilisé à des fins différentes et donc les étapes suivantes et les conditions utilisées pour la conservation peut donc varier en conséquence. Par exemple,le tissu rétinien peut être placé dans des tubes de stabilisation contenant de l'ARN réactifs (tels que RNAlater) ou un tampon de lyse (pour l'extraction d'ARN ou ADN), la dispase / trypsine (pour l'isolement de cellules), des solutions de fixation (avant d'incorporer les tissus dans de la paraffine et OCT immunohistochimie).
- Effacer toute la zone de travail et nettoyer la zone à l'aide de 70% de pulvérisation d'alcool isopropylique.
3. Les résultats représentatifs
La jante cornéoscléral comme on le voit dans la figure 1a est une cornée correctement excisée avec la quantité requise de la jante et de la morphologie endothéliale scléral, ce genre de la cornée est généralement utilisé pour kératoplastie. Si le stroma de la cornée antérieure excisé est endommagé avec présence d'opacité, la cornée peut être utilisé pour kératoplastie endothéliale / postérieure kératoplastie lamellaire (endothélium avec une partie de stroma). Considérant que, si la couche endothéliale est endommagée ou si la densité cellulaire endothéliale est <2200 cellules / mm 2 (IlAlian standard), la cornée peut être utilisé pour kératoplastie lamellaire antérieure (épithélium avec une partie de antérieure du stroma). Si le nombre de cellules endothéliales est inférieure à la nécessaire, la cornée peut être utilisé pour kératoplastie lamellaire antérieure ou de recherche tandis que, si la cornée est endommagée complètement, il pourrait être utilisé pour la recherche comme le montre la figure 1b, 3b et 3c ou mis au rebut. Les dommages pourraient être une cause de mauvaise manipulation du tissu, les chirurgies de la cataracte avant menant à stromales ou Descemet cicatrices endothéliales, le développement de la blessure physique au cours etc la vie du patient Par conséquent, il devient nécessaire de vérifier tous les tissus avec lampe à fente, puis sous le microscope optique pour fines cicatrices ou des plis et détachements. La cornée est habituellement conservée dans deux conditions différentes, comme la culture d'organes (environ 31 ° C) habituellement utilisé dans les pays européens ou les conditions d'hypothermie (environ 4 ° C) habituellement utilisé aux Etats-Unis. Nous utilisons la culture d'organes, car il contribue à régénérer le barrageâge des cellules épithéliales, de revitaliser contrôle des cellules endothéliales avec un temps de post-mortem de haut, une période de stockage de 4 semaines, ce qui donne la fenêtre suffisante pour la planification d'une chirurgie, donne suffisamment de temps pour les tests microbiologiques (bactéries et champignons) et sérologiques, etc La cornée peut être bien conservés dans le milieu de transport pour 7 jours.
La sclérotique pourrait être réduit de part en part assurer l'élimination en douceur toutes les plaques choroïdiens. Le liquide du vitré peuvent excréter lorsque le nerf optique, la choroïde ou de la rétine est fortement diminuée comme le montre la figure 4. Rétines si excisées pour l'analyse d'ARN doivent être conservés dans le RNAlater dès que les tissus sont excisées. Habituellement 1X1 cm de la choroïde et la rétine couche est excisé et après le garder dans RNAlater pendant 24 heures à 4 ° C est conservé sous -80 ° C dans des tubes Eppendorf frais (tubes Safe-Lock, 2 ml) jusqu'à son utilisation ou expédiés à sec glace. Le tissu rétinien devrait être excisée à l'aide de deux pinces à proximité du nerf optique loin de l'irisou de la marge ciliaire à éviter une contamination par d'autres structures pigmentées et doit être transférée dans le récipient en préservant immédiatement ARN obtient instable lors de la récupération de la rétine.
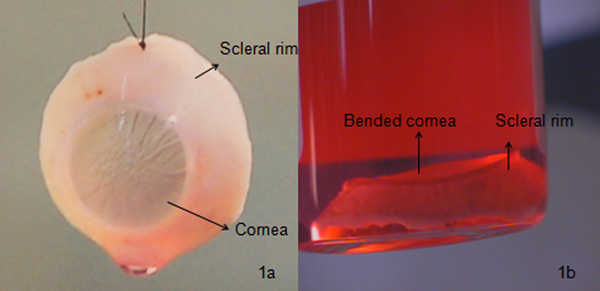
Figure 1: Comparaison entre une bonne et une cornée de mauvaise qualité:. A) Une cornée correctement excisée. Une telle cornée est habituellement conservé dans la culture d'organe pendant 4 semaines. Microbiologiques (en utilisant l'instrument Bactec 9240) et morphologiques (coloration des cellules avec du bleu trypan pour la détermination de la mortalité cellulaire et en observant les cellules sous un microscope optique avec un grossissement de 100X) l'examen est effectué avant de le transporter à l'hôpital (figure 3a), b) une cornée plié , ce qui mène finalement à un rejet du greffon en raison de plis à haute Descemet et haute dommages aux cellules endothéliales examinés à l'aide d'un microscope lampe à fente. Une telle cornée est habituellement utilisé pour les research ou est rejeté.

Figure 2. Méthode utilisée pour assurer une excision précise du tissu rétinien. A) Dissection de la sclérotique de l'globe oculaire à l'aide de lame 24mm avec 95 mm ou des ciseaux courbes extrémités franches stériles et 100 mm 11x2 gouvernés par 0,70 mm pince dents stériles. La sclérotique doit être coupé par la tenue d'un côté avec la pince en le coupant tout droit vers le nerf optique à l'aide des ciseaux. La couche choroïde sera maintenant facile de voir; b) L'utilisation de deux 100 mm 11x2 gouvernés par 0,70 mm dents des pinces stériles, de la choroïde est éliminé par le déchirer, ce qui révèle le sous-jacent couche transparente la rétine; c) Transparent couche de la rétine est excisé très soigneusement à proximité de le nerf optique, sans l'excrétion du fluide vitreux en conformité avec la pince mêmes. Les deux pinces devrait tenir de chaque côté de la rétine et le tissu doit être enlevé doucement starting près du nerf optique se déplaçant vers la cornée, pour obtenir une bonne quantité de tissu rétinien. Le tissu peut être coupé en différentes tailles et utilisés pour des expériences d'analyse; d) Les différentes couches de l'œil après l'enlèvement de cornée peut être consulté dans cette figure. Le corps est retiré choroïde d'abord suivi par la rétine sans endommager les autres parties de l'oeil.

Figure 3. Comparaison des différents types de densité cellulaire et de la morphologie vues sous un grossissement de 100 fois un microscope optique. A) la densité des cellules endothéliales bonne (> 2200 cellules / mm 2) et de la morphologie (polymorphisme moins, la dégénérescence faible, la dystrophie pas et 0% mortalité) dans une cornée qui est approprié pour la transplantation, b) la densité des cellules endothéliales pauvre (environ 1200 - 1400 cellules / mm 2) et de la morphologie (polymorphisme très élevé et dégénérescenceration des cellules) avec environ 30-40% de la mortalité globale sont observées après coloration au bleu trypan; c) Une partie des cellules endothéliales sont endommagés en raison de détachement d'une feuille endothéliale lors de la récupération de la cornée à partir de globe oculaire. Ceci est confirmé par l'observation de la mortalité des cellules dans la région teinté au bleu trypan; d) plis de Descemet sont formés en raison de mauvaise gestion de la cornée par pliage, la création de croix de tension de la cornée, en utilisant les instruments intensément etc au moment de l'excision. La figure montre les épais développés plis iatrogènes trouvés entre la périphérie et la zone optique de la cornée.
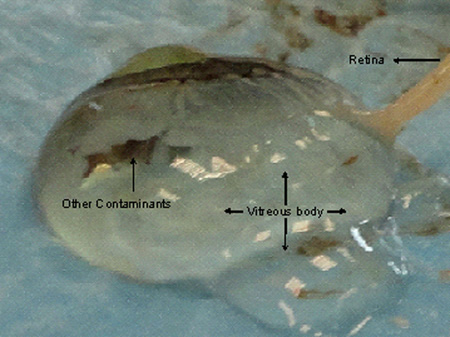
Dommages Figure 4. À la choroïde et la rétine tout en tissus à exciser la cornée mène éventuellement à l'excrétion du fluide vitré. La rétine se impliqué dans le corps vitré qui rend difficile l'accise un bon tissu de qualité wiThout contamination.

Tableau 1. Résumé de la gamme d'activités effectuées à l'aide globes oculaires humains en 2009 et 2010 à la Fondazione Banca Degli Occhi (Venezia, Italie). Environ 60% des tissus ont été utilisés pour la transplantation, laissant ainsi un grand nombre de globes oculaires (environ 40%) pour la recherche scientifique et médicale.
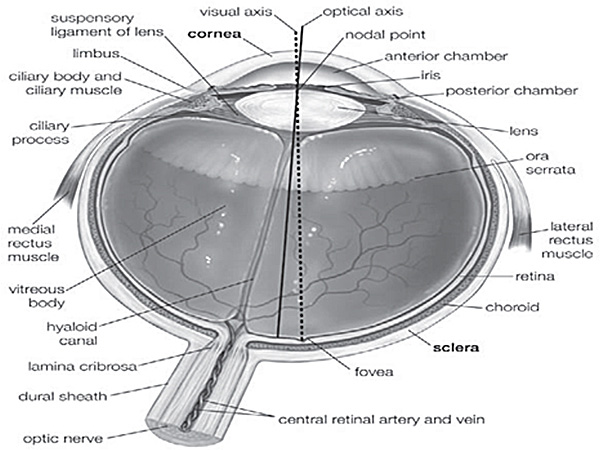
Figure 1 supplémentaire. Anatomie de l'oeil humain 5. Différentes parties de l'œil humain sont indiqués dans cette figure, utilisée pour suivre la position exacte des tissus.
Access restricted. Please log in or start a trial to view this content.
Discussion
Les deux, l'excision correcte et la bonne conservation des tissus de la cornée et la rétine sont essentielles comme des défauts mineurs tels que des lésions endothéliales ou nombre élevé de plis de Descemet peut conduire à l'échec de greffe de la cornée tandis que les modifications de température ou une mauvaise manipulation peut compromettre l'intégrité des tissus rétiniens. Le but de cet article est de montrer comment les tissus de la cornée et la rétine peut être isolé de manière optima...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n'ont aucun conflit d'intérêts.
Remerciements
Ce travail a été soutenu en partie par des subventions de la Région de la Vénétie (Ricerca Sanitaria Finalizzata n.292/2008 et Ricerca Sanitaria Finalizzata 2009). Les auteurs remercient le Dr C. Griffoni pour les données 2009/2010 de synthèse sur l'utilisation des globes oculaires humains.
Access restricted. Please log in or start a trial to view this content.
matériels
Matériaux pour l'excision de la cornée et la rétine.
| Name | Company | Catalog Number | Comments |
| Description du produit | Dimensions | Société / Institut | |
| Surveillé scalpel jetable | Dimension de la lame 15 | Swann-Morton | |
| Pansements stériles | 5 cm X 5 cm, 8 couches, 5 pcs | Artsana | |
| Stérile serviette jetable médicale | 35 X 50 cm | U.Jet | |
| Des ciseaux stériles | Lames 24 mm / longueur globale. 95 mm courbée, émoussée | e.janach | |
| Pinces stériles | En acier inoxydable -100 mm 11 x 2 gouverné par 0,70 mm dents | e.janach | |
| Griffe cornée - dispositif médical à usage unique | NIIOS (Hippocratech) | ||
| Préparations | |||
| PBS | 100 ml de PBS [10x] dans 900 ml d / w (eau distillée) | Sigma-Aldrich | |
| Na-thiosulfate | 1 g de Na-thiosulfate dans 1 litre de PBS [1x] | Sigma-Aldrich | |
| I-PVP | 5 g I-PVP dans 1 litre d / w | Sigma-Aldrich |
Tableau 2. Le tableau suivant décrit les matériaux utilisés pour l'excision de la cornée et la rétine et la société qu'ils sont reçus.
Matériaux pour support de stockage (2000 ml).
| Composants | Fournisseur | Numéro de catalogue | Concentration | Quantité |
| MEM(1X) liquide | Invitrogen | 32360-034 | 1900 ml | |
| Pyruvate de sodium | Invitrogen | 11360-039 | 1 mM (10ml / l) | 20 ml |
| L-glutamine | Invitrogen | 25030-032 | 2 mM (10ml / l) | 20 ml |
| Antibiotiques / antifongique | Sigma-Aldrich | A5955-20ML | 10ml / l | 20 ml |
| Veau nouveau-né du sérum | Invitrogen | 26010-74 | 2% (de 20 ml / l) | 40 ml |
Tableau 3. Matériaux pour support de stockage.
Préparation de support de stockage
Ajouter tous les ingrédients en utilisant des concentrations spécifiques indiquées ci-dessus dans un bocal et bien mélanger. Les filtreren utilisant la taille des pores de 0,2 micron (Millipore, Milan, Italie) avec l'aide d'une pompe péristaltique. Préserver le milieu dans des bouteilles à la température ambiante.
Matériaux pour le milieu de transport (2000 ml).
| Composants | Fournisseur | Numéro de catalogue | Concentration | Quantité |
| MEM (1X) liquide | Invitrogen | 32360-034 | 1800 ml | |
| Pyruvate de sodium | Invitrogen | 11360-039 | 1mM (10 ml / l) | 20ml |
| L-glutamine | Invitrogen | 25030-032 | 2 mM (10 ml / l) | 20ml |
| Veau nouveau-né du sérum | Invitrogen | 26010-74 | 2% (de 20 ml / l) | 40 ml |
| Dextran T500 | Pharmacosmos | 551005004007 | 6% (60 g / litre) | 120 g / l |
Tableau 4. Matériel pour le milieu de transport.
Préparation de milieu de transport
Ajouter Dextran 6% dans ~ 1,5 litre de MEM et laisser toute la nuit. Ajouter le reste des ingrédients dans les médias et filtrer à l'aide du filtre de 0,2 micron (Millipore, Milan, Italie) en utilisant une pompe à vide. Préserver le milieu dans des bouteilles à la température ambiante.
Références
- Fay, A. Diseases of the visual system. Cecil Medicine. Goldman, L., Ausiello, D. , 23rd ed, Saunders Elsevier. Philadelphia, Pa. (2007).
- Parekh, M., Megaw, R., Ray-Chaudhuri, A., Ahmad, S. Patents in Limbal Stem Cell Biology. Recent patents on Regenerative Medicine. 1, 207-212 (2011).
- Pharm, U. S. The Eye: The physiology of human perception. Britannica educational publishing. 36, 19-27 (2011).
- Lang, G. Ophthalmology: A pocket textbook atlas. , 2nd Edition, 115-117 Forthcoming.
- Liesbeth, P. els Organ Culture: The method of choice for preservation of human donor corneas. Br. J. Ophthalmol. 81, 523-525 (1997).
- Meyer, J. S., Howden, S. E., Wallace, K. A., Verhoeven, A. D., Wright, L. S., Capowski, E. E., Pinilla, I., Martin, J. M., Tian, S., Stewart, R., Pattnaik, B., Thomson, J., Gamm, D. M. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. , (2011).
- Trifunovic, D., Karali, M., Camposampiero, D., Ponzin, D., Banfi, S., Marigo, V. A high-resolution RNA expression atlas of retinitis pigmentosa genes in human and mouse retinas. Invest. Ophthalmol. Vis. Sci. 49, 2330-2336 (2008).
- Mora, P., Montanini, L., Ferrari, S. Retina. 30, 1555(2010).
- Claybon, A., Bishop, A. J. R. Dissection of a Mouse Eye for a Whole Mount of the Retinal Pigment Epithelium. J. Vis. Exp. (48), e2563(2011).
- Skeie, J. M., Tsang, S. H., Mahajan, V. B. Evisceration of Mouse Vitreous and Retina for Proteomic Analyses. J. Vis. Exp. (50), e2795(2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon