Method Article
Profilage thiol redox du protéome par spectrométrie de masse isotopique de l'étiquetage
Dans cet article
Résumé
Réactif niveau de l'espèce d'oxygène est élevé lorsque les cellules rencontrent des conditions de stress. Ici, nous montrons l'exemple de la coloration diaminobenzidine 3'-3 'ainsi que l'étiquetage cysTMT et spectrométrie de masse pour établir le profil du protéome redox dans Pseudomonas syringae Traités feuilles de tomate.
Résumé
Pseudomonas syringae pv DC3000 souche. Tomate non seulement provoque la maladie bactérienne chez grain Solanum lycopersicum, mais aussi sur les espèces de Brassica, ainsi que tous les Arabidopsis thaliana, un 1,2 hôte génétiquement traitable plante. L'accumulation d'espèces réactives de l'oxygène (ROS) dans les cotylédons inoculés avec DC3000 indique un rôle de ROS dans la mort cellulaire nécrotique moduler cours de la maladie grain bactérien de la tomate 3. Le peroxyde d'hydrogène, un composant de ROS, est produite après l'inoculation des plants de tomates avec Pseudomonas 3. Le peroxyde d'hydrogène peut être détectée en utilisant un histochimique tache 3'-3 'diaminobenzidine (DAB) 4. Coloration DAB réagit avec le peroxyde d'hydrogène pour produire une tache brune sur les 4 tissus de la feuille. ROS a un rôle réglementaire de l'environnement redox cellulaire, qui peut changer l'état d'oxydo-réduction de certaines protéines 5. La cystéine est un acide aminé important sensibles àchangements redox. En vertu de l'oxydation légère, oxydation réversible de groupes cystéine sulfhydryle sert en tant que capteurs et transducteurs de signaux redox qui régissent une variété de processus physiologiques 6,7. De masse en tandem tag (TMT) réactifs permettre l'identification simultanée et multiplexés quantification des protéines dans des échantillons différents en utilisant la spectrométrie de masse 8,9. Les cystéine-réactifs TMT (cysTMT) réactifs permettant l'étiquetage sélectif et quantification relative de la cystéine-contenant des peptides à partir de six échantillons biologiques. Chaque étiquette cysTMT isobare a la masse même parent nominale et est composé d'un groupe sulfhydryle réactif, un bras espaceur MS neutre et d'un rapporteur MS / MS 10. Après l'étiquetage, les échantillons ont été soumis à la digestion de la protéase. Les peptides cystéine-marquées ont été enrichie en utilisant une résine contenant des anticorps anti-TMT anticorps. Au cours de MS / MS, une série d'ions rapporteurs (c.-à-, 126-131 Da) émergent dans la région de faible masse, fournissant des informations sur une quantification relative.Le flux de travail est efficace pour réduire la complexité de l'échantillon, l'amélioration de la plage dynamique et d'étudier les modifications de cystéine. Ici, nous présentons redox analyse protéomique de la tomate Pst DC3000 traités (Rio Grande) laisse en utilisant la technologie cysTMT. Cette méthode à haut débit a le potentiel pour être appliqué à l'étude d'autres redox processus régulés physiologiques.
Protocole
1. Faire pousser des plants et des bactéries Préparation
- Les semis sont mis à germer dans un mélange Metromix sol 500 (Sociétés institutions de Bretton Woods) dans une chambre de croissance (160 umol photons m -2 s -1 avec une photopériode de 8 heures de lumière à 22 ° C et 16 heures d'obscurité à 20 ° C pendant 1 semaine. Relative l'humidité a été fixé à 70%. Les semis ont été arrosées avec l'eau du robinet au besoin pour garder le sol de se dessécher.
- Deux plants de taille similaire sont ensuite transplantées dans des pots de 4 po de diamètre contenant le Metromix 500 sol et cultivées pendant 3 semaines supplémentaires dans les mêmes conditions que les 1.1.
- Pseudomonas syringae (Pst) est initialement T-strié sur Kings B moyen (KBM) plaques (par litre: 20 g protéose peptone, 0,1975 g MgSO 4, 1% glycérol, 1,5 g K 2 HPO 4, 18 g Agar) et cultivées pendant deux jours à 28 ° C. Une seule colonie est recueilli, mélangé à 300μl Kings liquide B moyen (20 g protéose peptone, 0,1975 g MgSO 4 , 10 ml de glycérol, 10 ml de 100x K 2 HPO 4 actions (1,5 g de K 2 HPO 4 dans 10 ml de H 2 O), et étalée sur un plateau B Kings moyen. Ceci est cultivée pendant une nuit à 28 ° C.
- L'inoculum est préparé bactéries en grattant les bactéries cultivées à partir de la plaque KBM dans 20 ml H 2 O. Un DO 600 de 0,03 (~ 10 6 ufc / ml) est préparée dans 1 L de tampon d'inoculation (10 mM MgCl 2 + 400 pi Silwett-70). Tampon d'inoculation des bactéries moins a été préparé pour la solution de contrôle.
2. L'inoculation de tomates avec Pst et H 2 O 2 histochimique Stain
- Quatre usines semaine anciens ont été inoculées par trempage dans la solution d'ensemencement ci-dessus pendant 30 secondes. Des sacs en plastique ont été mis sur les plantes immédiatement après l'inoculation.
- 3'-3 'diaminobenzidine (DAB) tache 11 a été préparé (1 mg / ml DAB dans H 2 O, pH 3,8 (HCl)) trois days avant utilisation pour obtenir une solubilisation complète. La solution a été secouée pour mélanger à la température ambiante.
- Vingt-quatre heures après le traitement, la feuille pleinement développée a été retiré, placé dans DAB tache côté épidermique en place, et le vide infiltré pendant 15 min. Les feuilles ont ensuite été mis dans le noir à température ambiante pendant la nuit pour la coloration.
- Les feuilles ont été bouillis dans de l'éthanol 95% pendant 10 min, puis conservés dans l'éthanol à 75%.
3. Extraction des protéines
- Après la récolte, les feuilles de tomates ont été broyés en poudre fine avec de l'azote liquide à l'aide de mortier et un pilon.
- Pour 0,5 g de tissu, ajoutez 1,25 ml de Tris pH 8,8 phénol tamponné et 1,25 ml / 0,5 g de tampon d'extraction (0,1 M Tris-HCl pH 8,8, EDTA 10 mM, 0,9 M de saccharose) puis continuer de broyage pendant quelques minutes plus dans un hotte.
- Transférer l'extrait dans le tube à centrifuger Oakridge (Thermo Fisher Scientific Nalgene Société) et agiter pendant 2 h à température ambiante.
- Centrifuger à 5000 xget 15 ° C pendant 10 min. Transférer la phase supérieure de phénol dans un nouveau tube propre.
- Retour-extraire la phase aqueuse avec un volume égal de tampon extrait phénol; agiter sur un agitateur pendant 30 min. Centrifuger et transférer l'extrait dans un nouveau tube Falcon.
- Répétez l'étape ci-dessus une fois de plus et de transférer l'extrait à nouveau Oakridge tube.
- Précipiter phénol protéines extraites en ajoutant 5 volumes de 0,1 M d'acétate d'ammonium dans le méthanol à 100% (stocké à -20 ° C). Vortex et incuber à -20 ° C pour la nuit.
- Recueillir le culot de protéines par centrifugation à 20.000 xg, 4 ° C pendant 20 min.
- Laver les 2 granulés fois avec de l'acétate d'ammonium 0,1 M froid dans le méthanol et 2 fois avec de l'acétone à froid de 80%. Ajouter 1,5 ml d'éthanol à froid de 70% à granulés et à suspendre. Transférer dans un microtube de 2 mL (États-Unis scientifique) et centrifuger à 14000 rpm, 4 ° C pendant 20 min. Retirer l'éthanol.
- Sécher le culot brièvement dans un concentrateur SpeedVac et dissoudre dans une extr protéinestampon d'action, par exemple des protéines ReadyPrep d'extraction de réactif Kit 3 (8 M d'urée, CHAPS 4%, 40 mM Tris-base, 2 M thiourée) (Bio-Rad). Centrifuger à 14000 rpm et 20 ° C pendant 30 min pour former une pastille. Recueillir le surnageant.
- Mesurer la concentration de protéines en utilisant un dosage de protéines CB-X selon le manuel du fabricant (Geno technologie).
4. Préparation de l'échantillon et l'étiquetage des peptides avec cysTMTs
- Préparer échantillon de protéine à une concentration de 2-5 mg / mL. Ici, nous utilisons 100 ug de protéines pour chaque marqueur de masse, 20 pl-50 échantillons ul. Pour cette expérience, tous les 6 balises ont été utilisés.
- Ajouter un volume égal de tampon d'alkylation (100 mM Tris-HCl pH 7,5, 200 mM iodoacétamide) pour l'échantillon de protéine de bloquer le groupe thiol libre. Tampon doit être préparé. Alkylation est effectuée à 37 ° C pendant 1 heure.
- Précipiter la protéine par addition de 1 ml d'acétone 80% à froid à -20 ° C pendant une nuit. Pellet la protéine par centrifugation à 14.000rpm, 4 ° C pendant 20 min. Laver les 3 granules fois avec de l'acétone 80% vortex à chaque fois. Eliminer le surnageant et laisser l'air tout sec sur la glace.
- Reprendre le culot dans 50 ul de tampon de lyse (6 M d'urée, 50 mM Tris base, EDTA 1 mM). 0,5 pi de 100 mM de Tris (2-carboxyéthyl) phosphine (TCEP) est ensuite ajouté pour réduire les liaisons disulfures en incubation pendant une heure à température ambiante.
- Préparer les balises en ajoutant 20 uL d'acétonitrile pour les tubes réactifs pour solubiliser les balises. Vortex et spin vers le bas.
- Laver PTCE en utilisant une Microcon 3Kd dispositif de filtre centrifuge (Millipore). Ajouter un échantillon de 50 ul à Microcon 3Kd colonne, et 50 ul de tampon de lyse à la colonne. Centrifuger pendant 15 min à 10000 xg et 4 ° C. Répétez cette étape pour un total de trois fois. Retirer la colonne et inverser dans un tube propre. Centrifuger pendant 5 min à 1000 xg et 4 ° C.
- Vérifiez le pH. Si nécessaire, ajuster le pH à 7,0 à 8,0 avec 1 M HCl.
- Ajouter 5 pi de l'cysTMRéactif T pour chaque échantillon (Le kit de réactifs cysTMT fournit 20 balises ul pour jusqu'à 500 ug de protéines. Cette méthode utilise 100 g de protéine, donc nous utilisons un cinquième de la balise.). Laisser la réaction se poursuivre pendant 2 h à température ambiante.
- Les échantillons ont été combinées avec du tampon échantillon de Laemmli (Bio-Rad) dans un rapport 1:1.
5. Retrait de la non-réagi Fractionnement Tag échantillon
- Les échantillons ont été bouillis pendant 5 min et séparés sur un gel pré-coulé de polyacrylamide à 12% (Bio-Rad). Le gel a été rincé trois fois par intervalles de 5 minutes avec filtre H 2 O et colorées avec du bleu de Coomassie (Bio-Rad) pendant 1 heure. Le gel a été teinté de nuit avec H 2 O.
- Douze fractions ont été recueillies auprès de chaque voie de gel. Les fractions ont été déterminés par des concentrations de bandes protéiques. Les fractions ont été coupés en morceaux de 1 mm et recueilli dans un tube de 1,5 ml.
- Morceaux de gel étaient de-teinté à l'aide d'acétonitrile 50% et de 0,1 M de bicarbonate d'ammonium dans H 2 O. Cette étape doit être répétée jusqu'à ce que la couleur bleue est supprimée à partir de morceaux de gel (environ 3-4 fois, à 15 min à chaque fois).
- De morceaux de gel-tachées ont été séchés à l'aide d'acétonitrile 100% (couvrir morceaux de gel) pendant 15 min, le surnageant éliminé, et les morceaux séchés en utilisant un SpeedVac.
- Dissoudre la trypsine (Promega) à 1:10 (la trypsine: protéines) rapport dans le même volume (comme échantillon composite étiqueté) de 25 mM de bicarbonate d'ammonium. Par exemple, 600 g de protéine échantillon avec un volume de 500 ul besoin de 60 mg de trypsine dissous dans 500 ul de 25 mM de bicarbonate d'ammonium.
- Ajouter la solution de trypsine à des morceaux de gel et de mettre sur la glace pour se réhydrater. Si les morceaux ne sont pas couverts ajouter 50 tampon bicarbonate d'ammonium mM. Après réhydratation, incuber à 37 ° C Pour les 12-16 heures.
- Retirer l'extrait protéique liquide à partir des échantillons incubés.
- Arrêter la réaction et de supprimer toute digestion protéique restante en couvrant des morceaux de gel avec de l'acide formique à 5%, 50% d'acétonitrile .. Agiter morceaux de gel pendant 20 min à température ambiante température. Transférer le surnageant dans des tubes extraits des échantillons de protéines de 5,7. Répétez la procédure d'extraction à deux reprises. Sécher les peptides extraits à l'aide de la SpeedVac.
6. Enrichissement de l'échantillon de cysTMT marqués-peptides
- Ajouter un gradient de l'anti-TMT résine pour tubes de 0,5 mL pour une suspension de 50%. (Gradient a été déterminée à partir de la concentration dans le gel de la bande de fractionnement. Si une collection fraction se compose d'une bande sombre, plus de résine est nécessaire. Fractions les plus faibles avec des bandes exigent moins de résine car il ya moins de protéines.)
- La résine est ensuite lavée trois fois avec un volume de colonne de 1x Tris-solution saline tamponnée (SCT) (25 mM Tris, 0,15 M de NaCl, pH 7,2) (Thermo Scientific Pierce produits de recherche de protéines).
- Ajouter 200 ul 1xTBS à chaque échantillon. Les échantillons sont ensuite ajoutés à l'anti-TMT résine (Thermo Scientific Pierce produits de recherche de protéines) et on agite à température ambiante pendant 2 h puis en basculant une nuit à 4 ° C.
- Ajouter l'échantillon à la colonne (LeRMO scientifiques Produits Pierce recherche sur les protéines).
- Laver chaque colonne trois fois avec 1x 200 ul du SCT. Cette étape est suivie avec lave trois fois avec CHAPs 0,05% (dissous dans 1x SCT).
- La colonne est ensuite lavée trois fois avec 4 M d'urée dans 1x SCT. Deux cents microlitres de H 2 O est ensuite utilisée pour laver les trois colonnes fois.
- Chaque échantillon est élué trois fois avec 200 ul de tampon d'élution de 50% (50% d'acétonitrile, 0,4% de TFA).
- Les échantillons sont ensuite séchés dans un concentrateur sous vide.
7. Spectrométrie de masse
- Remettre en suspension les échantillons dans 12 uL d'acétonitrile 3% avec de l'acide formique 0,1% et injecter 5 pi directement sur un Eksigent NanoLC-1D colonne de chromatographie liquide haute pression (AB SCIEX, Etats-Unis).
- Peptides sont séparés sur une colonne ID Proteopep II um C18 75 x 20 cm Objectif Nouveau, Etats-Unis) à l'aide d'un gradient 4-60% (R: acétonitrile 3%, 0,1% d'acide formique; B: acétonitrile 97%, 0,1% formique acide)à 3 pl / min pendant 60 min.
- Un Thermo Scientific LTQ XL Orbitrap spectromètre de masse a été utilisée pour détecter des peptides en utilisant un top 2 x 3 expérimentation consistant en une seule étape suivie par MS acquisition de 3 spectres MS / MS avec une plus grande consommation d'énergie C-trap de dissociation (HCD) fragmentation suivie par 3 MS / MS avec dissociation induite par collision (CID) pour l'identification des protéines. Paramètres de ce mode sont les suivantes: largeur d'isolement: 3,0 m / z, l'énergie de la collision: 50% (10% en deux étapes). Seulement peptides doublement et triplement-accusés ont été sélectionnés pour la fragmentation. Paramètres d'exclusion dynamiques ont été mis à: Répétez count = 1; Durée répétition = 60; taille de la liste d'exclusion = 500; Exclusion durée = 28. Les valeurs cibles sont les suivants: MS = 5 e 5; MS / MS (HCD) = 1 e 5. Temps de transfert d'ions ont été fixés à 500 pour 300 pour FTMS et MS / MS (HCD). Deux microscans ont été nécessaires pour spectres HCD.
8. Recherche base de données et quantification
- Les données acquises CID et HCD étaient una analysé: à l'aide du logiciel Thermo Scientific Discoverer Proteome 1.2 (Thermo Scientific Pierce produits de recherche de protéines) à travers un flux de travail mis en place un ramifiée qui Reporter Ion Quantizer (20 ppm tolérance de la masse d'ions fragments) afin de quantifier le rapport. Un segment distinct du traitement MS 2 spectres à travers le spectre de sélection, Normalizer spectre, et les nœuds de mérou spectre.
- Les données ont été ensuite recherché contre le moteur de recherche SEQUEST. Une tolérance de 20 ppm en masse a été utilisé. Modifications statiques ont été mis à l'réactif cysTMT (304,18 Da) et les modifications dynamiques inclus phosphorylation et l'oxydation méthionine (15,99 Da). Une base de données personnalisée pour Solanum lycopersicum a été composé à partir d'ARN de données (avec environ 350.000 entrées de l'Université Harvard) 13 a été utilisé dans les deux cas.
9. Les résultats représentatifs
Une image représentative d'une feuille de plante témoin de tomate et une feuille de Pseudomonas inoculé estle montre la Figure 1. Une différence entre le contrôle et les feuilles traitées Pseudomonas traités est observée. Après les feuilles sont enlevées et colorées à l'aide DAB, le processus de la coloration permet de la tache histochimique à montrer des signes de ROS dans le tissu végétal (Figure 2). Figure 2A est représentatif d'une feuille de contrôle sans coloration. La figure 2B est représentatif d'une feuille traitée avec une coloration positive pour Pseudomonas et H 2 O 2. Un exemple de données Découvrez Proteome de sortie d'une protéine redox différemment réglementée est illustré à la figure 3. Cette protéine est un connu ferrédoxine-1 redox protéines réglementé 14 et a été montré à jouer un rôle dans la défense contre Pseudomonas syringae pv de tomate 15. Pic d'intensité entre le contrôle et les échantillons inoculés est utilisé pour obtenir une quantification relative, qui a montré des changements significatifs dans ferredoxen-1 régulation redox (p <0,05). Des pics d'intensité élevés suggèrent que cette protéine est oxydée dans la réponse au traitement des agents pathogènes. La figure 4 est un exemple de données Découvrez Proteome sortie d'une protéine qui a même la régulation redox d'une protéine entre un contrôle et échantillon inoculé. Pics d'intensité similaire suggèrent la présence de ponts disulfure pas réglementé par un changement de traitement. La méthode va révolutionner la façon dont les scientifiques à détecter redox des cystéines réactives et des disulfures 10.

Figure 1. Une image représentative de la tomate inoculés laisse avec la solution de contrôle (A) et Pseudomonas (B).

Figure 2. Une image représentant de coloration DAB de la tomate inoculés laisse avec la solution de contrôle (A) et Pseudomonas (B). Les feuilles ont été colorées à l'aide 3'-3 'diaminobenzidine. La chlorophylle a été retiré de feuilles en faisant bouillir dans de l'éthanol à 95%. Coloration foncée indique la présence de H 2 O 2. Ne laisse que inoculé avec la culture des bactéries ont montré une coloration foncée.
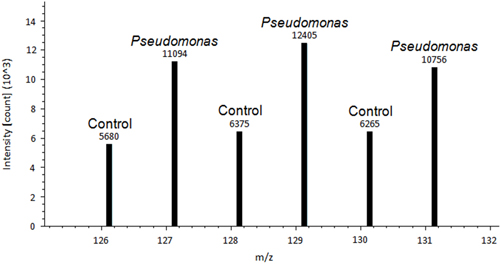
Figure 3. Un exemple de données Découvrez Proteome de sortie de la ferrédoxine-1, protéine régulée différemment redox 14. L'intensité de crête au-dessus de chaque pic est utilisée pour la quantification absolue. Pic d'intensité entre le contrôle et les échantillons inoculés est utilisépour effectuer une quantification relative.

Figure 4. Un exemple de données Découvrez Proteome sortie d'une protéine qui a une intensité de crête similaire entre un contrôle et échantillon inoculé. Pics d'intensité similaire suggèrent la présence de ponts disulfure pas réglementé par un changement de traitement.
Discussion
Ce protocole fournit des informations sur l'exécution de coloration DAB ainsi que la quantification cysTMT étiquetés cystéine redox. Ces procédures sont bénéfiques dans l'examen de la production de ROS ainsi que l'effet sur la régulation des protéines lors de Solanum lycopersicum est inoculé avec Pseudomonas syringae. Les méthodes présentées dans ce protocole constituent un moyen d'examiner ROS dans des échantillons de feuilles entières d'une manière qui cause le moins de dommages aux tissus de la feuille. La procédure d'étiquetage fournit un moyen d'examiner potentiellement redox protéines réglementés en utilisant une méthode de marquage la cystéine. Cela est bénéfique lorsque l'on examine un stade précoce de la réponse au stress.
Méthodes comme marqueur d'affinité codé par un isotope (ICAT) et cysTMT peut être utilisé dans l'examen potentiels redox protéines régulées dans des échantillons biologiques. ICAT permet l'étiquetage et la comparaison de deux échantillons 12. Les deux méthodes étiqueter cystéines libres et peut être utilisé pour la protéine quantification 10,12. Cependant, la méthode permet cysTMT pour une diminution de la variation expérimentale ainsi que le multiplexage 10. Le nombre de balises disponibles permet aux chercheurs d'inclure les répliques ou les échantillons multiples dans leur conception expérimentale. Avoir plus d'échantillons fournit le potentiel pour un plus grand nombre de protéines identifiées. Un inconvénient majeur de la technique cysTMT parce qu'elle compromet la qualité globale de l'identification des protéines en raison des mesures d'enrichissement sélectif pour cysTMT marqués (6.5 à 6.6-peptides). Le nombre de peptides pour l'identification des protéines dépend en grande partie sur le nombre de résidus cystéine dans la séquence protéique. Ce problème peut être surmonté en soumettant une partie de l'échantillon avant enrichissement tryptique pour l'identification par spectrométrie de masse des protéines.
En raison de la nature de la conception expérimentale ainsi que le mécanisme de l'étiquetage que la méthode cysTMT utilise, certaines étapes sont essentielles. Lors de l'exécution des protéines précisionpitation et le culot de lavage (3,9), il est important de conserver des échantillons dans de la glace pour réduire la dégradation des protéines. Au cours de l'étiquetage cysTMT, l'enlèvement de l'agent réducteur (4,6) est important parce que les échantillons peuvent être soumis à l'étiquetage inverse. L'étiquetage inverse est possible si la réduction de réactif reste dans l'échantillon. Si les échantillons sont réduites après l'étiquetage, la balise cysTMT peut être retiré. Une fois que les étiquettes sont ajoutés aux échantillons, le niveau de pH doit être vérifié (4.7) afin d'avoir une efficacité optimale étiquetage. En outre, l'analyse des données dépend de ce qui est requis du chercheur et le but ultime en utilisant le protocole. Il est également tributaire du logiciel utilisé comme chaque logiciel dispose d'algorithmes différents.
Cette expérience utilise des agents pathogènes comme un éliciteur pour la production accrue de réactifs espèces oxydantes dans la tomate, mais d'autres réponses redox réglementés peuvent être évalués en conséquence. Cette conception expérimentale est adaptable à d'autres plantes et systèmes animaux.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier le Dr Greg Martin (Université Cornell) et son groupe de fournir la souche DC3000, les graines de tomates, et des conseils. Ils aimeraient également remercier le Dr Zhonglin Mou de l'aide avec le protocole DAB et la Division de la protéomique à l'UF Centre interdisciplinaire de recherche en biotechnologie de l'aide dans le développement de la méthode. Le protocole d'extraction de protéines a été modifié à partir de Hurkman et Tanaka 16. Le protocole sur l'étiquetage cysTMT, les étapes 4 à 6 a été adapté en fonction de l'original Thermo Fisher Scientific Pierce produit manuelle 17. Ce travail a été financé par la National Science Foundation (MCB 0818051 à S Chen).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| Metromix 500 | Les entreprises des IBW | TX-500 | |
| 3,3 '-diaminobenzidine | Sigma-Aldrich | D8001 | |
| ReadyPrep réactif séquentielle kit extraction 3 | Bio-Rad | 163-2104 | |
| Dosage de la protéine CB-X | Geno technologie | 786-12x | |
| réactifs cysTMT | Thermo Scientific Pierce produits de recherche de protéines | 90071 | |
| Tampon d'échantillon Laemmli | Bio-Rad | 161-0737 | |
| Bio-Safe Comassie (G-250 tache) | Bio-Rad | 161-0786 | |
| Microcon 3Kd colonne | Millipore | 42403 | |
| Immobilisé Anti-TMT résine | Thermo Scientific Pierce produits de recherche de protéines | 90076 | |
| Colonne Centrifugeuse | Thermo Scientific Pierce produits de recherche de protéines | 89896 | |
| Proteopep II colonne C18 | Nouvel Objectif | PFC7515-PP2-10 | |
| NanoLC-1D HPLC | AB Sciex | 90389 | |
| LTQ XL Orbitrap | Thermo Scientific | 0020137580 | |
| SpeedVac | Labconco | 7812013 | |
| Proteome Discoverer 1.2 du logiciel | Thermo Scientific Pierce produits de recherche de protéines | ||
| Trypsine | Promega | V5111 | |
| Tube Centrifugeuse Oakridge | Thermo Scientific NalgeSociété ne | 3139-0050 | |
| Microtube (2ml) | États-Unis scientifique | 1620-2700 | |
| 12% Mini-PROTEAN TGX préfabriqué Gel | Bio-Rad | 456-1043 | |
| Haut de Forme > Bio-Safe Coomassie StainBottom du formulaire | Bio-Rad | 161-0786 | |
| Kit d'enrichissement TMT | Thermo Scientific Pierce produits de recherche de protéines | 90077 |
Références
- Almeida, N. F. A draft genome sequence of Pseudomonas syringae pv. tomato T1 reveals a type III effector repertoire significantly divergent from that of Pseudomonas syringae pv. tomato DC3000. Mol. Plant Microbe Interact. 22, 52-62 (2009).
- Preiter, K. Novel virulence gene of Pseudomonas syringae pv. tomato strain DC3000. J. Bacteriol. 187, 7805-7814 (2005).
- Apostol, I., Heinstein, P. F., Low, P. S. Rapid stimulation of an oxidative burst during elicitation of cultured plant cells: role in defense and signal transduction. Plant Physiol. 90, 109-116 (1989).
- Orozco-Cardenas, M., Ryan, C. A. Hydrogen peroxide is generated systemically in plant leaves by wounding and systemin via the octadecanoid pathway. Proc. Natl. Acad. Sci. U.S.A. 96, 6553-6557 (1999).
- Tonks, N. K. Redox redux: revisiting PTPs and the control of cell signaling. Cell. 121, 667-670 (2005).
- Alvarez, S., Wilson, G. H., Chen, S. Determination of in vivo disulfide-bonded proteins in Arabidopsis. J. Chromatogr. B. 877, 101-104 (2009).
- Apel, K., Hirt, H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annu. Rev. Plant Biol. 55, 373-399 (2004).
- Dayon, L. Relative quantification of proteins in human cerebrospinal fluids by MS/MS using 6- plex isobaric tags. Anal. Chem. 80, 2921-2931 (2008).
- Thompson, A. Tandem mass tags: a novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS. Anal. Chem. 75, 1895-1904 (2003).
- Rosenblatt, M. A novel cysteine-reactive tandem mass tag reagent for subproteome labeling, enrichment and quantitation. , TP169 (2010).
- Clark, J. Phenotypic analysis of Arabidopsis mutants: diaminobenzidine stain for hydrogen peroxide. Cold Spring Harb. Protoc. , (2009).
- Sethuraman, M. Isotope-Coded affinity tag (ICAT) approach to redox proteomics: identification and quantification of oxidant-sensitive cysteine thiols in complex protein mixtures. J. Proteome Res. 3, 1228-1233 (2004).
- Asso, M. EPR and redox characterization of ferredoxins I and II from Desulfovibrio vulgaris Miyazaki. Biochem. Biophys. Res. Commun. 211, 198-204 (1995).
- Huang, H. e. Disease resistance to bacterial pathogens affected by the amount of ferredoxin-I proteins in plants. Mol. Plant Pathol. 8, 129-137 (2007).
- Hurkman, W., Tanaka, C. Solubilization of plant membrane proteins for analysis by two-dimensional gel electrophoresis. Plant Physiol. 81, 802-806 (1986).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon