Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèle murin de l'asthme induit par les allergènes
Dans cet article
Résumé
Des modèles de souris expérimentales de l'asthme allergique offrent de nouvelles possibilités pour l'étude de la pathogenèse des maladies et le développement de nouvelles thérapies. Ces modèles sont bien adaptés à des facteurs de mesure relatives à la réponse immunitaire allergique, inflammation des voies respiratoires, et de la physiopathologie pulmonaire.
Résumé
L'asthme est une cause majeure de morbidité et de mortalité, affectant quelque 300 millions de personnes à travers le monde. 1 Plus de 8% de la population américaine souffre d'asthme, de la prévalence croissante. 2 Comme avec d'autres maladies, les modèles animaux de la maladie allergique des voies respiratoires facilitent grandement compréhension de la pathophysiologie sous-jacente, aider à identifier des cibles thérapeutiques potentielles, et de permettre des essais précliniques de possibles nouvelles thérapies. Modèles de la maladie allergique des voies respiratoires ont été développés dans plusieurs espèces animales, mais les modèles murins sont particulièrement attractive en raison du faible coût, disponibilité, et bien caractérisés système immunitaire de ces animaux. 3 Disponibilité d'une variété de souches transgéniques augmente encore l'attrait de ces modèles. 4 Ici, nous décrivons deux modèles murins de la maladie allergique des voies respiratoires, à la fois l'ovalbumine employant comme antigène. Après une sensibilisation initiale par injection intrapéritonéale, un modèle LivrERS le défi de l'antigène par nébulisation, l'autre par la livraison intra-trachéale. Ces deux modèles offrent des avantages complémentaires, les uns avec les imitant les principales caractéristiques de l'asthme humain. 5
Les principales caractéristiques de l'asthme aigu comprennent une réponse exagérée des voies aériennes à des stimuli tels que la méthacholine (hyperréactivité bronchique; AHR) et inflammation des voies respiratoires éosinophiles riches. Ce sont également des effets importants de provocation allergénique dans nos modèles murins, 5,6 et nous décrire les techniques permettant de mesurer les et donc d'évaluer les effets de la manipulation expérimentale. Plus précisément, nous décrivons les deux 8 invasives 7 et non-invasif des techniques de mesure de l'hyperréactivité bronchique ainsi que des méthodes pour évaluer l'infiltration de cellules inflammatoires dans les voies respiratoires et du poumon. Cellules inflammatoires des voies aériennes sont recueillies par lavage broncho-alvéolaire du poumon tandis que l'histopathologie est utilisée pour évaluer les marqueurs de l'inflammation dans l'organe. Cestechniques fournissent des outils puissants pour étudier l'asthme d'une façon qui ne serait pas possible chez les humains.
Protocole
La sensibilisation aux allergènes et I. Défi (voir Figure 1)
A. Pour Défi intratrachéale
- Pour la sensibilisation initiale, injecter mâle ou femelle C57BL / 6 ou BALB / c (6-8 semaines) par voie intrapéritonéale au jour 0 et à nouveau au jour 7 avec 20 pg d'ovalbumine (OVA; Sigma-Aldrich, St. Louis, MO) émulsionné dans 0,2 ml de phosphate stérile (PBS) contenant 2 mg d'hydroxyde d'aluminium (Sigma-Aldrich) ou avec 2 mg d'hydroxyde d'aluminium dans 0,2 ml de PBS stérile comme témoin.
- Défi avec un antigène, le cas échéant (par exemple, aux jours 14, 16, 18 et 20). Procédure de récusation suit.
- Anesthésier souris avec une voie intrapéritonéale (ip) d'injection d'un mélange de kétamine (90 mg / kg) et de xylazine (10 mg / kg). Assurez-vous de la souris est entièrement anesthésié pendant au moins 10 min.
- Surface de fonctionnement Angle à 45 degrés ou plus. Placez la souris sur cette surface garder la face ventrale vers le haut et la tête en haut.
- Crochet tHLit sous incisives de tenir la tête en arrière. Niveau les pattes avec l'autre pour assurer la trachée est droite et à utiliser la bande d'étiquettes à maintenir les pieds. Faire tremper site chirurgical avec 70% et EtOH écouvillon.
- Appliquer bupivacaïne (0,1 à 0,2 ml de solution à 0,25%) par voie topique à l'endroit de l'incision.
- Nip peau sur la gorge avec une pince et tirez doucement vers l'extérieur. Faire une petite incision verticale avec des ciseaux chirurgicaux. Réduire la taille de l'incision.
- Préparer une seringue de 1 ml avec 50 ul de PBS ou OVA 0,1% dans du PBS et l'insérer dans une pipette répétitive (Tridak Stepper, Torrington, CT). Prendre la pipette dans une main et utiliser l'autre pour tenir le tissu de retour avec la pince à épiler et d'exposer la trachée.
- En tenant la seringue comme parallèle à la trachée que possible, d'insérer l'aiguille à travers la trachée mur et injecter la solution.
- Maintenir la souris dans une suite à l'injection orientation verticale pour laisser le temps pour une solution à s'installer dans les poumons.
- Surface de la plaie doucement et stérilement étroite avecpince à épiler et joint avec suture.
- Placez la souris sur le sternum vers le bas sur un coussin chauffant et lui permettre de récupérer jusqu'à totalement ambulatoire. Après la récupération, le retour de la souris à l'établissement de soins des animaux et de la surveiller quotidiennement les signes de sérome, inflammation ou une infection, et déhiscence de la plaie jusqu'à ce que la plaie est complètement guérie.
B. Pour Défi par nébulisation
- Sensibiliser les souris au jour 0 par injection intrapéritonéale de 20 mg d'OVA (Sigma-Aldrich) émulsionné dans 0,2 ml de PBS stérile contenant 2 mg d'hydroxyde d'aluminium (Sigma-Aldrich) ou avec 2 mg d'hydroxyde d'aluminium dans 0,2 ml de PBS stérile que le contrôle .
- Au jour 14, de stimuler une sensibilisation par injection ip tel que décrit ci-dessus.
- Sur le 21 e jour, 22 ème, 23 ème, 24 ème et 25 ème après la sensibilisation initiale, les souris défi par une exposition de 30 min à l'OVA 1% nébulisée ou PBS seul livré via un nébuliseur ultrasonique (Buxco Systems Research, Wilmington, Caroline du Nord).
- Souris lieu dans la salle principale de la WBP; les acclimater dans la chambre de pléthysmographie pendant au moins 10 min.
- Placer 1 ml de OVA 0,1% dans du PBS stérile ou stérile PBS seul, tel que décrit dans les étapes 4-6 ci-dessous, via un nébuliseur. Nébuliser pendant 30 min.
- Retirer du nébuliseur et jeter toute solution restante.
- Nébulisation peut être effectuée sur tous les souris simultanément en utilisant une chambre de nébulisation.
II. Détermination de l'hyperréactivité bronchique à la méthacholine
A. Mesure non invasive de l'hyperréactivité des voies aériennes par pléthysmographie corps entier-(WBP; Buxco recherche sur les systèmes, Wilmington, NC)
- Laisser la bouteille méthacholine poudre se réchauffer à température ambiante avant ouverture (méthacholine est très hygroscopique et former des amas inutiles si on les laisse à absorber l'eau). Préparer une dose de 200 mg / ml de solution mère dans du PBS stérile, puis assurez-série 2-dilutions (par exemple, 100, 50, 25, 12,5 et 60,25 mg / ml). Conserver les solutions froid.
- Mettre en place l'équipement comme suit: raccorder l 'entrée principale de la WBP d'un nébuliseur, le biais des flux d'entrée à l'air de la pompe, et la sortie WBP à piéger le gaz en utilisant un tube de caoutchouc étanche. Attacher transducteur de pression pour réduire les sorties des chambres principales et renvoi de la WBP. Connectez transducteur de pression pour préamplificateur avec les câbles fournis, et se connecter au PC en utilisant préamplificateur spécifique d'acquisition de données de la carte.
- Calibrer le préamplificateur en utilisant le logiciel selon les recommandations du fabricant.
- Souris lieu dans la salle principale de la WBP; les acclimater dans la chambre de pléthysmographie pendant au moins 10 min, puis des lectures de base de disques (Penhbase) pendant 3 min.
- Placer 1 ml de PBS stérile dans le nébuliseur. Nébuliser pendant 2 min, puis surveiller les variables respiratoires pour un supplément de 6 min au cours de la phase de séchage. Retirer du nébuliseur et jeter tout reste PBS.
- Placer 1 ml de 6,25 mg / ml méthacholine dans le nébuliseur et rnébulisation EPEAT pendant 2 min, plus un cycle de suivi de 6 minutes.
- Répétez la mesure avec 12,5, 25, 50 et 100 mg / ml méthacholine, en utilisant la période de nébulisation même 2-min et cycle de suivi de 6 minutes.
- Retirer les souris à partir des chambres et de les renvoyer dans leurs cages.
- Recharge nébuliseur tasse avec 1 ml de PBS stérile et exécuter une autre séquence pour rincer la tubulure.
- Arrêtez les flux d'air, démonter, et essuyer toutes les chambres avant de lancer une deuxième série d'animaux.
B. Mesure invasive de la réactivité des voies respiratoires par commandée par ordinateur Ventilateur (flexiVent; SCIREQ Inc, Montréal, Canada)
- Peser la souris et anesthésier par voie intrapéritonéale (ip) d'injection de 60 mg de sodium par kg de poids corporel pentobarbital.
- Après anesthésie, position adéquate les souris ventro-dorsale pour trachéotomie.
- Désinfectez la peau du cou avec de l'éthanol 70%. Appliquer bupivacaïne (0,1 à 0,2 ml de solution à 0,25%) par voie topique à l'ile site ncision. Incisez et ouvrir la peau du cou. Séparez les muscles du cou et d'exposer la trachée.
- Faire un 1 - à 2 mm de l'incision dans la trachée avec des ciseaux fins (être certain de ne pas couper la trachée) et insérez la sonde trachéale avec prudence. Attachez un fil de suture autour de la trachée pour empêcher une fuite d'air.
- Poser la souris dans la chambre de pléthysmographe et connecter le tube inséré la trachée et la ventilation.
- Démarrer une ventilation mécanique. Réglez la fréquence respiratoire approprié et le volume courant / course (150 coups / min et 200 pi, respectivement pour une souris de 20 g). Assurez-vous que le thorax se déplace en synchronie avec le ventilateur. Si la souris est la «lutte» avec le ventilateur (auto-respiration), injecter plus d'anesthésie et d'attendre la synchronisation.
- Après les mesures de base, de maintenir la souris sous ventilation de base pour un autre 3 min, puis prendre un 2 e série de mesures d'impédance. Cette 2 ème série de mesures de base est utilisé pour calcmuler les valeurs de référence moyennes.
- Livrer CPE ou à la méthacholine (MCH) (défis 6,25, 12,5, 25, 50 et 100 mg / ml) par la canalisation de débit inspiratoire du ventilateur grâce à un nébuliseur ultrasonique.
- Après chaque défi avec MCh (6,25, 12,5, 25, 50 et 100 mg / ml), le retour du piston à fournir un Vt de 10 ml / kg à 120 respirations par minute et de prendre des mesures d'impédance.
III. Mesure de l'infiltration cellulaire dans l'espace aérien
A. Effectuer lavage broncho-alvéolaire (LBA)
- Après la mesure de la procréation assistée, l'euthanasie des souris avec du CO 2, et de positionner chaque souris sur le dos sur le pavé chirurgicale.
- Faire tremper la zone avec de l'EtOH 70%.
- Commençant à l'abdomen inférieur, ouvrir la cavité abdominale et enlever la peau / supérieure du muscle, se déplaçant vers le haut vers les côtes.
- Une fois les côtes sont visibles, utiliser des ciseaux pour bien percer la membrane. Poumons devrait se rétracter, le diaphragme. Soyez particulièrement careful à ne pas entailler les poumons ou le cœur.
- Coupez la cage thoracique pour bien exposer les poumons et le cœur (éviter de couper les principaux vaisseaux sanguins pour empêcher le sang de remplir le site).
- En utilisant une seringue de 1 ml avec une aiguille de calibre 27 (BD seringues, Franklin Lakes, NJ), la ponction des ventricules cardiaques et lentement et soigneusement retirer la seringue pour prélever le sang. Prenez soin d'éviter l'effondrement du cœur.
- Recueillir le sérum de ce sang en utilisant le protocole standard. Conserver à -70 ° C jusqu'à son utilisation.
- Coupez la peau et les tissus de la gorge jusqu'à ce que la trachée est révélé. Dégagez suffisamment de tissu pour travailler facilement dans le domaine (encore une fois, éviter de couper les principaux vaisseaux sanguins).
- L'aide de ciseaux courbes, coupées en vertu de la trachée se frayer un chemin.
- Passez le point d'une pince courbes sous la trachée et de saisir la fin d'un morceau de fil de suture. Tirer le fil de suture dans la trachée.
- Faire un demi-nœud lâche à propos de la trachée, faible dans la gorge.
- CAREFully une entaille, de taille suffisante pour la canule, au-dessus du fil de suture.
- Soin insérer la canule dans le trou et dans la trachée-delà du point du fil de suture. Appuyez doucement sur l'avant jusqu'à ce que la canule émerge juste à l'entrée dans les poumons (trop loin: poumons de crevaison; trop court: la trachée effondrement lors de la tentative de récupérer BAL).
- Serrer fil de suture et faire un nœud complet pour sceller la trachée autour canule.
- Seringue Lock (contenant 1 ml de PBS) sur la canule, et appuyez doucement sur le fluide dans les poumons. Lobes du poumon devrait individuellement gonfler lentement. Ne pas trop remplir. Pour une souris pleine de 0,9 à 1,0 ml cultivé est le maximum absolu. 0,8 ml peut être plus sûr. Verrouiller la seringue à canule lâche, sinon il est susceptible de causer des dommages lors d'une tentative de se désengager.
- Retirer du fluide à partir de poumons. Si on rencontre une résistance (tissu aspiré dans la canule), appuyez sur la canule lentement plus loin dans les poumons et reprendre les enlever. Aussi essayez de tourner la canule en place. Si tous les else échoue, retirer la canule à mi-chemin; la trachée est beaucoup plus susceptible de s'effondrer dans ce cas.
- Détacher la seringue de la canule, le dépôt liquide de LBA dans le récipient, et répéter 2 fois avec une solution de PBS frais.
- Conserver la solution sur de la glace jusqu'à ce que BAL filé vers le bas.
- Utilisez le liquide de LBA et le sérum pour mesurer l'OVA IgE spécifique à l'aide disponible dans le commerce IgE de souris kits ELISA (bioproduits MD, St. Paul, MN).
B. Compter les cellules et détermination des taux différentiels
- Centrifuger le liquide BAL 5 min à ~ 600 × g, 4 ° C.
- Remettre en suspension le culot cellulaire doucement dans du PBS et de garder sur la glace.
- Chargez un hématimètre norme Neubauer avec la suspension cellulaire diluée et de compter les cellules.
- Retirer aliquotes de 2 × 10 4 cellules 10 à 40 du volume ul pour cytospins. Diluer les cellules si nécessaire.
- Pour cytospins, mélanger 2 × 10 4 cellules, 130 pi de PBS et 10 ul FBS. Ajouter le mélange de cellule entière à double cytospin entonnoir et centrifuger 10 min à 700 rpm, en utilisant cytoslides doubles pour les échantillons en double.
- Laisser les lames sécher à température ambiante pendant 1 h avant la coloration.
- Colorer les lames en utilisant Diff-Quick tache (Siemens, Newark, DE).
IV. Les résultats représentatifs
Constriction des voies respiratoires à la suite des stimuli provocateurs excessive est une caractéristique importante de la clinique de l'asthme. Nous décrivons deux méthodes de mesure de l'hyperréactivité bronchique à la méthacholine telle chez les souris sensibilisées et OVA contestée: l'ensemble du corps pléthysmographie (Figure 2) et l'oscillation forcée à l'aide du système flexiVent (Figure 3). Les deux méthodes montrent que la sensibilisation et le défi OVA produit une hyperréactivité bronchique chez la souris.
Inflammation des voies respiratoires éosinophiles riche en est une autre caractéristique importante de l'asthme et la maladie clinique allergique des voies respiratoires chez les souris. Comme le montre la figure 4 , la sensibilisation et l'OVA défi augmente considérablement le nombre total de cellules qui peuvent être récupérés à partir des voies respiratoires par BAL. Les numéros d'éosinophiles et, dans une moindre mesure, les neutrophiles sont particulièrement augmenté.
Les données indiquent que les résultats allergiques maladies des voies respiratoires de la surproduction d'anticorps IgE aux antigènes sensibilisants. Sensibilisation et un défi à l'OVA en utilisant les protocoles que nous décrivons augmente les taux d'IgE dans le sérum et le fluide BAL des souris traitées (figure 5).
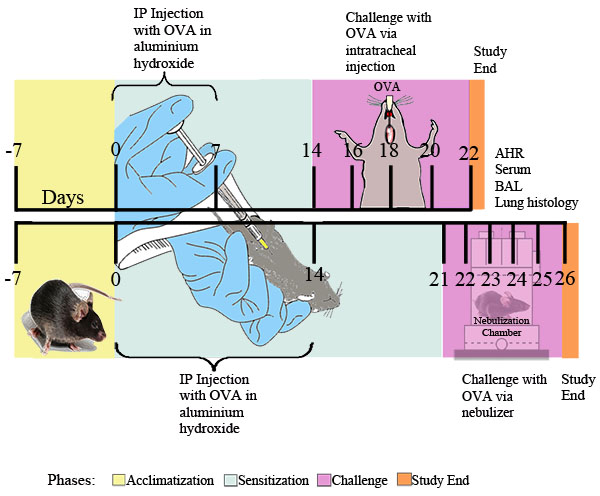
Figure 1. Schéma d'expérimentation pour l'OVA induit l'asthme allergique. Souris ont été sensibilisées à deux reprises ip avec 20 pg d'OVA émulsionnée dans 2 mg d'hydroxyde d'aluminium dans 0,2 ml de PBS stérile, ou 2 mg d'hydroxyde d'aluminium dans 0,2 ml de PBS stérile seul, suivi à la points de temps indiqué par le contester avec 0,1% OVA ou une solution stérile de PBS ou par ex quotidienne posure pendant 30 minutes à l'OVA 1% nébulisée dans du PBS ou du PBS seul livré via un nébuliseur ultrasonique (Buxco). Vingt-quatre heures après l'exposition OVA final, la réactivité bronchique a été déterminée. Par la suite, le liquide de LBA, des échantillons de sang, les cellules pulmonaires, et les tissus ont été prélevés pour une analyse plus approfondie.
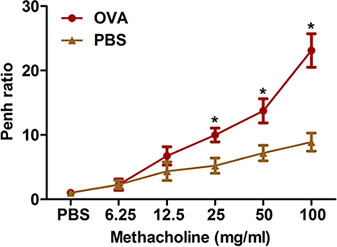
Figure 2. Souris d'évaluation des induite par l'allergène hyperréactivité bronchique par une méthode non invasive. (N = 4/groupe) ont été sensibilisés et mis au défi avec de l'OVA. Vingt-quatre heures qui suivent le dernier défi, l'hyperréactivité bronchique à la métacholine inhalée a été déterminée en utilisant la pléthysmographie corps entier tel que décrit dans le protocole. Penh a été déterminée et exprimée en rapport Penh (moyenne Penh sur l'intervalle de temps de 8 minutes avec de la méthacholine, divisé par le Penh moyenne sur l'intervalle de 8 minutes avec du PBS). * P <0,05 vs PBS.
iles/ftp_upload/3771/3771fig3.jpg "/>
Figure 3. Souris d'évaluation des induite par l'allergène hyperréactivité bronchique par une méthode invasive (oscillations forcées). (N = 4/groupe) ont été sensibilisés et mis au défi avec de l'OVA. Vingt-quatre heures qui suivent le dernier défi, l'hyperréactivité bronchique à des concentrations croissantes de métacholine inhalée a été déterminée par l'oscillation forcée (flexiVent) méthode telle que décrite dans le protocole. Une résistance, B) des voies respiratoires; élastance pulmonaire C). * P <0,05 vs PBS.
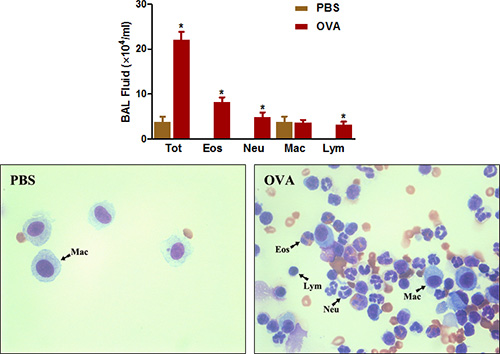
Figure 4. BAL nombre de cellules de fluide. Souris (n = 4/groupe) ont été sensibilisés et mis au défi avec de l'OVA. Vingt-quatre heures qui suivent le dernier défi, (Haut) Cellules BAL ont été recueillis et nombre total de cellules ont été comptées comme décrit dans le protocole. (Bas) diapositives Cytospin étaient préparé et colorées avec Diff-Quick. TOT = nombre total de cellules; Eos = Une éosinophiles; Neu = Une neutrophiles; Mac = macrophages; Lym = Lymphocytes. * P <0,05 vs PBS.
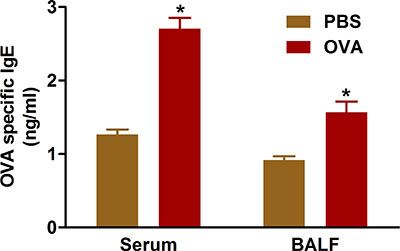
Figure 5. OVA-IgE spécifiques. Souris (n = 4/groupe) ont été sensibilisés et mis au défi avec de l'OVA. Vingt-quatre heures qui suivent le dernier défi, IgE a été mesurée dans le liquide BAL et dans le sérum du sang recueilli par ponction cardiaque tel que décrit dans le protocole. * P <0,05 vs PBS.
Discussion
Les modèles animaux de la maladie allergique des voies respiratoires fournissent des outils importants pour les études pertinentes à l'asthme clinique. Un certain nombre de modèles différents, qui emploient diverses espèces et les antigènes, ont été développés. La souris, une espèce de laboratoire attrayants et fréquemment utilisée, offre également un certain nombre d'avantages pour les modèles de la maladie allergique des voies respiratoires. 9,10 Bien que ces modèles ne reproduisent...
Déclarations de divulgation
Des expériences sur des animaux ont été effectuées en conformité avec les directives et les règlements énoncés par le Comité Atlanta VAMC IACUC sous protocole # V010-10.
Remerciements
Ce travail a été soutenu par des subventions du NIH HL093196 (RCR) et de la recherche Atlanta et de l'éducation de la Fondation (AREF).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du produit | Entreprise | Numéro de catalogue | Commentaires |
| Ovalbumin | Sigma-Aldrich St. Louis, MO | A5503 | |
| L'hydroxyde d'aluminium | Sigma-Aldrich | 239186 | |
| Acétyl-β-méthylcholine chlorure de | Sigma-Aldrich | A2251 | |
| Sel de sodium pentobarbital | Sigma-Aldrich | P3761 | |
| Pléthysmographie corps entier (WBP) système de | Buxco recherche sur les systèmes Wilmington, NC | http://www.buxco.com | |
| FlexiVent | SCIREQ, Inc Montréal, Canada | http://www.scireq.com | |
| Microscope optique | Leica Microsystems, Inc Buffalo Grove, IL | ||
| Cytospin 4 | Thermo Scientific Asheville, Caroline du Nord | ||
| Diff-Quick tache | Siemens Newark, DE | B4132-1A | |
| Pipette à répétition | Tridak Torrington, CT | STP4001-0025 |
Références
- Braman, S. S. The global burden of asthma. Chest. 130, 4S-12S (2006).
- Akinbami, L. J., Mooman, J. E., Liu, X. Asthma Prevalence, Health Care Use, and Mortality: 2005-2009. National Health Statistics Reports. 32, 2005-2009 (2011).
- Bates, J. H., Rincon, M., Irvin, C. G. Animal models of asthma. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297, 401-410 (2009).
- Drazen, J. M., Finn, P. W., De Sanctis, G. T. Mouse models of airway responsiveness: physiological basis of observed outcomes and analysis of selected examples using these outcome indicators. Annu. Rev. Physiol. 61, 593-625 (1999).
- Epstein, M. M. Do mouse models of allergic asthma mimic clinical disease. Int. Arch. Allergy Immunol. 133, 84-100 (2004).
- Blyth, D. I., Pedrick, M. S., Savage, T. J., Hessel, E. M., Fattah, D. Lung inflammation and epithelial changes in a murine model of atopic asthma. Am. J. Respir. Cell Mol. Biol. 14, 425-438 (1996).
- Martin, T. R., Gerard, N. P., Galli, S. J., Drazen, J. M. Pulmonary responses to bronchoconstrictor agonists in the mouse. J. Appl. Physiol. 64, 2318-2323 (1988).
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Gelfand, E. W. Pro: mice are a good model of human airway disease. Am. J. Respir. Crit. Care Med. 166, 5-8 (2002).
- Shapiro, S. D. Animal models of asthma: Pro: Allergic avoidance of animal (model[s]) is not an option. Am. J. Respir. Crit. Care Med. 174, 1171-1173 (2006).
- Zosky, G. R. Ovalbumin-sensitized mice are good models for airway hyperresponsiveness but not acute physiological responses to allergen inhalation. Clin. Exp. Allergy. 38, 829-838 (2008).
- Nials, A. T., Uddin, S. Mouse models of allergic asthma: acute and chronic allergen challenge. Dis. Model. Mech. 1, 213-220 (2008).
- Wenzel, S., Holgate, S. T. The mouse trap: It still yields few answers in asthma. Am. J. Respir. Crit. Care Med. 174, 1173-1178 (2006).
- Rayamajhi, M. Non-surgical Intratracheal Instillation of Mice with Analysis of Lungs and Lung Draining Lymph Nodes by Flow Cytometry. J. Vis. Exp. (51), e2702 (2011).
- Swedin, L. Comparison of aerosol and intranasal challenge in a mouse model of allergic airway inflammation and hyperresponsiveness. Int. Arch. Allergy Immunol. 153, 249-258 (2010).
- Gueders, M. M. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflamm. Res. 58, 845-854 (2009).
- Zhu, W., Gilmour, M. I. Comparison of allergic lung disease in three mouse strains after systemic or mucosal sensitization with ovalbumin antigen. Immunogenetics. 61, 199-207 (2009).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94, 1129-1136 (2003).
- Hoymann, H. G. Invasive and noninvasive lung function measurements in rodents. J. Pharmacol. Toxicol. Methods. 55, 16-26 (2007).
- Chong, B. T., Agrawal, D. K., Romero, F. A., Townley, R. G. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39, 163-168 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon