Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La croissance de la Mycobacterium tuberculosis Les biofilms
Dans cet article
Résumé
Mycobacterium tuberculosis forme des biofilms de drogues tolérantes quand elles sont cultivées dans certaines conditions. Nous décrivons ici les méthodes de culture, M. biofilms tuberculose et la détermination de la fréquence des persistants de drogue tolérante. Ces protocoles seront utiles pour d'autres études sur les mécanismes de la tolérance au médicament chez M. la tuberculose.
Résumé
Mycobacterium tuberculosis, l'agent étiologique de la tuberculose humaine, a une capacité extraordinaire de survivre contre les stress environnementaux, notamment des antibiotiques. Bien que la tolérance au stress de M. la tuberculose est l'une des contributeurs susceptibles à la chimiothérapie de 6 mois à long de la tuberculose 1, les mécanismes moléculaires qui sous-tendent ce phénotype caractéristique de l'agent pathogène restent floues. Beaucoup d'espèces microbiennes ont évolué pour survivre dans des environnements stressants par auto-assemblage en très organisée, la surface fixée, et la matrice des structures encapsulées appelé biofilms 2-4. La croissance dans les collectivités qui semble être une stratégie de survie préféré des microbes, et est réalisé grâce à des composants génétiques qui régulent la surface de fixation, les communications intercellulaires, et la synthèse de substances polymériques extracellulaires (EPS) 5,6. La tolérance au stress environnemental est probablement facilité par EPS, et peut-être par le physiol'adaptation logique de bacilles individu à microenvironnements hétérogènes au sein de l'architecture complexe des biofilms 7.
Dans une série d'articles récents, nous avons établi que M. la tuberculose et le Mycobacterium smegmatis ont une forte propension à se développer dans des structures multicellulaires organisés, appelés biofilms, qui peuvent tolérer plus de 50 fois les concentrations minimales inhibitrices des médicaments anti-tuberculeux isoniazide et 8-10 rifampicine. M. la tuberculose, cependant, nécessite curieusement conditions spécifiques à former des biofilms matures, en particulier de rapport de 9:01 espace de tête: les médias ainsi que l'échange limité de l'air avec l'atmosphère 9. Exigences de conditions environnementales spécialisées pourrait être lié au fait que M. la tuberculose est un agent pathogène obligatoire humaine et a donc adapté aux environnements de tissus. Dans cette publication, nous la démonstration de méthodes de culture de M. tuberculosebiofilms dans une bouteille et un format de plaque à 12 puits, ce qui est pratique pour les études bactériologiques ainsi que génétiques. Nous avons décrit le protocole d'une souche atténuée de M. la tuberculose, mc 2 7000, avec la suppression dans les deux locus, panCD et RD1, qui sont cruciaux pour la croissance in vivo de la 9 pathogène. Cette souche peut être utilisé sans danger dans une enceinte BSL-2 pour la compréhension de la biologie de base de l'agent pathogène tuberculose évitant ainsi l'exigence d'un coûteux BSL-3 installation. La méthode peut être étendue, moyennant des modifications appropriées dans les médias, à se développer un biofilm d'autres espèces de mycobactéries cultivables.
Dans l'ensemble, un protocole uniforme de biofilms culture mycobactérienne aidera les enquêteurs s'intéressent à l'étude des caractéristiques de base élastiques de mycobactéries. En outre, une méthode claire et concise de la croissance des biofilms mycobactériens aidera également le inv clinique et pharmaceutiqueestigators pour tester l'efficacité d'un médicament potentiel.
Protocole
1. Biofilms plus en plus de M. la tuberculose dans une bouteille de 250 mL vis plafonné
- La préparation des médias: Dissoudre 0,5 g de KH 2 PO 4, 0,5 g de MgSO 4, 4 g de L-asparagine, 2g d'acide citrique, 0,05 g de citrate d'ammonium ferrique, 60mL de glycérol dans 900 ml d'eau. Ajuster le pH à 7,0 avec NaOH. Autoclave, frais et juste avant de commencer l'expérience, ajouter stérile ZnSO 4 à une concentration finale de 0,1% p / v Depuis mc 2 7000 est un auxotrophe pantothénate cette souche nécessite également de l'acide pantothénique à 10μg/mL de concentration finale.
Note: Ceci est une composition standard des médias Sauton utilisés pour M. tuberculosis. Toutefois, si nécessaire d'autres médias spécialisés peuvent également être utilisés pour d'autres espèces de mycobactéries.
- La préparation des inoculums: Grow M. la tuberculose dans 7H9OADC avec 0,05% de Tween-80 pendant une semaine, ou DO 600 de 0,7 à 1,0. Le culture peut être directement utilisée comme inoculum à une dilution de 1:100.
- Distribuer 25 ml de Sauton médias à une bouteille de 250 ml en polystyrène vis plafonné (Corning). Ajouter 250μl de l'inoculum dans le milieu, bouchon de la bouteille très serré et le placer tranquillement dans un incubateur humidifié 37 ° C pendant 3 semaines. Observez la bouteille une fois par jour pour s'assurer qu'il n'y a pas de contamination.
- A la fin de la troisième semaine, dévisser le bouchon de la bouteille afin de permettre une nouvelle croissance de M. la tuberculose à l'interface. Si le bouchon n'est pas desserré, à ce stade, puis la concentration en oxygène insuffisante dans le conteneur va retarder la croissance des bactéries encore.
2. La croissance de M. biofilms tuberculose dans des plaques 12 puits
- Préparer les médias et l'inoculum de mc 2 7000 tel que décrit dans les sections A1 et A2.
- Mélanger 60 ml de médias avec 600μl d'inoculum. Distribuer 4,5 millions deL du mélange dans chaque puits de la plaque. Recouvrir la plaque avec un couvercle. Envelopper la plaque à plusieurs reprises avec du parafilm. Incuber la plaque tranquillement dans incubateur humidifié à 37 ° C pendant 5 semaines.
3. Détermination de la fréquence des persistants de drogues tolérantes en M. la tuberculose biofilms
- Grow M. biofilms tuberculose dans un format de 12 puits comme décrit dans la section B. Cela va prendre un total d'environ 5 semaines de.
- Une fois que les biofilms sont élevés (après 5 semaines d'incubation) d'injecter votre choix de l'antibiotique à une concentration désirée dans les médias sous les biofilms en utilisant une microsonde dans une pipette.
Remarque: Le volume des médias sous les pellicules réduit à environ 3.0mL. Donc, les enquêteurs devraient donc calculer la quantité de médicament.
- Swirl doucement la plaque de sorte que l'antibiotique est bien diffusé dans le milieu. Pour obtenir des résultats statistiquement significatifs, injecter le antibiotiquesotique dans quatre puits. En parallèle, injecter le même volume de solvant dans lequel l'antibiotique a été dissous dans quatre autres puits, et de laisser les quatre derniers puits de la plaque vierge. Recouvrir la plaque avec un couvercle et de mettre de nouvelles couches de parafilm autour de la plaque. Placez-le revenir dans l'incubateur pour la période désirée.
- À la fin de l'incubation, ouvrir la plaque et ajouter le Tween-80 à la concentration finale de 0,1% (volume / volume) dans chacun des puits. Swirl toute la plaque en douceur pour la dispersion uniforme du détergent. Incuber la plaque à température ambiante pendant 15 minutes. Mélanger le contenu de chaque puits avec la pipette plusieurs fois afin que le contenu entier peut être uniformément transférés à un tube de 15 ml conique.
- Centrifuger le contenu du tube à 4000rpm pendant 10 minutes à température ambiante. Reprendre le culot dans 5 ml de tampon de lavage fraîche (PBS avec 10% de glycérol et 0,05% de Tween-80). Répétez les trois temps de lavage. Reprendre le culot dans 5 ml de tampon de lavage. Gardez-le sur la bascule pour overnight à 4 ° C.
Remarque: Bien que basse température a été initialement développé pour M. smegmatis (afin de minimiser sa croissance lors de la dispersion) et utilisé pour M. tuberculosis ainsi, les espèces à croissance lente peut très probablement être secoué à la température ambiante sans aucun impact sur le résultat. Rocking à la température ambiante pourrait être nécessaire si vous travaillez dans BSL-3 installation.
- Préparer une seringue stérile équipée micropointe (2-200 pl), en coupant son extrémité la plus large à la taille appropriée, en l'adaptant à la seringue et l'envelopper avec du parafilm. Passez l'ensemble du contenu du tube à travers la seringue à embout-équipée et recueillir dans un des tubes de 15 ml frais. Répétez cette étape 5 à 6 fois jusqu'à ce que vous observez une suspension assez homogène.
- Préparer des dilutions en série de la suspension et la plaque des dilutions sur la plaque 7H11OADC pour déterminer le nombre de colonies viables dans chaque puits. Incuber les boîtes pendant trois semaines à 37 ° C incubateur. Déterminer la fréCY d'objets persistants dans la population biofilm en calculant le rapport du nombre de colonies obtenues dans antibiotique traitée à celles obtenues lors de solvant plaques traitées.
4. Les résultats représentatifs
Lorsqu'elle est cultivée dans une bouteille, la croissance de M. la tuberculose peut être vu à la base de la bouteille à la fin de la première semaine. À la fin de la deuxième semaine, la croissance inégale des bactéries sur l'interface air-support peut être vu, même si la croissance à l'interface air-media est toujours visible à la fin de la troisième semaine (fig. 1A). À ce moment de la fixation des bactéries à la paroi du récipient est également observée. A partir de ce point de la croissance de la culture se fait principalement sur l'interface air-médias. Le liquide sous la surface de la croissance est clair. En règle générale, la structure évolue d'ici la fin de la cinquième semaine (figure 1B). Si l'incubation est prolongée, les structures de va commencer à couler au fond du récipient. Curieusement,serrage du bouchon jusqu'à la fin de la troisième semaine est une étape importante dans le processus, et pour des raisons inconnues une bouteille lâche-capped retarde significativement l'initiation de la croissance sur l'interface 9.
Dans le format de 12 puits, un biofilm robuste à l'interface air-médiatique est perçue dans chacun des puits à la fin de cinq semaines (figure 2A). Si les plaques ne sont pas enveloppés complètement, puis la croissance du biofilm différentiel est observée. Dans le pire des cas, l'évaporation importante des médias peuvent retarder la croissance des bactéries (figure 2B). Ainsi, l'emballage de la plaque est nécessaire à la fois pour empêcher l'évaporation ainsi que de fournir un environnement pour la formation de biofilm (voir paragraphe précédent).
Le nombre de bacilles viables dans les biofilms déterminés avec cette technique est tout à fait reproductible. Réponse de M. tuberculose biofilms varie avec la nature des antibiotiques. Pour un antibiotique bactéricide tels que la rifampicine, la perte de la viabilité suit une bipha tendance sic 9. Un déclin rapide de la viabilité au cours des trois à quatre premiers jours, suivie d'une phase persistante dans laquelle un petit pourcentage de la population restent totalement récalcitrant aux antibiotiques, quelle que soit la concentration de l'antibiotique ou le temps d'exposition. La figure 3 montre le nombre de bacilles viables dans les biofilms matures après une exposition de 7 jours à 50μg/mL (50 fois plus élevé que le MIC) de la rifampicine.

Figure 1A. Apparition précoce de M. bacilles de la tuberculose sur l'interface air-media de bactéries après 3 semaines d'incubation.

La figure 1B. Elevage biofilms de M. la tuberculose sur l'interface air-médias après cinq semaines d'incubation.
820/3820fig2A.jpg "/>
Figure 2A. 5-semaine biofilms vieux de M. la tuberculose cultivé dans 12 puits de format.
La figure 2B. Une tentative a échoué à croître M. biofilms tuberculose dans 12 puits de plaque sans parafilm.
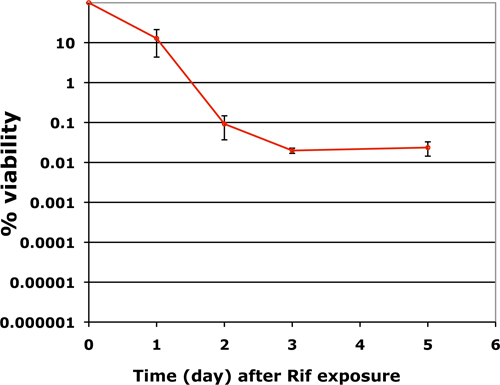
Figure 3. Un graphique représentatif sur la fréquence des persistants de drogues tolérantes en M. la tuberculose biofilms cultivés dans 12 puits format et exposées à 50μg/mL de rifampicine pendant sept jours.
Discussion
La tuberculose (TB), causée par l'infection de Mycobacterium tuberculosis, demeure une menace majeure pour la santé publique mondiale. Près d'un tiers de la population mondiale est estimée à asymptomatique infecté par l'agent pathogène, environ 9 millions de nouveaux cas apparaissent chaque année dans la clinique avec des symptômes de tuberculose évolutive et environ 1,7 million de personnes meurent de l'infection chaque année 11. Le lourd fardeau de la maladie est principa...
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Le travail a été réalisé avec le soutien financier de l'Institut national de la Santé et l'American Lung Association.
matériels
| Name | Company | Catalog Number | Comments |
| Incubator | VWR international | Model # 1923/25 | |
| Polystyrene culture bottles | Fisher Scientific | 03-374-300 | |
| 12-well tissue culture plate | VWR international | 62406-165 | |
| 50-mL conical tubes | VWR international | 89039-660 | |
| Rocker | Thermo Fisher Scientific, Inc. | 57019-662 | |
| Chromatographic refrigerator | VWR international | 55702-520 | |
| petri dish | VWR international | 25384-342 | |
| KH2PO4 (monobasic) | EMD Millipore | PX1565-1 | |
| MgSO4 | Fisher Scientific | M65-500 | |
| L-asparagine | Sigma-Aldrich | A4284-100G | |
| citric acid | Sigma-Aldrich | C1857-100G | |
| ferric ammonium citrate | Sigma-Aldrich | F5879-100G | |
| glycerol | EMD Millipore | GX0185-5 | |
| NaOH | Sigma-Aldrich | S8045-500G | |
| ZnSO4 | Sigma-Aldrich | Z4750-500G | |
| D-pantothenic acid | Sigma-Aldrich | P2250-25G | |
| Difco Middlebrook 7H9 Broth | BD Biosciences | 271310 | |
| Middlebrook OADC Enrichment | BBL | 212351 | |
| Tween-80 | Fisher Scientific | T164-500 | |
| 250mL storage bottle | Corning | 430281 | |
| 12 well plates | Falcon BD | 353043 | |
| rifampicin | Sigma-Aldrich | R3501-1G | |
| methanol | JT Baker | 9070-05 | |
| 10mlLsyringe | BD Biosciences | 301604 | |
| 1-200μL pipet tips | VWR international | 89079-458 | |
| parafilm M | VWR international | PM-996 | |
| 15mL centrifuge tube | Greiner Bio-One | 188-285 | |
| Difco Mycobacteria 7H11 Agar | BD Biosciences | 283810 | |
| NaCl | Fisher Scientific | BP358-1 | |
| KCl | Sigma-Aldrich | P9333-500G | |
| Na2HPO4 (dibasic) | Sigma-Aldrich | S0876-500G |
Références
- Saltini, C. Chemotherapy and diagnosis of tuberculosis. Respir. Med. 100, 2085-2097 (2006).
- Hall-Stoodley, L., Stoodley, P. Biofilm formation and dispersal and the transmission of human pathogens. Trends Microbiol. 13, 7-10 (2005).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Curr Opin Microbiol. 9, 588-594 (2006).
- Henke, J. M., Bassler, B. L. Bacterial social engagements. Trends Cell Biol. 14, 648-656 (2004).
- Kolter, R., Losick, R. One for all and all for one. Science. 280, 226-227 (1998).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Ojha, A. GroEL1: a dedicated chaperone involved in mycolic acid biosynthesis during biofilm formation in mycobacteria. Cell. 123, 861-873 (2005).
- Ojha, A. K. Growth of Mycobacterium tuberculosis biofilms containing free mycolic acids and harbouring drug-tolerant bacteria. Mol. Microbiol. 69, 164-174 (2008).
- Ojha, A. K., Trivelli, X., Guerardel, Y., Kremer, L., Hatfull, G. F. Enzymatic hydrolysis of trehalose dimycolate releases free mycolic acids during mycobacterial growth in biofilms. J. Biol. Chem. 285, 17380-17389 (2010).
- Dye, C., Lonnroth, K., Jaramillo, E., Williams, B. G., Raviglione, M. Trends in tuberculosis incidence and their determinants in 134 countries. Bull World Health Organ. 87, 683-691 (2009).
- Jindani, A., Dore, C. J., Mitchison, D. A. Bactericidal and sterilizing activities of antituberculosis drugs during the first 14 days. Am. J. Respir. Crit. Care Med. 167, 1348-1354 (2003).
- Carter, G., Wu, M., Drummond, D. C., Bermudez, L. E. Characterization of biofilm formation by clinical isolates of Mycobacterium avium. J. Med. Microbiol. 52, 747-752 (2003).
- Hall-Stoodley, L., Lappin-Scott, H. Biofilm formation by the rapidly growing mycobacterial species Mycobacterium fortuitum. FEMS Microbiol. Lett. 168, 77-84 (1998).
- Alibaud, L. Temperature-dependent regulation of mycolic acid cyclopropanation in saprophytic mycobacteria: role of the Mycobacterium smegmatis 1351 gene (MSMEG_1351) in CIS-cyclopropanation of alpha-mycolates. J. Biol. Chem. 285, 21698-21707 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon