Method Article
Détermination du nombre de cellules de mammifères, taille des cellules et la santé des cellules à l'aide du Moxi Mini Z Compteur de cellules automatisé
Dans cet article
Résumé
Le Moxi Z miniature compteur de cellules automatisé est un nouvel instrument qui combine le principe Coulter avec la technologie brevetée du capteur à couche mince et d'un algorithme logiciel propriétaire pour effectuer le calibrage et le comptage d'une gamme de taille large de particules ainsi que pour déterminer la santé globale de monodisperse cultures de cellules de mammifères. Ce protocole décrit l'utilisation de cet instrument pour le comptage et l'évaluation de la santé des cultures cellulaires.
Résumé
Particle and cell counting is used for a variety of applications including routine cell culture, hematological analysis, and industrial controls1-5. A critical breakthrough in cell/particle counting technologies was the development of the Coulter technique by Wallace Coulter over 50 years ago. The technique involves the application of an electric field across a micron-sized aperture and hydrodynamically focusing single particles through the aperture. The resulting occlusion of the aperture by the particles yields a measurable change in electric impedance that can be directly and precisely correlated to cell size/volume. The recognition of the approach as the benchmark in cell/particle counting stems from the extraordinary precision and accuracy of its particle sizing and counts, particularly as compared to manual and imaging based technologies (accuracies on the order of 98% for Coulter counters versus 75-80% for manual and vision-based systems). This can be attributed to the fact that, unlike imaging-based approaches to cell counting, the Coulter Technique makes a true three-dimensional (3-D) measurement of cells/particles which dramatically reduces count interference from debris and clustering by calculating precise volumetric information about the cells/particles. Overall this provides a means for enumerating and sizing cells in a more accurate, less tedious, less time-consuming, and less subjective means than other counting techniques6.
Despite the prominence of the Coulter technique in cell counting, its widespread use in routine biological studies has been prohibitive due to the cost and size of traditional instruments. Although a less expensive Coulter-based instrument has been produced, it has limitations as compared to its more expensive counterparts in the correction for "coincidence events" in which two or more cells pass through the aperture and are measured simultaneously. Another limitation with existing Coulter technologies is the lack of metrics on the overall health of cell samples. Consequently, additional techniques must often be used in conjunction with Coulter counting to assess cell viability. This extends experimental setup time and cost since the traditional methods of viability assessment require cell staining and/or use of expensive and cumbersome equipment such as a flow cytometer.
The Moxi Z mini automated cell counter, described here, is an ultra-small benchtop instrument that combines the accuracy of the Coulter Principle with a thin-film sensor technology to enable precise sizing and counting of particles ranging from 3-25 microns, depending on the cell counting cassette used. The M type cassette can be used to count particles from with average diameters of 4 - 25 microns (dynamic range 2 - 34 microns), and the Type S cassette can be used to count particles with and average diameter of 3 - 20 microns (dynamic range 2 - 26 microns). Since the system uses a volumetric measurement method, the 4-25 microns corresponds to a cell volume range of 34 - 8,180 fL and the 3 - 20 microns corresponds to a cell volume range of 14 - 4200 fL, which is relevant when non-spherical particles are being measured. To perform mammalian cell counts using the Moxi Z, the cells to be counted are first diluted with ORFLO or similar diluent. A cell counting cassette is inserted into the instrument, and the sample is loaded into the port of the cassette. Thousands of cells are pulled, single-file through a "Cell Sensing Zone" (CSZ) in the thin-film membrane over 8-15 seconds. Following the run, the instrument uses proprietary curve-fitting in conjunction with a proprietary software algorithm to provide coincidence event correction along with an assessment of overall culture health by determining the ratio of the number of cells in the population of interest to the total number of particles. The total particle counts include shrunken and broken down dead cells, as well as other debris and contaminants. The results are presented in histogram format with an automatic curve fit, with gates that can be adjusted manually as needed.
Ultimately, the Moxi Z enables counting with a precision and accuracy comparable to a Coulter Z2, the current gold standard, while providing additional culture health information. Furthermore it achieves these results in less time, with a smaller footprint, with significantly easier operation and maintenance, and at a fraction of the cost of comparable technologies.
Protocole
1. Préparation des échantillons
- Diluer la suspension de cellules avec ORFLO diluant ou un diluant approprié de sorte que la concentration cellulaire se situe dans la plage de fonctionnement de l'instrument (3000 à 500 000 cellules par millilitre de type M de cassette ou de 3000 à 2.500.000 cellules / mL dans la cassette de type S).
- Une dilution de 1:5 à 1:20 (Type M cassette) ou pas de dilution à 1:5 de dilution (cassette de type S) est recommandé pour les lignées cellulaires de mammifères les plus, mais la dilution appropriée dépendra du type de cellule et de la densité de semis. Le volume nécessaire pour un décompte précis est d'environ 75 pi.
2. Le traitement des échantillons
- Tournez le Z Moxi en appuyant sur le bouton d'alimentation et de l'écran d'accueil s'affiche.
- Appuyez sur le plateau vers le bas et insérez une cassette dans le Z. Moxi L'échantillon pipette 75μL ... l'écran sera affiché.
- Pipeter un échantillon 75 pL dans l'orifice de remplissage de la cassette (ovale bleunumérotés de 1 ou 2, selon le fin de la cassette a été insérée dans l'instrument). Ce sont des cassettes jetables, qui peuvent être utilisés pour les tests 2. Remarque: Placez la pointe de pipette directement dans le chargement et à ~ 45 ° angle de sorte que la pointe est pris sous la lèvre avant du puits. Lors de la distribution, il est important que le vide n'est pas «aller de l'avant» de la distribution du fluide que pourrait causer des poches d'air d'entrer dans la cassette. Il est recommandé d'avoir une petite perle (la taille de l'entrée ainsi) de la forme liquide sur le bien pendant la distribution.
- Pour le comptage des cellules de mammifères les plus, touchez l'écran n'importe où pour commencer. Pour le comptage des particules très petites (de 4 à 8 um de diamètre en moyenne pour le type M et 3-8 um de diamètre en moyenne pour le type S), le Z Moxi peut être exécuté en mode petites particules. Note: le type de cassette est indiqué dans la barre noire dans la partie supérieure de l'écran. Dans ce mode, Moxi Z définit l'échelle de diamètre de 2 à 10 um que la valeur par défaut, et réalise la numération uchanter paramètres optimisés pour la détection de petites cellules. Appuyez sur la touche TOUCH voici un petit bouton Mode de particules (carré noir) pour lancer le test et exécuter dans ce mode.
- Le Z Moxi va commencer le test et les résultats de comptage de cellules sera terminée en environ 8 secondes (type M cassette) ou 15 secondes (cassette de type S).
- Le ajustement de courbe et calculs MVI commencer automatiquement et ne nécessitent que quelques secondes supplémentaires. Quand un ajustement approprié est trouvé, les résultats seront alors automatiquement affichée sur l'écran.
- Pour faire Gating le mode d'acquisition par défaut, appuyez sur la courbe d'ajustement sur le bouton pour basculer le comte en mode d'ouverture de porte.
- À ce stade, la cassette peut être enlevée de l'unité.
3. Gestion des données
- Si l'échelle AutoMode est éteint, les résultats sont d'abord présentés pour un compte d'ajustement de courbe sur une échelle de 2-34 pm de diamètre (type M cassette) ou 2-26 μm (cassette de type S). Si mise à l'échelle Automode est activé, le Z Moxi automatiquement l'échelle de l'axe horizontal (axe x) à la plage qui est plus proche de la largeur de la courbe de la population-forme tout en assurant toutes les données de courbe d'ajustement est affichée.
- Si l'échelle AutoMode est éteint, pour afficher manuellement les résultats à une résolution plus élevée, touchez l'icône 2-26 um (type M) ou sur l'icône 2-18 um (Type S). Remarque: Le type de cassette est indiqué dans la boîte bleue en haut à gauche de l'écran. Il est recommandé lors du comptage des cellules plus petites ou des particules d'améliorer à la fois les capacités d'ajustement de courbe ainsi que la capacité de l'utilisateur visuellement discrimination nuances des données.
- En augmentant la résolution horizontale, le bouton mise à l'échelle d'ajuster dynamiquement pour permettre à vélo entre les gammes disponibles échelle axe des x: 2-34, 2-26, 2-18 et 2-10 um pour la cassette de type M; ou 2 -26, 2-18, et 2-10 um pour la cassette du type S. Cette fonctionnalité est uniquement dispoble immédiatement après une numération cellulaire.
- Compter informations (cellules par ml) pour la courbe d'ajustement ou de la région fermée est affichée dans une zone noire sous le côté gauche de l'histogramme. Moyenne taille de la cellule d'information est affichée dans la boîte noire sous le côté droit de l'histogramme.
- La valeur MVI est affichée une boîte bleue en haut à droite de l'histogramme. Si le test a été exécuté en mode petite particule, la MVI ne s'applique pas et sera affiché comme «MVI = SPM». En outre, si la concentration de cellules est en dehors de la plage de fonctionnement MVI, un message de «MVI = Out of Range" sera affiché.
- Pour enregistrer l'histogramme en cours, touchez l'icône Terminé. Cela permet d'économiser les données avec un nom de «Test XXX" où XXX est le numéro de test correspondant.
- Pour régler manuellement la porte de l'histogramme, appuyez sur pour basculer l'Fit Curve compte des résultats sur le bouton. Cela rend Gating le mode d'acquisition par défaut. Ensuite, faites glisser chaque marqueur de déclenchement bleu pour définir les portes ou appuyez sur eflèches e gauche et droite (ceux-ci apparaissent en touchant le marqueur de porte bleu) d'ajustement de grille fines seules les cellules entre les marqueurs sont comptés. L'échelle verticale histogramme est automatiquement redimensionnée en fonction de l'amplitude de la population courbe d'ajustement. Pour régler cette échelle verticale, faites glisser l'écran vers le haut ou vers le bas dans la région histogramme.
- Touchez le comte Gated bouton résultats pour ramener l'affichage en mode d'ajustement de courbe et de faire en mode ajustement de la courbe du mode d'acquisition par défaut.
- Ensuite, appuyez sur l'icône Terminé pour enregistrer les résultats et revenir à l'écran d'accueil. Pour supprimer les résultats, appuyez sur l'icône supprimer à tout moment pour supprimer définitivement les résultats du test.
4. L'analyse des données précédemment acquises
- Pour ouvrir un test enregistrés, appuyez sur l'icône Histogramme sur l'écran d'accueil.
- Icônes pour un maximum de neuf histogrammes enregistrées seront affichées sur l'écran.Appuyez sur l'icône appropriée pour le critère de l'intérêt ou appuyez sur la Page Up et Page Down icônes pour afficher les résultats de tests plus.
- Chaque histogramme sera ouvert dans le mode de comptage soit Curve Fit ou mode de comptage Gated, selon la façon dont il a été enregistré. En mode de comptage Gated, marqueurs de déclenchement peuvent être positionnés comme vous le souhaitez en faisant glisser chaque marqueur de déclenchement bleu indépendamment. Porte automatique en touchant sur le sommet désiré. Touchez pour basculer entre le comte et les modes Gated ajustement de la courbe de comptage.
- Appuyez sur les icônes de zoom et un zoom arrière pour régler l'échelle verticale de l'histogramme. L'échelle verticale peut également être modifié par la verticale passant un doigt sur la place d'affichage (pour augmenter) ou vers le bas (pour diminuer).
- Appuyez sur l'icône Supprimer pour supprimer définitivement les résultats du test.
- Appuyez sur l'icône Terminé pourfermer les résultats des tests et revenir à l'écran d'accueil. (Remarque: vue zoomée ne seront pas enregistrées.)
5. Transfert de données vers un PC
- Les données peuvent être transférées vers un PC en utilisant l'application Moxichart Orflo ou via transfert USB en branchant le câble USB Moxi Z à un PC ou un Mac. Pour le transfert Bluetooth (MoxiChart), d'abord déterminer ID Bluetooth de l'appareil en appuyant sur l'icône Bluetooth sur l'écran d'accueil de l'unité de Moxi Z.
- Sur l'ordinateur, ouvrez l'application MoxiChart et cliquez sur l'icône Bluetooth dans le coin supérieur droit. Puis, choisissez le périphérique qui correspond à l'ID Bluetooth du Z Moxi et sélectionnez un dossier de destination pour les fichiers téléchargés.
- Moxichart transférera automatiquement tous les fichiers dans le répertoire spécifié via la connexion Bluetooth.
- Les fichiers transférés par Bluetooth (MoxiChart) ou USB peut être ouvert et d'analysezed directement avec l'application MoxiChart ou, parce qu'ils sont formatés. csv, ils peuvent être ouverts directement dans Microsoft Excel ou d'autres programmes d'analyse de données pour l'analyse de plus / custom.
6. Les résultats représentatifs
Pour évaluer la précision et l'exactitude des Z Moxi, les chiffres de HEK-293, les cellules HeLa, CHO-K1, la levure, Jurkat E6-1 des cellules, des cellules PC12, et de précision calibré suspensions de perles avec des concentrations allant de 0-500,000 cellules / mL (de type M cassette) et 0-2-2.5e 6 cellules / ml (cassette de type S) ont été comptées et comparées en utilisant un Coulter Z2 et le Z. Moxi Tous les cellules de mammifères ont été obtenus à partir de l'American Type Culture Collection (ATCC) et cultivé comme décrit précédemment 7-11. Brièvement, les cellules ont été cultivées en suspension dans 75 mm 2 flacons de culture tissulaire avec les médias de base de RPMI 1640 (Jurkat E6-1, PC12), MEM (HEK-293, HeLa), ou F12K (CHO-K1) des cellules. Tous les médias a été complétée par10% de sérum de veau fœtal et 100 mg de streptomycine U penicillin/100. Flacons ont été maintenues dans un incubateur à 37 ° C avec 5% de CO 2. Les cellules ont été repiquées tous les 3 jours. Les cellules de levure (X5, C. albicans, Vin 13) ont été donnés et l'utiliser immédiatement comme prévu. Concentrations de l'échantillon initial de ~ 500.000 cellules / ml pour les données de type M et les cassettes de ~ 2-2.5e 6 cellules / ml pour la cassette du type S ont été établies en utilisant le Z2 Coulter. Subséquents des niveaux de concentration théoriques ont été préparés par dilutions successives avec des tampons physiologiques (Isoton II ou une solution saline équilibrée de Hank). À chaque concentration, des échantillons identiques ont été mesurées par les deux systèmes et représentées les unes des autres. Comme on le voit dans la figure 2, il y avait une forte corrélation linéaire (de type M r 2> 0,9886, Type S r 2> 0,9781) entre les chiffres pour tous les échantillons. Les concentrations ont également été comparés à des concentrations cellulaires attendus / théorique à la fois avec le Z et le Moxi Z2 ( Figure 3) et de nouveau fait preuve de fortes corrélations linéaires (de type M r 2> 0,9758, Type S r 2> 0.9774).
Pour évaluer la précision, HEK-293 et nombre de cellules HeLa ont été effectuées en utilisant le Z2 Coulter, Moxi Z, et un hémocytomètre. Le coefficient moyen de variation (CV, n = 19) des numérations cellulaires en utilisant le Z Moxi (Type M cassette), Coulter Z2 et un hémocytomètre ont été calculés avec CV est mesurée à partir de 5 chefs d'accusation distincts dans les cellules 200.000-300.000 / Gamme ml. La petite moyenne CV (Figure 4) de la Z Moxi est comparable à celle de la Z2 et est représentatif du niveau élevé de précision ne peut être atteinte avec Coulter technologies basées sur de comptage.
Dimensionnement de précision de l'instrument Moxi Z a été évaluée par la mesure suivante de perles achetées de précision, de polystyrène calibrées. Moyennes des mesures de taille de particules (n = 5) de Moxi Z ont été tracées selon des tailles de fabricant signalés. Comme on le voit in Figure 5, les mesures Moxi Z s'accompagnent pas les valeurs du fabricant avec une forte corrélation linéaire (r 2 = 0,9989).
Au-delà de la taille et les informations de comptage, Moxi Z fournit un réactif-libre, l'évaluation générale de la santé de culture cellulaire de mammifère avec un indice de viabilité Moxi rapporté (MVI) de valeur. Cet indice est généré à partir d'un rapport entre le nombre de cellules dans la population d'intérêt par rapport aux chiffres de particules totales. Pour démontrer les capacités de mesure MVI, lectures MVI (Type M cassette) ont été comparés au manuel standard et de cytométrie en flux techniques de mesure en direct / mort. Les populations de morts (<10% de viabilité) HEK-293 et les cellules HeLa ont été créées par des incubations nuit des cellules vivantes dans un fluorure de nutriments sans sodium, contenant un diluant (Isoton II, Beckman Coulter) à 37 ° C. Contrôlés les niveaux de viabilité théoriques ont été préparés par mélange ratiometrically des concentrations connues de cellules vivantes et mortes. Ressolutions ulting ont été analysés pour les niveaux de viabilité, en double exemplaire avec les chiffres et les mesures hémocytomètre deux cytomètre en flux. Mesures ont été faites hémocytomètre en utilisant une traditionnelle mélange 50/50 de 0,1% Solution bleu trypan et les cellules. Mesures de cytométrie de flux ont été faites en utilisant un cytomètre Goyave PCA (Merck) en utilisant le réactif Viacount et le fabricant spécifié par le protocole (Merck). Comme le montre la figure 6, les valeurs de coefficient de corrélation de Pearson (r 2) "de l'ajustement linéaire des données à MVI analogues pourcentages de viabilité hémocytomètre pour" cellules HEK et cellules HeLa ont été r 2 = 0,9937 et r 2 = 0,9728, respectivement. Ces résultats démontrent que cette approche fournit des informations de santé de la culture dans une large gamme de viabilités cellulaires qui se comparent favorablement aux mesures Live / Dead obtenus en utilisant un cytomètre en flux ou hémocytomètre.
Tableaux et figures (De Dittami et al, 2011.) 15:
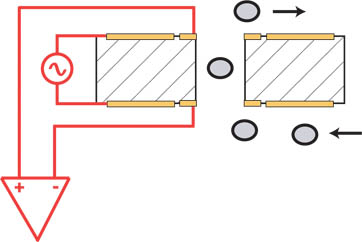
Figure 1. Thin-film de comptage Coulter: Le courant électrique est passé à travers la zone de cellule de détection de la cassette à film mince. Comme les cellules circuler seul fichier par l'intermédiaire du CSZ, les augmentations momentanées de tension sont mesurés par le Z. Moxi
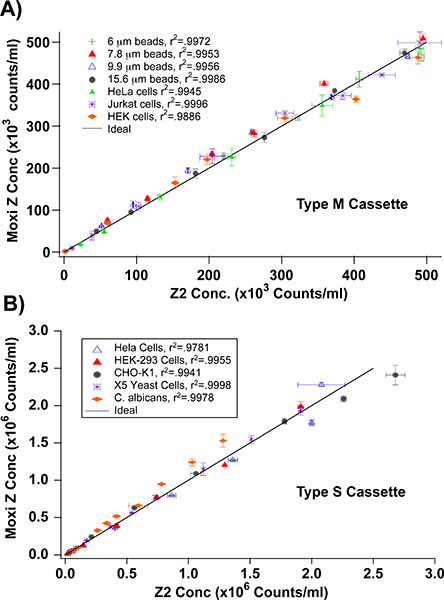
Figure 2. Moxi chiffres Z sont comparables à Coulter Z2 chiffres. Chiffres identiques de suspensions cellulaires et de talon ont été comptées en utilisant à la fois un Z2 Coulter et l'Z. Moxi Averaged valeurs de comptage (n = 3-4) des chiffres Z Moxi ont été tracées par rapport à la Coulter Z2 correspondant comtes et des valeurs r 2 de l'ajustement linéaire ont été déterminés. A) de type M cassette - gamme de concentration de 0 - 500.000 cellules par ml. B) la cassette de type S - gamme de concentration de 0 - 2-2.5e 6 / Bars ml.Error indiquent ± 1 écart-type.
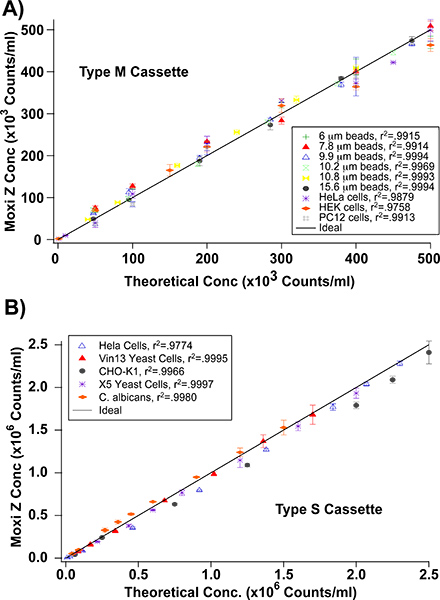
Figure 3. Mesures de concentration Moxi Z vs concentrations cellulaires théoriques. A) de type M cassette - des valeurs de concentration théoriques ont été préparés à partir de dilutions en série d'un 500.000 initiales cellules par ml d'échantillon B) de cassettes de type S -. Valeurs de concentration théoriques ont été préparés à partir de dilutions en série d'une initiale 2 - 2.5e 6 cellules / ml d'échantillon. Barres d'erreur indiquent ± écart-type 1.
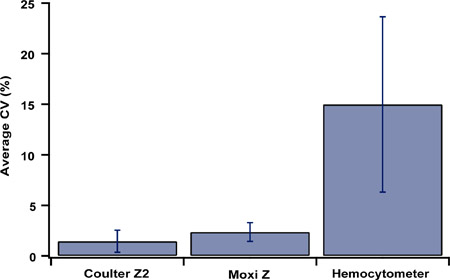
Figure 4. Coefficient de variation pour le Z2 Coulter, Moxi Z (Type M cassette), et hémocytomètre. Le coefficient moyen de variation (CV, n = 19) de cellules HEK-293 et nombre de cellules HeLa pour chaque approche ont été calculés avec CV mesurées à partir de 5 séparés chefs d'accusation de HEK-293 et les cellules HeLa dans le 200.000 - 300.000 cellules par ml. gamme Barres d'erreur indiquent ± écart-type 1.
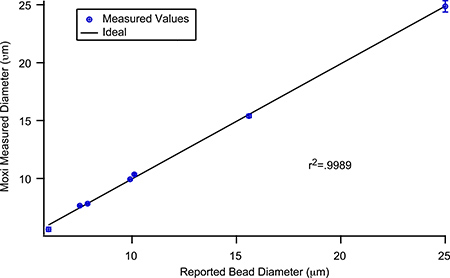
Figure 5. Précision des mesures de taille de particules en utilisant Moxi Z-Z Moxi mesurée taille des billes (Type M cassette) vs fabricant indique la taille du cordon. Barres d'erreur indiquent ± écart-type 1.
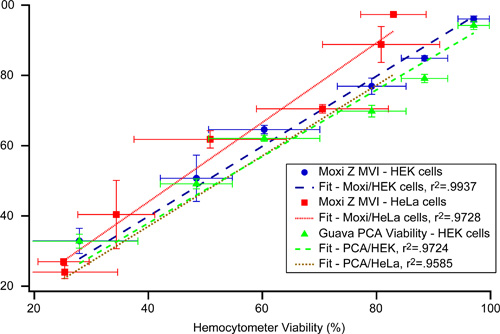
Figure 6. Évaluation de la santé de la culture à l'aide MVI - Comparaison des mesures de MVI (Type M cassette) et Goyave PCA Viacount viabilité par rapport visuels, trypan bleu compte de la viabilité colorées à l'aide d'un hémocytomètre.
Discussion
La mise en œuvre de l'approche sous-jacente Coulter peut être très déterministe de la précision globale des mesures. Une zone critique est la correction des numérations cellulaires premières pour «coïncidence» des événements où deux ou plusieurs cellules en même temps passer à travers l'ouverture et sont évalués comme un seul événement électrique. «Les événements de coïncidence" contribuer à l'erreur qui varie en fonction d'un certain nombre de facteurs, y compris la taille des cellules et le degré de regroupement (Davis et al 1967) 6. En conséquence, la correction de coïncidence requise pour un échantillon donné ne peut être prédit, variant considérablement entre les cellules / particules types et même entre les différentes cultures de types de cellules identiques. Créée théorie, ancrée dans les publications initiales par Coulter, consiste à appliquer un ajustement logarithmique des données brutes sur la base du nombre d'événements observés et empiriquement déterminée, le facteur de correction de particules spécifique, z. Bien que des chiffres exacts peuvent être correctement réalisé avec tson algorithme de correction, il est limité dans son application pratique en raison des grandes variations de valeurs de z entre les types de cellules et de la difficulté de prévoir avec exactitude correspondant à sa valeur. Ici, en utilisant le nombre "vrai" cellule identifiée par le raccord Moxi courbe Z en conjonction avec l'algorithme de correction de coïncidence, le Z Moxi corrige de façon dynamique pour une coïncidence pour obtenir les concentrations réelles. Lorsque comparés aux résultats obtenus à l'aide de haut de gamme Coulter Z2, Z Moxi produit compte comparables à travers une gamme de concentration de 0 à 500.000 cellules / ml (de type M cassette) et 3000 - 2-2.5e 6 cellules / ml (cassette de type S) . En outre, le Z Moxi atteint cette précision de comptage avec un coefficient similaire faible variation dans le nombre et la précision dans granulométrie qui est caractéristique de l'étalon-or, Coulter-technique dans le comptage des cellules.
En outre, les données présentées ici indiquent que le Z Moxi peut fournir de précieuses informationsen ce qui concerne la santé globale des cultures cellulaires. Le Z Moxi s'appuie sur l'approche d'ajustement de courbe avec un algorithme de logiciel propriétaire pour déterminer ce bilan de santé de la culture. Les modifications morphologiques associées à la mort cellulaire, tels que blebbing, se décomposer, et les distorsions volumétriques (Kataoka et Tsuruo 1996, Liegler et al 1995, Sheridan et al 1981) 12-14, permettent à l'Moxi-Z à distinguer les différences entre les impédimétriques vivent les populations et les morts cellulaires / débris des populations. Le MVI est généré par l'analyse de la distribution de la taille de la culture / particules pour identifier les contributions relatives des débris de particules, rétrécis cellules nécrotiques, et la courbe ajustée-population de cellules d'intérêt. La valeur MVI reflète donc un indice de population ou d'une mesure ratiométrique des chiffres de population monodisperses en ce qui concerne le profil de la population globale des particules. Cette valeur est alors algorithmiquement-ajustées des statistiques basées sur la population et des observations empiriques. Because de la MVI regarde d'autres paramètres que les approches traditionnelles de coloration, on ne s'attend pas à refléter ces techniques, mais fournit plutôt un autre point de vue précieux sur la santé d'une culture cellulaire, en particulier en ce qui concerne les débris et les contaminants microbiens.
En résumé, le compteur de cellules Moxi-Z est un instrument de paillasse ultra léger qui fournit des analyses précises, reproductibles de comptage des cellules, la taille des cellules, et la santé des cellules en utilisant le principe de Coulter et des algorithmes logiciels d'ajustement de courbe combinée avec une technologie de capteur à couche mince brevetée . Avec la cassette de type M, il est capable de compter des particules allant de 4 à 25 microns de diamètre (plage dynamique de 2 - 34 microns), en 8 secondes. Avec cassette du type S, il est capable de compter des particules allant de 3 à 20 microns de diamètre (plage dynamique de 2 - 26 microns), en 15 secondes. En outre, le Moxi-Z effectue des évaluations de santé, sans l'utilisation de réactifs. C'est intégration du travail beaucoup moinsnsive et subjective que le comptage manuel. En comparaison à la norme Coulter comptage, le Moxi est plus rapide, beaucoup plus petite, fournit de plus amples renseignements, nécessite un entretien beaucoup moins, c'est plus facile à utiliser, et est une fraction du coût.
Déclarations de divulgation
Gregory M. Dittami et SE Ayliffe sont des employés de Technologies Orflo, la société qui a conçu, fabrique et vend le Moxi Z. Richard D. Rabbitt fournit à temps partiel, de l'expertise de conseil versés aux technologies de l'Orflo.
La production et l'accès gratuit à cet article est sponsorisé par Technologies Orflo.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| ORFLO diluant | ORFLO | MXA006 | |
| Distributeur Cassette | ORFLO | Stocke jusqu'à 25 cassettes pour pratique de distribution | |
| Câble USB | ORFLO | Connecte instrument pour PC / Mac ou d'un adaptateur | |
| Adaptateur secteur (modèles américains et européens seulement) | ORFLO | Connecte le câble USB à une prise secteur | |
| USB Flash Drive | ORFLO | Magasins Moxi le logiciel Z et mode d'emploi | |
| Perles Vérifier l'étalonnage | ORFLO | ||
| Cassette d'étalonnage électronique | ORFLO | Cassette électronique pour vérifier le fonctionnement correct du système et d'étalonnage |
Références
- Fernyhough, M. E., Helterline, D. L., Vierck, J. L., Hill, R. A., Dodson, M. V. Coulter counter use in the enumeration of muscle and fat stem cells. Methods. Cell. Sci. 25, 221-225 (2003).
- Blades, A. N., Flavell, H. C. Observations on the use of the Coulter model D electronic cell counter in clinical haematology. J. Clin. Pathol. 16, 158-163 (1963).
- Morris, T. M. Particle Size Analysis of Beer Solids using a Coulter Counter. J. Inst. Brew. 90, 162-166 (1984).
- Marth, E. H. Electronic Somatic Cell Counting Procedure. Standard Methods for the Examination of Dairy Products. , 134-140 (1978).
- Parks, L. R., Jurbergs, K. A. Number and size distribution of particles in cellulosic solutions. J. Appl. Polym. Sci. 11, 193-199 (1960).
- Davis, R. E., Green, R. E. Automatic platelet counting with the Couler particle counter. J. Clin. Pathol. 20, 777-779 (1967).
- Dittami, G. D., Rabbitt, R. D. Electrically evoking and electrochemically resolving quantal release on a microchip. Lab on a Chip. 10, 30-35 (2010).
- Nahreini, P., Hanson, A., Prasad, K. High-yield production of recombinant antibody fragments in HEK-293 cells using sodium butyrate. BioTechiques. 34, 968-972 (2003).
- Escuyer, V., Collier, R. J. Anthrax Protective Antigen Interacts with a Specific Receptor on the surface of CHO-K1 Cells. Infection and Immunity. 59, 3381-3386 (1991).
- Isaacs, R. D. Borrelia bugdorferi bind to epithelial cell proteoglycans. J. Clin. Invest. 93, 809-819 (1994).
- Saito, Y., Takahashi, K. Characterization of selenoprotein P as a selenium supply protein. Eur. J. Biochem. 269, 5746-5751 (2002).
- Kataoka, S., Tsuruo, T. Physician Education: Apoptosis. Oncologist. 1, 399-401 (1996).
- Liegler, T. J., Hyun, W., Yen, T. S., Stites, D. P. Detection and quantification of live, apoptotic, and necrotic human peripheral lymphocytes by single-laser flow cytometry. Clin. Diagn. Lab Immunol. 2, 369-376 (1995).
- Sheridan, J. W., Bishop, C. J., Simmons, R. J. Biophysical and morphological correlates of kinetic change and death in a starved human melanoma cell line. J. Cell. Sci. 49, 119-137 (1981).
- Dittami, G. M., Rabbitt, R. D., Ayliffe, H. E. ORFLO Moxi Z: Revolutionizing electronic cell count accuracy and cell viability estimates through curve fitting. Life Science Magazine, VWR International. , (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon