Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Test in vitro avec dégagement mésothéliales que les modèles les étapes précoces de métastases du cancer de l'ovaire
Dans cet article
Résumé
Le dosage jeu mésothéliales décrite ici prend avantage des cellules marquées par fluorescence et la microscopie vidéo time-lapse de visualiser et de mesurer quantitativement les interactions de sphéroïdes multicellulaires cancer de l'ovaire et les monocouches de cellules mésothéliales. Ce test modélise les étapes précoces de métastases du cancer de l'ovaire.
Résumé
Cancer de l'ovaire est le cinquième cause de décès liés au cancer aux États-Unis 1. Malgré une réponse positive initiale à des thérapies, de 70 à 90 pour cent des femmes atteintes d'un cancer de l'ovaire développent des métastases nouvelles, et la récidive est souvent mortelle 2. Il est donc nécessaire de comprendre comment des métastases secondaires surviennent dans le but de développer de meilleurs traitements pour le cancer de l'ovaire stade intermédiaire et tardive. Métastases cancer de l'ovaire se produit lorsque les cellules malignes se détacher de la tumeur primaire et de diffuser dans toute la cavité péritonéale. Les cellules disséminées peuvent former des amas multicellulaires, ou sphéroïdes, qui soit rester seules, ou d'implants sur les organes dans la cavité péritonéale 3 (Figure 1, Film 1).
Tous les organes à l'intérieur de la cavité péritonéale sont revêtues d'un unique, continue, la couche de cellules mésothéliales 4-6 (figure 2). Cependant, les cellules mésothéliales sont absents de dessousmasses tumorales péritonéales, tels que révélés par les études d'un microscope électronique excisées de l'homme des coupes de tissus tumoraux 3,5-7 (Figure 2). Ceci suggère que les cellules mésothéliales sont exclus du dessous de la masse tumorale par un processus inconnu.
Précédent dans des expériences in vitro ont démontré que des cellules primaires de cancer de l'ovaire joindre plus efficacement à la matrice extracellulaire que de cellules mésothéliales 8, et des études plus récentes ont montré que les cellules mésothéliales péritonéales primaires fournissent effectivement un obstacle à l'adhésion cellulaire et l'invasion de l'ovaire (par rapport à l'adhérence et l'invasion sur des substrats qui n'ont pas été couverts avec des cellules mésothéliales) 9,10. Cela suggère que les cellules mésothéliales agir comme une barrière contre les métastases du cancer de l'ovaire. Les mécanismes cellulaires et moléculaires par lesquels les cellules cancéreuses de l'ovaire abus de cette barrière, et d'exclure le mésothélium ont, jusqu'à récemment, est resté inconnu.
Nous décrivons ici ela méthodologie e pour un test in vitro que les modèles de l'interaction entre les sphéroïdes cellulaires de cancer ovarien et les cellules mésothéliales in vivo (figure 3, Film 2). Notre protocole a été adapté à partir des méthodes décrites précédemment pour l'analyse des interactions de cellules tumorales ovariennes avec des monocouches mésothéliales 8-16, et a d'abord été décrite dans un rapport montrant que les cellules tumorales ovariennes d'utiliser une activation de l'intégrine-dépendante de la myosine et la force de traction afin de promouvoir l'exclusion de la à partir de cellules mésothéliales en vertu d'une tumeur 17 sphéroïde. Ce modèle tire parti de time-lapse microscopie à fluorescence pour surveiller les populations de cellules deux en temps réel, fournissant des informations spatiales et temporelles de l'interaction. Les cellules cancéreuses ovariennes exprimer protéine fluorescente rouge (RFP), tandis que les cellules mésothéliales exprimer la protéine fluorescente verte (GFP). DP-exprimant sphéroïdes cellulaires de cancer ovarien joindre à la monocouche GFP-exprimer mésothéliales. La propagation sphéroïdes, envahir, etforcer les cellules mésothéliales côté créant un trou dans la monocouche. Ce trou est visualisée comme l'espace négatif (noir) dans l'image GFP. La superficie du trou peut alors être mesurée pour l'analyse quantitative des différences dans l'activité de contrôle et de jeu entre les populations expérimentales de cancer de l'ovaire et / ou des cellules mésothéliales. Ce test ne nécessite qu'un petit nombre de cellules cancéreuses de l'ovaire (100 cellules par sphéroïdes X 20-30 sphéroïdes par condition), il est donc possible d'effectuer ce test en utilisant des échantillons précieux primaires de cellules tumorales. En outre, ce test peut être facilement adapté pour le criblage haut débit.
Protocole
1. Cancer de l'ovaire Sphéroïde cellule Formation
- DP-exprimant les cellules cancéreuses de l'ovaire sont cultivées dans un milieu de base de 10% (un milieu de culture de cellule personnalisé contenant un mélange 50:50 de 199 et MCDB105, inactivé à 10% sérum de veau fœtal et 1% stylo-streptococcique). Pour exprimer la demande de propositions non étiquetés cellules cancéreuses de l'ovaire, transfecter les cellules avec un plasmide contenant DP et sélectionnez des cellules exprimant RFP. Alternativement, les vecteurs viraux peuvent être utilisés pour exprimer transitoirement protéines fluorescentes, ou des cellules peuvent être pré-incuber avec un rouge fluorescent cellule traqueur colorant (Invitrogen).
- Avant de former des sphéroïdes cancer de l'ovaire, il est nécessaire de préparer à faible adhérence 96 puits ronds plats culture sur le fond. Pour produire les plaques de culture à faible adhérence, 30μl poly-HEMA (6mg polyhydroxyéthylméthacrylate dans 1 ml à 95% EtOH) solution est ajoutée à chaque puits de 96 puits plat Corning culture cellulaire. Les plaques à 96 puits sont incubés dans une 37 ° C non humidifié incubateur pour évaporer l'éthanol, le fait de laisser un film de poly-HEMA sur chaque puits. Ce film de poly-HEMA empêche les cellules de se fixer à la partie inférieure du puits, forçant les cellules à croître en suspension 18. [Sinon, Ultra-Low des plaques de culture de fixation (Corning) peut être utilisé à la place de la poly-HEMA plats revêtus.]
- Après les plaques à faible adhérence des culture sont préparés, trypsiniser une plaque de cellules cancéreuses de l'ovaire, les cellules à granules dans une centrifugeuse de paillasse (Heraeus) à 900 RCF pendant 3 minutes, aspirer le surnageant et remettre en suspension dans un milieu de base 10%.
- Compter les cellules en utilisant un hémocytomètre.
- Ajuster la concentration de ces cellules qu'il ya 100 cellules par 50 pi de milieu de base de 10%.
- Ajouter 50 pi de la suspension cellulaire diluée suspension uniforme dans chaque puits de la boîte de culture et 96 poly-HEMA couché.
- Incuber la plaque à 96 puits dans une étuve à 37 ° C de culture cellulaire pendant 16 heures (cette quantité de temps doit être augmenté ou diminué en fonction de la quantité de temps nécessaire pour queune lignée cellulaire particulière pour former sphéroïdes multicellulaires ou souhaités conditions expérimentales) pour permettre aux cellules cancéreuses de l'ovaire à se regrouper, former un sphéroïde multicellulaire unique dans chaque puits. Certaines cellules tumorales peuvent subir l'apoptose au cours de cette période, il est donc important de choisir un moment avant l'induction de l'apoptose.
2. Mésothéliales Formation monocouche de cellules
- Dans une hotte de culture cellulaire, pré-enduire les puits d'une à 6 puits à fond de verre plat MatTek avec de la fibronectine en ajoutant 2 ml d'une fibronectine 5 pg / ml solution de PBS dans chaque puits de la parabole et l'incubation à température ambiante pendant 30 minutes. La qualité optique du verre-fonds dans les plats MatTek permettre l'imagerie haute résolution microscopique.
- GFP-exprimant les cellules mésothéliales sont cultivées dans un milieu de base de 10%. Trypsiniser une plaque de cellules mésothéliales, ralentit dans une centrifugeuse de table (Heraeus) à 900rpm pendant 3 minutes, aspirer le surnageant, et remettre en suspension dans un milieu de base 10%. Lacellules mésothéliales utilisés ici ont été déjà exprimant la GFP quand ils ont été obtenus, mais non marqués cellules mésothéliales peut être produite par transfection avec un plasmide contenant la GFP ADNc, ou pré-incubation des cellules dans une cellule à fluorescence verte suiveur de colorant (Invitrogen).
- Après l'incubation fibronectine de 30 minutes (à l'étape 2.1), laver les puits de la boîte de MatTek avec 2 ml de PBS.
- Aspirer le PBS et la plaque 6 x10 5 cellules mésothéliales par puits dans chaque puits de la boîte de 6 puits MatTek. Incuber le plat MatTek dans un incubateur à 37 ° C durant la nuit de culture cellulaire pour permettre aux cellules mésothéliales de joindre à l'antenne et de former une monocouche.
3. Mésothéliales Assay élimination des cellules
- Utiliser une pipette pour recueillir les sphéroïdes cancer de l'ovaire de la 96 puits poly-HEMA plaque revêtue.
- Aspirer le milieu d'un puits de la boîte de 6 puits contenant MatTek une monocouche de cellules mésothéliales. Laver une fois avec 2 ml de PBS. Ajouter tous les sphéroïdes de la 96 puits ptard pour un puits de la vaisselle MatTek (~ 3x le nombre de sphéroïdes qui vont être imagée pour tenir compte de l'atterrissage sphéroïdes de la part de l'antenne qui ne peuvent pas être imagée).
- Placer le plat MatTek sur la scène d'un microscope inversé à fluorescence à champ large capable d'effectuer imagerie time-lapse pour la durée d'au moins 8 heures. Utilisez une platine motorisée à des postes d'images multiples dans le plat, avec de multiples événements intercalation sphéroïde, en une seule expérience. Nous utilisons un Nikon Ti-E inversé motorisé Widefield fluorescence time-lapse microscope avec système de mise au point parfaite et intégrée à faible [20x-0.75 ouverture numérique (NA)] agrandissement / NA différentiels de contraste d'interférence (DIC) optique, un transilluminateur halogène Nikon à 0,52 NA longue distance de travail (GDL) condenseur, Nikon rapide (<100 millisecondes le temps de commutation) filtres d'excitation et d'émission (GFP Ex 480/40, Em 525/50, DP-mCherry Ex 575/50 Em 640/50), Sutter rapide transmissibles question à deux volets à épifluorescence trajet de la lumière intelligentetres, un Nikon linéaire codé platine motorisée, un Hamamatsu ORCA-AG refroidi charge-coupled device (CCD), une chambre sur mesure microscope d'incubation avec la température et le CO 2 de contrôle, Nikon NIS-Elements AR logiciel version 3, et un Table TMC isolation contre les vibrations.
- Les sphéroïdes cellulaires de cancer ovarien se déposent au fond du plat et le joindre à la monocouche de cellules mésothéliales. Recueillir la GFP, RFP et les images de phase de 20 + sphéroïde / monocouche interactions, toutes les 10 minutes, pendant 8 heures.
- Les sphéroïdes DP-exprimant cellulaires de cancer ovarien envahira dans la monocouche GFP cellule exprimant mésothéliale créant un trou dans la monocouche. Au bout de 8 heures, de mesurer la dimension des trous en traçant les trous noirs dans les images en utilisant un logiciel GFP éléments (ou un autre logiciel approprié tel que l'image J). Normaliser la taille du trou de la taille initiale sphéroïde en divisant la dimension du trou à 8 heures par la taille de l'ellipsoïde de l'image correspondant au temps zéro DP. Dans cet exexemple, la taille du trou a été mesurée seulement une fois, mais elle peut être mesurée à plusieurs reprises tout au long de l'expérience huit heures afin de mieux comprendre la dynamique de l'intercalation.
4. Les résultats représentatifs
Dans cet exemple, nous avons comparé la capacité de clairance mésothéliales OVCA433 sphéroïdes cellulaires de cancer ovarien qui ont atténué l'expression de la taline-1 pour contrôler OVCA433 sphéroïdes. OVCA433 sphéroïdes de chaque groupe ont été ajoutées à un plat contenant MatTek ZT monocouches de cellules mésothéliales. Six sphéroïdes de chaque groupe ont été imagées toutes les 10 minutes pour huit heures (Figure 4, Film 3, Film 4). Les trous réalisés dans la monocouche par les sphéroïdes d'épandage ont été mesurés et six positions de chaque groupe ont été en moyenne. La figure 4 montre que la zone de dégagement moyenne créée par sphéroïdes Tallinn knockdown 1 était significativement plus petite que la superficie moyenne créée par sphéroïdes de contrôle, ce qui suggère que taline est nécessaire pour le dédouanement mésothéliales par OVCA433 sphéroïdes cancer de l'ovaire.
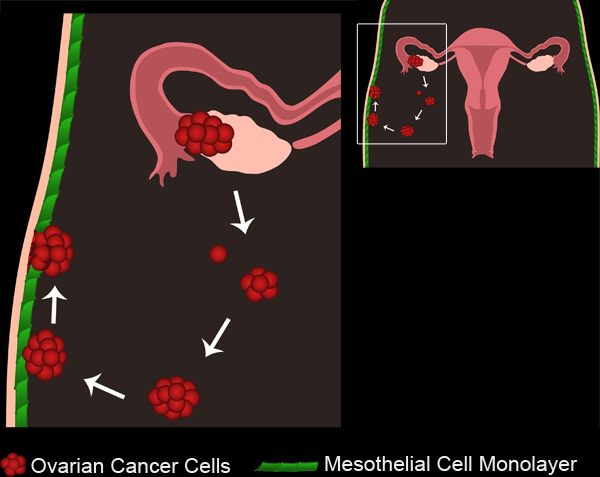
Figure 1. Métastases du cancer de l'ovaire. Tumeurs ovariennes primaires se développent soit à partir de l'épithélium de surface de l'ovaire ou des trompes de Fallope. Les cellules tumorales ou groupes se détachent de la tumeur primaire et de recueillir dans la cavité péritonéale. Les cellules tumorales peuvent alors se regroupent pour former des sphéroïdes multicellulaires. Sphéroïdes puis fixez les monocouches de cellules mésothéliales qui tapissent la cavité péritonéale. Les cellules mésothéliales sont exclus de dessous le sphéroïde cancer de l'ovaire joint, permettant les sphéroïdes pour accéder à la membrane sous-sol sous-jacent.
Film 1. Métastases du cancer de l'ovaire. Cliquez ici pour voir le film .
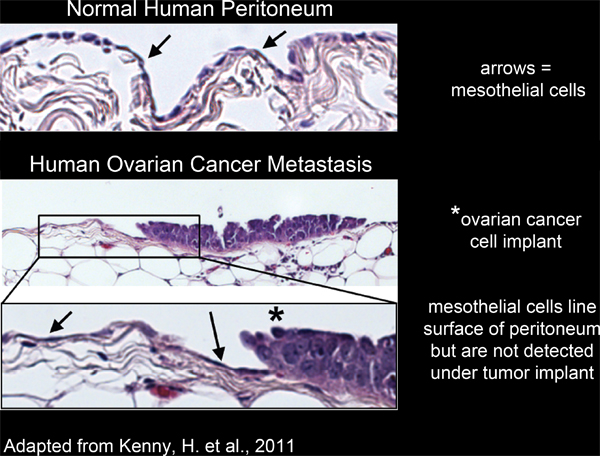
Figure 2. ligne mésothéliales cellules de la surface de tissu péritonéal humaine et sont exclus de la sous implants cellulaires de cancer ovarien.
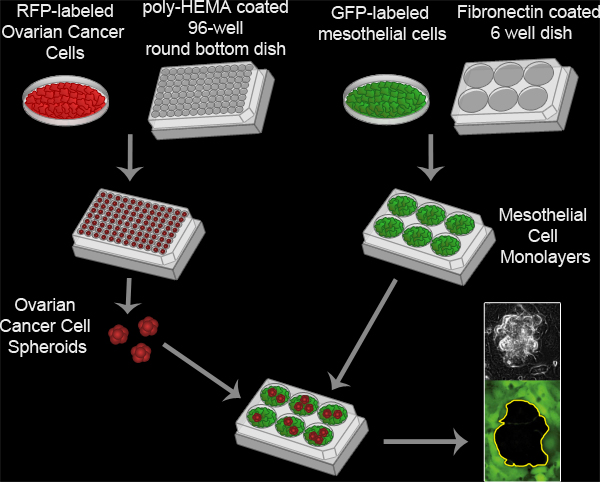
Figure 3. Essai Dégagement mésothéliales. Cancer de l'ovaire sphéroïdes sont formés par incubation 100 DP-exprimant cellules de cancer ovarien par puits dans une poly-HEMA revêtu 96 coupelle inférieure puits de culture ronde à 37 ° C pendant 16 heures. Poly-HEMA empêche les cellules de se fixer à la boîte de culture, les cellules permettant de rester en suspension et d'adhérer les uns aux autres pour former une grappe unique par puits. Monocouches de cellules mésothéliales sont préparés en étalant 6x10 5 cellules mésothéliales par puits dans une fibronectine revêtu 6 puits plat MatTek et l'incubation de la plaque à 37 ° C pendant 16 heures. Les sphéroïdes sont ensuite transférés à la boîte de MatTek avec la monocouche mésothéliales et les deux populations cellulaires sont imagées toutes les 10 minutes pour 8 heures en utilisant un Nikon Ti-E Inverted motorisé Widefield fluorescence time-lapse microscope et logiciels Elements.
Movie 2. Essai Dégagement mésothéliales. Cliquez ici pour voir le film .
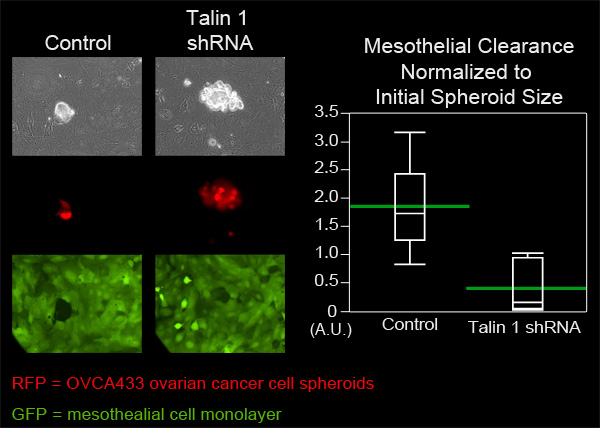
Atténuation Figure 4. De Talin une expression dans OVCA433 sphéroïdes diminue la capacité de clairance mésothéliales. OVCA433 sphéroïdes (rouge) avec et sans expression atténuée de taline 1 ont été autorisés à se fixer et envahir une monocouche ZT mésothéliales (vert). Les deux populations de cellules ont été imagées toutes les 10 minutes pour 8 heures en utilisant un Nikon Ti-E inversé motorisé Widefield fluorescence time-lapse microscope et un logiciel éléments. Le graphique montre que taline une atténuationdiminue significativement la clairance des cellules mésothéliales (parcelle quantile avec des barres vertes au moyen).
Movie 3. Contrôle OVCA433 sphéroïdes (rouge) qui envahissent en une monocouche mésothéliales (vert). Cliquez ici pour voir le film .
Atténuation Movie 4. De Talin une expression dans OVCA433 sphéroïdes (rouge) diminue mésothéliales (vert) la capacité de clairance. Cliquez ici pour voir le film .
Discussion
Le "test Dégagement mésothéliales" présentée ici utilise la microscopie time-lapse pour surveiller les interactions de sphéroïdes multicellulaires cancer de l'ovaire et les monocouches de cellules mésothéliales, dans le détail spatial et temporel grande. Auparavant, plusieurs groupes ont utilisé des dosages 8-14 points de terminaison pour montrer que les cellules cancéreuses de l'ovaire et de joindre à envahir des monocouches de cellules mésothéliales. Ce test est unique en ce...
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Nous tenons à remercier le Nikon Imaging Center à Harvard Medical School, en particulier des eaux Jennifer, Lara Petrak et Salmon Wendy, de formation et de l'utilisation de leurs microscopes timelapse. Nous aimerions également remercier Rosa Ng et Achim Besser pour des discussions utiles. Ce travail a été soutenu par des subventions du NIH 5695837 (à M. Iwanicki) et GM064346 à ACC; par une subvention de la Dre Miriam et Sheldon Adelson G. Medical Research Foundation (pour ACC).
matériels
| Name | Company | Catalog Number | Comments |
| Réactif | Entreprise | Numéro de catalogue | Commentaires |
| OVCA433 cellules ovariennes cancéreuses | Don de Dr. Dennis Slamon | ||
| ZT cellules mésothéliales | Cadeau du Dr Tan Ince | ||
| Milieu 199 | Gibco | 19950 | |
| MCDB105 | Cellule Applications Inc | 117-500 | |
| FBS-inactivé par la chaleur | Gibco | 10082 | |
| Pen-Strep | Gibco | 15070 | |
| Plaques à 96 puits | Corning Costar | 3799 | |
| Polyhydroxyéthylméthacrylate (poly-HEMA) | Sigma-Aldrich | 192066-25G | Pour poly-HEMA solution dissoudre 6mg poly-HEMA poudre dans 1 ml de EtOH 95% |
| EtOH | Pharmco-AAPER | 111ACS200 | Diluer à 95% en 2 0 dH |
| Hotte de culture cellulaire | Nuaire | NU-425-300 | |
| De culture de tissu incubateur | Thermo Scientific | 3110 | |
| incubateur pour le poly-HEMA plaques | Instruments Labline | Imperial III 305 | |
| Centrifugeuse de table | Heraeus | 75003429/01 | |
| 6 puits à fond de verre plat | MatTek Corp. | P06G-1.5-20-F | |
| La fibronectine | Sigma | F1141-1MG | |
| PBS | Cellgro | 21-040-CV | |
| Microscope Timelapse: | |||
| Microscope | Nikon | Ti-E inversé motorisé fluorescence time-lapse microscope avec système de mise au point intégré Parfait | |
| Lentille | Nikon | 20X-0.75 apeture numérique | |
| Transilluminateur halogène | Nikon | 0,52 NA condenseur longue distance de travail | |
| Filtres d'excitation et d'émission | Chroma filtres passe uniques dans le logement Nikon | GFP Ex 480/40, Em 525/50 DP-mCherry Ex 575/50 Em 640/50 | |
| Transmissibles et Epifluoresce trajet de la lumière | Sutter | Volets Smart | |
| Linéaire codé platine motorisée | Nikon | ||
| Refroidi caméra à dispositif à couplage de charge | Hamamatsu | ORCA-AG | |
| Microscope chambre d'incubation avec la température et le CO 2 de commande | custom-built | ||
| Tableau isolation des vibrations | TMC | ||
| NIS-Elements | Nikon | Version 3 |
Références
- Jemal, A. . CA Cancer J. Clin. 59, 225-249 (2009).
- Ries, L. G., Melbert, D., Krapcho, M., Stinchcomb, D. G., Howlader, N., Horner, M. J., Mariotto, A., Miller, B. A. . SEER Cancer Statistics Review, 1975-2005. , (2007).
- Burleson, K. M. Ovarian carcinoma ascites spheroids adhere to extracellular matrix components and mesothelial cell monolayers. Gynecol. Oncol. 93, 170-181 (2004).
- Birbeck, M. S., Wheatley, D. N. An Electron Microscopic Study of the Invasion of Ascites Tumor Cells into the Abdominal Wall. Cancer Res. 25, 490-497 (1965).
- Witz, C. A., Monotoya-Rodriguez, I. A., Schenken, R. S. Whole explants of peritoneum and endometrium: a novel model of the early endometriosis lesion. Fertil. Steril. 71, 56-60 (1999).
- Zhang, X. Y. Characteristics and growth patterns of human peritoneal mesothelial cells: comparison between advanced epithelial ovarian cancer and non-ovarian cancer sources. J. Soc. Gynecol. Investig. 6, 333-340 (1999).
- Kenny, H. A., Nieman, K. M., Mitra, A. K., Lengyel, E. The First Line of Intra-abdominal Metastatic Attack: Breaching the Mesothelial Cell Layer. Cancer Discovery. 1, 100-102 (2011).
- Niedbala, M. J., Crickard, K., Bernacki, R. J. Interactions of human ovarian tumor cells with human mesothelial cells grown on extracellular matrix. An in vitro model system for studying tumor cell adhesion and invasion. Exp. Cell. Res. 160, 499-513 (1985).
- Kenny, H. A., Krausz, T., Yamada, S. D., Lengyel, E. Use of a novel 3D culture model to elucidate the role of mesothelial cells, fibroblasts and extra-cellular matrices on adhesion and invasion of ovarian cancer cells to the omentum. Int. J. Cancer. 121, 1463-1472 (2007).
- Ksiazek, K. Senescent peritoneal mesothelial cells promote ovarian cancer cell adhesion: the role of oxidative stress-induced fibronectin. Am. J. Pathol. 174, 1230-1240 (2009).
- Burleson, K. M., Boente, M. P., Pambuccian, S. E., Skubitz, A. P. Disaggregation and invasion of ovarian carcinoma ascites spheroids. J. Transl. Med. 4, 6-6 (2006).
- Heyman, L. Vitronectin and its receptors partly mediate adhesion of ovarian cancer cells to peritoneal mesothelium in vitro. Tumour. Biol. 29, 231-244 (2008).
- Heyman, L. Mesothelial vitronectin stimulates migration of ovarian cancer cells. Cell. Biol. Int. 34, 493-502 .
- Lessan, K., Aguiar, D. J., Oegema, T., Siebenson, L., Skubitz, A. P. CD44 and beta1 integrin mediate ovarian carcinoma cell adhesion to peritoneal mesothelial cells. Am. J. Pathol. 154, 1525-1537 (1999).
- Leroy-Dudal, J., Heyman, L., Gauduchon, P., Carreiras, F. Adhesion of human ovarian adenocarcinoma IGROV1 cells to endothelial cells is partly mediated by the alphav integrins-vitronectin adhesive system and induces an alteration of endothelial integrity. Cell. Biol. Int. 29, 482-488 (2005).
- Leroy-Dudal, J. Transmigration of human ovarian adenocarcinoma cells through endothelial extracellular matrix involves alphav integrins and the participation of MMP2. Int. J. Cancer. 114, 531-543 (2005).
- Iwanicki, M. Ovarian cancer spheroids use myosin-generated force to clear the mesothelium. Cancer Discovery. 1, 144-157 (2011).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Gregoire, L., Munkarah, A., Rabah, R., Morris, R. T., Lancaster, W. D. Organotypic culture of human ovarian surface epithelial cells: a potential model for ovarian carcinogenesis. In Vitro Cell Dev. Biol. Anim. 34, 636-639 (1998).
- Roberts, P. C. Sequential molecular and cellular events during neoplastic progression: a mouse syngeneic ovarian cancer model. Neoplasia. 7, 944-956 (2005).
- Okada, T., Okuno, H., Mitsui, Y. A novel in vitro assay system for transendothelial tumor cell invasion: significance of E-selectin and alpha 3 integrin in the transendothelial invasion by HT1080 fibrosarcoma cells. Clin. Exp. Metastasis. 12, 305-314 (1994).
- Zervantonakis, I. K., Kothapalli, C. R., Chung, S., Sudo, R., Kamm, R. D. Microfluidic devices for studying heterotypic cell-cell interactions and tissue specimen cultures under controlled microenvironments. Biomicrofluidics. 5, 13406-1310 (2011).
- Brandt, B. 3D-extravasation model -- selection of highly motile and metastatic cancer cells. Semin. Cancer Biol. 15, 387-395 (2005).
- Condeelis, J., Segall, J. E. Intravital imaging of cell movement in tumours. Nat. Rev. Cancer. 3, 921-930 (2003).
- Dai, J., Ting-Beall, H. P., Hochmuth, R. M., Sheetz, M. P., Titus, M. A. Myosin I contributes to the generation of resting cortical tension. Biophys. J. 77, 1168-1176 (1999).
- Laferriere, J., Houle, F., Taher, M. M., Valerie, K., Huot, J. Transendothelial migration of colon carcinoma cells requires expression of E-selectin by endothelial cells and activation of stress-activated protein kinase-2 (SAPK2/p38) in the tumor cells. J. Biol. Chem. 276, 33762-33772 (2001).
- Dong, C., Slattery, M. J., Rank, B. M., You, J. In vitro characterization and micromechanics of tumor cell chemotactic protrusion, locomotion, and extravasation. Ann. Biomed. Eng. 30, 344-355 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon