Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement et culture de cellules embryonnaires de rat neurones: un protocole rapide
Dans cet article
Résumé
Nous décrivons une méthode rapide d'isoler et de la culture neurones de l'hippocampe et du cortex à partir d'embryons de rongeurs. Ce protocole nous permet d'effectuer des expériences dans lesquelles presque purs des cultures de neurones sont nécessaires.
Résumé
Nous décrivons une méthode rapide de dissocier et de la culture neurones de l'hippocampe ou corticale à partir d'embryons de rat E15-17. La procédure peut être appliquée avec succès à l'isolement de la souris et l'homme neurones primaires et les progéniteurs neuronaux. Neurones dissociés sont maintenues dans un milieu sans sérum jusqu'à plusieurs semaines. Ces cultures peuvent être utilisés pour nucléofection, immunocytochimie, la préparation des acides nucléiques, ainsi que l'électrophysiologie. Les seniors cultures neuronales peuvent également être transfectées avec un taux d'efficacité de bon par transduction lentivirale et, de manière moins efficace, avec le phosphate de calcium ou à base de lipides des méthodes telles que la lipofectamine.
Protocole
1. Poly-D-Lysine (PDL): Préparation
- Ajouter 5 ml de solution stérile ddH 2 O à 5 mg de PDL pour obtenir une solution stock de 1 mg / ml.
- Mélanger la solution stock de pipetage à plusieurs reprises.
- Utiliser immédiatement ou conserver Poly-D-Lysine solution à 2-8 ° C.
2. Poly-D-Lysine (PDL): revêtement en plastique Vaisselle Culture Cellulaire
- Diluer la solution mère PDL stérile O ddH 2 à la concentration finale de 10 pg / ml.
- Introduire à la pipette assez de solution dans un plat de 60 mm pour couvrir la surface de culture (3 ml pour un plat de 60 mm).
- Basculer doucement pour un revêtement uniforme de la surface de culture.
- Incuber les plaques enduites à la température ambiante (RT) pendant la nuit.
- Le lendemain, généralement le jour de la dissection, retirez la solution de poly-D-Lysine par aspiration et laver rapidement avec 3 ml de solution stérile O. ddH 2 Répétez cette étape. Après le second lavage, éliminer l'eau complètement par aspiration.
- Les plaques peuvent être conservés à 4 ° C pendant jusqu'à trois semaines.
3. Poly-D-Lysine (PDL) et la laminine: Préparation et revêtement de verre à deux chambres diapositives
- Des solutions d'achat d'actions Mix PDL (1 mg / ml) et de la laminine (1 mg / ml) dans stérile O ddH 2 à la concentration finale de 10 et 5 pg / ml, respectivement.
- Introduire à la pipette assez de solution dans les puits d'un verre à deux chambres de diapositives pour couvrir la surface de la culture (1 ml pour chaque puits d'une verre de 2 et de deux chambre de coulissement).
- Basculer doucement pour un revêtement uniforme de la surface de culture.
- Incuber les plaques enduites à la température ambiante pendant la nuit.
- Le lendemain, retirer la solution de revêtement Poly-D-Lysine-laminine par aspiration et laver rapidement à deux reprises avec 1 ml de solution stérile O. ddH 2 Après le second lavage, éliminer l'eau complètement par aspiration.
- Diapositives de la Chambre peuvent être conservés à 4 ° C pendant jusqu'à trois semaines.
Remarque: Toute diapositive chambre de verre peut être revêtue following ce protocole. Nous utilisons souvent des diapositives à deux chambres parce que chaque diapositive offre un cadre de contrôle-essai expérimental (par exemple non traité par rapport traité, non transfectées par rapport transfectées).
4. Dissection neuronale et de la Culture
- Réchauffez les réactifs suivants dans un bain à 37 ° C l'eau:
- TrypLE Express sur son origine flacon de 100 ml.
- Neurobasal/B27 milieu complet (voir I tableau). Le volume chauffé dépend du nombre de plats à plaquer (par exemple 30 ml pour dix plats de 60 mm en plaqué).
- Ajouter 3 ml d'eau froide Hibernate solution E à quatre plats 60 mm de la culture et 13 ml d'une 15 ml BD Falcon tube en polypropylène de haute clarté conique.
- Ajouter 25-30 ml de milieu de dissection froide (voir le tableau II, le Dr Olimpia Meucci, communication personnelle) à chacune des trois boîtes de culture de 100 mm. Ces plaques, contenant un grand volume de milieu, seront utilisés pour laver les embryons immédiatement après leurl'enlèvement des sacs amniotiques (étapes 4.7 et 4.8).
- Euthanasier un rat chronométré E17 enceinte de CO 2 en conformité avec la politique des services de santé sur les soins sans cruauté et l'utilisation des animaux de laboratoire publique et en vertu d'un soin des animaux institutionnellement approuvé et utiliser le protocole.
- Vaporiser le bas-ventre avec de l'EtOH 70% et couper dedans à travers la peau et les muscles avec une paire de ciseaux exposer l'utérus et les embryons.
- Retirez tous les fœtus et les placer dans un récipient stérile de 100 mm plat contenant un excès de milieu de dissection froide (25-30 ml, voir l'étape 4.3).
- Couper les embryons en utilisant une petite paire de ciseaux de poche amniotique et les placer dans le second de 100 mm plat contenant milieu de dissection froide.
- Laver les embryons à la température ambiante en inclinant légèrement le plat de 100 mm pendant 5-10 secondes. Ensuite, transférer les embryons rincés à la troisième 100 mm plat contenant un milieu de dissection. Deux lavages en excès du milieu sont généralement suffisantes pour éliminer toute trace de sang. Toutefois, si nécessaire, se laver une fois de plus l'aide d'un frais de 100 mm plat contenant 25-30 ml de milieu de dissection froide.
- En utilisant une pince stéréomicroscope et courbes, d'extraire le cerveau de chaque embryon de rat par tirant la peau et le crâne. Placez cerveau entier dans l'un des plats de 60 mm (habituellement, avec pas plus de 5 cerveaux par boîte) avec le froid Hibernate E. Conserver ces plaques sur la glace.
- Prenez un plat à la fois et, sous un microscope à dissection, séparer les hémisphères et d'isoler les cortex cérébraux enlever le mésencéphale et les méninges.
- En option: couper le long de la ligne médiane cerveaux, d'extraire des hippocampes, et suivez la procédure ci-dessous pour isoler neurones de l'hippocampe.
- Collecter toutes les cortex disséqués dans un 15-ml tube conique clair contenant 13 ml de froid Hibernate E. Laissez les cortex cérébraux sur la glace jusqu'à ce que toutes les dissections sont terminées. En raison de leur petite taille, disséqué hippocampes peut être recueilli dans un tube de 1,5 ml Eppendorf, au lieu d'un tube de 15 ml. Si vous le souhaitez, à cette étape ou cortexhippocampes peuvent être placés dans un flacon cryotube contenant 1 ml de Hibernate E + 2% B27 + gentamicine (50 pg / ml) + Fungizone (250 ng / ml) dans la proportion de 2-4 ou 2-4 cortex hippocampes par flacon. Le tissu cérébral peut être conservé à 4 ° C dans l'obscurité pendant une semaine (plus tard les temps n'ont pas encore testé). Si nécessaire, utilisez une pince fine pour transférer le tissu cérébral d'un tube de 15 ml contenant Hibernate E puis suivre le protocole ci-dessous pour isoler les neurones.
- Transférer le tube à une hotte de culture tissulaire. Autoriser les cortex à se déposer au fond du tube, puis retirez délicatement le surnageant.
- Ajouter 13 ml d'Hibernate E frais pour le tube de 15 ml conique, permettent cortex se déposent au fond du tube et retirez soigneusement le surnageant. Répétez cette étape plusieurs fois et 2, après le dernier lavage, retirez soigneusement tous les médias.
- Enzymatiquement digérer cortex cérébral en ajoutant 1-2 ml (selon le nombre de cortex; utiliser moins pour l'isolement hippocampes) de Tr chaudsypLE Express. Sceller le bouchon du tube avec du parafilm et laisser flotter le tube dans un bain à 37 ° C pendant 10 minutes.
- Vaporiser le tube avec de l'éthanol 70% avant d'ouvrir le couvercle et ajouter 10 ml d'Hibernate E. Autoriser les cortex à se déposent au fond du tube et retirer le surnageant. Répétez cette étape trois fois pour se laver les TrypLE Express. En dernière étape, retirez soigneusement tous les médias.
- Doucement triturer (4-5 fois) les cortex dans 2 ml de milieu complet Neurobasal/B27 l'aide d'un poli au feu Pasteur en verre (environ 1 mm de diamètre). Soyez prudent pour éviter les bulles.
- Répétez encore 4-5 fois avec une solution stérile Pasteur en verre plus petit pipette de diamètre (c.-à-propos d'une pipette mm de diamètre 1.2 à 3.4). Ne pas utiliser une pipette Pasteur inférieur à ce ou il détruira les cellules.
- Laisser les morceaux restants de tissus (en général très peu, le cas échéant) à régler.
- Transférer la supérieure unique de cellules en suspension à une nouvelle de 15 ml tube, laissant derrière lui des morceaux de tissu sont installés. FourrureTher diluer la suspension cellulaire jusqu'à 10-12 ml avec Neurobasal/B27 milieu complet.
- Mélangez bien et diluer les cellules de comptage par addition de 10 pl de la suspension cellulaire à 490 pi de solution de comptage 50x (voir tableau III) dans un tube Eppendorf de 1,5 ml.
- Cellules de la plaque sur PDL plaques revêtues à la densité de 5,0 x 10 4 / cm 2. Si nucléofection doit être exécuté, il est recommandé étalement des cellules à une concentration plus élevée (8-10 x 10 4 / cm 2).
- Normalement, nous disséquons 9-10 fœtus par expérience, que d'environ 13 x 10 6 neurones sont dérivées de chaque fœtus E17. Si plus d'embryons sont nécessaires, assurez-vous que toute la procédure ne doit pas durer plus de deux heures.
- Si vous le souhaitez, 24 heures après l'isolement, 10 uM de cytosine-β-D-arabinofuranoside (ARAC) peuvent être ajoutés à chaque plat, afin de prévenir la prolifération des cellules gliales. Toutefois, cette étape n'est pas nécessaire puisque Neurobasal/B27 milieu inhibe la prolifération gliale, Selon les recommandations du fabricant (Invitrogen / Gibco).
- Les neurones peuvent être utilisés pour des expériences après 4-5 jours in vitro, bien que l'heure exacte dépend du stade de différenciation souhaitée. Nous avons des neurones en culture pour un maximum de 4 semaines sans une diminution significative de la survie (Figure 1).
- Pour la culture prolongée, remplacez milieu de culture chaque semaine avec fraîchement préparé Neurobasal/B27 milieu complet.
5. Les résultats représentatifs
Des neurones en culture sur des lames de verre de la chambre peut être soumis à l'immunocytochimie. La figure 1 montre une image typique d'un neurone cortical fixé au bout de cinq jours dans la culture et immunomarquées anti-MAP-2 anticorps de montrer des processus neuronaux.
La figure 2 montre une image représentative d'un neurone hippocampe de rat après 3 semaines de culture. La morphologie des neurones d'une cellule complètement différencié est mis en évidence par le MAP-2 immunolabeling (MAP-2 marqueur neuronal, clone anticorps monoclonal de souris AP-20, Gene Tex, Irvine, CA), à la suite d'une procédure standard, comme décrit précédemment 1. Les images sont visualisées avec le Nikon Eclipse E400 microscope à fluorescence verticale équipée d'EXI Aqua caméra (Qimaging), axe Z motorisé, et SlideBook5 acquisition / déconvolution logiciels (imagerie intelligente Innovations, Inc, Denver, CO). Une série de trois images bidimensionnelles de chaque image individuelle ont été déconvolué l'une image bidimensionnelle et réglé par l'ajustement du signal de coupure d'intensité maximale près d'augmenter la résolution.
La figure 3 montre la pureté des cultures de neurones. Lysats de protéines ont été obtenues à partir DIV7 cultures neuronales de rat (CTX) et à partir d'un cas de glioblastome humain (GBM). Comme prévu, le lysat neuronale est fortement positive pour la protéine neuronale MAP-2 et négatif pour la GFAP marqueur astrocytaire, tandis que le lysat de protéine GBM est négative fou MAP-2 et positive pour la GFAP.
Bien que, dans notre protocole, nous avons été en utilisant E Hibernate pendant plusieurs années comme la dissection et de rinçage moyenne, récemment, nous avons exploré une utilisation supplémentaire et très pratique de celui-ci afin de préserver les tissus du cerveau pour une utilisation ultérieure. La figure 4 illustre quelques jours in vitro 5 (DIV5) culture de neurones corticaux de rat isolés à partir de cortex conservés à 4 ° C pendant une semaine dans Hibernate E + B27 après leur dissection d'origine à partir des embryons. Les neurones ont été étalées sur un verre à deux chambres lame enduite avec PDL et de la laminine, comme décrit précédemment. L'image acquise a été déconvolution utilisant SlideBook5 acquisition / logiciel de déconvolution comme décrit ci-dessus (Figure 2).

Figure 1. L'image représentant d'un neurone cortical nucleofected avec pmaxGFP (Amaxa, Lonza, Walkersville, MD) et immunomarquées avec le PAM-2 Anticorps, en rouge. Le grossissement est de 100x.
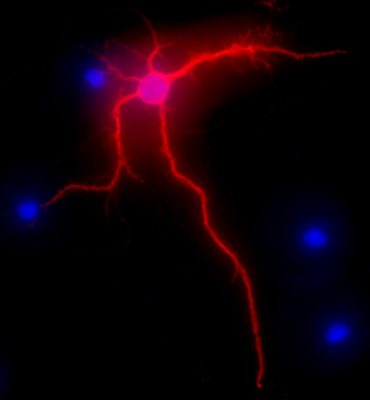
Figure 2. L'image représentant montrant MAP-2 immunomarquage, en rouge, des neurones de l'hippocampe après 3 semaines de culture. Coloration au DAPI, en bleu, montre noyaux cellulaires. Le grossissement est de 40x.

Figure 3. Western blot montrant la pureté des cultures de cellules neuronales. 30 pg de rat neuronales humaines et lysats protéiques GBM ont été séparés par électrophorèse et soumis à une analyse par Western blot à la suite des procédures standard 1. Anti-MAP-2 était un lapin polyclonal de la signalisation cellulaire (Danvers, MA), anticorps anti-GFAP était un anticorps monoclonal de souris de Chemicon (Millipore, Billerica, MA), et la souris des anticorps monoclonaux anti-GRB2 anticorps était de Transduction Laboratories (BD Sparks, MD). GRB2 a été utilisé comme un contrôle de chargement.

Photos représentatives Figure 4. De jours in vitro 5 (DIV5) neurones corticaux de rat obtenues à partir de cortex gauche dans Hibernate E + B27 à 4 ° C pendant une semaine après leur dissection. Le contraste de phase A) des neurones cultivés sur un verre de deux chambre de coulissement. Le grossissement est de 20X. B) Immunofluorescence montrant l'expression de la MAP-2 dans les processus neuronaux, en vert, la culture était négative pour la GFAP marqueur astrocytaire. Coloration au DAPI, en bleu, indique noyaux cellulaires. Le grossissement est de 40x.
Discussion
La méthode de la dissection et la culture de neurones d'hippocampe de rat et corticale décrite ici permet d'effectuer des expériences en utilisant presque purs des cultures de neurones cultivés dans un milieu chimiquement défini (Figure 3). Bien que les protocoles pour les neurones en culture presque purs dans des milieux sans sérum ont été décrits précédemment 2,3,4, il ya des changements importants réalisés dans notre méthode. Différent de protocoles traditionnels (c....
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous remercions Jonna Ellis pour son assistance éditoriale. Le projet décrit a été soutenue par R01MH079751 Nombre Prix (PI: F. Peruzzi) de l'Institut national de la santé mentale. Le contenu est exclusivement la responsabilité de leurs auteurs et ne représentent pas nécessairement les vues officielles de l'Institut national de santé mentale ou de la National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Réactif | Concentration | ||
| Neurobasal | 98% | ||
| B27 | 2% | ||
| Glutamax | 0,5 mM |
Tableau I. Neurobasal/B27 milieu complet.
| Réactif | Concentration |
| Glucose | 16 mM |
| Saccharose | 22 mM |
| HEPES | 10 mM |
| NaCl | 160 mM |
| KCl | 5 mM |
| Na 2 HPO 4 | 1 mM |
| KH 2 PO 2 | 0,22 mM |
| La gentamicine | 50 pg / ml |
| Fungizone | 250 ng / ml |
| pH | 7.4 |
| Osmolarité | 320-330 mOsm |
Tableau II. Milieu de dissection.
| Réactif | Volume (pl) |
| Neurobasal/B27 milieu complet | 240 |
| Bleu de Trypan Stain 0,4% | 250 |
| Total | 490 |
Tableau III. 50x comptage solution.
| Réactif | Entreprise | Cat. nombre |
| Hibernate E | Brainbits | 767171 |
| Neurobasal | Gibco, Invitrogen | 21103-049 |
| B27 | Gibco, Invitrogen | 17504-044 |
| Fungizone | Gibco, Invitrogen | 15290-018 |
| Sulfate de gentamicine | Sigma-Aldrich | G1264 |
| Glutamax 200 mM | Gibco, Invitrogen | 35050 |
| TrypLE express w / o rouge de phénol | Gibco, Invitrogen | 12604 |
| Cytosine-β-D-arabinofuranoside chlorhydrate | Sigma-Aldrich | C6645 |
| Poly-D-Lysine | Sigma-Aldrich | P6407 |
| Laminine 1 mg / ml | Millipore | CC095 |
| HEPES | Sigma-Aldrich | H3375 |
| Bleu de Trypan Stain 0,4% | Gibco, Invitrogen | 15250 |
Tableau IV. Des réactifs spécifiques.
| Équipement | Entreprise | Cat. nombre |
| Microscope stéréo | Olympe | SZ61 |
| Grande pince | FST | 11022-14 |
| À pointe fine pince | Moria | MC40B |
| Micro à pointe fine pince | Moria | MC31 |
| Tranchantes comme un rasoir ciseaux | Roboz | RS-6820 |
| Micro Ciseaux à dissection | FST | 91460-11 |
| Micro dissection Ciseaux courbes | FST | 14067-11 |
| Verre 2-chambre diapositives | Lab-Tek | 154461 |
| Boîtes de 60 mm | BD Falcon | 353002 |
| Boîtes de 100 mm | Corning | 430167 |
| Tubes de 15 ml | BD Falcon | 352099 |
| 1,5 ml cryo-tube de flacon | Nunc | 375353 |
Tableau V. Equipements spécifiques.
Références
- Aprea, S. Tubulin-mediated binding of human immunodeficiency virus-1 Tat to the cytoskeleton causes proteasomal-dependent degradation of microtubule-associated protein 2 and neuronal damage. J. Neurosci. 26, 4054-4062 (2006).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res. Dev. Brain Res. 120, 199-210 (2000).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Method for serum-free culture of late fetal and early postnatal rat brainstem neurons. Brain Res. Brain Res. Protoc. 6, 91-99 (2001).
- Brewer, G. J. Serum-free B27/neurobasal medium supports differentiated growth of neurons from the striatum, substantia nigra, septum, cerebral cortex, cerebellum, and dentate gyrus. J. Neurosci. Res. 42, 674-683 (1995).
- Banker, G., Goslin, K. . Culturing nerve cells. , (1998).
- Eletto, D. Inhibition of SNAP25 expression by HIV-1 Tat involves the activity of mir-128a. J. Cell Physiol. 216, 764-770 (2008).
- Gualco, E. IGF-IR-dependent expression of Survivin is required for T-antigen-mediated protection from apoptosis and proliferation of neural progenitors. Cell Death Differ. 17, 439-451 (2010).
- Gage, F. H. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl. Acad. Sci. U.S.A. 92, 11879-11883 (1995).
- Keyser, D. O., Pellmar, T. C. Synaptic transmission in the hippocampus: critical role for glial cells. Glia. 10, 237-243 (1994).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 (1997).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon