Method Article
Génération d'une ligne Immortalisé microvasculaire murin des cellules endothéliales du cerveau comme un
Dans cet article
Résumé
Cette méthode décrit comment isoler et d'immortaliser les cellules endothéliales microvasculaires du cerveau de souris. Nous décrivons un protocole étape par étape à partir de l'homogénéisation du tissu cérébral, phases de digestion, l'ensemencement et l'immortalisation des cellules. Habituellement, cela prend environ cinq semaines pour obtenir un ensemble homogène, immortalisé ligne de cellules endothéliales microvasculaires.
Résumé
Les cellules épithéliales et endothéliales (CE) sont la construction de barrières paracellulaires qui protègent le tissu de l'environnement externe et interne. La barrière hémato-encéphalique (BHE) constituée des CE, astrocytes finaux pieds, péricytes et la membrane basale est responsable de la protection et de l'homéostasie du parenchyme cérébral. Dans les modèles in vitro BBB sont des outils communs pour étudier la structure et la fonction de la BHE au niveau cellulaire. Un nombre considérable de différents modèles in vitro BBB ont été établis pour la recherche dans différents laboratoires à ce jour. Habituellement, les cellules sont obtenues à partir de bovins, porcins, les tissus du cerveau de rat ou de la souris (examinée en détail dans la revue de Wilhelm et al. 1). Échantillons de tissus humains ne sont disponibles que dans un nombre restreint de laboratoires ou d'entreprises 2,3. Alors que les préparatifs de cellules primaires prennent du temps et les cultures communautaires peuvent varier d'un lot à l'autre, la mise en place d'immortalisé CE lines est le centre d'intérêt scientifique.
Ici, nous présentons une méthode pour établir un cerveau immortalisé endothéliales des microvaisseaux du cerveau de souris en ligne néonatale. Nous décrivons la procédure étape par étape, la liste des réactifs et des solutions utilisées. La méthode établie par notre laboratoire permet l'isolement d'une ligne homogène de cellules immortalisées endothéliales dans les quatre à cinq semaines. Les lignes de cellules endothéliales microvasculaires du cerveau appelée Cend 4 (à partir de cortex cérébral) et cerebEND 5 (à partir de cortex cérébelleux), ont été isolées selon cette procédure dans le laboratoire Förster et ont été effectivement utilisés pour l'explication des différents processus physiologiques et pathologiques au Bureau. Utilisation Cend et cerebEND nous avons démontré que ces cellules répondent aux glucocorticoïdes et d'oestrogènes 4,6-9-traitement 10 ainsi que de pro-infammatory médiateurs, comme le TNFalpha 5,8. En outre, nous avons étudié la pathologie de multiples sclerosis 11 et 12,13 hypoxie sur l'échelon communautaire. Le Cend et lignes cerebEND peut être considéré comme un bon outil pour étudier la structure et la fonction de la BHE, les réponses cellulaires d'ECS à différents stimuli ou de l'interaction de la CE avec des lymphocytes ou des cellules cancéreuses.
Protocole
1. Isolement des microvaisseaux du cerveau
- Pour chaque préparation utiliser cinq à dix souriceaux nouveau-nés des deux sexes (3-5 jours).
- Euthanasier une souris selon locaux IACUC / vétérinaire recommandations, retirez immédiatement le cerveau, et le transfert dans une boîte de Petri contenant la solution suivante: 15 mM de HEPES (pH 7,4), 153 mM NaCl, 5,6 mM KCl, 2,3 mM de CaCl 2, 2H 2 x O, 2,6 mM de MgCl 2 x 6 H 2 O, 1% (p / v) de BSA (ci-après dénommé tampon A).
- Sauf indication contraire, toutes les procédures d'isolement doit être effectuée à la température ambiante (RT) (22-24 ° C) sous la hotte à flux laminaire. Couper le cerveau (cerveau sans cervelet et le tronc cérébral), après élimination des méninges et des fragments capillaires, dans le tampon A l'aide d'un scalpel stérile. Pipeter le tissu fragmente de haut en bas à l'aide d'une pipette 10 ml jusqu'à ce sans grumeaux apparaissent. Transférer la suspension dans un tube Falcon de 50 ml et centrifuger à 250 xg pendant 5 min à température ambiante.
Remarque: Méninges peut être identifié en tant que minces membranes transparentes, à la surface du tissu cérébral. Ils peuvent être soigneusement retiré avec une pince stérile.
- Jeter le surnageant.
- Dissoudre le culot dans 4,5 ml de tampon A avec 1,5 ml de 0,75% (p / v) de la collagénase / dispase (Roche) et incuber pendant 45 min à 37 ° C dans un bain d'eau (parfois secouer).
- Pendant ce temps, préparer les plaques à 12 puits par enduction quatre puits avec du collagène IV (0,1 mg / ml dans 50 mM d'acide acétique). Permettre de se conformer pendant 1 heure.
- Arrêtez la digestion par addition de 15 ml de tampon glacé A. Remettre en suspension le culot à fond.
- Centrifuger la suspension à 250 xg pendant 10 min à température ambiante.
- Jeter le surnageant.
- Pour supprimer la myéline, ajouter 10 ml de 25% (p / v) de BSA (Sigma, pureté> 98%) et centrifuger à 1000 xg pendant 20 min à 4 ° C. 25% de BSA doit être dissoute dans du PBS 1x (PAA Laboratories) et filtré sur 0,2 f umiltre).
- Eliminer délicatement le surnageant, dissoudre le culot dans 10 ml de tampon A et transférer dans un nouveau tube Falcon.
- Centrifuger la suspension à 250 xg pendant 5 min à température ambiante. Le culot résultant contient les cellules endothéliales.
- Laver deux fois le collagène IV-12-enduit et plaque avec du PBS.
- Reprendre le culot dans 4 ml de milieu de culture (DMEM contenant 10% de SVF, 50U/ml pénicilline / streptomycine, 1% de L-glutamine) et la plaque de la suspension cellulaire dans deux puits de 2 ml dans chaque puits. Ajouter la puromycine à une concentration finale de 4 ng / ml et incuber pendant 45 min à 37 ° C dans un incubateur de culture cellulaire. Cette étape permet d'éliminer rapidement les cellules adhérentes. Remarque: La puromycine est ajouté pendant 24 heures. Seul le cerveau ECs peuvent le métaboliser, pour d'autres types cellulaires puromycine est toxique 14.
- Transférer le support 2 ml contenant des cellules non adhéré à l'étape 1.14 dans deux puits frais (ces puits contiennent la fraction CE). Remplir les puits avec les cellules collées de step 1,14 avec 2 ml de milieu frais (ces puits contiennent d'autres types cellulaires, par exemple, les fibroblastes, les astrocytes et peut être cultivé en parallèle et utilisés pour les comparaisons de la morphologie).
- Changer le support le jour suivant.
2. Immortalisant les cellules endothéliales microvasculaires du cerveau
- Cultiver le GP + E-86 Neo (GPENeo) 15 fibroblastes, sécrétant un virus déficient pour la réplication avec polyome moyen T oncogène dans du milieu DMEM contenant 10% de SVF inactivé par la chaleur, 50U/ml pénicilline / streptomycine et 2 mg / ml de G418 ( . PAA Laboratories) dans des flacons revêtus de gélatine Remarque: polyome milieu de transfection oncogène T provoque avantage de croissance des EC sur les non-ECS conduisant à une monocouche homogène de cellules avec une morphologie endothéliale 4 à 6 semaines de culture. GPENeo ne sont pas disponibles dans le commerce et peuvent être obtenues en tant que matériau public partagé (s'il vous plaît se référer à des publications originales 4,16).
- Pour utiliser le support contenant le virus de immortalisation, cultiver les cellules GPENeo dans un milieu sans G418 pendant 24 h.
- Prélever 10 ml du surnageant et ajouter GPEneo Polybrene (hexadiméthrine bromure) (Sigma) à une concentration finale de 8 pg / ml, stériliser par filtre de 0,45 um pour éliminer les débris cellulaires.
- Retirez le milieu de croissance des cultures communautaires établis dans la partie 1 et ajouter 2 ml de surnageant GPEneo / Polybrene mélange dans les puits. Répétez cette opération le lendemain avec une nouvelle GPEneo surnageant / Polybrene mélange. Remarque: Polybrene est utilisé pour fabriquer des pores dans la paroi cellulaire afin de faciliter l'infection avec les particules virales).
- Retirer le surnageant GPEneo / Polybrene mélange le lendemain, laver les cellules deux fois avec du PBS et maintenir les cellules dans le milieu de croissance changeantes tous les 3 jours. À la confluence, diviser les cellules de collagène IV 1:2 sur des plaques revêtues.
- En règle générale, stables endothéliales cérébrales lignées cellulaires (cend) doit être obtenu 4-5 semaines plus tard.
- Décongeler les cellules de cryoaliquot au bain-marie et le transfert dans 15 ml Falcon-avec 10 ml préchauffé à moyen terme.
- Centrifuger la suspension à 250 xg pendant 5 min à température ambiante.
- Retirer moyen de transférer la pastille dans le collagène IV enduit T flacon de 25 cm2 de culture cellulaire avec un milieu de croissance préchauffé (densité cellulaire pour le placage doit être au moins 1x 10 4 cellules / ml).
- Changer le milieu le lendemain, et après que les cellules ont atteint la confluence (généralement après 5 jours) diviser les cellules.
4. Fractionnement des cellules Cend (Note: Le fractionnement devrait être fait seulement une fois par semaine, éviter l'éclatement supérieur à 1:4).
- Éliminer le milieu, laver les cellules avec du PBS.
- Ajouter 3 ml d'eau tiède trypsine-EDTA (PAA Laboratories) (T flacon de 75 cm2), incuber à 37 ° C et attendre que la couche des cellules est dispersée (habituellement dans les 5 à 15 minutes).
- Ajouter 5 ml omilieu de croissance f, pipeter de haut en bas, et le transfert à un nouveau collagène IV enduit de ballon.
5. La congélation des cellules cend-
- Obtenir la suspension cellulaire tel que décrit à l'étape 4
- Centrifuger la suspension à 250 xg pendant 5 min à température ambiante.
- Remettre en suspension les cellules (obtenu à partir de 1 T 75 cm 2 flacon) culot dans 6 ml milieu de congélation (95% milieu de croissance, 5% DMSO).
- Diviser la suspension cellulaire en quatre 1,5 ml cryo-aliquotes. Remarque: Un cryo-aliquote peut être ensemencées sur T flacon de 25 cm2.
- Conserver les aliquotes cryo-sous azote la température du liquide vapeur.
cend milieu de croissance: 450 ml de DMEM, 10% SVF, 10 ml de L-glutamine, 2% MEM-Kit, 2% NEAA, 10 pyruvate natrium ml, 50 U / ml de pénicilline / streptomycine
6. Les résultats représentatifs
Les cellules Cend et cerebEND ont été caractérisées par immunomarquages de endothéliale une BBB marqueurs ainsi que par la mesure de la résistance électrique transendothéliale (TEER) et la perméabilité. Le Cend et cerebEND présentaient une morphologie similaire à des cultures primaires de cerveau EC, avec des monocouches de cellules allongées serrées qui présentaient une inhibition de croissance à confluence. Les cellules ont exprimé des niveaux détectables de bien claudine-5, occludine et VE-cadhérine protéines qui ont été localisées au niveau des jonctions cellule-cellule, comme indiqué par immunofluorescence (figure 3) 4,5. CEND cellules en culture en milieu sans sérum réduite conduit à une augmentation de la TEER (à partir de 150 Qcm 2 en présence de 10% de sérum de 500 Qcm 2 en présence de 2% de sérum), qui a été potentialisée par l'ajout d'hydrocortisone (800 Qcm 2) ou de l'insuline (1.000 Qcm 2) 4. Des monocouches de Cend cultivées dans le sérum réduit moyenne pendant 21 jours a TEER de 900 Qcm 2 (figure 4). TEER a été mesurée à l'aide d'un ensemblecontenant des électrodes de passage du courant et de la tension de mesure (World Precision Instruments). A titre de comparaison, le premier micro-vasculaire cérébral EC a été signalé à avoir des valeurs TEER de 200-600 Qcm 2 et une lignée de souris disponible dans le commerce cellule bEnd.3 eu TEER valeurs de 100-140 Qcm 2 (pour revue récente, voir Abbé 2005 et Toth et al., 2011 17,18). En outre, le passage des macromolécules, telles que la non-chargé FITC-dextran des masses moléculaires 4, 10, 70 et 500 kDa, ou la fluorescéine (300 Da) à travers la monocouche de cend en milieu de différenciation 2% de SVF plus de 4 heures a diminué par rapport à des cellules témoins maintenues dans un milieu de croissance contenant 10% de FCS: flux paracellulaire a été réduite à 30% de cellules de contrôle de la fluorescéine, de 26% pour FITC-dextran 10 et 70 kDa, et le flux a été réduit à 4,5% des cellules de contrôle de FITC -dextrtan 500 kDa. Semblable à Teer valeurs, la perméabilité était au plus bas niveau dans les cellules cultivées en présence de glucocorticoids (GC) 4. Dans d'autres études, nous avons identifié les gènes cibles des glucocorticoïdes, occludine, la claudine-5 et VE-cadhérine dans l'endothélium vasculaire cérébral 4,7,9. GC traitement conduit à une augmentation de l'expression de ces protéines et à la transposition de la VE-cadhérine au cytosquelette. La médiation directe GC-régulation des protéines des jonctions serrées occludine et la claudine-5 apparaît à travers des éléments de réponse GC dans leurs régions promotrices 4,7,19. En outre, la claudine-5 a été identifié comme une cible oestrogène roman vasculaire 10 endothélium.
Sous-tend la dysfonction endothéliale nombreuses maladies différentes. Nous avons cultivé la cend sous oxygène / glucose privation (AMG) conditions. AMG a conduit à la perturbation de la fonction BBB, ce qui pourrait être reconstitué après un traitement combiné avec GC et inhibiteur du protéasome bortezomib 12. Conditions des autres ministères a conduit à une forte augmentation de la captation du glucose et de l'expression des transpor glucosetres dans cerebEND, qui pourrait être atténué par l'ajout de MK801, un inhibiteur non compétitif de l'récepteur NMDA 13.
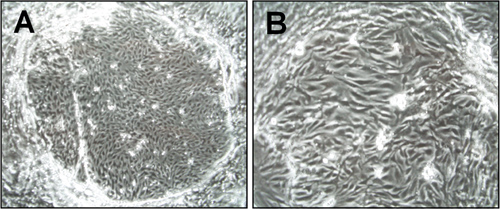
Figure 1. Morphologie des cellules endothéliales microvasculaires du cerveau (CEND) une semaine après l'isolement. Images de microscopie optique ont été prises dans le cadre du 6x (A) et 15x (B) agrandissement. Les colonies île formés de cellules endothéliales sont visibles.
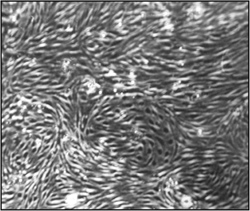
Figure 2. Morphologie des cellules endothéliales microvasculaires du cerveau (CEND) un mois après l'isolement et l'immortalisation. Images de microscopie optique ont été prises dans le cadre du grossissement 15x. A confluence, monocouche homogène de cellules endothéliales peuvent être observés.
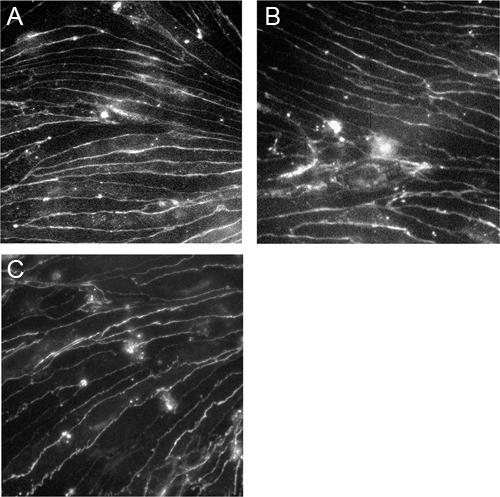
Figure 3. Microvascul cerveau immortaliséar les cellules endothéliales expriment la claudine-5, occludine et VE-cadhérine. cellules ont été cultivées sur Cend collagène IV recouvertes de lamelles et colorées avec des anticorps contre la claudine-5 (A), occludine (B) et VE-cadhérine (C). Les images ont été prises avec un microscope Zeiss Axioscop2 sous le grossissement de 40x.
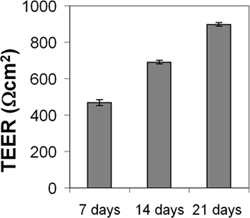
Figure 4. Mesure de la résistance électrique trans-endothéliale (TEER) de Cend monocouche. CEND ont été cultivées sur des filtres de collagène IV transwell-enduits (taille des pores 0,4 um). Après avoir atteint la confluence, les cellules ont été maintenues dans un milieu contenant 2% de FCS. TEER a été mesurée après 7, 14 et 21 à l'aide d'un ensemble contenant des électrodes de passage du courant et de la tension de mesure.
Discussion
La procédure décrite peut être utilisée pour l'isolement de complications microvasculaires ECs à partir de souches de souris différentes, ainsi que de différentes souches de souris knock-out pour étudier les changements spécifiques dans la fonction endothéliale vasculaire. En tant que méthode d'immortalisation, nous avons utilisé la transformation avec des polyomavirus murin oncoprotéine, Polyome moyen T antigène. Il se transforme rapidement immatures cellules endothéliales in vivo et in vitro 20,21,22. D'autres méthodes d'immortalisation des contraceptifs d'urgence décrites dans la littérature comprennent par exemple l'immortalisation avec antigène T de SV40 grand nombre de virus simien vacuolisante 40 23, produit du gène E1A d'adénovirus 24 ou la surexpression de la sous-unité catalytique de la télomérase humaine 3. L'immortalisation avec PyMT est spécifique pour le murin EC immatures, ce qui permet d'obtenir une culture homogène CE de souriceaux nouveau-nés dans un court laps de temps. Modifie les propriétés immortalisation des cellules et eles résultats obtenus avec e lignées cellulaires immortalisées devraient être comparés soit avec des cellules primaires ou à des expériences in vivo sur des souris. PyMT immortalisé CE a été décrit pour exprimer des niveaux élevés d'activité fibrinolytique accrue résultant de la production de l'urokinase-type plasminogen activator et une diminution de la production d'inhibiteurs de l'activateur du plasminogène 25. La comparaison directe des PyMT immortalisé bEND5 lignée cellulaire avec primaire ECs a révélé que dans les modèles in vitro BBB sont bien adaptés pour les études d'adhérence cellulaire T 26.
Les lignées cellulaires établies conformément à la procédure décrite peut être utilisée au nombre de passages bas afin de maintenir les propriétés de barrière par une expression élevée de protéines BBB et CE de jonction, comme les cellules perdent ces propriétés au cours du vieillissement. Ainsi, après la perte de propriétés de barrière, la préparation d'une nouvelle lignée cellulaire doit être envisagé. Densité de placage cellule doit être élevée pour EC, car cela est essentiel pour la prolifération cellulaire. Ceci doit être pris en compte lors de la procédure d'isolement ainsi que la maintenance de la immortalisé EC. Chaque nouvelle lignée cellulaire doit être testé pour ses propriétés de barrière et de contaminants possibles avec d'autres types cellulaires. Monocouches CE peut être teinté avec l'antigène du muscle anti-galactocérébroside, anti-protéine acide fibrillaire gliale et anti-lisse comme anticorps primaires pour exclure la contamination par les oligodendrocytes, les astrocytes et les péricytes 4,27. Afin d'éliminer la contamination par les vaisseaux meningal, l'expression de la thrombomoduline peut être testée, qui est exprimée dans tous les lits vasculaires, à l'exception du cerveau 28.
Fait intéressant, les lignées immortalisées de cellules endothéliales microvasculaires isolées à partir de différentes régions du cerveau diffèrent dans leurs propriétés de barrière et la sensibilité aux stimuli pro-inflammatoires. A titre d'exemple, les cérébraux et cérébelleux Cend lignées cellulaires cerebEND peut citer 4,5. CerebEND a montré, en comparaisonà Cend, baisse des niveaux d'expression des principaux composants des jonctions serrées claudine-1 et occludine. Cependant, les niveaux de claudine-3 et -12 ont été plus élevés dans cerebEND. La fonction de barrière de cellules cerebEND beaucoup plus souffert sous un traitement avec le médiateur inflammatoire, le TNF que les propriétés de barrière de cellules Cend fait 5. Vulnérabilité supérieur du cervelet à des stimuli inflammatoires, peuvent être observés in vivo chez les patients de sclérose en plaques et dans son modèle animal expérimental encéphalomyélite auto-immune 29. Ces résultats intéressants montrent la nécessité de produire et de caractérisation individuelle des modèles in vitro pour les différentes régions du cerveau, afin d'améliorer le ciblage futur médicament dans le cerveau.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Cette recherche a été soutenue par la DFG Deutsche Forschungsgemeinschaft sous numéro de subvention FO 315/4-1 et la DFG SFB 688.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Albumine de sérum bovin (BSA) | Sigma-Aldrich | A7906 | Pureté> 98% |
| collagène IV | Sigma-Aldrich | C5533 | 50 pg / ml dans 50 mM d'acide acétique |
| Collagénase / dispase | Roche | 10269638001 | |
| Dulbecco modifié Eagle (DMEM) | Sigma-Aldrich | D5796 | |
| Diméthylsulfoxyde (DMSO) | Sigma-Aldrich | D2650 | |
| Sérum de veau foetal (FCS) | Laboratoires AAP | A15110-1333 | concentration finale 10%, inactivé à la chaleur (30 min à 56 ° C) |
| L-glutamine | Biochrom AG | K0282 | Stockage: ≤ -15 ° C |
| MEM Vitamine | Biochrom AG | K0373 | Stockage: ≤ -15 ° C |
| Na-pyruvate | Biochrom AG | L0473 | |
| Néomycine (G418) | Laboratoires AAP | P11-012 | |
| Acides aminés non essentiels (AEN) | Biochrom AG | K0293 | Stockage à 4 ° C |
| Pénicilline / streptomycine | Biochrom AG | A2212 | Stockage: ≤ -15 ° C |
| Tampon phosphate salin (PBS) | Biochrom AG | L1825 | |
| Polybrène (hexadiméthrine bromure) | Sigma-Aldrich | 107689 | 0,8 mg / ml dans du PBS, un stockage à -20 ° C |
| Puromycine | Sigma-Aldrich | P8833 | |
| Trypsine / EDTA | Biochrom AG | L1825 | 0,05%, 0,02% d'EDTA dans du PBS |
Références
- Wilhelm, I., Fazakas, C., Krizbai, I. A. In vitro models of the blood-brain barrier. Acta Neurobiol. Exp (Wars). 71, 113 (2011).
- Forster, C. Differential effects of hydrocortisone and TNFalpha on tight junction proteins in an in vitro model of the human blood-brain barrier. J. Physiol. 586, 1937 (2008).
- Weksler, B. B. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. FASEB. J. 19, 1872 (2005).
- Forster, C. Occludin as direct target for glucocorticoid-induced improvement of blood-brain barrier properties in a murine in vitro system. J. Physiol. 565 (Pt 2), 475 (2005).
- Silwedel, C., Forster, C. Differential susceptibility of cerebral and cerebellar murine brain microvascular endothelial cells to loss of barrier properties in response to inflammatory stimuli. J. Neuroimmunol. 179, 37 (2006).
- Forster, C. Glucocorticoid effects on mouse microvascular endothelial barrier permeability are brain specific. J. Physiol. 573 (Pt 2), 413 (2006).
- Burek, M., Forster, C. Y. Cloning and characterization of the murine claudin-5 promoter. Mol. Cell Endocrinol. 298, 19 (2009).
- Forster, C., Kahles, T., Kietz, S., Drenckhahn, D. Dexamethasone induces the expression of metalloproteinase inhibitor TIMP-1 in the murine cerebral vascular endothelial cell line cEND. J. Physiol. 580 (Pt.3), 937 (2007).
- Blecharz, K. G., Drenckhahn, D., Forster, C. Y. Glucocorticoids increase VE-cadherin expression and cause cytoskeletal rearrangements in murine brain endothelial cEND cells. J. Cereb. Blood Flow Metab. 28, 1139 (2008).
- Burek, M., Arias-Loza, P. A., Roewer, N., Forster, C. Y. Claudin-5 as a novel estrogen target in vascular endothelium. Arterioscler. Thromb Vasc. Biol. 30, 298 (2010).
- Blecharz, K. G. Glucocorticoid effects on endothelial barrier function in the murine brain endothelial cell line cEND incubated with sera from patients with multiple sclerosis. Mult. Scler. 16, 293 (2010).
- Kleinschnitz, C. Glucocorticoid insensitivity at the hypoxic blood-brain barrier can be reversed by inhibition of the proteasome. Stroke. 42, 1081 (2011).
- Neuhaus, W. Addition of NMDA-receptor antagonist MK801 during oxygen/glucose deprivation moderately attenuates the upregulation of glucose uptake after subsequent reoxygenation in brain endothelial cells. Neurosci. Lett. 506, 44 (2012).
- Perriere, N. Puromycin-based purification of rat brain capillary endothelial cell cultures. Effect on the expression of blood-brain barrier-specific properties. J. Neurochem. 93, 279 (2005).
- Golenhofen, N., Ness, W., Wawrousek, E. F., Drenckhahn, D. Expression and induction of the stress protein alpha-B-crystallin in vascular endothelial cells. Histochem Cell Biol. 117, 203 (2002).
- Risau, W., Engelhardt, B., Wekerle, H. Immune function of the blood-brain barrier: incomplete presentation of protein (auto-)antigens by rat brain microvascular endothelium in vitro. J. Cell Biol. 110, 1757 (1990).
- Abbott, N. J. Dynamics of CNS barriers: evolution, differentiation, and modulation. Cell Mol. Neurobiol. 25, 5 (2005).
- Toth, A. Patented in vitro blood-brain barrier models in CNS drug discovery. Recent Pat. CNS Drug Discov. 6, 107 (2011).
- Harke, N. Glucocorticoids regulate the human occludin gene through a single imperfect palindromic glucocorticoid response element. Mol. Cell Endocrinol. 295, 39 (2008).
- Kiefer, F., Courtneidge, S. A., Wagner, E. F. Oncogenic properties of the middle T antigens of polyomaviruses. Adv. Cancer Res. 64, 125 (1994).
- Kiefer, F. Endothelial cell transformation by polyomavirus middle T antigen in mice lacking Src-related kinases. Curr. Biol. 4, 100 (1994).
- Ong, S. H. ShcA and Grb2 mediate polyoma middle T antigen-induced endothelial transformation and Gab1 tyrosine phosphorylation. EMBO J. 20, 6327 (2001).
- O'Connell, K. A., Edidin, M. A mouse lymphoid endothelial cell line immortalized by simian virus 40 binds lymphocytes and retains functional characteristics of normal endothelial cells. J. Immunol. 144, 521 (1990).
- Roux, F. Regulation of gamma-glutamyl transpeptidase and alkaline phosphatase activities in immortalized rat brain microvessel endothelial cells. J. Cell Physiol. 159, 101 (1994).
- Montesano, R. Increased proteolytic activity is responsible for the aberrant morphogenetic behavior of endothelial cells expressing the middle T oncogene. Cell. 62, 435 (1990).
- Steiner, O., Coisne, C., Engelhardt, B., Lyck, R. Comparison of immortalized bEnd5 and primary mouse brain microvascular endothelial cells as in vitro blood-brain barrier models for the study of T cell extravasation. J. Cereb. Blood Flow Metab. 31, 315 (2010).
- Skaper, S. D., Conn, M. . Methods in Neurosciences. 2, 1303 (1990).
- Ishii, H. Thrombomodulin, an endothelial anticoagulant protein, is absent from the human brain. Blood. 67, 362 (1986).
- Minagar, A., Alexander, J. S. Blood-brain barrier disruption in multiple sclerosis. Mult. Scler. 9, 540 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon