Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La production de vecteurs lentiviraux pour les cellules de transduction du Système Nerveux Central
Dans cet article
Résumé
Dans ce protocole, nous décrivons la production, la purification et le titrage des vecteurs lentiviraux. Nous donnons un exemple de transfert de gènes lentiviraux vecteur médiation dans neurones en culture primaire et les astrocytes. Nos méthodes peuvent également s'appliquer à d'autres types cellulaires In vitro Et In vivo.
Résumé
Efficient gene delivery in the central nervous system (CNS) is important in studying gene functions, modeling neurological diseases and developing therapeutic approaches. Lentiviral vectors are attractive tools in transduction of neurons and other cell types in CNS as they transduce both dividing and non-dividing cells, support sustained expression of transgenes, and have relatively large packaging capacity and low toxicity 1-3. Lentiviral vectors have been successfully used in transducing many neural cell types in vitro 4-6 and in animals 7-10.
Great efforts have been made to develop lentiviral vectors with improved biosafety and efficiency for gene delivery. The current third generation replication-defective and self-inactivating (SIN) lentiviral vectors are depicted in Figure 1. The required elements for vector packaging are split into four plasmids. In the lentiviral transfer plasmid, the U3 region in the 5' long terminal repeat (LTR) is replaced with a strong promoter from another virus. This modification allows the transcription of the vector sequence independent of HIV-1 Tat protein that is normally required for HIV gene expression 11. The packaging signal (Ψ) is essential for encapsidation and the Rev-responsive element (RRE) is required for producing high titer vectors. The central polypurine tract (cPPT) is important for nuclear import of the vector DNA, a feature required for transducing non-dividing cells 12. In the 3' LTR, the cis-regulatory sequences are completely removed from the U3 region. This deletion is copied to 5' LTR after reverse transcription, resulting in transcriptional inactivation of both LTRs. Plasmid pMDLg/pRRE contains HIV-1 gag/pol genes, which provide structural proteins and reverse transcriptase. pRSV-Rev encodes Rev which binds to the RRE for efficient RNA export from the nucleus. pCMV-G encodes the vesicular stomatitis virus glycoprotein (VSV-G) that replaces HIV-1 Env. VSV-G expands the tropism of the vectors and allows concentration via ultracentrifugation 13. All the genes encoding the accessory proteins, including Vif, Vpr, Vpu, and Nef are excluded in the packaging system. The production and manipulation of lentiviral vectors should be carried out according to NIH guidelines for research involving recombinant DNA (http://oba.od.nih.gov/oba/rac/Guidelines/NIH_Guidelines.pdf). An approval from individual Institutional Biological and Chemical Safety Committee may be required before using lentiviral vectors. Lentiviral vectors are commonly produced by cotransfection of 293T cells with lentiviral transfer plasmid and the helper plasmids encoding the proteins required for vector packaging. Many lentiviral transfer plasmids and helper plasmids can be obtained from Addgene, a non-profit plasmid repository (http://www.addgene.org/). Some stable packaging cell lines have been developed, but these systems provide less flexibility and their packaging efficiency generally declines over time 14, 15. Commercially available transfection kits may support high efficiency of transfection 16, but they can be very expensive for large scale vector preparations. Calcium phosphate precipitation methods provide highly efficient transfection of 293T cells and thus provide a reliable and cost effective approach for lentiviral vector production.
In this protocol, we produce lentiviral vectors by cotransfection of 293T cells with four plasmids based on the calcium phosphate precipitation principle, followed by purification and concentration with ultracentrifugation through a 20% sucrose cushion. The vector titers are determined by fluorescence- activated cell sorting (FACS) analysis or by real time qPCR. The production and titration of lentiviral vectors in this protocol can be finished with 9 days. We provide an example of transducing these vectors into murine neocortical cultures containing both neurons and astrocytes. We demonstrate that lentiviral vectors support high efficiency of transduction and cell type-specific gene expression in primary cultured cells from CNS.
Protocole
1. Emballage de vecteurs lentiviraux
Les vecteurs lentiviraux sont produites par co-transfection d'un vecteur lentiviral de transfert et d'autres plasmides requis pour l'emballage dans des cellules 293T par la méthode de transfection au phosphate de calcium. Nous utilisons 10 100-mm boîtes de culture tissulaire dans ce protocole. Il peut être agrandie ou réduite en fonction des applications. La lignée cellulaire 293T est maintenue dans un milieu de Dulbecco Eagle modifié (DMEM) avec du glucose à haute (4500 mg / L), supplémenté avec 10% de sérum de veau fœtal (FBS), 100 unités / ml de pénicilline, 100 pg / ml de streptomycine à 37 ° C incubateur avec 5% de CO 2.
- Semences 293T cellules à confluence de 30-40% à 10 100 mm boîtes de culture tissulaire (3 x 10 6 cellules / boîte) dans un milieu de culture. Retour des cellules de l'incubateur.
- Après 20-24 h de culture, vérifier la densité cellulaire. Les cellules doit être d'environ 80% de confluence au moment de la transfection.
- Préparer un tube de 50 ml. Ajouter 4,4 ml TE79/10 (1 mM Tris-HCl, 0,1 mML'EDTA, pH 7,9) moins le volume total de l'ADN plasmidique suivant. Ajouter 100 ug transfert lentiviral plasmide (figure 1), 58 mg pMDLg / pRRE, 31 ug pCMV-G, 25 ug pRSV-Rev, 600 pi 2M CaCl 2. Mélanger délicatement.
- Préparer un autre tube de 50 ml. Ajouter 5 ml 2x HBS (0,05 M de HEPES, 0,28 M de NaCl, 1,5 mM Na 2 HPO 4, pH 7,12).
- Prenez l'ADN-CaCl 2 par mélange de 10 ml pipette et ajouter dans le tube contenant 2 x HBS, goutte à goutte tout en vortex le tube.
- Gardez la réaction de précipitation à la température ambiante (RT) pendant 30 min.
- Retirer les boîtes de culture de pépinière. Mélanger la réaction de précipitation et par vortex. Ajouter 1 ml de suspension à chacune des cellules plat de 100 mm contenant. La suspension doit être ajouté lentement, goutte à goutte tout en remuant doucement le support dans le plat. Retour de ces plats à l'incubateur et laisser reposer pendant 5 h.
- Retirer le milieu de la culture. Ajouter 6 ml milieu de culture frais contenant 6 mM de sodium butyrate à chaque plat. Retour aux cultures de l'incubateur. Après une nuit de culture, s'il ya un rapporteur fluorescent dans la construction, vérifier l'expression du gène rapporteur sous microscope à fluorescence. Habituellement, plus de 80% des cellules expriment le gène rapporteur si elle est entraînée par un promoteur ubiquiste (par exemple promoteur CMV).
- Deux jours (40-44 h) après la transfection, ramasser le surnageant à partir de 10 plats en 2 tubes de 50 ml (environ 30 ml dans chaque tube). Congeler le surnageant dans congélateur à -80 ° C ou aller à l'étape suivante.
2. La concentration et la purification des vecteurs
- Centrifuger le fraîchement prélevé ou décongelés surnageant à 900 g (environ 2000 tours par minute) pendant 10 min pour enlever tous les débris de cellules dans le surnageant.
- Fixer une seringue de 60 ml, à un filtre de 0,2 um-SFCA seringue. Transférer surnageant de 50 ml tube de la seringue. Filtrer le surnageant dans un tube à centrifuger polyallomère.
- Prenez 5 ml de saccharose à 20% (préparé dans du PBS) dans une pipette de 5 ml. Insérerla pipette à la partie inférieure du tube de centrifugeuse contenant surnageant. Ajouter lentement la solution de saccharose dans le surnageant vecteur. Répétez ces étapes pour surnageant d'un autre tube.
- Centrifuger le surnageant à 11000 rpm et 4 ° C pendant 4 h avec rotor Beckman SW28 balançoire.
- Eliminer le surnageant. Ajouter 150 ul Lactose 4% (préparé dans du PBS) à chaque tube de la centrifugeuse. Remettre en suspension les culots.
- Transfert du vecteur concentré de tous les tubes à centrifuger dans un tube de 1,5 ml. Laisser le tube sur la glace pendant 15 min.
- Mélanger la suspension vecteur par pipetage. Spin avec microcentrifugeuse à pleine vitesse (environ 16000 g) pendant 1 min.
- Transférer le surnageant dans un nouveau tube de 1,5 ml. Divisez l'échantillon final en 20 aliquotes et les a entreposés dans congélateur à -80 ° C.
3. Le titrage des Vecteurs
- Graine 5 x 10 4 / puits de cellules HT1080 12 à plaque de puits dans 1 ml du milieu DMEM supplémenté avec 10% de FBS.
- Après overnigla culture ht, compter les cellules d'un puits et marquer le nombre de cellules.
- Faire 5 fois de dilution en série (1:5, 1: 25; 1:125, et 1:625) du vecteur concentrée avec du milieu de culture. Ajouter I ul de chaque vecteur dilués dans les puits séparés. Les échantillons peuvent être dupliquées pour augmenter la précision.
- Ajouter une pi 4 mg / ml polybrène (bromure d'hexadiméthrine) dans chaque vecteur de puits contenant et dans un puits sans vecteur. Mélanger en secouant doucement la plaque. Retour à l'incubateur pendant 48 h.
- Evacuer le milieu des puits de culture cellulaire. Laver chaque puits avec du PBS. Ajouter 250 pi 1x trypsine-EDTA solution aux cellules. Lorsque les cellules se détachent (3-5 min), ajouter 1 ml milieu de culture. Remettre en suspension les cellules par pipetage. Transfert suspension cellulaire à 1,5 ml tubes à centrifuger.
- Centrifuger à 900 g pendant 6 min. Pour les vecteurs avec un gène rapporteur fluorescent (par exemple GFP), passez à l'étape 3.7 pour l'analyse FACS. Pour les vecteurs sans un journaliste, passez à l'étape 3.8 pour qPCR en temps réel.
- Pour les vecteurs contenant un fluogène rapporteur fluorescentes, éliminer le surnageant et remettre en suspension le culot avec 300 ul de 3,7% de formaldéhyde dans du PBS. Déterminer le pourcentage des cellules rapporteur positifs par analyse par FACS. Le titre sera représenté sous forme d'unités de transduction par millilitre concentrée vecteur (TU / ml).
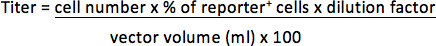
Par exemple, si 1 x 10 5 cellules a été transduites avec pl 1/25 (0,04 pi) du vecteur et les cellules de 30% sont positifs journaliste, le titre sera:
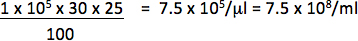
N'utilisez que les dilutions tomber dans une relation linéaire entre le pourcentage de cellules positives et la quantité de vecteur ajoutée pour calculer le titre. Le titre final doit être une moyenne des titres obtenus à partir de transductions d'au moins 2 montants différents du vecteur.
- Pour les vecteurs sansgène rapporteur fluorescent, extraire l'ADN génomique de cellules HT1080 en utilisant QIAamp DNA Mini Kit (Qiagen) selon le protocole du fabricant. Amplifier la séquence du vecteur dans l'ADN génomique en utilisant ABI Prism 7000 Sequence Detection System (Applied Biosystems) avec des amorces (en matière de VIH-1 PBS / psi région 17) 5'-CCGTTGTCAGGCAACGTG-3 'et 5'-AGCTGACAGGTGGTGGCAAT-3', et la sonde TaqMan 5 '-FAM-AGCTCTCTCGACGCAGGACTCGGC-TAMRA-3'. Gène de l'albumine qui est un gène à copie unique dans le génome (2 copies par cellule) a également été amplifiée avec les amorces 5'-TGAAACATACGTTCCCAAAGAGTTT-3 'et 5'-CTCTCCTTCTCAGAAAGTGTGCATAT-3', et la sonde 5'-FAM-TGCTGAAACATTCACCTTCCATGCAGA-TAMRA-3 «comme un contrôle interne. Déterminer les nombres de copies du vecteur et de l'albumine par PCR dans la plaque de 96 puits selon l'instruction de la fabrication avec le programme suivant: 50 ° C pendant 2 min, 95 ° C pendant 10 min, et 35 cycles de 95 ° C pendant 15 secondes et 60 ° C pendant 2 min. Dix-dilutions de plasmides de concentration connue (représenté sous forme de copienombre) contenant les séquences de matrice doit également être amplifié pour créer une courbe d'étalonnage pour la quantification des échantillons inconnus. Le titre sera représenté sous forme d'unités d'intégration par millilitre concentrée vecteur (UI / ml).
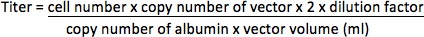
4. La transduction de cultures néocorticaux
Cultures néocorticaux contenant à la fois les neurones et les cellules gliales sont préparés à partir de cortex de souris en utilisant un procédé de revêtement en deux étapes, comme décrit précédemment 18. Neocortices obtenus à partir de souris fœtales à 14-16 jours de gestation sont étalées sur une monocouche précédemment établi gliales dans du MEM supplémenté avec 10% de FBS, 20 mM de glucose et 2 mM de glutamine de 24 puits plaque de culture tissulaire.
- Après 5 jours in vitro, ajouter 10 uM cytosine arabinoside (Ara-C) dans la CENALla culture ortical pour inhiber la division cellulaire non-neuronales. Continuer la culture des cellules pendant 2 jours.
- Milieu de culture chaud à 37 ° C bain-marie pendant 5-10 min. Remplacer l'Ara-C contenant un milieu de milieu de culture frais (500 pl / puits).
- Ajouter vecteur avec désirée IAM (multiplicité d'infection, le rapport du nombre de particules de vecteur au nombre de cellules cibles) à la culture. Continuer la culture pendant 24 h. Nous utilisons MOI de 1-10 (généralement 5) dans des cultures primaires corticales.
- Remplacez le milieu de culture par du milieu frais. Continuer la culture. Si il ya un gène rapporteur dans la construction de vecteur, vérifiez les cellules sous un éclairage fluorescent microscope 2 jours après transduction. Expression du gène rapporteur est visible dans les neurones 2-7 après transduction, en fonction de la conception du vecteur et la dose utilisée.
5. Les résultats représentatifs
Les titres de vecteurs lentiviraux produites avec cette gamme protocole 10 8 -10 10 UI / ml, WHICh sont adaptés pour la transduction d'une variété de types de cellules du SNC à la fois in vitro et in vivo. tableau 1 et figure 2 montrent un résultat représentatif en utilisant les vecteurs produits par ce protocole. Nous transduites murins cultures néocorticales avec des vecteurs lentiviraux exprimant la protéine fluorescente verte (GFP), contrôlée par synapsine (SYN) promoteur ou gliale la protéine acide fibrillaire (GFAP) promoteur. Sept jours après transduction, nous avons effectué immunomarquage pour les neurones et les astrocytes étiquettes avec des anticorps anti-neun et anti-GFAP, respectivement. Comme le montre le tableau 1 et fig. 2A, après transduction avec le vecteur portant le promoteur synapsine, plus de 90% des neurones (cellules + de Neun) expriment la GFP et aucun astrocytes (GFAP + cellules) exprimer ce gène rapporteur. Lorsque le promoteur GFAP est utilisé dans la construction du vecteur (figure 2B), environ 80% des astrocytes (GFAP + cellules) expressions GFP; tous les cellules GFP + sont les astrocytes comme l'a confirmé par colocalisation avec la GFAP et l'absence d'expression de la GFP dans les cellules NeuN-étiquetés. Ces résultats démontrent que les vecteurs lentiviraux sont très efficaces pour fournir des transgènes à des cellules de CNS et de l'expression génique des cellules spécifiques peuvent être obtenus lorsque les promoteurs appropriés sont utilisés.
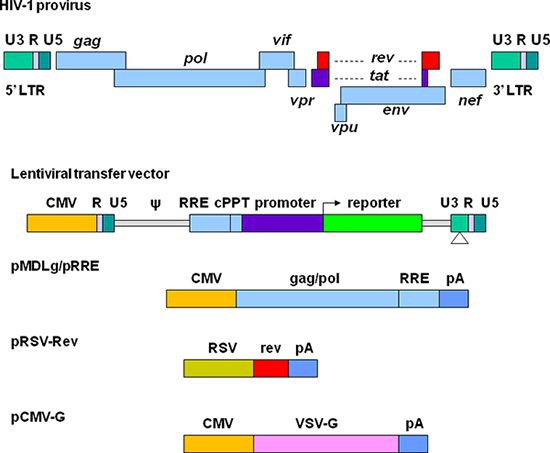
Figure 1. Représentation schématique du VIH à base de vecteurs lentiviraux et les plasmides d'emballage. Le provirus VIH-1 est affiché en haut. Les éléments de production de vecteur sont séparés en quatre différents plasmides. Le transfert lentivirale plasmide contient un hybride 5 'LTR dans lequel la région U3 est remplacé par le cytomégalovirus (CMV), le signal d'encapsidation (ψ), la séquence RRE, le tube polypurique centrale (cPPT), un gène d'intérêt (par exemple une rapporteur fluorescent) le long d'un promoteur de choix, et l'extrémité 3 'LTR dans lequel leséquences cis réglementaires sont complètement retirés de la région U3. pMDLg / pRRE contient les gènes gag et pol et RRE séquence de VIH-1 sous le contrôle du promoteur CMV. pRSV-Ap contient la séquence codante de Rev dirigée par le promoteur RSV. pCMV-G contient le gène de protéine VSV-G sous le contrôle du promoteur CMV. PA indique que le signal de polyadénylation de l'homme β-globine.
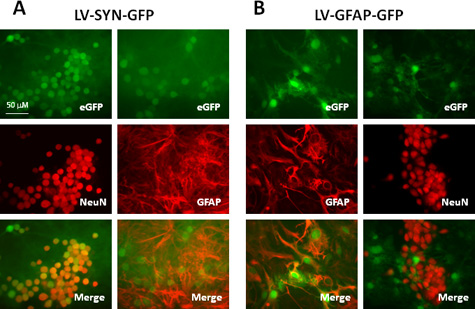
Figure 2. Expression de gènes rapporteurs dans la souris culture mixte néocorticale transduits avec des vecteurs lentiviraux porteurs de cellules spécifiques au type de promoteurs. Les cultures ont été transduites avec LV-SYN-GFP (A) ou LV-GFAP-GFP vecteurs (B) à une MOI de 5. Sept jours après transduction, les cellules ont été immunomarquées avec anticorps anti-NeuN ou anti-GFAP. Panneaux supérieurs montrent fluorescence de la GFP, les panneaux du milieu montrent immunocoloration et panneaux inférieurs sont fusionnés images (GFP: vert; NeuN ou GFAP: rouge).
| Vecteur | Cellules GFP + dans les neurones | + GFP dans les astrocytes |
| LV-SYN-GFP | 92,2 ± 7,3 | 0 |
| LV-GFAP-GFP | 0 | 78,3 ± 11,5 |
Tableau 1. Comparaison de l'expression de la GFP dans murins cultures néocorticales transduits avec des vecteurs lentiviraux portant des promoteurs différents: a.
quelques cultures néocorticales murins (5 x 10 5 / puits dans 24 puits) ont été transduites avec le LV-SYN-GFP ou LV-GFAP-GFP à une MOI de 5. Sept jours après transduction, les cultures ont été fixées et immunocolorées pour NeuN ou GFAP. Le nombre de cellules GFP et NeuN / GFAP exprimant ont été comptés dans les images à partir de 10 champs par condition expérimentale. Les valeurs représentent le pourcentage de neurones (cellules + de Neun) ouastrocytes (GFAP + cellules) qui ont également exprimé le gène rapporteur GFP. Les valeurs indiquées sont des moyennes ± SD de trois expériences indépendantes.
Discussion
Dans ce protocole, nous avons montré la production de vecteurs lentiviraux et l'application de ces vecteurs dans les cultures néocorticales. Nous avons démontré l'efficacité et de la cellule spécifique au type de transduction par les vecteurs produits par ces méthodes. Lorsque le promoteur synapsine est utilisé, expression de la GFP est strictement neurone spécifique. Lorsque le promoteur GFAP est utilisé, expression de la GFP est exclusivement dans les astrocytes. Si aucune cellule spécifique au type...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par le NIH Neuroscience Blueprint subvention de base (P30 NS057105, BJS) à l'Université de Washington, le Programme de subvention de projet NS032636 (BJS) et par le Centre de l'espoir pour les troubles neurologiques.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| DMEM | Sigma-Aldrich | D5796 | |
| MEM | Invitrogen | 11090-081 | |
| Sérum de veau fœtal | Hyclone | SV3001403 | |
| PBS | Mediatech | 21-040-CM | |
| Trypsine-EDTA | Sigma-Aldrich | T3924 | |
| Le butyrate de sodium | Sigma-Aldrich | B5887 | |
| Hexadiméthrine bromure de (polybrène) | Sigma-Aldrich | H9268 | |
| Des cellules 293T | ATCC | CRL-11268 | |
| Cellules HT1080 | ATCC | CCL-121 | |
| Falcon 100 x 20 mm tissus culturplat e | BD Biosciences | 353003 | |
| 1 x 3 ½ tube de la centrifugeuse polyallomoer | Beckman-Coulter | 326823 | |
| De 0,2 micron filtre à seringue | Corning | 431219 | |
| QIAamp DNA Mini Kit | Qiagen | 51304 |
Références
- Naldini, L. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272, 263-267 (1996).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J. Virol. 72, 9873-9880 (1998).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nat. Rev. Neurosci. 4, 353-364 (2003).
- Gascon, S., Paez-Gomez, J. A., Diaz-Guerra, M., Scheiffele, P., Scholl, F. G. Dual-promoter lentiviral vectors for constitutive and regulated gene expression in neurons. J. Neurosci. Methods. 168, 104-1012 (2008).
- Hioki, H. Efficient gene transduction of neurons by lentivirus with enhanced neuron-specific promoters. Gene Ther. 14, 872-882 (2007).
- Li, M. Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells. J. Neurosci. Methods. 189, 56-64 (2010).
- Naldini, L., Blomer, U., Gage, F. H., Trono, D., Verma, I. M. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector. Proc. Natl. Acad. Sci. U.S.A. 93, 11382-11388 (1996).
- Blomer, U. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. J. Virol. 71, 6641-6649 (1997).
- Consiglio, A. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc. Natl. Acad. Sci. U.S.A. 101, 14835-14840 (2004).
- Jakobsson, J., Ericson, C., Jansson, M., Bjork, E., Lundberg, C. Targeted transgene expression in rat brain using lentiviral vectors. J. Neurosci. Res. 73, 876-885 (2003).
- Arya, S. K., Guo, C., Josephs, S. F., Wong-Staal, F. Trans-activator gene of human T-lymphotropic virus type III (HTLV-III). Science. 229, 69-73 (1985).
- Sirven, A. The human immunodeficiency virus type-1 central DNA flap is a crucial determinant for lentiviral vector nuclear import and gene transduction of human hematopoietic stem cells. Blood. 96, 4103-4110 (2000).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8033-8037 (1993).
- Farson, D. A new-generation stable inducible packaging cell line for lentiviral vectors. Hum. Gene Ther. 12, 981-997 (2001).
- Broussau, S. Inducible packaging cells for large-scale production of lentiviral vectors in serum-free suspension culture. Mol. Ther. 16, 500-507 (2008).
- Wang, X., McManus, M. Lentivirus production. J. Vis. Exp. (32), e1499 (2009).
- Sastry, L., Johnson, T., Hobson, M. J., Smucker, B., Cornetta, K. Titering lentiviral vectors: comparison of DNA, RNA and marker expression methods. Gene Ther. 9, 1155-1162 (2002).
- Snider, B. J., Lobner, D., Yamada, K. A., Choi, D. W. Conditioning heat stress reduces excitotoxic and apoptotic components of oxygen-glucose deprivation-induced neuronal death in vitro. J. Neurochem. 70, 120-129 (1998).
- Mazarakis, N. D. Rabies virus glycoprotein pseudotyping of lentiviral vectors enables retrograde axonal transport and access to the nervous system after peripheral delivery. Hum. Mol. Genet. 10, 2109-2121 (2001).
- Kato, S. Neuron-specific gene transfer through retrograde transport of lentiviral vector pseudotyped with a novel type of fusion envelope glycoprotein. Hum. Gene Ther. 22, 1511-1523 (2011).
- Segura, M. M., Garnier, A., Durocher, Y., Ansorge, S., Kamen, A. New protocol for lentiviral vector mass production. Methods Mol. Biol. 614, 39-52 (2010).
- Kutner, R. H., Puthli, S., Marino, M. P., Reiser, J. Simplified production and concentration of HIV-1-based lentiviral vectors using HYPERFlask vessels and anion exchange membrane chromatography. BMC Biotechnol. 9, 10 (2009).
- Laughlin, M. A., Chang, G. Y., Oakes, J. W., Gonzalez-Scarano, F., Pomerantz, R. J. Sodium butyrate stimulation of HIV-1 gene expression: a novel mechanism of induction independent of NF-kappa B. J Acquir Immune Defic Syndr Hum Retrovirol. 9, 332-339 (1995).
- Gasmi, M. Requirements for efficient production and transduction of human immunodeficiency virus type 1-based vectors. J. Virol. 73, 1828-1834 (1999).
- Palsson, B., Andreadis, S. The physico-chemical factors that govern retrovirus-mediated gene transfer. Exp. Hematol. 25, 94-102 (1997).
- Lizee, G. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum. Gene Ther. 14, 497-507 (2003).
- Lee, J. K., Chung, J., McAlpine, F. E., Tansey, M. G. Regulator of G-Protein Signaling-10 Negatively Regulates NF-{kappa}B in Microglia and Neuroprotects Dopaminergic Neurons in Hemiparkinsonian Rats. J. Neurosci. 31, 11879-11888 (2011).
- Shevtsova, Z., Malik, J. M., Michel, U., Bahr, M., Kugler, S. Promoters and serotypes: targeting of adeno-associated virus vectors for gene transfer in the rat central nervous system in vitro and in vivo. Exp. Physiol. 90, 53-59 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon