Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Les îlots de rongeurs évaluation de la réplication et la fonction des cellules bêta dans Adenovirally transduites isolées
Dans cet article
Résumé
Ce protocole permet d'identifier les facteurs qui modulent fonctionnelle masse des cellules bêta de trouver des cibles thérapeutiques potentielles pour le traitement du diabète. Le protocole consiste en une méthode simplifiée pour évaluer la réplication des îlots et la fonction des cellules bêta des îlots de Langerhans isolés de rat après la manipulation de l'expression des gènes par des adénovirus.
Résumé
L'homéostasie du glucose est principalement contrôlée par les hormones du système endocrinien de l'insuline et le glucagon, sécrété par la version bêta du pancréas et des cellules alpha, respectivement. Fonctionnelle masse des cellules bêta est déterminée par la masse des cellules bêta anatomique ainsi que la capacité des cellules bêta pour répondre à une charge en éléments nutritifs. Une perte de masse des cellules bêta fonctionnelles est au cœur de ces deux formes principales de diabète 1-3. Considérant que les résultats en déclin bêta fonctionnelles de masse de cellules à partir d'une attaque auto-immune de type 1 du diabète, dans le diabète de type 2, cette décroissance se développe à la fois une incapacité des cellules bêta à sécréter de l'insuline de façon appropriée et la destruction des cellules bêta à partir d'un cadre de mécanismes. Ainsi, les efforts visant à restaurer la fonctionnalité de masse des cellules bêta sont primordiaux pour un meilleur traitement des cures et potentiels pour le diabète.
Des efforts sont en cours pour identifier les voies moléculaires qui peuvent être exploitées afin de stimuler la réplication et d'améliorer la fonction des cellules bêta.Idéalement, les objectifs thérapeutiques permettrait d'améliorer à la fois la croissance des cellules bêta et la fonction. Peut-être plus important, cependant, c'est de déterminer si une stratégie qui stimule la croissance des cellules bêta se fait au prix de la fonction des cellules bêta atteinte (par exemple avec certains oncogènes) et vice-versa.
Par systématiquement la suppression ou la surexpression de l'expression de gènes cibles dans les îlots isolés de rat, on peut identifier des cibles thérapeutiques potentielles pour augmenter la masse des cellules bêta fonctionnelles 4-6. Des vecteurs adénoviraux peut être utilisé à des protéines efficacement surexpriment ou démontable en îlots isolés de rat 4,7-15. Ici, nous présentons une méthode pour manipuler l'expression des gènes en utilisant transduction adénovirale et d'évaluer la réplication des îlots et la fonction des cellules bêta des îlots de Langerhans isolés de rat (figure 1). Cette méthode a été utilisée précédemment pour identifier de nouvelles cibles qui modulent la réplication des cellules bêta ou la fonction 5,6,8,9,16,17.
Protocole
1. Transduction adénovirale et la culture d'îlots de rats
- Préparer une plaque à 6 puits de culture tissulaire non revêtu par addition de 2 ml de milieu (RPMI 1640 contenant 8 mM de glucose, 10% de sérum bovin foetal, de 50 unités / ml de pénicilline, et 50 mg / ml de streptomycine) au nombre requis de puits. Par exemple, une expérience typique peut exiger trois puits - un de chaque pour un contrôle sans virus, un contrôle du virus (par exemple, GFP-exprimer adénovirus), et le groupe expérimental.
- Chauffer la plaque à 37 ° C en le plaçant dans un incubateur de culture tissulaire pendant au moins 30 min.
- Immédiatement après isolement des îlots de rat 18,19, 100-200 îlots lieu dans des puits individuels de la plaque à 6 puits culture non-tissu enduit. Soixante îlots sont nécessaires pour la sécrétion d'insuline et des essais d'incorporation de thymidine. Les îlots restants peuvent être utilisés pour l'isolation de l'ARN pour les études d'expression génique ou l'isolement de protéines pour immunoblot.
[Note: De ce point de l'avant, s'il vous plaît suivre les protocoles institutionnels pour la manipulation, l'utilisation et l'élimination des matières infectieuses.]
- Agiter doucement la plaque pour amener les îlots au centre du puits.
- Pipeter l'adénovirus directement sur les îlots dans le centre du plat. Utilisez 100-500 multiplicités d'infection (MOI, le rapport des cellules cibles à virales unités formatrices de plages).
- Laisser reposer pendant 5 min îlots.
- Placer la plaque dans l'incubateur de culture tissulaire (37 ° C, 5% de CO 2).
- Après 24 h, agiter doucement la plaque pour amener les îlots aux centres des puits et transférer les îlots en utilisant une micropipette P200 à un nouveau puits contenant du milieu frais. Si les îlots sont attachés à la plaque, ils peuvent être délogés en douceur avec la pointe de la pipette.
[Remarque: Pour vérifier effi transduction adéquatecy, l'utilisation d'un virus de la GFP de commande exprimant est bénéfique, comme îlots peut alors être imagée par microscopie confocale à vérifier la pénétration de l'adénovirus dans le noyau îlot.]
- Culture des îlots pour un supplément de 24-72 heures, selon le rythme souhaité de l'expérience des études pilotes d'optimisation. Par exemple, l'induction d'une réponse proliférative peut exiger des durées allant de 24 à 72 h ou knockdown du gène d'intérêt peut exiger 48 ou 72 heures. Transfert des îlots sur des milieux frais chaque jour.
- Pour la finale 24 h de l'expérience, la culture des îlots dans un milieu contenant 1 pCi [méthyl-3 H] -thymidine/ml médias (généralement de 1 pl thymidine / ml les médias).
[Note: De ce point de l'avant, s'il vous plaît suivre les protocoles institutionnels pour la manipulation, l'utilisation et l'élimination des matières radioactives.]
2. Essai sécrétion d'insuline
- Préparer letampon de dosage sécrétion (SAB) solution stock 10X (1,14 M de NaCl, 47 mM de KCl, 12 mM KH 2 PO 4, 11,6 mM MgSO 4) et solution de CaCl 2 de stock 100X (0,25 M CaCl 2). Ces solutions mères peuvent être préparées à l'avance et conservé à température ambiante.
- Fraîchement préparer 50 ml de la RFA de travail (5 mL de SAB 10X, 1 ml de HEPES 1 M, 0,5 ml de CaCl 2, 100X 0,28 ml de 35% de BSA, 0,11 g de NaHCO 3, et de l'eau stérile à 50 ml) dans un conique de 50 ml tube et chaude à 37 ° C en plaçant dans un bain-marie à 37 ° C.
- Introduire à la pipette 10 ml de la SAB de travail dans un tube de 15 ml conique et ajouter 66,8 ul de 2,5 M de D-glucose pour préparer le taux élevé de glucose (16,7 mM) SAB.
- Ajouter 44,8 ul de 2,5 M de D-glucose à la tranche restante de 40 ml de la SAB travaille pour préparer le faible taux de glucose (2,8 mM) SAB.
- Étiquette trois microtubes de 1,7 ml pour chaque puits de la plaque à 6 puits et ajouter 1 ml de tampon phosphate salin (PBS).
[Remarque: Comme les îlots sont radioactifs, s'il vous plaît suivre les protocoles institutionnels pour la manipulation, l'utilisation et l'élimination des matières radioactives.]
- Placez 20 îlots dans chaque microtube. Faites de chaque tentative d'ajout d'îlots de taille comparable à chaque microtube. Par exemple, chaque tube peut contenir 5 à petite, 10 moyennes et 5 de grande taille (îlots voir Figure 1).
[Note: Les îlots peuvent être visualisées en utilisant soit un stéréoscope dissection ou d'un microscope standard.]
- Après les îlots se sont installés sur le fond du tube par gravité (~ 2 min), aspirer le PBS avec une micropipette et le jeter.
[Remarque: Comme une alternative à la décantation par gravité, les tubes peuvent être centrifugés à 300 g pendant 1 min.]
- Pour la pré-incubation, ajouter 400 ul de la faible glucose SAB, placer les tubes (avec leurs bouchons ouvert) dans la incubateur de culture tissulaire (37 ° C, 5% de CO 2), et pré-incuber pendant 60 min. Aspirer le pré-incubation faible taux de glucose SAB et le jeter.
- Pour la sécrétion d'insuline basale, ajouter 400 ul de la faible concentration de glucose SAB, placer les tubes (avec leurs bouchons ouvert) dans la incubateur de culture tissulaire (37 ° C, 5% de CO 2), et incuber pendant 60 min. Recueillir le faible taux de glucose SAB et enregistrer pour le dosage radioimmunologique l'insuline.
- Pour la sécrétion d'insuline stimulée, ajouter 400 ul de la forte concentration de glucose SAB, placer les tubes (avec leurs bouchons ouvert) dans la incubateur de culture tissulaire (37 ° C, 5% de CO 2), et incuber pendant 60 min. Recueillir le taux élevé de glucose SAB et enregistrer pour le dosage radioimmunologique l'insuline.
3. Essai d'incorporation de thymidine
- Ajouter 1 ml de PBS, après les îlots se sont installés sur le fond du tube par gravité, aspirer le PBS avec une micropipette, jeter, et répétez cettel'étape la fois.
- Ajouter 500 ul de la glace froide d'acide trichloracétique (TCA, 10% w / v) et incuber sur de la glace pendant 30 min.
- Centrifuger les tubes à 16 000 xg pendant 3 min à 4 ° C.
- Aspirer le TCA, ajouter 80 ul de NaOH 0,3 N, et incuber pendant 30 min à température ambiante. Pendant ce temps, vigoureusement vortex les échantillons pour 5-10 s toutes les 10 min.
- Ajouter 4 ml de cocktail de comptage Econo-sécuritaire de 7 ml de liquide à scintillation tubes de comptage.
- Ajouter 50 ml de l'échantillon dans le tube de comptage à scintillation, plafonner le tube, agiter brièvement, et compter dans un compteur à scintillation liquide.
- Mesurer la concentration de protéines en utilisant l'acide bicinchoninique (BCA) de dosage et 10 ul de l'échantillon selon le protocole du fabricant.
4. Analyse des données
- Effectuer le dosage radioimmunologique l'insuline en suivant le protocole du fabricant.
- Normaliser la sécrétion d'insuline et des données d'incorporation de thymidine avec le concentré de protéineentration.
5. Les résultats représentatifs
Un exemple de l'expérience pour évaluer la réplication des îlots et la fonction des cellules bêta des îlots de Langerhans chez le rat est montré dans la figure 2. Cet exemple montre que la surexpression adénovirale de hypothétique "Gene # 6" stimule la réplication robuste îlot sans altérer la fonction des cellules bêta. Dans le panneau supérieur, les résultats du test d'incorporation de thymidine démontrer que l'augmentation de l'expression de "Gene # 6" augmente la synthèse d'ADN, telle que mesurée par l'incorporation de thymidine. Parce que la plupart des cellules de l'îlot de rat sont des cellules bêta, il est probable que cette augmentation de l'incorporation de thymidine indique une augmentation de la réplication des cellules bêta. Cependant, les expériences de confirmation doit être effectuée pour établir fermement cette. Dans le panneau du bas, les résultats du test la sécrétion d'insuline démontrer que la surexpression de "Gene # 6" ne modifie pas l'une des fonctions primaires de cellules bêta, c'est à dire, ila sécrétion de glucose nsulin à basse et haute. La qualité de l'isolement des îlots et la santé des îlots suivant le traitement avec des adénovirus est indiqué par la multiplication par la sécrétion d'insuline à des concentrations de glucose basse et haute. Si l'augmentation de l'expression de "Gene # 6" fonction des cellules bêta avec facultés affaiblies, ce serait probablement correspond à une diminution de l'insuline sécrétée à fortes concentrations de glucose (16,7 mM de stimulation). Une courbe dose-réponse pour différentes concentrations de glucose pourrait également être effectuée.
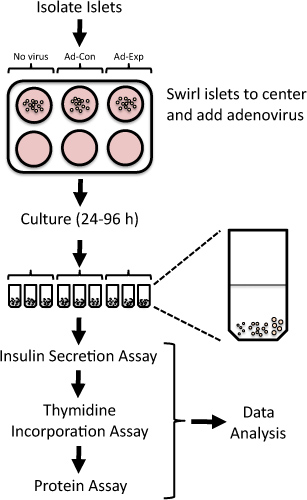
Figure 1. Vue d'ensemble du protocole pour évaluer la réplication des îlots et la fonction des cellules bêta des îlots de Langerhans isolés de rat après adéno-médiation des altérations dans l'expression des gènes. Îlots de rat fraîchement isolés sont exposés à des adénovirus pendant 24 h puis cultivées jusqu'à 96 h. L'incorporation de thymidine est évalué dans le dernier 24 h, suivi par la mesure de la sécrétion d'insuline àglucose basse et haute.
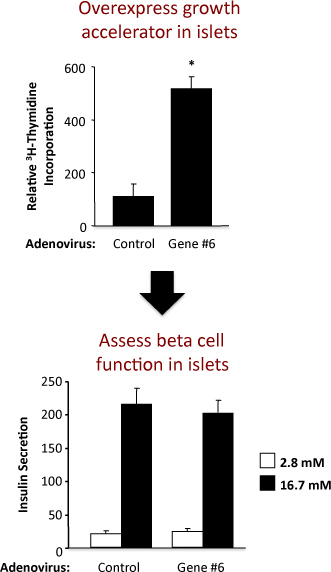
Figure 2. Les résultats d'une expérience en utilisant un adénovirus contrôle et un adénovirus un gène hypothétique étiquetés comme "Gene # 6" surexprimant. Le panneau supérieur montre l'incorporation de la thymidine et le panneau inférieur de la sécrétion d'insuline.
Discussion
Établir des voies qui peuvent être modulés afin de stimuler la réplication et d'améliorer la fonction des cellules bêta sont pertinentes pour les deux principales formes de diabète. Parce que fonctionnelle masse des cellules bêta est tributaire de l'existence et la fonction de cellules sécrétrices d'insuline, l'évaluation de ces déterminants a simultanément ses avantages. Ce protocole décrit un protocole simplifié pour déterminer si la surexpression ou la suppression d'une protéine c...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par des subventions du NIH DK078732 (à PTF).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| RPMI 1640 les médias | Gibco | 11879 | |
| Pénicilline / streptomycine | Gibco | 15140 | |
| Des plaques 6 puits | BD-Falcon | 35-1146 | Non-TC traités |
| [Méthyl-3 H]-thymidine | Perkin Elmer | NET027Z001MC | 1 mCi / ml |
| Micro-centrifugeuse tubes | Denville | C2170 | 1,7 ml |
| NaCl | Sigma | 59888 | |
| KCl | Acros | 42409 | |
| KH 2 </ Sub> PO 4 | Acros | 20592 | |
| MgSO 4 | Acros | 41348 | |
| CaCl 2 | Acros | 34961 | |
| HEPES | Sigma | H0887 | Solution à 1 M |
| 35% de BSA | Sigma | A7979 | |
| NaHCO 3 | Acros | 42427 | |
| D-glucose | Sigma | G8769 | |
| TCA | Fisher Scientific | SA9410-1 | 10% p / v |
| NaOH | Acros | 12426 | |
| Tube de comptage à scintillation | Sarstedt | 58.536 | 7 ml, PP |
| Bouchon du tube de comptage à scintillation | Sarstedt | 65.816 | |
| Econo-Safe cocktail de comptage | RPI | 111175 | |
| L'insuline RIA | Siemens | TKIN2 | |
| BCA Assay Kit | Thermo Scientific | 23250 | |
| Équipement | |||
| Centrifuger | Eppendorf | 5415R | |
| Comptage à scintillation portoir | Sarstedt | 93.1431.001 | |
| Compteur à scintillation liquide | Perkin Elmer | Tri-Carb 2910TR |
Références
- Ferrannini, E. beta-Cell function in subjects spanning the range from normal glucose tolerance to overt diabetes: a new analysis. J. Clin. Endocrinol. Metab. 90, 493-500 (2005).
- Weyer, C., Bogardus, C., Mott, D. M., Pratley, R. E. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J. Clin. Invest. 104, 787-794 (1999).
- Keenan, H. A. Residual insulin production and pancreatic ss-cell turnover after 50 years of diabetes: Joslin Medalist Study. Diabetes. 59, 2846-2853 (2010).
- Bain, J. R., Schisler, J. C., Takeuchi, K., Newgard, C. B., Becker, T. C. An adenovirus vector for efficient RNA interference-mediated suppression of target genes in insulinoma cells and pancreatic islets of langerhans. Diabetes. 53, 2190-2194 (2004).
- Fueger, P. T. Trefoil factor 3 stimulates human and rodent pancreatic islet beta-cell replication with retention of function. Mol. Endocrinol. 22, 1251-1259 (2008).
- Schisler, J. C. Stimulation of human and rat islet beta-cell proliferation with retention of function by the homeodomain transcription factor Nkx6.1. Mol. Cell Biol. 28, 3465-3476 (2008).
- Chan, C. B. Overexpression of uncoupling protein 2 inhibits glucose-stimulated insulin secretion from rat islets. Diabetes. 48, 1482-1486 (1999).
- Cozar-Castellano, I., Takane, K. K., Bottino, R., Balamurugan, A. N., Stewart, A. F. Induction of beta-cell proliferation and retinoblastoma protein phosphorylation in rat and human islets using adenovirus-mediated transfer of cyclin-dependent kinase-4 and cyclin D1. Diabetes. 53, 149-159 (2004).
- Icyuz, M. Adenovirus infection activates akt1 and induces cell proliferation in pancreatic islets1. Transplantation. 87, 821-824 (2009).
- Kaneto, H. Activation of the hexosamine pathway leads to deterioration of pancreatic beta-cell function through the induction of oxidative stress. J. Biol. Chem. 276, 31099-31104 (2001).
- Antinozzi, P. A., Berman, H. K., O'Doherty, R. M., Newgard, C. B. Metabolic engineering with recombinant adenoviruses. Annu. Rev. Nutr. 19, 511-544 (1999).
- Newgard, C. B., Becker, T. C., Berman, H. K., O'Doherty, R. M. Regulation of overexpressed hexokinases in liver and islet cells. Biochem. Soc. Trans. 25, 118-122 (1997).
- Becker, T. C., BeltrandelRio, H., Noel, R. J., Johnson, J. H., Newgard, C. B. Overexpression of hexokinase I in isolated islets of Langerhans via recombinant adenovirus. Enhancement of glucose metabolism and insulin secretion at basal but not stimulatory glucose levels. J. Biol. Chem. 269, 21234-21238 (1994).
- Csete, M. E. Adenoviral-mediated gene transfer to pancreatic islets does not alter islet function. Transplant Proc. 26, 756-757 (1994).
- Csete, M. E. Efficient gene transfer to pancreatic islets mediated by adenoviral vectors. Transplantation. 59, 263-268 (1995).
- Meng, Z. X. Activation of liver X receptors inhibits pancreatic islet beta cell proliferation through cell cycle arrest. Diabetologia. 52, 125-135 (2009).
- Ronnebaum, S. M. A pyruvate cycling pathway involving cytosolic NADP-dependent isocitrate dehydrogenase regulates glucose-stimulated insulin secretion. J. Biol. Chem. , (2006).
- Milburn, J. L. Pancreatic beta-cells in obesity. Evidence for induction of functional, morphologic, and metabolic abnormalities by increased long chain fatty acids. J. Biol. Chem. 270, 1295-1299 (1995).
- Szot, G., Koudria, P., Bluestone, J. Murine Pancreatic Islet Isolation. J. Vis. Exp. (7), e255 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon