Method Article
Conversion d'un test ELISA de capture à un test Luminex xMAP utilisant une méthode de dépistage d'anticorps Multiplex
Dans cet article
Résumé
Un test ELISA peut être facilement converti en un dosage Luminex xMAP et, grâce aux bienfaits de multiplexage, plusieurs anticorps peuvent être projetés simultanément pour identifier une paire d'anticorps optimal, ce qui entraîne une sensibilité accrue et une gamme dynamique, tout en réduisant les coûts du test.
Résumé
Le dosage immuno-enzymatique (ELISA) a longtemps été le principal outil pour la détection d'analytes d'intérêt dans des échantillons biologiques pour la recherche à la fois sciences de la vie et les diagnostics cliniques. Cependant, le test ELISA a ses limites. Il est généralement réalisé dans une microplaque de 96 puits, et les puits sont recouverts d'anticorps de capture, ce qui nécessite une quantité relativement importante de l'échantillon pour capturer un antigène d'intérêt. La grande surface des puits et la liaison hydrophobe de l'anticorps de capture peut également conduire à fond non spécifique contraignante et plus. En outre, la plupart des tests ELISA compter sur l'intermédiaire d'enzyme amplification du signal afin d'obtenir une sensibilité raisonnable. D'amplification telle n'est pas toujours linéaire et peut fausser les résultats ainsi.
Au cours des 15 dernières années, une nouvelle technologie a vu le jour qui offre les avantages de la technique ELISA, mais aussi permet un débit plus élevé, une plus grande souplesse, volume de l'échantillon réduit, et à moindre coût, avec un wo similairerkflow 1, 2. Luminex xMAP de la technologie est une plate-forme de réseau de microsphères (billes) permettant à la fois monoplex et essais multiplex qui peuvent être appliquées à la fois des protéines et acides nucléiques applications 3-5. Les billes ont l'anticorps de capture immobilisé de façon covalente sur une surface plus petite, ce qui nécessite moins anticorps de capture et les volumes d'échantillons plus petites, par rapport à ELISA, et la liaison non spécifique est réduite de manière significative. Volumes d'échantillons plus petits sont importantes lorsque l'on travaille avec des échantillons limitant tels que le liquide céphalo-rachidien, du liquide synovial, etc 6. Multiplexage le dosage réduit encore le volume d'échantillon exigences, permettant plusieurs résultats à partir d'un seul échantillon.
Les récentes améliorations de Luminex comprennent: le nouveau système MAGPIX, une plus petite, moins coûteuse, plus facile à utiliser l'analyseur; faible concentration magnétique MagPlex microsphères qui éliminent le besoin de coûteux plaques filtrantes et viennent dans une concentration de travail mieux adapté pour le développement de tests et defaible débit demandes, et l'anticorps xMAP accouplement (ABC) du kit qui comprend un protocole, les réactifs et produits consommables nécessaires pour coupler billes à l'anticorps de capture d'intérêt. (Voir la section Matériaux pour une liste détaillée du contenu du kit.)
Dans cette expérience, nous convertissons un test pré-optimisée ELISA pour la cytokine TNF-alpha à la plate-forme xMAP et comparer la performance des deux méthodes 7-11. TNF-alpha est un biomarqueur utilisé dans la mesure des réponses inflammatoires chez les patients souffrant de troubles auto-immunes.
Nous commençons par le couplage quatre anticorps de capture candidats à quatre ensembles de microsphères ou des régions différentes. Lorsque mélangés, ces quatre ensembles de permettre l'analyse simultanée de tous les quatre candidats ayant quatre anticorps de détection distinctes afin de déterminer la meilleure paire d'anticorps, les réactifs d'épargne, de l'échantillon et le temps. Deux dosages xMAP sont ensuite construits avec les deux paires d'anticorps les plus optimales et leur performance estpar rapport à celle du dosage ELISA originale en ce qui concerne la puissance du signal, la gamme dynamique, et la sensibilité.
Protocole
I. Préparation des réactifs
- Sélection d'anticorps et de préparation
- Identifier les anticorps à être utilisés dans l'expérience.
- Quatre anticorps de capture: spécifique pour le TNF alpha humain, monoclonaux ou polyclonaux; toutes les espèces même hôte.
- Quatre anticorps de détection: spécifique pour le TNF alpha humain, soit non modifié, biotinylé, ou PE-conjugué.
- Un anticorps de confirmation: PE-conjugué et spécifique pour les espèces hôtes des anticorps de capture.
- Reconstituer tous les anticorps à des concentrations de travail recommandées par le fabricant.
- Sélectionnez quatre flacons de faible concentration MagPlex microsphère (talon) des ensembles ou des régions, par exemple, les numéros de pièce Luminex MC10012-ID, MC10013-ID, MC10014-ID, et MC10015-ID.
- Identifier les anticorps à être utilisés dans l'expérience.
- Couplage d'anticorps à MagPlex microsphères, en utilisant l'anticorps xMAP (ABC) Kit d'accouplement
Réfer au manuel de l'utilisateur abc Kit (N ° de pièce 89-00002-00-319) pour la procédure de couplage complet. (Remarque: photosensible microsphères doivent être protégés de la lumière chaque fois que possible.)- Amener les réactifs dans le kit ABC à la température ambiante et les tubes de réaction d'étiquettes avec les quatre numéros de région de talon sélectionnés pour la réaction de couplage. Transférer le contenu des quatre flacons de perles MagPlex (1 ml chacun, soit 2,5 x 10 6 perles) dans les tubes de réaction quatre étiquetés.
- Laver chacun des ensembles de billes à deux reprises dans 500 ul de tampon d'activation, tel que décrit dans le manuel de kit ABC.
- Activez chaque ensemble de billes avec 480 ul de tampon d'activation, 10 pi de sulfo-NHS, et 10 ul du réactif EDC, conformément à la procédure dans le manuel de kit ABC, et incuber pendant 20 minutes. (Remarque:. Réactif EDC doit être reconstitué dans 250 pi de tampon d'activation immédiatement avant cette étape)
- Répétez l'étape de lavage précédente avec le désormais "activé" microsphères un total de thrEE Times avec 500 pi de tampon d'activation, tel que décrit dans le manuel de kit ABC.
- Préparer quatre solutions distinctes, chacune contenant 7,5 ug (soit 3 mg / millions microsphères) des anticorps de capture dans un tampon d'activation.
- Ajouter ces solutions quatre anticorps de capture à leurs tubes de réaction respectifs, chaque tube vortex immédiatement, et incuber pendant deux heures sur un rotateur.
- Répétez l'étape de lavage précédente avec le désormais "couplé" microsphères un total de trois fois avec 500 ul du tampon de lavage inclus avec le kit ABC.
- Après l'étape finale de lavage, ajouter 500 pl du tampon de lavage à chaque tube de réaction pour fournir une concentration finale du stock de 5 millions anticorps couplés billes par millilitre. Vortex et sonication les tubes de réaction pour disperser les microsphères.
REMARQUE: Partiellement submergeant le flacon microsphère fermé dans un nettoyeur à ultrasons rempli d'eau DI fournit sonication efficace pour toutes les étapes de lavage. (Voir le tableau des matériaux pour l'eplus de détails.) QUIPEMENTS - Stocker les billes couplées à 2-8 ° C et protégé de la lumière jusqu'à ce que nécessaire.
- Dénombrement des microsphères couplées
- Comptez le nombre de microsphères récupéré après la réaction de couplage en utilisant un compteur de cellules ou hématimètre. Reportez-vous au manuel d'utilisation de l'instrument de comptage pour des instructions appropriées pour le faire. La reprise de la réaction de couplage est généralement plus de 90%.
- Confirmation du couplage
- Confirmer la réaction de couplage a réussi en préparant des solutions de test des stocks de billes couplées pour chaque ensemble, avec la concentration finale de 100 perles / ul dans du tampon de dosage (PBS avec 1% de BSA). Préparer des dilutions de la phycoérythrine-(PE-) étiquetés anticorps anti-espèce de confirmation IgG à 4 pg / ml dans le tampon essai.
- Aliquote de 50 pl de chaque solution d'essai dans quatre puits d'une à fond rond, plaque de 96 puits, pour un total de 16 puits. Puis ajouter 50 μL de tampon de dosage dans huit des puits, afin de mesurer de fond, et 50 ul d'anticorps de confirmation dilué dans les huit puits restants.
- Mélanger les réactions doucement par pipetage de haut en bas plusieurs fois avec une pipette multi-canaux. Couvrir la plaque et incuber pendant 30 minutes à température ambiante sur un agitateur de plaque.
- Placer la plaque sur une plaque magnétique séparateur pendant 1-2 minutes à tirer les billes de la solution. Ensuite, enlever le liquide par force inversant la plaque, tandis que sur le séparateur, au cours d'une poubelle.
- Laver chaque puits deux fois par addition de 100 ul de tampon de dosage et élimination du surnageant de la plaque d'une manière similaire en utilisant le séparateur plaque magnétique.
- Remettre en suspension les billes dans 100 ul de tampon de dosage par un léger pipetage haut et en bas à cinq reprises avec une pipette multi-canaux.
- Analyser sur un instrument Luminex xMAP, tels que l'instrument MAGPIX. L'intensité du signal fluorescent de cette réaction est directly proportionnelle à la quantité de protéine sur la surface des perles, qui fournit une évaluation rapide de la quantité relative de protéine couplée à des billes.
- Couplage biotine aux anticorps non modifiés pour la détection
- Si en utilisant des anticorps de détection non modifiées, biotinyler ces anticorps avec le Thermo Fisher EZ-Link Sulfo-NHS-LC-Biotine Réactif (Cat. n o PI-21335) et la procédure décrite dans la notice. Une fois biotinylé, les anticorps de détection peut être ensuite marqué avec de la streptavidine phycoérythrine (PE-SA) dans le dosage (III.6 étape.) De sorte qu'ils peuvent être détectés avec l'analyseur xMAP.
II. Configuration de dosage
- Préparer un mélange initial de tous les quatre ensembles de billes en ajoutant 10 pl de chaque à 0,96 ml de PBS avec 1% de BSA (tampon de dosage. Voir le tableau des matériaux) afin de déterminer qui est le plus efficace avec le test xMAP.
- Préparer les solutions d'anticorps de détection par dilbuer à chacun de 1 ug / ml dans le tampon essai.
- Préparer la norme R & D Systems protéine TNF-α à 2000 pg / mL dans le tampon essai.
- Diluer la streptavidine-rPhycoerythrin (SA-PE) (à condition @ 1 mg / ml) à 8 pg / ml dans le tampon essai.
III. Dépistage des anticorps
- Ajouter 50 pL du mélange de microsphères d'anticorps couplé à chacun des 16 puits d'une Costar à fond rond plaque à 96 puits pour le test de criblage.
- Ajouter 50 ul de tampon de dosage à 8 des 16 puits, afin de mesurer arrière-plan.
- Ajouter 50 ul de la R & D Systems TNF-α standard (@ 2000 pg / mL) pour les 8 autres puits, pour mesurer la réponse.
- Incuber pendant une heure à température ambiante, protégé de la lumière, tout en agitant sur une plaque de dosage agitateur.
- Ajouter 50 ul de chacune des quatre anticorps de détection de quatre puits (deux arrière-plan et deux de réponse) et incuber pendant 30 minutes à température ambiante, à l'abri de la lumière, tout en agitant sur une plaque d'essai shaker.
- Ajouter 50 ul du réactif SA-PE à tous les puits et incuber 15 minutes à température ambiante, à l'abri de la lumière, tout en agitant sur une plaque de test shaker.
- Placer la plaque sur un séparateur plaque magnétique pendant une minute puis retirez du liquide par force inversant la plaque.
- Ajouter 100 ul du tampon de dosage pour chacun des 16 puits, placer la plaque sur le séparateur plaque magnétique pendant une minute puis retirez du liquide par force tout en inversant la plaque sur le séparateur.
- Ajouter 100 ul de tampon de dosage pour chacun des 16 puits et lire la plaque avec l'instrument Luminex MAGPIX; se référant au manuel de l'utilisateur pour un fonctionnement correct.
- Sélectionnez une paire d'anticorps qui répond à vos force du signal désiré.
IV. xMAP test fonctionnel
- Après avoir sélectionné l'anticorps de capture mieux, diluer 100 ul de ce stock d'anticorps couplé à billes (à partir de l'étape IB8) à 10 ml avec le tampon.
- Ajouter 50 uL deles perles dilué à 78 puits de deux Costar à fond rond plaques à 96 puits. (78 puits x 2 plaques = 156 puits) Chaque plaque sera utilisée pour évaluer la performance d'un anticorps de détection différent.
- Préparer une courbe de 12 points standard, en commençant à 8000 pg / mL et se terminant à 4 pg / mL, avec la R & D Systems TNF-α standard. Ajouter 50 ul six réplicats de chaque dilution de chacune des plaques, ainsi que six puits avec 50 ul de tampon de dosage de chaque, comme un arrière-plan, pour un total de 78 puits par plaque.
- Incuber les plaques pendant une heure à température ambiante, protégé de la lumière, tout en agitant sur une plaque de dosage agitateur.
- Ajouter 50 ul de l'anticorps de détection premier à tous les 78 puits de la première plaque. Répéter pour l'anticorps de détection seconde sur la seconde plaque.
- Incuber les plaques pendant 30 minutes, à température ambiante, protégé de la lumière tout en agitant sur une plaque de dosage agitateur.
- Ajouter le pL 50 du réactif SA-PE dans tous les puits de chaque plaque.
- Incuberles deux plaques pour 15 minutes, à température ambiante à l'abri de la lumière tout en agitant sur une plaque de test shaker.
- Placer les plaques sur les séparateurs à plaques magnétiques pour une minute, puis retirer du liquide par force tout en inversant la plaque sur le séparateur.
- Ajouter 100 ul de tampon de dosage pour chacun des 78 puits sur les plaques; placer les plaques sur des séparateurs de plaques magnétiques pour une minute, puis retirer du liquide par force inversant la plaque.
- Ajouter 100 ul de tampon de dosage pour chacun des 78 puits sur des plaques et d'analyser sur l'instrument MAGPIX, se référant au manuel de l'utilisateur pour un fonctionnement correct.
V. ELISA
- En suivant les instructions fournies avec le R & D Systems humaines TNF-α/TNFSF1A DuoSet kit ELISA (R & D N ° de pièce DY210), mesurer la réponse générée par le standard fourni avec le kit R & D. Répétez le test ELISA trois fois de plus, en remplaçant la capture de R & D Systems et la détection de fourmiibodies avec les anticorps des autres fournisseurs. Par souci de simplicité, la paire des anticorps par le vendeur (par exemple, anticorps de capture Millipore avec un anticorps de détection Millipore, anticorps de capture Abcam avec un anticorps de détection Abcam, etc.)
- Évaluer chaque paire indépendamment, tel que requis par le format ELISA, avec chacune des trois étalons de protéine TNF-alpha.
VI. Les résultats représentatifs
Ce protocole montre comment une caractéristique ELISA peut être converti en la plate-forme tout en utilisant xMAP la capacité de multiplexage de la technologie d'optimiser le dosage rapide. Le test ELISA utilisé dans cet exemple a été le Tumor Necrosis Factor-humain alpha (TNF-α) DuoSet trousse ELISA de la R & D Systems (R & D N ° de pièce DY210).
En plus de la paire d'anticorps fournis dans le kit, trois paires d'anticorps d'autres provenant de différentes sources (voir le tableau des matériaux) ont été évalués en utilisant simultanément la plate-forme xMAP. Four des anticorps ont été désignés comme anticorps de capture et ont été couplés à MagPlex faible concentration microsphères. Les quatre autres anticorps ont été désignés comme anticorps de détection, dont trois qui ont été achetés que la biotine couplé et le quatrième a été biotinylé comme décrit dans le Protocole.
Les anticorps de cette étude ont été choisis en fonction de la disponibilité et le vendeur. Toutefois, en milieu de pratique, les anticorps doivent être choisis en fonction des préférences de l'utilisateur individuel et l'expérience de performance passé avec cet anticorps. Bien que, cette expérience ne teste pas l'aptitude d'un anticorps comme anticorps de capture par rapport anticorps de détection, ce protocole peut être facilement modifiée à cet effet.
Les dosages Luminex xMAP sont réalisées comme un multiplex d'évaluer l'ensemble d'anticorps de capture quatre sous forme de mélange, en combinant les quatre ensembles de TNF-α anticorps couplé microsphères MagPlex. Les anticorps de capture ont été évalués avec chacun des quatreAnticorps de détection biotinylés individuellement, de telle sorte que l'interaction d'un anticorps de détection avec chacun des quatre anticorps de capture peut être déterminée simultanément. Quatre de tels essais, effectués en parallèle, a déterminé les interactions de tous les quatre anticorps de détection avec les quatre anticorps de capture. La figure 1 montre les données comparatives de ces tests de dépistage.
Les résultats ont indiqué que la paire d'anticorps à partir du DuoSet R & D Systems mieux réalisée avec une réponse résultant à 6183 intensité de fluorescence moyenne (MFI) unités. Il a également été observé que les anticorps de détection de Millipore (86% de la réponse de R & D d'anticorps paire) et Abcam (67%) ont fourni une réponse raisonnable dans le dosage xMAP, lorsqu'il est combiné avec l'anticorps de R & D des systèmes de capture. Les anticorps de capture de Abcam, Millipore et Novus produit une réponse moins souhaitable dans le dosage xMAP.
Il est important de noter, que le purpose de cette étude n'est pas nécessairement de mettre en évidence les différences entre les anticorps particuliers ou des vendeurs, mais simplement pour illustrer qu'il existe des différences observables dans leurs performances lorsqu'ils sont utilisés dans des conditions similaires, et que la plate-forme xMAP peuvent offrir un moyen efficace d'évaluation de ces différences.
La R & D Systems DuoSet protocole a été utilisé pour comparer les quatre paires d'anticorps dans un format ELISA. La R & D Systems protocole a été utilisé avec toutes les paires d'anticorps, car il est le reflet de protocoles ELISA typiques largement utilisés aujourd'hui, et il est analogue à protocoles utilisés avec la technologie xMAP. Les tests ELISA ont montré que la paire d'anticorps à partir de R & D Systems a de nouveau donné les meilleurs résultats (Figure 2). La paire d'anticorps à partir Abcam produit pas de réponse et les paires d'anticorps à partir de Millipore et Novus produits réponses modestes.
Afin d'évaluer toute variation de la réactivité des anticorps avec la norme, tous les quatre antibodpaires y ont été testés avec trois différents recombinants normes de protéines de TNF-alpha, à partir de trois fournisseurs différents (voir le tableau des matériaux). Les données de la figure 2 montrent que les normes de protéines recombinantes de TNF-alpha à partir des trois fournisseurs ont donné des résultats équivalents.
La protéine TNF-α de R & D Systems a été utilisé pour générer des courbes standard avec la technique ELISA (tableau 1) et les dosages xMAP (tableaux 2 et 3). Alors que le test ELISA a été fait avec la paire de R & D Systems anticorps, les dosages xMAP utilisé l'anticorps R & D Systems et de capture soit l'anticorps de détection de la R & D Systems ou Millipore. La protéine TNF-α de R & D Systems a été dilué pour produire une gamme de concentrations allant de 8000 à 4 pg / mL. Seule la paire d'anticorps à partir de R & D Systems produit le résultat escompté dans le dosage xMAP, avec une réponse> 20.000 IMF, comme le montre le tableau 2 etFigure 3. Lorsque l'anticorps de détection de Millipore a été utilisé avec le test xMAP à la place de l'anticorps de R & D des systèmes de détection (tableau 3), la réponse (6.000 IMF) était d'environ 30% de la réponse obtenue avec l'anticorps de détection de la R & D Systems; comme indiqué dans Figure 3.
Les données du tableau 1 représente la courbe standard du test ELISA, qui avait recommandé un fabricant de TNF-α fourchette de 16 à 1000 pg / mL. Cette gamme a été très limitée en raison de la DO à 1000 pg / mL a été légèrement supérieure à 2 unités de DO et le spectrophotomètre est incapable de mesurer plus de 3 OD. En raison de la limite avec le spectrophotomètre, il n'était pas possible d'augmenter la portée du test ELISA plus loin. En outre, les données du tableau 1 indiquent que la R & D Systems DuoSet ELISA n'est pas capable de détecter le TNF-α à des concentrations beaucoup moins de 16 pg / mL. D'autre part, le dosage est capable de xMAP de mesureING TNF-α à une concentration de moins de 7,8 pg / mL avec l'anticorps de capture de R & D Systems combinés avec l'anticorps de détection à partir soit R & D Systems ou Millipore.
La gamme dynamique et la sensibilité des deux méthodes est mieux illustré lors du traçage dans une échelle logarithmique (figure 4). Une distinction claire entre la pente des réponses ELISA et les réponses des dosages xMAP peuvent être vu qui indique en outre une plus grande capacité de limiter pour la détection de TNF-α avec le test ELISA, à deux concentrations supérieures et inférieures.
Les limites de détection (LOD) pour les deux dosages fonctionnels xMAP de TNF-alpha ont été approchée par l'identification la plus faible de TNF-α la concentration avec un niveau de réponse observé (IMF) supérieure à fond, en plus de trois fois son écart-type (SD). Pour atteindre une signification statistique, six répétitions ont été utilisés pour déterminer la SD pour les méthodes à la fois le xMAP et ELISA. Thestimations de e LOD sont optimistes et destiné à fournir un «meilleur des cas" scénario, étant entendu que dans des conditions normales de fonctionnement, seuls deux ou trois répétitions sera utilisée. Dans le tableau 2, il peut être observé que, lors de l'utilisation de la paire de R & D Systems, le plus bas du TNF-α concentration à 3,91 pg / ml produit une réponse de 66 IMF, qui est supérieure à la réponse de l'arrière-plan + 3SD, respect de ces critères . Lorsque l'anticorps de détection Millipore a été utilisé avec l'anticorps de R & D des systèmes de capture (tableau 3), la limite de détection était de moins de 7,81 pg / mL. Dans ce cas, le plus bas de TNF-α deuxième concentration produit une réponse acceptable de 17 IMF; plus de la réponse de la plus faible de TNF-α concentration plus trois fois son écart-type. (10 IMF + 3 (2,4) = 16,29 IMF) De même, la limite de détection pour l'ELISA R & D Systems DuoSet a été estimée à entre 63 pg / ml et 31 pg / mL (Tableau 1).
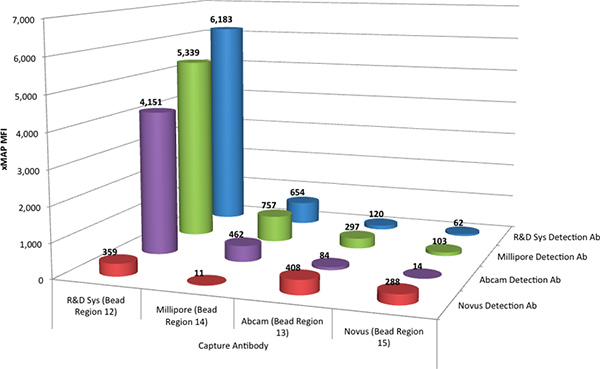
Figure 1. L'intensité médiane de fluorescence (MFI) de la norme R & D Systems (@ 2000 pg / mL) pour chaque combinaison possible des anticorps de capture quatre (couplé à quatre régions de microsphères différents) et les anticorps de détection quatre. Cliquez ici pour agrandir comprendre .
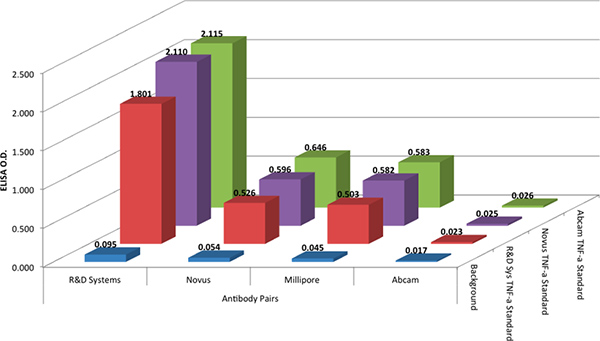
Figure 2. La densité optique (DO) de trois différentes normes recombinantes (@ 1000 pg / ml) pour quatre combinaisons de capture et de détection des anticorps paire. Capture et anticorps de détection ont été arbitrairement jumelé par le vendeur, par souci de simplicité. Cliquez ici pour agrandir la figure .
| pg / mL | OD | Ecart | 3 SD |
| 1000 | 2,084 | 0,035 | 2,187 |
| 500 | 1,328 | 0,038 | 1,441 |
| 250 | 0,787 | 0,025 | 0,863 |
| 125 | 0,476 | 0,026 | 0,554 |
| 63 | 0,304 | 0,023 | 0,374 |
| 31,3 | 0,212 | 0,025 | 0,287 |
| 15,6 | 0,167 | 0,026 | 0,244 |
| 0 | 0,118 | 0,021 | 0,182 |
Tableau 1 La densité optique (DO) de la série de dilution de 2 fois spécifié par l'insert de R & D Systems paquet DuoSet, pour une utilisation comme une courbe standard;., Y compris l'écart-type (SD) et la limite estimée de détection (LOD), entre 31,3 pg / mL et 63 pg / mL.
| R & D des systèmes de capture et de détection Anticorps | |||
| pg / mL | IMF | Ecart | 3 SD |
| 8000 | 20320 | 463 | 21707 |
| 4000 | 15594 | 223 | 16263 |
| 2000 | 11098 | 79 | 11336 |
| 1000 | 6985 | 160 | 7465 |
| 500 | 4149 | 80 | 4390 |
| 250 | 2233 | 30,0 | 2323 |
| 125 | 1199 | 43,8 | 1330 |
| 63 | 636 | 14,0 | 678 |
| 31,3 | 340 | 12,9 | 379 |
| 15.6 | 183 | 5.9 | 201 |
| 7.8 | 103 | 2.2 | 109 |
| 3.9 | 66 | 2.4 | 73 |
| 0 | 11 | 0.8 | 13,8 |
Tableau 2 L'intensité médiane de fluorescence (MFI) d'une série standard de dilution mesuré par la technologie xMAP, en utilisant la paire d'anticorps inclus avec le DuoSet R & D Systems;., Y compris l'écart-type (SD) et la limite estimée de détection (LOD), moins de 3,91 pg / mL.
| R & D des systèmes de capture Ab avec Millipore détection Ab | |||
| pg / mL | IMF | Std Dev | 3 SD |
| 8000 | 5800 | 143 | 6229 |
| 4000 | 3881 | 120 | 4242 |
| 2000 | 2176 | 73 | 2396 |
| 1000 | 1138 | 32,1 | 1234 |
| 500 | 578 | 31,3 | 671 |
| 250 | 289 | 6.2 | 307 |
| 125 | 142 | 3.1 | 151 |
| 63 | 75 | 5.3 | 91 |
| 31,3 | 44 | 3.3 | 54 |
| 15,6 | 28 | 2.6 | 35,5 |
| 7.8 | 17 | 1.5 | 21,2 |
| 3.9 | 10 | 2.0 | 16,3 |
| 0 | 7 | 1.4 | 11,4 |
Tableau 3 L'intensité médiane de fluorescence (MFI) d'une série standard de dilution mesuré par la technologie xMAP, en utilisant l'anticorps R & D des systèmes de capture et l'anticorps EMD de détection Millipore;., Y compris l'écart-type (SD) et la limite estimée de détection (LOD), moins que 7,81 pg / mL.
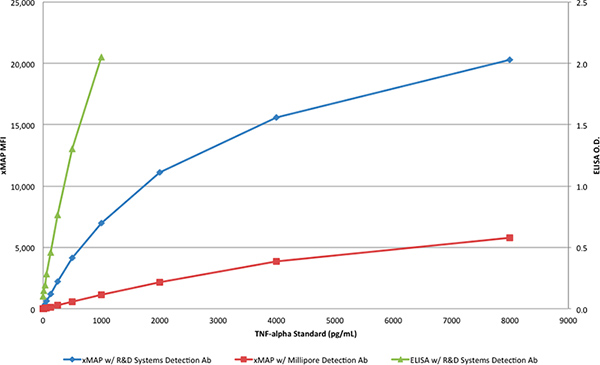
Figure 3. Les courbes standards des deux dosages xMAP et la R & D Systems DuoSet ELISA. Cliquez ici pour agrandir la figure .
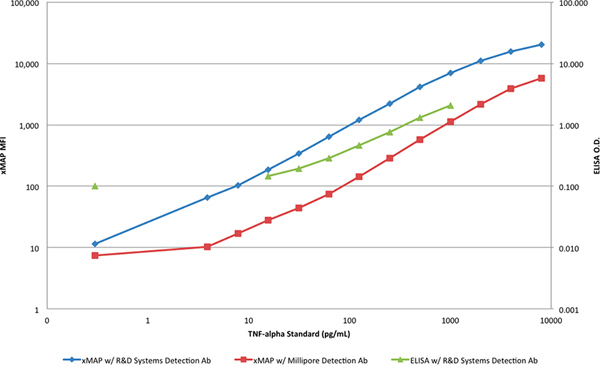
Figure 4. Une comparaison des courbes xMAP standard et la courbe étalon ELISA dans une échelle log-log. Cliquez ici pour agrandir la figure .
Discussion
La conversion d'un test ELISA pour la plate-forme Luminex xMAP peuvent être aussi simples que la substitution streptavidine peroxydase de raifort (SA-HRP) dans un cadre typique kit ELISA avec de la streptavidine phycoérythrine (SA-PE), et l'optimisation de la performance. Pour ceux qui veulent créer un immunoessai xMAP de la terre vers le haut, ce qui peut être accompli avec un protocole simple qui permet également l'évaluation multiplex rapide, des paires d'anticorps. Les réactifs pour le dosage xMAP ont été facilement préparés en utilisant le kit Anticorps xMAP couplage pour coupler les anticorps de capture désignés pour MagPlex faible concentration des microsphères. L'utilisation d'une faible concentration microsphères réduit le coût de l'élaboration de tests, tout en offrant la performance de dosage même de concentration plus élevée des microsphères. Le montant de temps requis pour préparer couplé MagPlex microsphères est d'environ 3 heures, ce qui est beaucoup plus rapide que les 22 - 24 heures nécessaires pour recouvrir le puits d'une plaque ELISA, suivie d'un traitementdes puits revêtus. La performance du test xMAP est également supérieure à la technique ELISA en termes de limite de détection (<4 pg / ml vs> 31 pg / mL) et dynamique large (<4 pg / mL à> 8000 pg / ml contre 16 pg / ml à 1000 pg / mL). Lecteurs de plaques ont une gamme limitée DO qui est soit 3 ou 4 DO, limitant la limite supérieure de la plage dynamique pour un dosage.
Sans doute, tous les anticorps travailler dans un format ELISA et tous les anticorps qui fonctionnent bien dans un test ELISA sont facilement transférables au format de dosage xMAP. Toutefois, étant donné que des dosages xMAP peuvent être multiplexés (c'est à dire, fonctionner simultanément), il est possible d'évaluer la capture de plusieurs combinaisons et détection des anticorps en même temps d'identifier la meilleure paire à utiliser pour un essai. Ce processus permet d'économiser beaucoup de temps et réactifs par rapport à la procédure d'élaboration ELISA, qui se limite à l'évaluation d'une paire à la fois. Si deux ou plusieurs paires d'anticorps effectuer équivalente; d'autres paramètres de l'essai peutêtre considéré pour déterminer l'aptitude de la paire (par exemple, disponibilité, coût, etc.)
En plus de la performance du test et une flexibilité améliorées avec le dosage xMAP, il ya aussi d'importantes économies. La quantité recommandée d'anticorps nécessaire pour enrober un seul puits d'une plaque ELISA est 400ng, alors que la quantité requise pour les billes utilisées dans un puits d'un dosage xMAP est d'environ 7,5 ng. Ainsi, la quantité d'anticorps nécessaire pour un ELISA ainsi fournira plus de 50 résultats des tests, si elle est utilisée dans un test xMAP. Pour les applications impliquant des échantillons précieux, xMAP a également un avantage significatif. Le volume de l'échantillon recommandé pour le test ELISA est de 100 pi tandis que le volume requis pour le dosage xMAP peuvent être la moitié de ce que, ou moins.
En résumé, la conversion d'un test ELISA pour la plate-forme Luminex xMAP est simple, efficace et économique, tout en produisant un essai avec une gamme dynamique supérieure et de la sensibilité.
Déclarations de divulgation
Ce travail a été fait à Luminex Corporation avec du matériel fabriqué à Luminex Corporation.
R & D Systems & EMD Millipore sont des partenaires stratégiques de Luminex Corporation; licence pour développer et commercialiser des tests multiplex xMAP base.
Remerciements
Ce travail a été financé par Luminex Corporation.
matériels
| Name | Company | Catalog Number | Comments |
| Description | Vendeur | Numéro de catalogue | Commentaires |
| Human TNF-α/TNFSF1A DuoSet kit ELISA | R & D Systems | DY210 | Comprend monoclonaux et de la biotine couplés des anticorps polyclonaux et recombinant standards protéine TNF-α |
| Anticorps monoclonal anti-TNF-α | Abcam | Ab18696 | Anticorps de capture, clone CH8820 |
| Anticorps monoclonal anti-TNF-α | Abcam | Ab16166 | Anticorps Biotine détection couplé, clone AS1 |
| TNF alpha protéines | Abcam | Ab9642 | Recombinant norme protéine TNF-α |
| Anticorps monoclonal anti-TNF-α | Novus | NBP1-50115 | Anticorps de capture, clone 4H31 |
| Anticorps monoclonal anti-TNF-α | Novus | NB100-78162 | Anticorps Biotine détection couplé, clone MAb11 |
| TNF alpha protéines | Novus | NBC1-18460 | Recombinant norme protéine TNF-α |
| Anticorps monoclonal anti-TNF-α | EMD Millipore | MAB1141 | Anticorps de capture, cloner 3C7.2 |
| Anticorps polyclonaux anti-TNF-α | EMD Millipore | 654250 | Anticorps polyclonal de lapin de détection |
| Streptavidine-phycoérythrine | Mousse | SAPE-001 | Réactif fluorescent pour reporter test Luminex xMAP |
| MAGPIX w / Software XPONENT | Luminex Corporation | MAGPIX-XPONENT | Instrument Luminex |
| xMAP Anticorps Coupling (ABC) Kit | Luminex Corporation | 40-50016 | Comprend réactif EDC, sulfo-NHS réactif, tampon d'activation, tampon de lavage, des tubes de 1,5 mL de réaction, et les pipettes jetables |
| MagPlex microsphères, à faible concentration | Luminex Corporation | MC10012-ID, MC10013-ID, MC10014-ID, MC10015-ID | Perles à faible concentration (@ 2,5 x 10 6 billes / mL) |
| EZ-Link Sulfo-NHS-LC-Biotine | Thermo Fisher | PI-21335 | Kit de détection des anticorps pour Biotinylation non modifiée |
| Tecan Infini F200 Lecteur | Tecan | Lecteur de plaque ELISA | |
| Phosphate Buffered Saline | Sigma-Aldrich | P-3688 | 1% du PBS-BSATampon de dosage, |
| Une pinte-Cleaner Compact ultrasons, 115 VAC | Cole-Parmer | WU-08849-00 | Produire une fréquence de fonctionnement effective de 55 kHz |
| Séparateur magnétique Tube | Luminex Corporation | CN-0288-01 | Pour la séparation seul tube de 1,5 ml magnétique dans les étapes de lavage de couplage |
| Séparateur plaque magnétique | Luminex Corporation | CN-0269-01 | Pour 96-ainsi la séparation plaque magnétique dans les étapes de lavage de dosage |
Références
- Fulton, J. R., McDade, R. L., Smith, P. L., Kienker, L. J., Kettman, J. R. Advanced multiplexed analysis with the FlowMetrix system. Clinical Chemistry. 43, 1749-1756 (1997).
- Carson, R. T., Vignali, A. A. Simultaneous quantation of 15 cytokines using a multiplexed flow cytometric assay. J. Immunol. Methods. 227, 41-52 (1999).
- Peck, D., Crawford, E. D., Ross, K. N., Stegmaier, K., Golub, T. R., Lamb, J. A method for high-throughput gene expression signature analysis. Genome Biol. 7, 61 (2006).
- VanDerMeid, K. R., Su, S. P., Krenzer, K. L., Ward, K. W., Zhang, J. Z. A method to extract cytokines and matrix metalloproteinases from Schirmer strips and analyze using Luminex. Mol Vis. 17, 1056-1063 (2011).
- Liu, J., Kibiki, G., Maro, V., Maro, A., Kumburu, H., Swai, N., Taniuchi, M., Gratz, J., Toney, D., Kang, G., Houpt, E. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. J. Clin. Virol. 50, 308-313 (2011).
- de Jager, W., Prakken, B. J., Bijlsma, J., WJ Kuis, W., Rijkers, G. T. Improved multiplex immunoassay performance in human plasma and synovial fluid following removal of interfering heterophilic antibodies. J. Immunol. Methods. 300, 124-135 (2005).
- Codorean, E., Nichita, C., Albulescu, L., Raducan, E., Popescu, I. D., Lonita, A. C., Albulescu, R. Correlation of xMAP and ELISA cytokine profiles; development and validation for immunotoxicological studies in vitro. Roum. Arch. Microbiol. Immunol. 69, 3-19 (2010).
- de Jager, W., te Velthuis, H., Prakken, B. J., Kuis, W., Rijkers, G. T. Simultaneous detection of 15 human cytokines in a single sample of stimulated peripheral blood mononuclear cells. Clin. Diagn. Lab. Immunol. 10, 133-139 (2003).
- DuPont, N. C., Wang, K. H., Wadhwa, P. D., Culhane, J. F., Nelson, E. L. Validation and comparison of Luminex multiplex cytokine analysis kits with ELISA: Determinations of a panel of nine cytokines in clinical sample culture supernatants. J. Reprod. Immunol. 66, 175-191 (2005).
- Richens, J. L., Urbanowicz, R. A., Metcalf, R., Corne, J., O'Shea, P., Fairclough, L. Quantitative validation and comparison of multiplex cytokine kits. Journal of Biomolecular Screening. 15, 562-568 (2010).
- Rizzi, G., Zhang, Y. J., Latek, R., Weiner, R., Rhyne, P. W. Characterization and development of a Luminex-based assay for the detection of human IL-23. Bioanalysis. 2, 1561-1572 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon