Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement et culture de cellules de crêtes neurales de tube neural embryonnaire murin
Dans cet article
Résumé
Isolement de la crête neurale embryonnaire à partir du tube neural facilite l'utilisation de In vitro Méthodes pour étudier la migration, l'auto-renouvellement, et multipotence de la crête neurale.
Résumé
Le feuillet embryonnaire de la crête neurale (CN) est une population progénitrices multipotentes qui provient à la face dorsale du tube neural, subit une transition épithélio-mésenchymateuse (EMT) et migre à travers l'embryon, donnant lieu à divers types cellulaires 1-3. NC a également la capacité unique d'influencer la différenciation et la maturation des organes cibles 4-6. Lorsque explanté in vitro, les progéniteurs NC subissent une auto-renouvellement, de migrer et se différencier en une variété de types de tissus, y compris les neurones, cellules gliales, les cellules musculaires lisses, des cartilages et des os.
Multipotence NC a été décrite pour la première à partir d'explants du tube neural aviaire 7-9. Dans l'isolement in vitro de cellules NC facilite l'étude de la dynamique de NC, y compris la prolifération, la migration et multipotence. Des travaux supplémentaires dans les systèmes aviaires et le rat ont démontré que les cellules explantées NC conservent leur potentiel de NC lorsque transplantées dans l'embryon 10-13. Parce que ces propriétés inhérentes cellulaires sont conservés dans les progéniteurs NC explantés, le dosage du tube neural explant fournit une option intéressante pour l'étude de la NC in vitro.
Pour atteindre une meilleure compréhension de l'mammifères NC, de nombreuses méthodes ont été employées pour isoler les populations NC. NC dérivés progéniteurs peuvent être cultivées à partir de post-migratoires endroits à la fois dans l'embryon et l'adulte pour étudier la dynamique de progéniteurs NC post-migratoires 11,14-20, mais l'isolement des progéniteurs NC comme ils émigrent à partir du tube neural fournit une conservation optimale de la CN cellule potentiel et des propriétés de migration 13,21,22. Certains protocoles utilisent la fluorescence tri cellulaire (FACS) pour isoler une population enrichie en progéniteurs NC particuliers 11,13,14,17. Cependant, quand on commence avec des embryons à un stade précoce, le nombre de cellules adéquates pour les analyses sont difficiles à obtenir avec FACS, ce qui complique l'isolement de début NC populations à partir d'embryons individuels. Ici, nous décrivons une approche qui ne repose pas sur FACS et les résultats dans un environ 96% de la population NC pure, basée sur un journaliste Wnt1-Cre activé lignée 23.
La méthode présentée ici est une adaptation de protocoles optimisés pour la culture de rat NC 11,13. Les avantages de ce protocole par rapport aux méthodes précédentes sont que 1) les cellules ne sont pas cultivés sur une couche nourricière, 2) FACS n'est pas nécessaire d'obtenir une population relativement pur NC, 3) prémigratoire cellules NC sont isolés et 4) les résultats sont facilement quantifiés. En outre, ce protocole peut être utilisé pour l'isolement de NC de tout modèle de la souris mutante, ce qui facilite l'étude des caractéristiques NC avec différentes manipulations génétiques. La limitation de cette approche est que le NC est supprimé à partir du contexte de l'embryon, qui est connue pour influencer la survie, la migration et la différenciation de la NC 2,24-28.
Protocole
1. Plaques Préparation
- Utiliser une technique stérile à tout moment.
- Préparer la fibronectine (FN) en diluant 100 uL de plasma humain FN stock dans un volume final de 3,3 ml dans du PBS de Dulbecco (DPBS). La concentration finale est de 30 pg / ml, ce qui peut être conservé à 4 ° C pendant 1 semaine.
- Recouvrez le fond de chaque puits d'une culture de tissu stérile de quatre plats bien avec une solution FN et laisser reposer pendant 15 minutes. Assurez-vous que la surface est entièrement recouverte. Sensibiliser les médias pendant cette période (étapes 2 et 3).
- Retirer FN solution et laisser les plaques sécher. Rincer délicatement les puits avec 500 uL de DMEM, supprimer DMEM, et ajouter 500 ul d'auto-renouvellement (SR) à moyen (voir ci-dessous). Incuber à 37 ° C dans un incubateur humidifié contenant 5 pour cent de CO 2. Remplissez cette heure environ avant la dissection de sorte que les plaques seront à sec avant de l'utiliser.
2. Préparation moyen SR
- Pour la culture de la vague et le tronc NCà partir de dix embryons (environ une portée, selon le fond génétique de la lignée de souris), de préparer 25 ml de milieu SR. Mélanger 12,5 ml de glucose à faible DMEM, 7,5 ml de milieu Neurobasal, 25 l'acide rétinoïque ul (117 uM de concentration finale), et 25 pi de 2-mercaptoéthanol (50 mM de concentration finale). Mélangez bien.
- Ajouter 3,75 ml extrait d'embryon de poussin, 250 ul supplément sel N 2, 500 ul B27 supplément et 250 ul de pénicilline-streptomycine (1% en concentration finale). Filtrer le milieu à travers un filtre de 0,22 um.
- Ajouter 10 uL stérile IGF1 (20 pg / ml de concentration finale) et 20 bFGF ul stérile (20 pg / ml de concentration finale). Mélanger par inversion. Conserver à 4 ° C.
3. Préparation Lavable
- Pour environ 10 embryons de préparer 50 ml de milieu de lavage. Mélanger 50 mg de BSA avec 35 ml de glucose à faible DMEM, 15 ml de milieu Neurobasal, et 500 ul de pénicilline-streptomycine (1% en concentration finale). Filtre stérile avec un 0,22Filtre um.
4. Préparation de la collagénase / dispase
- Ajouter 50 uL de 100 mg / ml de collagénase / dispase à 5 mL dPBS. Mélangez bien.
- Seringue filtre avec un filtre de 0,2 um et ajoutez 1,5 ml dans chacun des trois puits d'une plaque douze bien. Introduire à la pipette d'environ 1 ml milieu de lavage dans les puits restants. Conserver la plaque entière sur la glace jusqu'à ce que prêt à digérer les tissus disséqués.
- Couper conseils d'un embout de pipette p20 et p1000 filtre avec une lame de rasoir stérile. Coupez juste au-dessous du bord biseauté de la pointe. La coupure sera p1000 être utilisé pour transférer l'embryon entier tandis que le p20 sera utilisé pour transférer des morceaux de tissu isolé.
5. Isoler vagal et Tube Neural Trunk à partir d'embryons DPC 9.5
- Pour les grossesses chronométrés, les barrages avec un bouchon vaginal sont considérés 0,5 dpc à midi le matin, le bouchon est observée. Sacrifice et enlever l'utérus à 9,5 dpc.
- Retirez la caduque de l'utérus et doucement remove l'embryon de la caduque. Une fois connu avec ce protocole, isoler 3-4 9.5 embryons DPC à la fois dans dPBS stériles. Utiliser une technique stérile et instruments de dissection stérilisés. Les instruments peuvent être stérilisés par autoclavage stérilisation par la chaleur, ou par incubation dans de l'éthanol.
- Pour antérieure vagal NC: l'utilisation d'aiguilles à insuline, couper le tube neural à la mi placode otique. Couper à nouveau le bord postérieur du somite 4 e. Coupez le tissu ventral du tube neural de supprimer les arcs branchiaux et le cœur.
- Pour NC tronc: l'utilisation d'aiguilles à insuline, enlever la partie du tube neural entre somites 16-22 (ou le dernier somite si les embryons sont développemental plus tôt que l'étape 22 somite).
- Gardez le sac vitellin et tout tissu restant embryonnaire pour le génotypage.
6. Retrait de la non-neuronal ectoderme et du mésoderme
- Placez tube neural contenant des segments dans la collagénase / dispase à température ambiante pendant 10 minutess. Laver immédiatement au milieu de lavage.
- Retourner tissu à dPBS stériles. Utiliser des aiguilles stériles à insuline, retirez délicatement l'ectoderme non neural du tissu et de séparer les somites loin du tube neural. Les dernières parties restantes du mésoderme à partir de tissus somite peut être retiré en triturant délicatement avec une cut-down p20 pointe. Attention à ne pas endommager le tube neural. Observez attentivement la situation au cours de la trituration.
- Placer le tube neural isolé par un lavage des deuxième et troisième 30 secondes de milieu de lavage.
- Laver une fois dans un milieu SR, et placer le tube isolé neuronal dans le centre d'un puits FN-revêtu qui a été préparé précédemment (étape 1.3). Humidifier la chambre de l'hypoxie avec un plat d'eau stérile. Placer la capsule dans la chambre de l'hypoxie et rincer la chambre avec le gaz mixte à 3% d'O 2 (utiliser un réservoir contenant un mélange de 1% de O 2, 6% de CO 2, 93% de N 2).
- Toujours manipuler la chambre avec un soin extrême pour assurer l'eexplants t ne sont pas perturbées et restent dans le centre du puits.
- Incuber à 37 ° C. Résumé des étapes 5-6 est illustré à la figure 1.
7. Retrait du tube neural
- Après 24 heures d'incubation, retirer le tube neural par un léger taquiner le bord du tube neural à l'écart des cellules qui migrent à l'aide d'une aiguille d'insuline stérile. Retirer et jeter le tube neural à partir du milieu en utilisant un coupe p20 stérile comme à l'étape 6.2 et remplacer le milieu avec SR milieu frais (Figure 2). Ceci est plus facile à faire à l'aide d'un microscope inversé.
8. Les résultats représentatifs
Après 24 heures d'incubation à 37 ° C dans des conditions hypoxiques, les cellules ont migré loin NC à partir du tube neural dans une population presque pur (figure 3a). Parfois, moins de cultures idéales ne cédera pas excroissances solides. Par exemple, il est possible que, après 24 heures til aura du tube neural recroquevillé sur lui-même et le NC ne sera pas migrer loin du tube neural (figure 3b). Parfois, le tube neural ne se fixe pas sur les plaques recouvertes de fibronectine.
Dans notre expérience, sous-optimale de migration NC ou des problèmes de fixation du tube neural peuvent être altérés par les conditions de normoxie ou de la concentration de la fibronectine, respectivement. L'activité enzymatique de la collagénase / dispase varie légèrement selon le lot et le temps de digestion doivent être ajustés de manière appropriée, cependant, ne digèrent pas le tissu de plus de quinze minutes. Overdigestion du tube neural contenant des tissus dans la collagénase / dispase se traduira également par des excroissances déficientes. Si le tissu somite ne s'enlève pas facilement à partir du tube neural après incubation dans la collagénase / dispase, le tube neural peuvent être incubés pendant plus de dix minutes. Parfois, le tube neural ne se fixe pas sur le substrat. Si tel est le cas, vérifiez l'fibronecconcentration en étain et les conditions de l'hypoxie.
Bien que les conditions normoxiques peut être utilisé pour la culture de type sauvage NC, des conditions hypoxiques imiter de plus près l'environnement in vivo 29,30. Dans notre expérience, des conditions hypoxiques est devenue critique lorsque la culture mutant NC. Par exemple, lorsque Foxd3 mutant NC ont été cultivées dans des conditions normoxiques, le tronc NC eu une excroissance de cellules fortement réduite par rapport aux contrôles. Cette disparité dans la taille excroissance a été supprimée lorsque les explants étaient cultivés dans des conditions hypoxiques (Figure 4). En outre, lorsque de type sauvage explants du tube neural ont été cultivées en normoxie, le nombre de cellules positives pour la caspase-était plus grande alors que des explants cultivés en hypoxie similaires (données non présentées). En maintenant toute la culture NC en hypoxie, les comparaisons ne peuvent plus facilement être faite entre la dynamique de contrôle et les cultures mutantes.
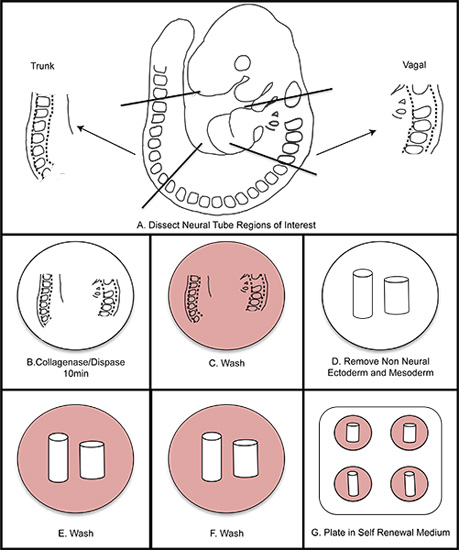
Figure 1. Schématique l'ensemble de l'isolement NC. A) Disséquer régions d'intérêt à partir de l'embryon. B) Le guide de tube neural dans la collagénase / dispase pendant dix minutes (ne pas dépasser quinze minutes). C) Laver en milieu de lavage. D) Disséquer l'écart l'ectoderme non-neural et du mésoderme. EF) Laver deux fois dans un milieu de lavage. G) Plaque en milieu auto-renouvellement. Incuber à 37 ° C dans 3% O 2 des conditions hypoxiques.
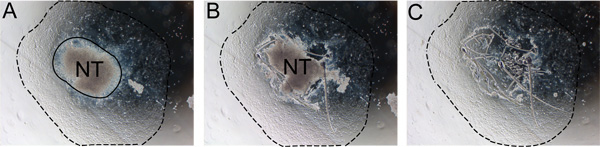
Figure 2. Retrait par étapes du tube neural de l'explant. Le tube neural doit être retirée après 24-48 heures pour éviter la contamination avec les non-NC cellules. A) Notez la frontière entre le tube neural et l'excroissance NC (ligne continue). B) coupés le long du bord du tube neural avec une aiguille d'insuline. C) Jeter le tube neural et de remplacer à moyen avec un milieu auto renouvelée. La ligne pointillée indique l'étendue de l'excroissance. Abréviation: NT, le tube neural.
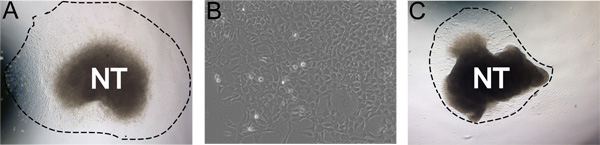
Figure 3. Exemples de résultats représentatifs. A) excroissance explant typique après 24 heures d'incubation dans un milieu auto-renouvellement dans des conditions hypoxiques (ligne en pointillés indique l'étendue de l'excroissance). B) Vue agrandie d'excroissance NC après 48 heures de culture. C) la culture idéale, avec un rendement moins excroissance faible. A et C ont été cultivées dans les mêmes conditions. Images de démontrer l'aire de répartition naturelle de la robustesse de la culture. Ce peut être affectée par l'efficacité de l'isolement du tube neural, la concentration du FN, des conditions hypoxiques, et l'heure dans la collagénase / dispase digestions.
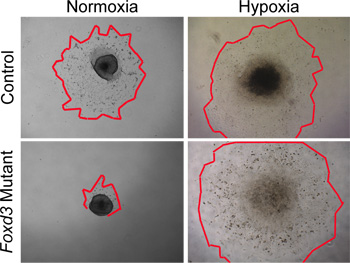
Figure 4. Dans les analyses in vitro de cultures d'explants NF en normoxie par rapport hypoxie. De contrôle (type sauvage), les cellules ont migré à partir d'explants NC du tube neural après 48 heures dans des conditions de culture normoxiques. En revanche, Foxd3 mutantNC avaient fortement réduit les excroissances cellulaires dans des conditions de normoxie (bords rouges marquent les contours des excroissances NC). Lorsque des explants comparables ont été cultivées dans des conditions hypoxiques, Foxd3 mutantes explants NC a augmenté comparativement à des contrôles, ce qui permet des analyses ultérieures. Remarque, ce comportement est bien corrélée avec le comportement de Foxd3 mutant NC in vivo.
Access restricted. Please log in or start a trial to view this content.
Discussion
Une attention particulière devrait être accordée à l'étape du développement de l'embryon afin d'assurer le succès de cette approche. Compter somites d'embryons de souris au début est essentiel à la fois pour la phase correspondant embryons à l'intérieur d'une portée et de déterminer les régions correctes de tube neural pour l'isolement. Une variation de un ou deux somites entre les embryons se situe dans une fourchette raisonnable du calendrier de développement, en fonction de ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Nous tenons à remercier Marc Wozniak pour l'assistance vidéo. Nous tenons également à remercier Sean Morrison à l'UT Southwestern pour le protocole original de culture de cellules de rat NC. Ce travail a été soutenu Vanderbilt University Medical Center Programme de soutien académique et par des subventions du NIH (HD36720 et HD036720-11S109) et le 11GRNT7690040 AHA pour PAL, bourses doctorales de l'AHA (0615209B) et le NIH (NS065604) à NAM, et l'ERP a été soutenu par une subvention des NIH de formation T32HD007502.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Réactif | Entreprise | Numéro de catalogue | Commentaires |
| DMEM (faible taux de glucose) | Gibco / Invitrogen | 11885 | |
| Moyen Neurobasal | Gibco | 21103 | |
| BSA | Sigma | A3912-10G | |
| dPBS | Gibco | 14190-144 | |
| IGF1 | BD Biosciences | 354037 | Entreposer dans 50 pg / ml d'aliquots à -20 ° C. |
| bFGF | BD Biosciences | 354060 | Entreposer dans 25 pg / ml aliquotes à -20 ° C. |
| La fibronectine | Gibco | 33016-015 | Stocké dans 1mg/mL aliquots à -20 ° C. |
| L'acide rétinoïque | Sigma | R2625 | Entreposer dans 35 pg / ml après reconstitution aliquotes dans de l'éthanol à -20 ° C. |
| Le 2-mercaptoéthanol | Sigma | D-5637 | |
| N 2 supplément | Gibco | 17502-048 | |
| B27 supplément | Gibco | 17504-044 | |
| Filtres Steriflip um 0,22 | Millipore | SCGP00525 | |
| La pénicilline-streptomycine | Invitrogen | 15140122 | |
| 0,20 filtres pm | Corning | 431219 | |
| Seringues (pour la filtration) | BD Biosciences | 301604 | |
| Quatre plaques à puits | Thermo Fisher Scientific | 176740 | |
| Collagénase / dispase | Roche | 269 638 | Activité varie par lot. Entreposer dans 100 mg / ml d'aliquots à -20 ° C. |
| Aiguilles à insuline (29 ½ Gage) | Becton Dickson | 309306 | |
| Chambre hypoxie | Billups-Rothenberg | ||
| Analyseur d'oxygène | Billups-Rothenberg | ||
| Forceps # 5 | Outils belle science | Pour enlever l'utérus et la caduque. | |
| Trypsine-EDTA (0,25%) | Gibco | 25200 |
Références
- Le Douarin, N., Kalcheim, C. The neural crest. , 2nd edn, Cambridge University Press. (1999).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Developmental biology. 344, 566-568 (2010).
- Saint-Jeannet, J. -P. Neural crest induction and differentiation. , Springer Science+Business Media, Landes Bioscience/Eurekah.com. (2006).
- Plank, J. L. Influence and timing of arrival of murine neural crest on pancreatic beta cell development and maturation. Developmental biology. 349, 321-330 (2011).
- Nekrep, N., Wang, J., Miyatsuka, T., German, M. S. Signals from the neural crest regulate beta-cell mass in the pancreas. Development. 135, 2151-2160 (2008).
- Freem, L. J. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. J. Anat. 217, 651-664 (2010).
- Cohen, A. M., Konigsberg, I. R. A clonal approach to the problem of neural crest determination. Developmental biology. 46, 262-280 (1975).
- Sieber-Blum, M., Cohen, A. M. Clonal analysis of quail neural crest cells: they are pluripotent and differentiate in vitro in the absence of noncrest cells. Developmental biology. 80, 96-106 (1980).
- Baroffio, A., Dupin, E., Douarin, N. M. L. e Common precursors for neural and mesectodermal derivatives in the cephalic neural crest. Development. 112, 301-305 (1991).
- White, P. M. Neural crest stem cells undergo cell-intrinsic developmental changes in sensitivity to instructive differentiation signals. Neuron. 29, 57-71 (2001).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Bronner-Fraser, M., Sieber-Blum, M., Cohen, A. M. Clonal analysis of the avian neural crest: migration and maturation of mixed neural crest clones injected into host chicken embryos. J. Comp. Neurol. 193, 423-434 (1980).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Biernaskie, J. A., McKenzie, I. A., Toma, J. G., Miller, F. D. Isolation of skin-derived precursors (SKPs) and differentiation and enrichment of their Schwann cell progeny. Nat. Protoc. 1, 2803-2812 (2006).
- Chung, I. H. Stem cell property of postmigratory cranial neural crest cells and their utility in alveolar bone regeneration and tooth development. Stem Cells. 27, 866-877 (2009).
- Biernaskie, J. SKPs derive from hair follicle precursors and exhibit properties of adult dermal stem cells. Cell Stem Cell. 5, 610-623 (2009).
- Hagedorn, L., Suter, U., Sommer, L. P0 and PMP22 mark a multipotent neural crest-derived cell type that displays community effects in response to TGF-beta family factors. Development. , 126-3781 (1999).
- Heanue, T. A., Pachnis, V. Prospective identification and isolation of enteric nervous system progenitors using Sox2. Stem Cells. 29, 128-140 (2011).
- Morrison, S. J. Culture in reduced levels of oxygen promotes clonogenic sympathoadrenal differentiation by isolated neural crest stem cells. J. Neurosci. 20, 7370-7376 (2000).
- Ito, K., Morita, T., Sieber-Blum, M. In vitro clonal analysis of mouse neural crest development. Developmental biology. 157, 517-525 (1993).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nat. Protoc. 6, 1568-1577 (2011).
- Mundell, N. A., Labosky, P. A. Neural crest stem cell multipotency requires Foxd3 to maintain neural potential and repress mesenchymal fates. Development. 138, 641-652 (2011).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development. 133, 99-106 (2006).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67, 47-56 (2007).
- Kasemeier-Kulesa, J. C., Bradley, R., Pasquale, E. B., Lefcort, F., Kulesa, P. M. Eph/ephrins and N-cadherin coordinate to control the pattern of sympathetic ganglia. Development. 133, 4839-4847 (2006).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the the chick. Dev. Dyn. 232, 939-949 (2005).
- Schwarz, Q., Maden, C. H., Vieira, J. M., Ruhrberg, C. Neuropilin 1 signaling guides neural crest cells to coordinate pathway choice with cell specification. Proc. Natl. Acad. Sci. U.S.A. 106, 6164-6169 (2009).
- Simon, M. C., Keith, B. The role of oxygen availability in embryonic development and stem cell function. Nat. Rev. Mol. Cell Biol. 9, 285-296 (2008).
- Ivanovic, Z. Hypoxia or in situ normoxia: The stem cell paradigm. J. Cell Physiol. 219, 271-275 (2009).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon