Method Article
Les petits extraits nucléaires pour les dosages fonctionnels de l'expression génétique Machineries
Dans cet article
Résumé
Un protocole pour la préparation de solides, des extraits HeLa nucléaires à petite échelle est décrite. Ce protocole est valable pour les essais qui exigent l'utilisation de petites populations de cellules, telles que les cellules traitées avec des médicaments ou ARNi. La méthode devrait être applicable à une grande variété de tests d'expression génique et d'autres types cellulaires, y compris les cellules du patient.
Résumé
Une grande partie des progrès réalisés dans l'expression des gènes compréhension a été faite en utilisant des systèmes in vitro. Pour la plupart des études, des analyses fonctionnelles sont réalisées en utilisant des extraits qui sont préparés en vrac à partir de 10-50 litres ou plus de cellules cultivées en suspension. Toutefois, ces préparations à grande échelle ne se prêtent pas à tester rapidement les effets in vitro qui résultent d'une variété de traitements cellulaires in vivo ou de conditions. Cet article journal vidéo montre un procédé de préparation fonctionnels petits extraits nucléaires, en utilisant des cellules HeLa comme un exemple. Cette méthode est réalisée à l'aide aussi peu que trois plaques de 150 mm de cellules cultivées sous forme de monocouches adhérentes. Pour illustrer l'efficacité des extraits à petite échelle, nous montrons qu'elles sont aussi actifs que des extraits nucléaires en vrac pour couplés ARN polymérase II de transcription / épissage réactions. Pour démontrer l'utilité du protocole extrait, nous montrons que l'épissage est abolie dans les extraits préparés à partir de cellules HeLas traités avec le médicament inhibiteur de l'épissage E7107. Le protocole à petite échelle devrait être d'application générale à tout processus ou type de cellule qui peut être étudié in vitro en utilisant des extraits cellulaires. Il s'agit notamment de cellules de patients qui ne sont disponibles en quantités limitées ou des cellules exposées à de nombreux agents tels que les médicaments, les agents endommageant l'ADN, ARNi, ou transfection, qui nécessitent l'utilisation de populations de cellules de petite taille. En outre, de petites quantités de cellules fraîchement cultivées sont pratiques et / ou nécessaire pour certaines applications.
Protocole
1. Les cellules HeLa croissance pour l'extraction nucléaire
- Plate cellules HeLa sur trois plaques de 150 mm avec du milieu DMEM supplémenté avec 10% de FBS et 1% de pénicilline / streptomycine. Croître dans une étuve à 37 ° C avec 5% de CO 2, jusqu'à cellules sont confluentes 90%.
Astuce-Split cellules 1:10 d'une plaque de confluence et de la récolte 3 jours après la séparation.
Tip-Une plaque supplémentaire peut être cultivé dans le cas où il ne sont pas suffisamment de cellules avec trois plaques (par exemple, si les cellules sont moins de 90% de confluence).
2. Préparer et Chill Solutions extrait nucléaire
- Préparer de nouvelles solutions comme indiqué dans le tableau 2.
- Aliquote de 10 ml de tampon hypotonique dans un tube Falcon de 15 ml. Aliquote de 1 ml de tampon de sel et 1 ml de tampon de faible teneur en sel dans tubes Eppendorf de 1,5 ml. Réfrigérer les tampons sur la glace. Ajouter les volumes appropriés de PMSF et de la TNT à chaque tampon juste avant d'utiliser (voir Tableau 1).
3. La récolte des cellules HeLa pour l'extraction nucléaire
- Aspirer les médias à partir des cellules et laver les cellules une fois avec 13 ml de PBS 1X à température ambiante par plaque.
- Aspirer le PBS de lavage.
Tip-Aspirer le plus de PBS que possible par aspiration d'abord, puis debout la plaque sur le côté, en attendant quelques secondes, et l'aspiration du reste.
- Utilisation d'un dispositif de levage cellule, racler cellules sur le bord inférieur des plaques, puis transférer les cellules à un tube Eppendorf. Évitez de faire des bulles. Les 3 plaques de cellules grattées doivent s'inscrire dans un tube Eppendorf de 1,5 ml.
Tip-Il est plus facile d'estimer le volume des cellules, si un tube Eppendorf est utilisé. Pour l'échelle, utilisez des tubes Falcon.
- Centrifuger à 4 ° C dans une microcentrifugeuse pendant 5 min à 100 xg à pellets des cellules.
4. Swell cellules HeLa dans un tampon hypotonique
- Aspirer soigneusement le PBS à partir du culot cellulaire et d'estimer la valeur d'hématocrite (PCV) en regardant la gradation sur le tube. Trois plaques confluentes de cellules HeLa rapporterait environ 500 pi de PCV.
- Ajouter 2 fois la PCV du tampon hypotonique au culot de cellules. Agiter doucement pour remettre les cellules. Utilisez un Pipetman P1000 doucement remettre les cellules en pipetant de haut en bas si nécessaire.
- Centrifuger à 4 ° C dans une microcentrifugeuse pendant 5 min à 100 xg à pellets des cellules. * Les cellules ont commencé à gonfler en ce moment, et le volume de la cellule devrait maintenant être d'environ 750 pi-1000 pl.
- Aspirer soigneusement le tampon hypotonique et ajouter de nouvelles tampon hypotonique à un volume final de 1,5 ml. Remettre en suspension les cellules.
- Incuber les cellules remises en suspension gonflées sur la glace pendant 10 min.
5. Lyse des cellules en utilisant un homogénéisateur Dounce
- Utilisez un tampon hypotonique pour rincer le Dounce puis le refroidir sur glace. Essuyez le sec pilon avec un wip tâche délicateer (par exemple Kimwipe). Retirer le tampon restant de la Dounce l'aide d'un embout 1000 ul micropipette prolongée.
- Transfert des cellules gonflées dans le Dounce. Déplacez lentement le pilon serré de la Dounce de haut en bas 5 fois pour lyser les cellules, en faisant attention d'éviter les bulles.
- Essai pour la lyse des cellules en utilisant une partie aliquote de 5 ul de cellules provenant de la Dounce. Placez la partie aliquote dans un tube Eppendorf et ajouter un volume égal de bleu trypan. Mettez le mélange sur une lame et d'examiner les cellules à l'aide d'un microscope optique. Les noyaux des cellules lysées seront apparaissent en bleu. Environ 90% de lyse est idéal.
Tip-Le nombre de fois où les cellules doivent être dounced variera en fonction de l'étanchéité de la Dounce. Lors de ce protocole pour la première fois, de déterminer le nombre de fois à Dounce en effectuant l'étape 5.3 après chaque course avec la Dounce. Ne pas trop Dounce, douncing excessive va détruire les noyaux.
- Transférer les cellules lysées à une pré-chilled tube Eppendorf et de spin dans une micro-4 ° C pendant 5 min à 1500 x g. Le culot contient les noyaux. Transférer délicatement le surnageant dans un nouveau tube, sans perturber les noyaux. Le surnageant contient le cytoplasme.
Tip-Le cytoplasme peut être utilisé tel quel ou traitées ultérieurement à un S100 en utilisant le même à haute vitesse de rotation utilisée pour les extraits en vrac (voir 1 pour la préparation d'un actif S100 à partir d'extraits en vrac).
6. Sel-Extraire le noyaux
- Estimer le volume emballé nucléaire (PNV) en regardant la gradation sur le tube. Un PCV de 500 ul donne généralement un PNV de 400 pi.
- Ajouter ½ X PNV de tampon de sel faible aux noyaux en insérant une extrémité micropipette au fond du tube et lentement presser le tampon dans le noyau tout en mélangeant doucement. Ne pas pipeter de haut en bas. Tapoter doucement les tubes afin de s'assurer que le culot est complètement remises en suspension dans le tampon faible teneur en sel avant de continuer.
- Ajouter ½ X PNV de tampon élevée en sel et mélanger rapidement 1 fois en inversant le tube. Ne secouez pas. Tournent à 4 ° C pendant 30 min.
Tip-Soyez doux avec les noyaux quand ils sont dans le tampon de sel pour éviter de les lyser.
- Centrifuger à 4 ° C dans une microcentrifugeuse pendant 15 min à 18000 x g. Le surnageant est l'extrait le sel nucléaires de haute activité (HS-NE). Trois plaques de cellules généralement céder 500-600 pi de HS-NE.
7. Concentrez-vous et Dialyser l'extrait nucléaire
- Transférer 500 ul de la HS-NE en réfrigérés mini-centricons (Amicon) et de spin pendant 50 min à 4 ° C dans une microcentrifugeuse à 14000 x g. Inverser le mini-centricon (Amicon) et le placer dans un nouveau tube Eppendorf. Spin pendant 2 min à 4 ° C 1000 xg pour récupérer le HS-NE. Le HS-NE seront concentrées à environ 115 pi.
- L'utilisation d'un Pipetman P200, transférer 45 aliquotes de la HS-NE en mini-dialyse Slide-A Lyzers les et placez-les dans 500 ml de tampon de dialyse réfrigérés. Faire en sorte que le fond de la diapositive-A-Lyzer est aligné avec le fond du flotteur. Remuer pendant 1-2 heures à 4 ° C. Le NE apparaît trouble après la dialyse.
Tip-Ne pas centrifuger pour éliminer le précipité trouble que l'on observe après la dialyse, que cette centrifugation réduit l'activité de l'extrait.
- La NE peut être utilisé immédiatement ou aliquotés. Aliquotes devraient être éclair congelés dans l'azote liquide et stockés à -80 ° C. La NE peut être stocké et subissent au moins deux cycles gel-dégel sans perdre l'activité.
8. Les résultats représentatifs
Récemment, l'efficacité des systèmes in vitro pour le couplage de la transcription ARNP II à l'épissage ont été mis au point 2-5. Ces systèmes travaillent cellules HeLa cultivées en vrac et donc ne se prêtent pas à tester rapidement les effets de certains traitements cellulaires sur des échantillons multiples. Sur la base de ce besoin d'une l'utilité générale d'un protocole extrait à petite échelle (voir Discussion), nous avons établi une solide petite échelle méthode extrait nucléaire. Les données représentatives de comparaison du ARNP II de transcription / épissage de réaction dans l'extrait à petite échelle avec l'extrait nucléaire vrac nucléaire est représenté sur la figure 2. Produit d'assemblage CMV-ADN, qui contient le promoteur de CMV et qui code pour un substrat d'épissage standard (Ftz 3, figure 2A) a été utilisé pour l'analyse. Lorsque cette construction a été incubé dans la masse (voies 1-3) ou à petite échelle (voies 4-6), extrait des niveaux similaires de la naissante pré-ARNm ont été synthétisés par le point 5 min le temps (Figure 2, les pistes 1 et 4 ). Après l'addition de α-amanitine de bloquer la transcription en outre, les intermédiaires et les produits d'épissage épissés accumulée au fil du temps avec une cinétique similaire dans les deux types d'extraits (Figure 2, pistes 2, 3, 5, 6). Ces résultats représentatifs montrent que l'efficacité du coup d'Etat dirigée par ARNP II de transcription / épissage système est similaire dans les extraits en vrac et à petite échelle nucléaires.
Pour démontrer l'utilité de la méthode extrait à petite échelle, des extraits ont été préparés à partir de cellules HeLa traitées avec l'inhibiteur de l'épissage, E7107, ou le pladiénolide contrôle négatif composé F 6,7, puis le couplage ARNP II de transcription / épissage essai a été effectué. Comme le montre la figure 3, la transcription par ARNP II produite efficacement dans des extraits préparés à partir à la fois le F pladiénolide et E7107 cellules traitées (10 points dans le temps min). En revanche, l'épissage a eu lieu normalement dans l'extrait préparé à partir des pladiénolide F-cellules traitées, mais a été abolie dans les cellules E7107-traitées (Figure 3, points 20-60 min de temps). Ces données fournissent la preuve de concept pour l'utilisation des extraits nucléaires à petite échelle pour le traitement spécial de cellules à petite échelle.
jpg "/>
Figure 1. Schéma du protocole Extrait à petite échelle. Étape P1. Les cellules sont cultivées en monocouche, récolté à partir de plaques en utilisant un dispositif de levage et de cellules gonflées par l'addition d'un tampon hypotonique. Etape P2. Les cellules sont lysées en utilisant un homogénéisateur Dounce et centrifugé pour obtenir un culot des noyaux. Etape P3. Les noyaux sont séparés du cytoplasme et de subir une extraction du sel. Etape P4. L'extrait nucléaire est concentrée et dialysée. Etape P5. Les résultats sont obtenus, qui montrent que des extraits nucléaires sont fonctionnels (voir la figure 2 pour plus de détails).
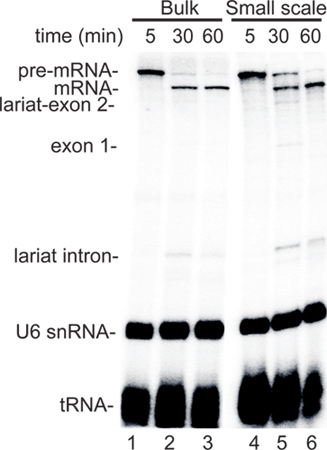
Figure 2. Les petits extraits nucléaires sont robustes dans un couplage ARNP II de transcription / épissage dosage. A. Schéma de la matrice d'ADN CMV-Ftz utilisé pour couplage ARNP II de transcription / épissage. Le promoteur de CMV et les tailles de l'intron et les exons sont indiquées. B. Comparaison des couplé ARNPII transcription / épissage dosage en utilisant soit extrait en vrac nucléaire ou à petite échelle extrait nucléaire. α-amanitine a été ajouté, après 5 min de la transcription et épissage a été autorisé à se produire pour 30 et 60 min. L'ARN a été extrait et fractionné sur un gel de polyacrylamide dénaturant à 5% et détectés par phosphoimager. Les intermédiaires d'épissage et les produits sont indiqués. Le endogène U6 snRNA et ARNt présents dans l'extrait et qui sont marqué au 32P pendant l'incubation sont indiqués. Voir 3 pour un protocole détaillé sur le couplage ARNP II de transcription / épissage système.
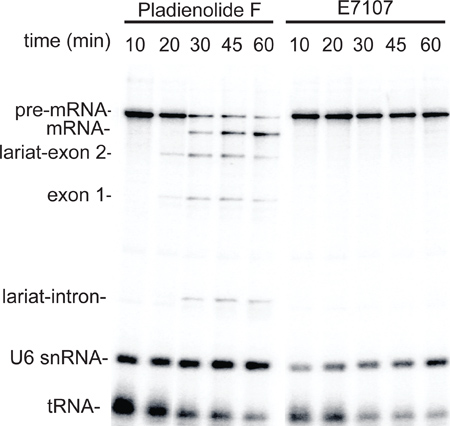
Figure 3. Les petits extraits nucléaires préparés à partir de cellules HeLa traitées avec le médicament inhibiteur de l'épissage E7107 sont défectueux dans l'épissage. Cellules ont été traitées avec 3 pladiénolide uM F ou E7107 comme6 et décrit ensuite utilisé pour préparer des petits extraits nucléaires. Une évolution dans le temps a été réalisée en utilisant la même transcription / épissage dosage comme dans la Figure 2. Les intermédiaires d'épissage et des produits, et U6 ARNsn et ARNt sont indiqués.
Discussion
Nous avons établi une méthode rapide et reproductible pour la préparation d'extraits nucléaires de petites quantités de cellules HeLa cultivées en monocouche. Nous avons démontré que ces extraits sont robustes, en montrant que la cinétique et de l'efficacité de ARNP II de transcription / épissage tests sont similaires dans les extraits à petite échelle et en vrac nucléaires. Nous avons montré l'utilité des extraits en démontrant que des extraits préparés à partir de cellules traitées avec un médicament inhibiteur de l'épissage sont actifs pour la transcription qui est défectueuse dans l'épissage.
Notre méthode pour la préparation de petits extraits nucléaires a été créée en combinant et en optimisant les méthodes précédemment établies pour en prendre des extraits de cellules HeLa cultivées en suspension à grande échelle 1,8 et une méthode pour la petite préparation d'extraits 9. Nous avons établi notre protocole parce que les précédentes petits extraits ne sont pas fonctionnels pour certains tests, tels que la transcription couplé / splicing dosage. Une différence importante entre l'ancienne petite échelle protocole 9 et le nôtre, c'est que nous avons optimisé les conditions de lyse des cellules en utilisant un mini-Dounce alors que le protocole précédent lysées cellules en les poussant à travers une aiguille de petit calibre 9. Les résultats d'aiguille de lyse dans des bulles, ce qui peut expliquer pourquoi les extraits étaient inactifs et / ou difficiles à reproduire pour certains dosages. Nous avons également ajouté une étape de concentration de notre protocole. Cette étape augmente l'activité des extraits, qui sont extrêmement sensibles à la concentration, et limite également la variabilité entre les extraits qui est inhérente aux petits préparatifs. Enfin, notre préparation est systématiquement réalisée avec seulement trois plaques de 150 mm de monocouches de cellules, sans effet significatif sur l'activité par rapport à des extraits en vrac. Ainsi, la procédure est susceptible d'être réduits pour les petits préparatifs qui nécessitent des réactifs coûteux ou de la disponibilité limitée des cellules. Par exemple, nous avons préparé small échelle des extraits de cellules knock-down RNAi et de chroniques des cellules de leucémie lymphoïde patients (CLL), et utilisé ces extraits pour les essais fonctionnels et / ou biochimiques (FEM, JLH, TY et RR, non publié). Nous avons constaté que les extraits sont précieux pour l'ARNi suivie par des dosages biochimiques spécifiques, tels que immunopreciptations, les westerns, et coloration à l'argent. Après avoir établi l'efficacité de renverser une protéine particulière, une étude plus détaillée peut être effectuée en faisant un effet de choc stable lignée cellulaire, qui peut être utilisé pour préparer des extraits supplémentaires à moindre coût. La spectrométrie de masse des protéines présentes dans immunoprécipités obtenu à partir de ces lignées de cellules knock-down sera également une application utile de la méthode. En plus de la transcription couplé / épissage test que nous avons utilisé comme exemple pour notre description du protocole ici, les extraits à petite échelle devraient être généralement applicable à de nombreux tests fonctionnels et biochimiques, tels que ceux utilisés pour la st différenteeps dans l'expression des gènes (par exemple le plafonnement, l'épissage, la transcription, la transformation microARN polyadénylation,). Le protocole peut également être adapté pour les types cellulaires de patients qui peuvent être obtenus soit en suspension (comme les cellules de LLC) ou cultivés dans la culture (telles que les fibroblastes des patients). Enfin, la fraction cytoplasmique obtenus au cours de la procédure devrait se révéler utile pour des analyses à la fois fonctionnelles et biochimiques qui nécessitent le cytoplasme.
Déclarations de divulgation
La production et l'accès gratuit à cet article est sponsorisé par Abcam, Plc.
Remerciements
Nous sommes reconnaissants à M. Winkelbauer-Hurt, E. Ibrahim, P. Valence, K. Dufu, H. Cheng pour des discussions utiles. Des cellules HeLa ont été obtenues de la National Culture Cellulaire Centre (Minneapolis, MN). Nous remercions également Eisai Co., Ltd pour fournir E7107 et le Nikon Imaging Center à Harvard Medical School de l'aide pour la microscopie optique. Ce travail a été soutenu par une subvention du NIH GM043375 à RR et de l'EGF et NRSA bourse pour JLH.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Nom complet du réactif | Entreprise | Numéro de catalogue |
| HEPES | 4 - (2-hydroxyéthyl) pipérazine-1-éthanesulfonique | Sigma | H3375-500G |
| MgCl 2 .6 H 2 O | Chlorure de magnésium hexahydraté | Sigma | M2670-500G |
| KCl | Chlorure de potassium | Pêcheur | P335-212 |
| PMSF | Fluorure de phénylméthanesulfonyle | Sigma | P7626-100G |
| TNT | Dithiothreitol | Américaine bioanalytique | AB00490-5G |
| EDTA | Éthylènediaminetétraacétate de disodium, dihydrate | Américaine bioanalytique | AB00500-01000 |
| Glycérol | MP Biomedicals | 800689 | |
| DMEM | Dulbecco milieu essentiel minimal | Invitrogen | 11995-073 |
| FBS | Sérum fœtal bovin | Gibco | 16140 |
| Pénicilline / streptomycine | Gibco | 15070 | |
| PBS | Phosphate Buffered Saline | Cellgro | 21-040-CV |
| Bleu de Trypan Stain 0,4% | Gibco | 15250 | |
| Lifters cellulaires | Corning | 29442-200 | |
| Plaques 150mm | VWR | 353025 | |
| Étendue Micropipette Astuce | Denville | P1126 | |
| Dounce homogénéisateur, 1ml, avec un pilon serré | Wheaton | 357538 | |
| Slidealyzers, MWCO 10 kDa | ThermoScientific | 69572 | |
| Mini-Centricons, MWCO 3kDa | Millipore (Amicon) | UFC500396 |
Tableau 1. Réactifs et équipements spécifiques.
| Solution | Finale | Stock | Dispenser |
| Hypotonique | HEPES 10 mM, pH 7,9 | HEPES 1M, pH 7,9 | 5 ml |
| 1,5 mM MgCl 2 | 1M MgCl 2 | 750 pi | |
| 10 mM de KCl | 3M KCl | 1,67 ml | |
| 0,2 mM de PMSF | 200 mM de PMSF | 500 pi | |
| 0,5 mM de DTT | 2M TNT | 125 pi | |
| Amener à 500 ml avec de l'eau | |||
| Faible teneur en sel | 20 mM d'HEPES, pH 7,9 | HEPES 1M, pH 7,9 | 2 ml |
| 1,5 mM MgCl 2 | 1M MgCl 2 | 150 pi | |
| 20 mM de KCl | 3M KCl | 667 pi | |
| & Nbsp; | 0,2 mM d'EDTA | EDTA 0,5 M | 40 pl |
| 25% de glycérol | Glycérol | 25 ml | |
| 0,2 mM de PMSF | 200 mM de PMSF | 100 pi | |
| 0,5 mM de DTT | 2M TNT | 25 pl | |
| Amener à 100 ml avec de l'eau | |||
| Concentration en sel élevée | 20 mM d'HEPES, pH 7,9 | HEPES 1M, pH 7,9 | 2 ml |
| 1,5 mM MgCl 2 | 1M MgCl 2 | 150 pi | |
| 1,4 M de KCl | 3M KCl | 48 ml | |
| 0,2 mM d'EDTA | EDTA 0,5 M | 40 pl | |
| 25% de glycérol | Glycérol | 25 ml | |
| 0,2 mM de PMSF | 200 mM de PMSF | 100 pi | |
| 0,5 mM de DTT | 2M TNT | 25 pl | |
| Amener à 100 ml avec de l'eau | |||
| Dialyse | 20 mM d'HEPES, pH 7,9 | HEPES 1M, pH 7,9 | 10 ml |
| 100 mM de KCl | 3M KCl | 16.625 ml | |
| 0,2 mM d'EDTA | EDTA 0,5 M | 200 pi | |
| Glycérol 20% | Glycérol | 100 ml | |
| 0,2 mM de PMSF | 200 mM de PMSF | 500 pi | |
| 0,5 mM de DTT | 2M TNT | 125 pi | |
| Amener à 500 ml avec de l'eau |
Tableau 2. Solutions pour la préparation extrait nucléaire.
Références
- Krainer, A. R., Maniatis, T., Ruskin, B., Green, M. R. Normal and mutant human beta-globin pre-mRNAs are faithfully and efficiently spliced in vitro. Cell. 36, 993-1005 (1984).
- Ghosh, S., Garcia-Blanco, M. A. Coupled in vitro synthesis and splicing of RNA polymerase II transcripts. Rna. 6, 1325-1334 (2000).
- Das, R. Functional coupling of RNAP II transcription to spliceosome assembly. Genes Dev. 20, 1100-1109 (2006).
- Hicks, M. J., Yang, C. R., Kotlajich, M. V., Hertel, K. J. Linking splicing to Pol II transcription stabilizes pre-mRNAs and influences splicing patterns. PLoS Biol. 4, e147 (2006).
- Yu, Y., Das, R., Folco, E. G., Reed, R. A model in vitro system for co-transcriptional splicing. Nucleic Acids Res. 38, 7570-7578 (2010).
- Kotake, Y. Splicing factor SF3b as a target of the antitumor natural product pladienolide. Nat. Chem Biol. 3, 570-575 (2007).
- Folco, E. G., Coil, K. E., Reed, R. The anti-tumor drug E7107 reveals an essential role for SF3b in remodeling U2 snRNP to expose the branch point-binding region. Genes. 25, 440-444 (2011).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Res. 11, 1475-1489 (1983).
- Lee, K. A., Bindereif, A., Green, M. R. A small-scale procedure for preparation of nuclear extracts that support efficient transcription and pre-mRNA splicing. Gene Anal. Tech. 5, 22-31 (1988).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon