Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une procédure optimisée pour Fluorescence-activated tri cellulaire (FACS) Isolement du système nerveux autonome progéniteurs neuronaux de viscères de souris sur le fœtus
Dans cet article
Erratum Notice
Résumé
Une procédure optimisée pour purifier la crête neurale-dérivés progéniteurs neuronaux à partir de tissus fœtaux de souris est décrite. Cette méthode tire parti d'expression parmi les allèles rapporteurs fluorescents d'isoler des populations distinctes par tri cellulaire activé par fluorescence (FACS). La technique peut être appliquée pour isoler les sous-populations neuronales au cours du développement ou de tissus adultes.
Résumé
Au cours du développement de la crête neurale (NC) dérivés de progéniteurs neuronaux migrer loin du tube neural pour former ganglions autonomes dans les organes viscéraux comme l'intestin et du tractus urinaire inférieur. Les deux cours du développement et dans les tissus matures ces cellules sont souvent très dispersés à travers les tissus de telle sorte que l'isolement des populations discrètes en utilisant des méthodes comme la capture laser micro-dissection est difficile. Ils peuvent cependant être directement visualisée par l'expression de journalistes fluorescentes chassés de régions régulatrices de gènes spécifiques des neurones comme la tyrosine hydroxylase (TH). Nous décrivons une méthode optimisée pour des rendements élevés de TH viable + de progéniteurs neuronaux à partir de tissus fœtaux de souris viscérales, y compris l'intestin et inférieure du tractus urogénital (LUT), fondée sur la dissociation et le tri cellulaire activé par fluorescence (FACS).
Le gène codant pour la Th enzyme limitante pour la production de catécholamines. Entériques progéniteurs neuronaux commencent à exprimer TH durIng leur migration dans l'intestin du fœtus 1 et TH est également présent dans un sous-ensemble de neurones des ganglions pelviens adultes 2-4. La première apparition de cette lignée et la distribution de ces neurones dans d'autres aspects de la LUT, et leur isolement n'a pas été décrite. Progéniteurs neuronaux exprimant TH peut être facilement visualisées par l'expression de l'EGFP dans des souris porteuses du transgène construction Tg (Th-EGFP) DJ76Gsat/Mmnc 1. Nous imagée expression de ce transgène dans des souris fœtales afin de documenter la distribution de TH + cellules dans la LUT développer à 15,5 coït jours après (DPC), désignant le matin de la détection prise de 0,5 jpc, et a observé que un sous-ensemble des progéniteurs neuronaux dans la coalescence pelvienne ganglions expresse EGFP.
Pour isoler TH + LUT progéniteurs neuronaux, nous avons optimisé les méthodes qui ont été initialement utilisés pour purifier les cellules souches neurales de crête de l'intestin de souris fœtale 2-6. Efforts antérieurs visant à isoler NC dérivés populations invoquésdigestion avec un cocktail de collagénase et de la trypsine pour obtenir des suspensions cellulaires pour la cytométrie en flux. Dans nos mains ces méthodes ont produit des suspensions cellulaires de la LUT avec la viabilité relativement faible. Compte tenu de l'incidence déjà faible de progéniteurs neuronaux dans les tissus fœtaux LUT, nous avons décidé d'optimiser les méthodes de dissociation de telle sorte que la survie des cellules dans les dissocie finales serait augmenté. Nous avons déterminé que douce dissociation dans Accumax (Cell Technologies innovantes, Inc), filtrage manuel, et le débit de tri à de faibles pressions nous ont permis d'atteindre la survie constamment supérieur (> 70% des cellules totales) avec des rendements ultérieurs de progéniteurs neuronaux suffisants pour l'analyse en aval. La méthode que nous décrivons peut être largement appliquée à isoler une variété de populations neuronales foetales à partir soit ou adulte tissus murins.
Protocole
1. Préparation des médias (Toutes les étapes de fait dans la hotte de culture tissulaire)
- Mélanger le suivant: 44 L-15 ml de milieu, 0,5 ml 100X pénicilline / streptomycine (P / S), 0,5 ml à 100 mg / ml de sérumalbumine bovine (BSA), 0,5 ml de HEPES 1M, 5 ml de tissus de qualité de l'eau de la culture. Assurez-vous de mélanger BSA et P / S avant d'ajouter. Ce volume devrait être suffisant pour la dissociation d'un maximum de cinq différents types de tissus. Ce support sera utilisé à l'étape de 3,4 à préparer des solutions de trempe à l'emploi après la dissociation enzymatique du tissu.
- Médias filtrants quoique 0,22 um polyéthersulfone (PES) de filtrage.
- Préparer la solution 1X saline équilibrée de Hank (HBSS) et Phosphate Buffered Saline 1X (PBS) à partir de stocks 10X en utilisant l'eau de qualité culture tissulaire. Filtrer à travers filtre de 0,22 um PSE. De grandes quantités de ces réactifs peuvent être préparés à l'avance et stocké à 4 ° C, aliquotage petits volumes dans une hotte de culture de tissus en fonction des besoins.
- Remplissez multiples de 15 ml tubes coniques avec 1X, (HBSSnombre de tubes à égaler le nombre de tissus que vous prévoyez sur le sous-dissection) de la tenue des tubes sur la glace.
2. Dissection
- Euthanasier chronométré souris enceinte en conformité avec des soins aux animaux et les protocoles d'utilisation du comité approuvés et de l'utérus dans un transfert 60 ou 100 mm boîte de Pétri contenant de la glace froide PBS 1X.
- Retirer de l'utérus d'embryons et l'euthanasie par décapitation dans la glace-froid du PBS 1X. Ecran individuellement sous illumination par fluorescence, se divisant en positifs transgéniques et de type sauvage (WT) piscines non transgéniques. Gardez embryons dans la glace-froid tout au long de la dissection du PBS 1X.
- Sous un microscope à dissection, sous-disséquer le tractus urogénital. Maintenez l'embryon en place au niveau des membres antérieurs avec des pinces fines. Retirer les viscères de la foie vers le bas pour le tubercule génital par l'insertion pince au niveau de la membrane puis brusquement tirant les organes internes vers le bas et à l'écart de la paroi dorsale du corps.
- En outre la sous-disséquer le tissu deintérêt loin du tissu environnant (figure 1). Placez chacun individuellement sous-type de tissu disséquée dans un tube de 15 ml conique contenant glacées HBSS 1X. La cagnotte de chaque type de tissu ensemble en fonction de phénotype embryon (c.-à-tout GFP + échantillons de l'intestin du fœtus sont regroupées dans un seul tube de 15 ml conique).
- En parallèle, disséquer les tissus comparables de type sauvage embryons à utiliser pour les contrôles de la rémunération à la cytométrie en flux.
3. La dissociation des tissus Subdissected
- Pellet sous-disséqué les tissus par centrifugation à 210 de la force centrifuge relative (fcr), 4 ° C pendant 5 min. Après centrifugation, aspirer hors de HBSS autant que possible.
- Reprendre le culot de tissus dans Accumax (Cell Technologies innovantes, Inc), en étant sûr de changer les embouts de pipette entre chaque échantillon afin d'éviter la contamination croisée des types de tissus. Le montant de Accumax ajoutée peut être adapté pour des montants plus ou moins de tissu. Typiquement, pour une-5 Échantillons intestin du fœtus, 1 ml de Accumax serait utilisé, mais les piscines tissus plus, il faudra un plus grand volume pour atteindre la dissociation.
- Placer les tubes dans 37 ° C bain-marie pour 20-45 min en fonction du stade du tissu étant isolé (par exemple 13,5 intestin dpc 20 min, 15,5 intestin dpc 35 min). A mi-chemin si le temps de dissociation, manuellement briser le tissu en frappant le tube contre le côté du bain d'eau (ou toute surface solide) et par "feuilletant" le tube (comme on pouvait secouer un thermomètre à l'ancienne au mercure). A la fin du temps de dissociation répéter le shake down procédure plusieurs fois pour mieux dissocier l'échantillon. Pour les échantillons les plus fragiles, de réduire la vigueur de la secousse vers le bas et au lieu d'utiliser la pipette pendant l'étape de trituration de 3,5 à atteindre un niveau approprié de la dissociation. Typiques fois de dissociation pour 14,5 et 15,5 jpc jpc LUT sont de 35 et 45 min, respectivement.
- Alors que le tissu est en incubation dans Accumax, maquillage trempe de sortelutions, appelé trempe et trempe 1:5. Trempe est effectuée en ajoutant 45 pl 5 mg / ml à la DNase I 6 ml de L-15 médias. Quench 1:5 est fait en ajoutant 45 pl 5 mg / ml DNase I à 30 ml L-15 avec les médias.
- À la fin de la dissociation, déplacez tubes de 15 ml sur de la glace et ajouter immédiatement une Quench ml dans chaque tube. Triturer chaque échantillon de haut en bas jusqu'à ce tissu est presque complètement dissocié (figure 2). Il y aura toujours quelques petits morceaux de tissu présent dans la solution. La réalisation d'un échantillon complètement homogène n'est ni facilement réalisable, ni souhaitable car elle peut entraîner de la viabilité cellulaire pauvres.
- Gardez l'échantillon sur la glace autant que possible pour le reste du protocole. Veillez à utiliser un embout de pipette frais quand la pipette ou Quench Quench 1:5 à éviter la contamination croisée des échantillons.
4. Filtrage de suspension cellulaire
- En utilisant des pinces qui ont été trempés dans de l'éthanol 70%, placer un 3 cm carrés de 38 mailles membrane en nylon (um Sefar Amérique) au cours de labouche d'une nouvelle 15 ml tube conique. Filtrer à travers les cellules de maille par pipetage dans le centre de la membrane en utilisant étroites conseils de forage. Si la membrane est saturée en filtrant, l'enlever, sécher l'embouchure du tube avec un Kimwipe, et utiliser une nouvelle pièce de maille en nylon pour filtrer le reste de la suspension cellulaire. Une fois que toutes les cellules ont été filtrées, utilisez 1 ml Quench 1:5 à rincer le tube et de filtrer toutes les cellules restantes.
- Lorsque le filtrage est terminée, ou lors du remplacement d'une membrane est bouché, utilisez une pince à retrousser les côtés de la maille et essuyer la membrane sur le dessus du tube pour éliminer les gouttelettes suspendues de cellules.
- Suspension de cellules par centrifugation à 210rcf, 4 ° C pendant 5 min. Aspirer le surnageant et remettre en suspension le culot dans 1 ml Quench 1:5.
- Suspension cellulaire Filtrer à travers maille de nylon en 5 tubes de polystyrène ml. Laver tube de 15 ml avec 1 ml Quench 1:5 et filtre pour capturer toutes les cellules restantes.
5. Préparation d'échantillons pour FACS
- Si vous utilisez le même tissu pour le tri et pour les contrôles de compensation, de transférer 1/10 e à 1/20 ème du volume d'échantillon à un nouveau 5 ml tube en polystyrène à utiliser pour les contrôles de compensation. Divisez l'échantillon de tissu de type sauvage en deux parties. Une partie sera souillé de type sauvage (WT uniquement) tandis que le second semestre aura 7-Aminoactinomycin D (7-AAD, un agent intercalant fluorescent exclus à partir de cellules vivantes utilisées en tant que "la viabilité tache") ajoutée à l'(7-AAD seulement ). Ces contrôles individuels sont nécessaires pour permettre la compensation de tout chevauchement spectral entre l'émission de fluorophores discrets au trieur de flux. Par exemple, pour un seul journaliste fluorescent comme la EGFP, les contrôles nécessaires seraient les suivantes: EGFP seule, non colorées cellules WT, et un tube coloré avec 7-AAD seulement (Figure 3).
- Remplissez tous les tubes de 5 ml contenant la suspension cellulaire avec Quench 1:5 et centrifuger à 210rcf, 4 ° C pendant 5 min. Aspirer le surnageant, en laissant environ 200 pi de liquidedans le tube.
- Diluer 7-AAD 1:1000 dans Quench 1:5. Ajouter dilution coloration 7-AAD à 7-AAD commande de compensation et ne échantillons à trier. Ne pas ajouter de 7-AAD à l'EGFP seul ou WT contrôle de la rémunération seulement. Volume de la 7-AAD doit être ajoutée varie en fonction de la quantité de matériau de départ et la taille de culot cellulaire obtenu. Une fois 7-DAA ont été ajoutées dans des tubes appropriés, des échantillons sont prêts à être triés.
Tissu Taille de la piscine échantillon Volume 7-AAD doit être ajouté à * tube de 15,5 Intestin dpc 1-5 200 pi 15,5 dpc LUT 1-5 150 pi
Tableau 1. Montant de 7-DAA ajouté à dissocie tissus différents * la quantité totale finale dans chaque tube varie par une quantité allant de 50 à 100 pl depuis l'aspiration de support est unn processus approximatif et réalisé pour éviter la boulette. Derniers volumes ne sont pas mesurées de manière à minimiser la manipulation de cellules dans la solution. - Préparer les tubes de prélèvement à capturer les cellules pour l'isolement d'ARN en ajoutant 0,75 ml TRIzol-LS à 1,5 ml microtubes.
- Si la collecte de cellules pour la culture in vitro, plutôt que d'isolement d'ARN, les cellules de tri directement dans l'auto-renouvellement des médias dans 6 des plaques de culture de tissus, enduits avec de la fibronectine et rempli avec les médias, comme décrit précédemment. 2,6,7
6. Cytométrie en flux
- Au cytomètre de flux, d'évaluer la rémunération premiers contrôles, en étant sûr de revenir rincer entre chaque échantillon afin d'éviter la contamination. Utilisez les profils des échantillons de compensation pour régler les tensions et portails pour le tri. Notez que si des cellules positives dans le tissu désiré sont présents en nombre limitant, un tissu distinct peut être utilisé pour établir les paramètres de compensation aussi longtemps que l'intensité de fluorescence et de la taille des cellulesentre des échantillons sont comparables.
- Définissez les paramètres d'indemnisation et les portes pour éviter les cellules mortes qui prennent 7-AAD colorant et de recueillir des cellules présentant à haute intensité de fluorescence de la GFP par rapport aux témoins non colorées (Figure 4).
- Trier maximum 25 000 cellules dans chaque microtube. Le tri doit être effectué à la plus basse pression possible avec une buse large alésage et le taux de faible débit (par exemple, 17psi, 100 buses um, 3000 événements par seconde) afin de préserver la viabilité progéniteur neuronal. Pour sortes d'isoler des cellules EGFP + de nous effectuons nos isolements sur un FACSAriaII BD Biosciences en utilisant un laser 488nm 20mW pour exciter le rapporteur de l'EGFP.
- Si les échantillons contiennent des concentrations cellulaires élevées, il est conseillé de diluer la suspension cellulaire en outre l'utilisation 1:1000 7-AAD tache de réaliser des économies de capture plus élevés lors du tri.
- Vortex chaque tube de cellules capturées dans TRIzol-LS immédiatement après le tri.
7. Les résultats représentatifs
Tissus de dissociation pour produire un suspensions cellulaires pour le tri de flux est un équilibre délicat entre la digestion enzymatique adéquat et éviter la sur-digestion qui peut entraîner des viabilités cellulaires faibles. Un exemple de niveau souhaité de tissus de dissociation est représenté sur la figure 2. Dans le tissu de façon appropriée avant digéré pièces de trituration manuelle des organes sous-disséqués sont encore clairement (Figure 2b, 2f). Dans les tissus qui sont enzymatiquement traités pendant une trop longue période de temps ou à une concentration trop élevée de l'enzyme, la suspension résultante manque tous les morceaux résiduels grandes de tissus (figure 2d, 2h).
Appropriée dissociation et filtrage manuel de produire des profils de tri à la cytométrie en flux qui présentent généralement supérieure à 90% de cellules viables et présentent des niveaux élevés d'expression de l'EGFP (Figure 4). Les populations cellulaires obtenues par cette méthode illustrent bienla viabilité et peuvent être capturés pour la culture subséquente ou d'analyse de l'expression génique par déclenchement pour la capture de l'EGFP + progéniteurs neuronaux.
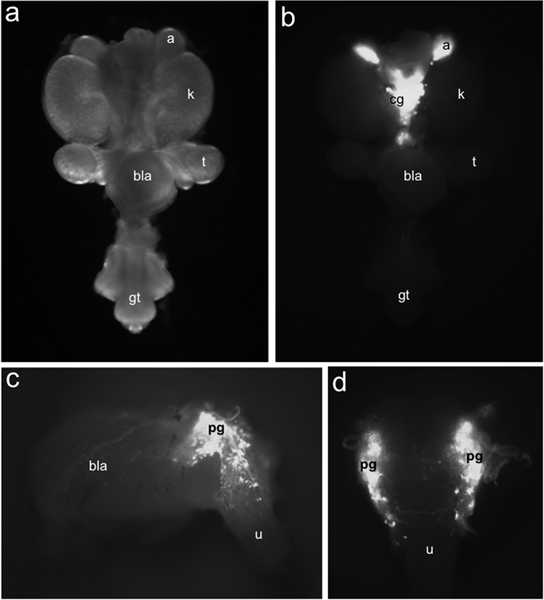
Figure 1. Répartition des TH-EGFP + neuronales progéniteurs dans LUT fœtus de souris. Tout le montage du tractus urogénital à 15,5 dpc vu ventralement sous un éclairage sur fond clair (a) par rapport à la distribution de cellules marquées par + EGFP TH-EGFP l'expression du transgène identifié sous un éclairage par fluorescence (b). TH-EGFP expression est présent dans les glandes surrénales (a) et les ganglions coeliaque dedans situé (cg). Latérale (c) vue de 15,5 DPC TH-EGFP sous-disséqués expositions de la vessie à partir de l'expression du transgène de fluorescence dans les ganglions pelviens (pg), la paroi de la vessie (bla) et de l'urètre (u). En vue dorsale (d) EGFP + cellules sont évidents dans l'urètre antérieur dorsal. D'autres labels: reins (k), les testicules (t), de la vessie (bla) et des organes génitaux tubercule (GT).

Figure 2. Images en fond clair de 15 dpc LUT foetal (a) et de l'intestin (e), respectivement, imagée moitié de la période d'incubation de dissociation, à la fin de l'incubation de dissociation avant rupture (b, f), après rupture manuelle (c, g), et dans un échantillon qui a été excessivement dissocié (d, h).
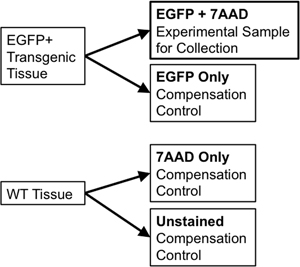
Figure 3. Schéma illustre la rémunération contrôle nécessaires pour établir les paramètres FACS rigoureuses de déclenchement.
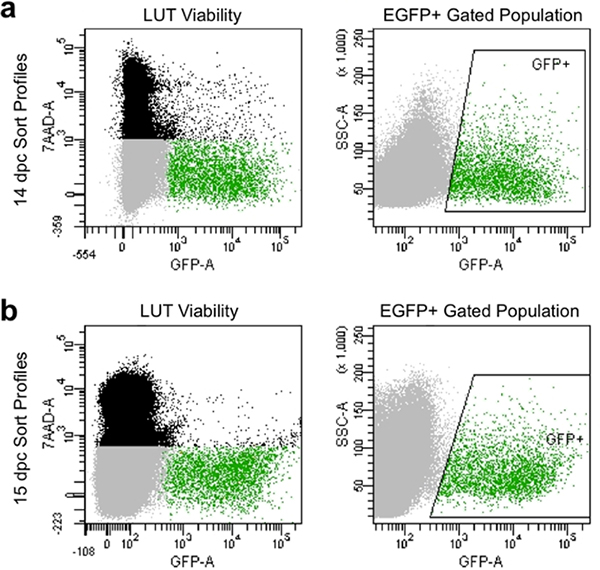
Figure 4. L'image représentant des profils de tri de flux à 14,5 dpc (a) et 15,5 jpc (b). Population noir est constitué de cellules uniques sur la base de diffusion vers l'avant et le côté qui sont morts et étiqueté par7-DAA fluorescence. Population de gris est constitué de cellules sur la base de singulets diffusion vers l'avant et le côté qui ont exclus 7-DAA et sont donc viables. Population vert fermée est indiquée par boîte "GFP +" zone et est constitué de cellules uniques que sont exclus 7-DAA (viables) et présentent de fluorescence EGFP.
Discussion
Lignes journaliste de souris exprimant journalistes fluorescentes sont de plus en largement disponibles grâce à des efforts multiples dans le milieu de la génétique murine 1,8,9. En conséquence, la méthode de la dissociation illustré ici peut être largement appliquée pour l'isolement de sous-types neuronaux distincts basés sur les profils d'expression des neurotransmetteurs ou des récepteurs de tissus fœtaux soit ou adulte. Alors que nous avons optimisé cette méthode basée sur l'exp...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier Catherine Alford pour des suggestions sur les méthodes de dissociation cellulaire et Kevin Weller, David Flaherty et la Bretagne Matlock pour le soutien à la ressource partagée cytométrie en flux à la Vanderbilt University Medical Center et Melissa A. Musser d'assistance artistique avec des illustrations. Nous remercions les Drs. Jack Mosher et Sean Morrison pour obtenir des conseils sur la mise en œuvre d'isolement des progéniteurs neuronaux. Le flux de ressource partagée MVC cytométrie est pris en charge par le Centre du cancer Vanderbilt Ingram (P30 CA68485) et la Vanderbilt Digestive Disease Research Center (P30 DK058404). Ce travail a été soutenu par un financement à partir de US National Institutes of Health des subventions DK064251, DK086594, et DK070219.
matériels
| Name | Company | Catalog Number | Comments |
| Nom réactif | Vendeur | Le numéro de catalogue | Commentaires |
| Accumax | Sigma (fab: Technologies des piles innovantes) | A7089-100ML | Conserver congelé en aliquots de 1 ml |
| DNase I | Sigma | D-4527 | Congelés à -20 ° C à 5 mg / ml dans 1xHBSS, (Utilisé dans Quench, Quench 1:5) |
| 10X PBS pH 7,4 | Gibco | 70011-044 | Compléter à 1x avec de l'eau de qualité culture tissulaire, puis filtre stérile |
| 10X HBSS w / o Ca ou Mg | Gibco | 14185-052 | Compléter à 1x avec de l'eau de qualité culture tissulaire, puis filtre stérile |
| Leibovitz milieu L-15 | Gibco | 21083027 | |
| Pénicilline / streptomycine 100X | Gibco | 15140-133 | Magasin aliquotés à -20 ° C |
| BSA | Sigma | A3912-100G | Stockez aliquotés à -20 ° C, 100 mg / ml dans de l'eau |
| Biowhittaker 1M HEPES à 0,85% de NaCl | Lonza | 17-737E | |
| 38 um NITEX Membrane Nylon Mesh | Sefar Amérique | 3-38/22 | Coupez-les en carrés ~ 3 cm. UV traiter toute la nuit pour stériliser dans la hotte de culture tissulaire. |
| 7-AAD | Invitrogen | A1310 | 1 mg / ml |
| TRIzol LS | Invitrogen | 10296-028 | |
| 5 tubes en polystyrène ml | Faucon | 352058 | |
| 15 ml tubes coniques | Corning | 430790 | |
| Beaux-Pince à dissection | Instruments belle science | 11251-30 | Dumont # 5 forcep, Dumoxel, la norme pointe 0.1x0.06mm |
| Dissection Spoon | Instruments belle science | 10370-18 |
Références
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon