Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement des noyaux de cardiomyocytes post-mortem des tissus
Dans cet article
Résumé
Noyaux cardiaque sont isolés par sédimentation de densité et immunomarquées avec des anticorps contre matériel péricentriolaire 1 (PCM-1) d'identifier et de trier les noyaux des cardiomyocytes par cytométrie de flux.
Résumé
Identification des noyaux des cardiomyocytes a été difficile dans des coupes de tissus comme la plupart des stratégies de compter uniquement sur les protéines marqueurs cytoplasmiques 1. Les événements rares dans les myocytes cardiaques tels que la prolifération et l'apoptose nécessite une identification précise des noyaux des myocytes cardiaques pour analyser le renouvellement cellulaire dans l'homéostasie et dans des conditions pathologiques 2. Ici, nous fournissons une méthode pour isoler les noyaux de cardiomyocytes post-mortem des tissus par la sédimentation de densité et immunomarquage avec des anticorps contre le matériel péricentriolaire 1 (PCM-1) et après le tri par cytométrie en flux. Cette stratégie permet une analyse à haut débit et l'isolement avec l'avantage de travailler aussi bien sur les tissus frais et congelés documents d'archives. Cela permet d'étudier des documents déjà recueillis dans des biobanques. Cette technique est applicable et testé dans un large éventail d'espèces et adapté à de multiples applications en aval tels que le carbone-14 datant 3, cellule-cyarticle analyse 4, la visualisation des analogues de la thymidine (BrdU par exemple et les UDI) 4, l'analyse du transcriptome et épigénétiques.
Protocole
1. Isolement des noyaux cardiaque
- Tubes ultracentrifugeuse Coat (Tubes à centrifuger Beckman # 363664) avec 10 ml de solution de revêtement de 1% de BSA / PBS. Reboucher les tubes et les laisser tourner pendant 30 min dans un rotateur tube. Retirer la solution de revêtement et de laisser la centrifugeuse tubes d'air sec (un tube par cœur de la souris est nécessaire pour l'analyse des cœurs de souris, en alternance jusqu'à 5 cœurs de souris ou 1 g de tissu cardiaque d'une espèce différente (par exemple l'homme) peuvent être traitées dans un tube).
- Toutes les étapes suivantes doivent être effectuées sur la glace. Disséquer le ventricule gauche du cœur de souris frais ou congelés composant logiciel enfichable avec un scalpel. Remarque, ce protocole est optimisé pour le coeur de la souris, mais peut également être adapté pour le rat ou le cœur humain. Vous pouvez également utiliser jusqu'à 1 g de tissu cardiaque d'une espèce différente.
- Couper l'échantillon dans de petites cabines avec un scalpel.
- Transférer les morceaux de tissus dans un tube Falcon de 50 ml remplie avec 15 ml de tampon de lyse.
- Homogénéiser letissu cardiaque avec un T-25 homogénéisateur Ultra-Turrax sonde (IKA) à 24.000 tours par minute pendant 10 sec.
- Diluer l'homogénat avec un volume égal de tampon de lyse à 30 ml.
- Utilisez un verre (40 ml) de continuer à douncer homogénéiser le tissu et sans les noyaux. Effectuer huit coups avec un pilon grand débattement.
- Passez les noyaux brut d'isoler par le biais de 100 um et 70 um en maille de nylon cellule crépine (BD Biosciences), consécutivement.
- Isoler les noyaux brut d'isoler dans une centrifugeuse réfrigérée (4 ° C) à 700 xg pendant 10 min.
- Eliminer le surnageant soigneusement en inversant les tubes et essuyez l'intérieur du tube avec un papier absorbant. Veillez à ne pas perturber le culot des noyaux.
- Dissoudre les noyaux brut isoler dans 5 ml de tampon de saccharose par la solution de pipetage plusieurs fois de haut en bas. Ajouter un nouveau 25 ml de tampon de saccharose à l'dissous culot.
- Ajouter 10 ml de tampon de saccharose fraîchement préparée à l'enduit tube d'ultracentrifugation (voir l'étape 1.1).
- Soigneusement superposer l'ajoute 10 ml de tampon de saccharose, avec les noyaux culot remis en suspension dans un tampon de saccharose dissous de l'étape 1.9.
- Équilibrer les tubes à centrifuger avant de les placer dans un rotor oscillant JS13.1 libre et placer le rotor dans une centrifugeuse à grande vitesse (Beckman Avanti S-25).
- Spin de l'échantillon noyaux à 13.000 xg à 4 ° C pendant 60 min.
- Lorsque la rotation est terminée, enlever les tubes soigneusement du rotor et jeter le surnageant en inversant les tubes et en essuyant le reste des débris de l'intérieur des tubes avec une serviette en papier.
- Dissoudre le culot dans 1 ml de noyaux tampon de stockage des noyaux (NSB, plus de tampon). Remarque: NSB, plus contient 1,5 mM de spermine comme stabilisant l'ADN.
- Passez à l'étape 2.1, immunomarquage des noyaux des cardiomyocytes.
2. Immunocoloration de cytométrie en flux
- Préparer le contrôle négatif pour immunocoloration. Prélever une partie aliquote de 20 sur ul de l'échantillon noyaux et unjj 980 ul de NSB, plus de mémoire tampon.
- Ajouter anti-péricentriolaire matériau 1 anticorps (anticorps de lapin anti-PCM-1, Anticorps Atlas) à l'échantillon des noyaux dans une dilution de 1:500 à immunolabel noyaux des cardiomyocytes. Ajouter l'anticorps d'isotype dans la même dilution que l'anticorps anti-PCM-1 au témoin négatif, préparé à l'étape 2.1.
- Incuber contrôle négatif et le tube échantillon à 4 ° C pendant la nuit.
- Laver l'échantillon témoin négatif et au moins une fois avec NSB, plus de tampon (spin down tubes dans une centrifugeuse réfrigérée (4 ° C) à 700 xg pendant 10 min. Rejeter le surnageant et dissoudre le culot des noyaux dans 1 ml de NSB, plus de tampon).
- Ajouter anticorps anti-lapin secondaire fluorescent (FITC ou APC) à un contrôle négatif et le tube échantillon dans une dilution de 1:1000.
- Incuber témoin négatif et le tube d'échantillon à 4 ° C pendant 1 h.
- Laver l'échantillon témoin négatif et au moins une fois avec NSB, plus de tampon (spin down tubes dans une centrifugeuse réfrigérée (4 ° C) à 700 xg pendant 10 min. Rejeter le surnageant et dissoudre le culot des noyaux dans 1 ml de NSB, plus de tampon).
- Procéder à l'analyse par cytométrie en flux et tri.
3. Cytométrie en flux
- Tubes Coat noyaux de collecte (Falcon 15 ml) avec 1% de BSA / PBS solution avant de commencer le tri par cytométrie en flux, comme décrit dans l'étape 1.1.
- Filtrer l'échantillon et le témoin négatif à travers un tamis de cellules um 30 et charger la première témoin négatif à l'cytomètre de flux (Afflux BD). Définir la grille des premier et second à définir les noyaux et les maillots (noyaux unique), sur la base de diffusion vers l'avant (FSC), avant de largeur d'impulsion de dispersion (FS largeur d'impulsion) et dispersion latérale (SSC) (fig. 2a et b). Ajout d'un ADN tache (DRAQ5 (1:500)) à l'échantillon peut aider à identifier la population des noyaux initialement.
- Chargez l'échantillon immunomarquées et de définir la troisième porte d'isoler les noyaux des cardiomyocytes (PCM-1-positve) de non-cardiomyocytes noyaux (PCM-1-négative). Démarrez le tri(Fig. 2c et d).
Facultatif: Dans le but d'analyser la teneur en ADN nucléaire (ploïdie) et d'effectuer une analyse du cycle cellulaire ajouter un ADN approprié tache pour les noyaux (par exemple Hoechst 33342 ou DRAQ5) (Fig. 2e).
- Après le tri par cytométrie en flux, placer les noyaux sur la glace et ré-analyser pour déterminer la pureté de tri (Fig. 3a et b).
- Isoler les noyaux triés dans les tubes de prélèvement à 1500 xg dans une centrifugeuse réfrigérée pendant 15 min.
- Dissoudre l'extrait noyaux dans un tampon compatible avec l'application en aval.
4. Les résultats représentatifs
La morphologie des noyaux et l'intégrité peut être évaluée par des taches d'ADN et visualisés par microscopie (Fig. 1). Succès PCM-1 étiquetage peut être évaluée par microscopie à épifluorescence et par cytométrie en flux (Fig. 1 et Fig. 2c et d). PCM-1-positive et les populations négatives devraient être bien séparés les uns des autres (Fig. 2c et d). Dans ventricule gauche murin environ 30% de tous les noyaux doit être noyaux cardiomyocytes (figure 2d). Tri pureté peut être évaluée par une nouvelle analyse des noyaux triés (Fig. 3a et b). Les deux populations des noyaux doit avoir une pureté supérieure à 95% de tri.
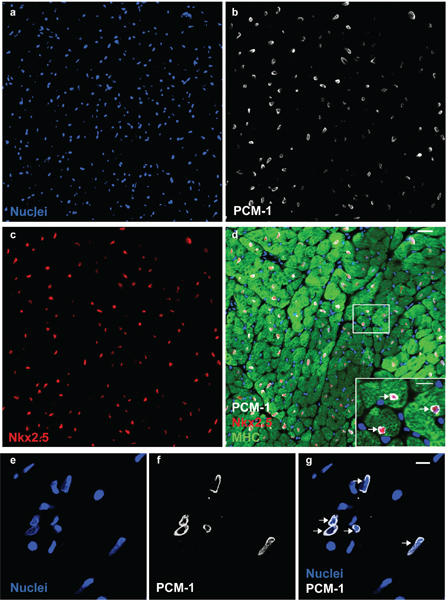
Figure 1. PCM-1 identifie les noyaux des cardiomyocytes. Noyaux cardiaque (a) sont colorées avec des anticorps à PCM-1 (b) et à Nkx2.5 (c) dans un coeur de souris adultes. (D) PCM-1-étiquetés noyaux sont entourés par le cytoplasme des cardiomyocytes (chaîne lourde de myosine (MHC)) et d'exprimer le facteur de transcription Nkx2.5, documenter l'identification exacte des noyaux des cardiomyocytes par PCM-1 coloration (barres d'échelle de 20 um et 10 um (d, en médaillon)). (E) des isolats noyaux cardiaques visualisés avec le colorant ADN DRAQ5. (F et g) Cardiomyocnoyaux YTE sont étiquetés avec des anticorps contre MIC-1 (échelle de barre de 10 um). Remarque, le schéma de coloration epinuclear de PCM-1 dans les noyaux des myocytes dans la section des tissus et dans les noyaux isolés (flèches).
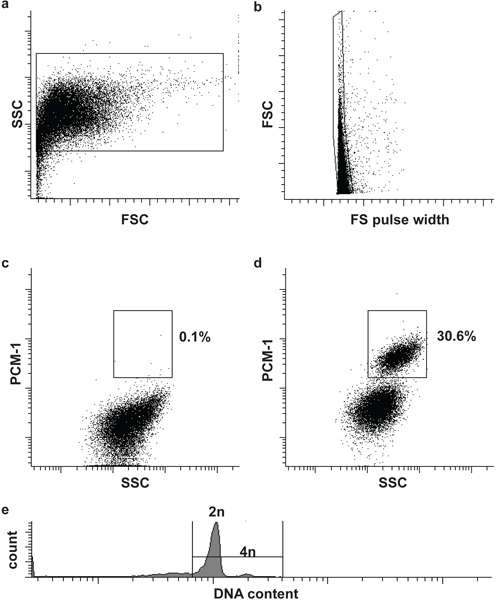
Figure 2. Tri par cytométrie en flux des noyaux des cardiomyocytes. (A) des noyaux cardiaque sont identifiés par diffusion vers l'avant (FSC) et sur le côté de dispersion (SSC). (B) Un deuxième porte identifie noyaux unique par le FSC et FS de largeur d'impulsion 5. (C, d) de déclenchement fluorescent permet la séparation des noyaux des cardiomyocytes (PCM-1-positif) et non-cardiomyocytes (PCM-1-négative) des noyaux de tissu cardiaque. (E) des cardiomyocytes de souris sont pour la plupart (> 80%) diploïde (2n), seul un petit sous-ensemble est tétraploïde (4n) 6. Remarque, les cardiomyocytes humains contiennent une fréquence plus élevée de noyaux polyploïdie (> 2n) 7,8.

Figure 3. Analyse de la pureté des noyaux des cardiomyocytes et non des cardiomyocytes triés. Re-analyse des noyaux non-cardiomyocytes (a) et des cardiomyocytes triés (b). Les deux populations montrent une pureté supérieure à 99% de tri.
Discussion
L'identification précise des noyaux des cardiomyocytes est crucial pour l'analyse des processus de régénération dans le myocarde 2,3. Les techniques conventionnelles pour isoler les cardiomyocytes des tissus frais sont principalement basées sur la digestion enzymatique des protéines de la matrice extracellulaire et la purification ultérieure à partir de cellules interstitielles par centrifugation à faible vitesse. Une purification supplémentaire des cardiomyocytes vivant à partir de cellule...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous tenons à remercier Marcelo Toro pour l'aide à la cytométrie en flux. Cette étude a été soutenue par le Suédois coeur et du poumon Fondation, la Commission européenne FP7 "CardioCell", Conseil de recherche suédois, AFA assurances et ALF. OB a été soutenu par la Deutsche Forschungsgemeinschaft.
matériels
| Name | Company | Catalog Number | Comments |
| 1. Tampon de lyse | |||
| Nom du réactif | |||
| 0,32 M de saccharose | |||
| 10 mM de Tris-HCl (pH = 8) | |||
| 5 mM de CaCl 2 | |||
| 5 mM d'acétate de magnésium | |||
| 2,0 mM d'EDTA | |||
| 0,5 mM EGTA | |||
| DTT 1 mM |
| 2. Tampon saccharose |
| Nom du réactif |
| 2,1 M de saccharose |
| 10 mM de Tris-HCl (pH = 8) |
| 5 mM d'acétate de magnésium |
| DTT 1 mM |
| 3. Tampon de stockage des noyaux (NSB plus) |
| Nom du réactif |
| 0,44 M de saccharose |
| 10 mM de Tris-HCl (pH = 7,2) |
| 70 mM de KCl |
| 10 mM MgCl 2 |
| 1,5 mM de spermine |
| Réactifs et appareillage | Entreprise |
| Isotype IgG de lapin-ChIP Grade, # ab37415 | Abcam |
| De lapin anti-PCM-1 anticorps, # HPA023374 | Anticorps Atlas |
| Ane sec. un anticorps anti-lapin Alexa 488 Fluor, # A-21206 ou l'équivalent sec. immunofluorescence | Life Technologies |
| DRAQ5 | Biostatus |
| crépines de cellules de 30 um, 70 um et 100 um | BD Biosciences |
| Verre douncer (40 ml) etpilon "L" | VWR (Wheaton Industries Inc) |
| T-25 Ultra-Turrax Homogénéisateur | IKA Allemagne |
| Outil de dispersion S25 N-18 G | IKA Allemagne |
| Beckman Avanti Centrifugeuse | Beckman Coulter |
| Falcon tubes 15 ml et 50 ml | VWR |
| Tubes à centrifuger Beckman # 363664 | Beckman Coulter |
| JS13.1 rotor oscillation libre | Beckman Coulter |
| Afflux cytomètre | Beckman Coulter |
| Rotator Tube | VWR |
Références
- Ang, K. L. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. American journal of physiology. Cell physiology. , 298-1603 (2010).
- Bergmann, O. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Experimental cell research. 327, 188-194 (2011).
- Bergmann, O. Evidence for Cardiomyocyte Renewal in Humans. Science. 324, 98-102 (1126).
- Walsh, S. Cardiomyocyte cell cycle control and growth estimation. Cardiovascular Research. , 1-31 (2010).
- Spalding, K., Bhardwaj, R. D., Buchholz, B., Druid, H., Frisén, J. Retrospective birth dating of cells in humans. Cell. 122, 133-143 (2005).
- Adler, C. P., Friedburg, H., Herget, G. W., Neuburger, M., Schwalb, H. Variability of cardiomyocyte DNA content, ploidy level and nuclear number in mammalian hearts. Virchows Arch. 429, 159-164 (1996).
- Herget, G. W., Neuburger, M., Plagwitz, R., Adler, C. P. DNA content, ploidy level and number of nuclei in the human heart after myocardial infarction. Cardiovascular Research. 36, 45-51 (1997).
- Adler, C. P., Friedburg, H. Myocardial DNA content. ploidy level and cell number in geriatric hearts: postmortem examinations of human myocardium in old age. Mol. Cell Cardiol. 18, 3953-39 (1986).
- Dubois, N. C. SIRPA is a specific cell-surface marker for isolating cardiomyocytes derived from human pluripotent stem cells. Nature. 29, 1011-1018 (2011).
- Hattori, F. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7, 61-66 (2010).
- Fransioli, J. Evolution of the c-kit-Positive Cell Response to Pathological Challenge in the Myocardium. Stem Cells. 26, 1315-1324 (2008).
- Elliott, D. A. NKX2-5(eGFP/w) hESCs for isolation of human cardiac progenitors and cardiomyocytes. Nature Methods. 8, 1037-1040 (2011).
- Laflamme, M. A. Evidence for Cardiomyocyte Repopulation by Extracardiac Progenitors in Transplanted Human Hearts. Circulation Research. 90, 634-640 (2002).
- Srsen, V., Fant, X., Heald, R., Rabouille, C., Merdes, A. Centrosome proteins form an insoluble perinuclear matrix during muscle cell differentiation. BMC cell biology. 10, 28 (2009).
- Spoelgen, R. A novel flow cytometry-based technique to measure adult neurogenesis in the brain. Journal of neurochemistry. 119, 165-175 (2011).
- Soonpaa, M. H., Kim, K. K., Pajak, L., Franklin, M., Field, L. J. Cardiomyocyte DNA synthesis and binucleation during murine development. The American journal of physiology. 271, H2183-H2189 (1996).
- Olivetti, G. Aging, cardiac hypertrophy and ischemic cardiomyopathy do not affect the proportion of mononucleated and multinucleated myocytes in the human heart. J Mol Cell Cardiol. 28, 1463-1477 (1996).
- Okada, S. Flow cytometric sorting of neuronal and glial nuclei from central nervous system tissue. Journal of cellular physiology. 226, 552-558 (2011).
- Matevossian, A., Akbarian, S. Neuronal Nuclei Isolation from Human Postmortem Brain Tissue. J. Vis. Exp. (20), e914 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon