Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un test de perméabilité du neuro-épithélium embryonnaire poisson zèbre
Dans cet article
Résumé
Nous décrivons une mesure animal vivant ensemble quantitative de la perméabilité du cerveau du poisson zèbre embryonnaire. La technique analyse la capacité à retenir le liquide céphalorachidien et les molécules de poids moléculaires différents dans la lumière du tube neural et quantifie leur mouvement hors des ventricules. Cette méthode est utile pour déterminer les différences de perméabilité épithéliale et la maturation au cours du développement et de la maladie.
Résumé
Le système ventriculaire du cerveau est conservée chez les vertébrés et est composé d'une série de cavités interconnectées appelées ventricules du cerveau, qui forment dès les premières étapes du développement du cerveau et sont maintenus tout au long de la vie de l'animal. Le système ventriculaire du cerveau est trouvé chez les vertébrés, et les ventricules se développer après la formation du tube neural, lorsque la lumière centrale se remplit de liquide céphalo-rachidien (LCR) 1,2. Le LCR est un liquide riche en protéine qui est essentielle pour le développement normal du cerveau et la fonction 3-6.
Chez le poisson zèbre, l'inflation ventricule cérébral commence à environ 18 h après la fécondation (HPF), après que le tube neural se ferme. Plusieurs processus sont associés à la formation ventricule cérébral, y compris la formation d'un neuro-épithélium, la formation des jonctions serrées qui régule la perméabilité et la production de CSF. Nous avons montré que la Na, K-ATPase est nécessaire pour l'inflation ventricule cérébral, affectant tous ces processuses 7,8, tandis que la claudine 5a est nécessaire pour la formation des jonctions serrées 9. De plus, nous avons montré que «détente» du neuro-épithélium embryonnaire, par l'intermédiaire de l'inhibition de la myosine, est lié à l'inflation ventricule cérébral.
Pour étudier la régulation de la perméabilité lors du gonflage du poisson zèbre ventricule cérébral, nous avons développé un test de rétention ventriculaire colorant. Cette méthode utilise l'injection ventricule cérébral chez l'embryon du poisson zèbre vivant, une technique développée précédemment dans notre laboratoire 10, à fluorescence étiqueter le liquide céphalo-rachidien. Les embryons sont ensuite imagée au fil du temps à mesure que le colorant fluorescent à travers les ventricules cérébraux et neuro-épithélium. La distance de la face de colorant s'éloigne de la base (non luminale) du côté neuroépithélium dans le temps est quantifiée et est une mesure de la perméabilité neuroépithéliale (figure 1). Nous observons que les colorants et les petits 70 kDa se déplacera à travers la neuro-épithélium et peut être detected en dehors du cerveau embryonnaire du poisson zèbre à 24 hpf (Figure 2).
Ce test de rétention colorant peut être utilisé pour analyser la perméabilité neuroépithéliale dans une variété de contextes génétiques différents, à des moments différents au cours du développement, et après perturbations de l'environnement. Il peut également être utile dans l'examen de l'accumulation pathologique de la CSF. Dans l'ensemble, cette technique permet aux chercheurs d'analyser le rôle et la régulation de la perméabilité au cours du développement et de la maladie.
Protocole
1. Préparation de la micro-injection
- Préparer aiguilles de microinjection en tirant des tubes capillaires en utilisant extracteur Sutter aiguille instruments.
- Aiguille microinjection charge par un colorant fluorescent (FITC-Dextran).
- Monter sur l'aiguille et un dispositif de micro-injection micromanipulateur.
- Cassez délicatement l'aiguille de micro-injection en utilisant une pince à environ 2 microns de largeur, cependant, cela peut varier selon la configuration de votre microinjecteur. Pour nos aiguilles de microinjection, ce qui correspond à la première région de l'aiguille de la pointe qui ne se plie pas.
- Mesurer la taille des gouttes dans de l'huile, le réglage du temps d'injection et de pression, de telle sorte que chaque dose administrée 1 nl. Exemple de réglages pour Harvard Apparatus microinjecteur sont: l'équilibre P = 1,4 psi, P out = 1,4 psi, P = 22,9 psi injecter, P = 67,8 psi claires avec un temps d'injection de 0,4 à 0.7 sec. Le diamètre de notre aiguille à l'aide de ces paramètres est d'environ 2 microns. Cependant, les paramètres seront microinjecteur spécifique, et varient d'unelon l'aiguille de diamètre.
2. Préparation des embryons
- Manteau de 2 plats avec 1% d'agarose dans de l'eau pour chaque condition, faire des trous dans l'agarose avec une pointe de pipette 1-200 ul, et enlever les bouchons d'agarose. Remplissez plats avec les médias d'embryons.
- Utilisation de forceps, des embryons dechorionate qui ont 18 ans ou plus hpf sous un stéréomicroscope. Les embryons sont mis en scène selon Kimmel et coll. 11.
- Transfert d'embryons dechorionated en agarose premier plat couché.
- Pour anesthésier embryons, ajouter tricaïne (0,1 mg / ml) à la parabole jusqu'à ce que les embryons s'immobilisent (faite en fonction Westerfield 12).
3. L'injection des ventricules cérébraux
- Embryons Orient de sorte que vous êtes à la recherche à leur face dorsale en plaçant la queue de l'embryon dans le trou. Si votre micromanipulateur est sur la droite, puis déplacez l'embryon de sorte que le cerveau antérieur est vers la gauche et vers la droite du cerveau postérieur.
- Position de l'aiguille au wipoint de dest du ventricule du cerveau postérieur.
- Soigneusement toit en tôle percer le cerveau postérieur du ventricule étant sûr de ne pas passer par la profondeur du cerveau dans le jaune (figure 1A).
- Injecter 1-2 nl de colorant fluorescent dans les ventricules en s'assurant que le colorant remplit toute la longueur des ventricules du cerveau.
- Transfert d'embryons dans le plat recouvert d'agarose seconde rempli avec les médias d'embryons et de ré-anesthésier comme décrit au paragraphe 2.4.
- IMMÉDIATEMENT commencer imagerie, comme décrit dans la section 4 pour obtenir une image temps zéro.
4. Imagerie
- Embryons Orient avec leur queue dans le trou tel que décrit à la section 3.1.
- Utilisez une loupe binoculaire avec éclairage à la fois émis et fluorescent pour prendre une image dorsale fond clair. Gardez l'agrandissement constant entre l'imagerie d'embryons différents. Cela permet une comparaison directe des analyses effectuées à l'aide Image J (5,2 à 6).
- Sans déplacer l'embryon, un microscope ou un plat, prendre uncorrespondant image fluorescente.
- Répétez l'opération pour chaque embryon à des moments souhaités.
5. Quantification du Mouvement Dye
- Fusionner clair et des images fluorescentes dans Photoshop comme décrit précédemment par Gutzman et Sive 10.
- Mesurer la distance de déplacement avant de colorant dans le logiciel Image J disponible à http://rsbweb.nih.gov/ij/ .
- Ouvrir le fichier fusionné dans l'image J et utilisez l'outil Ligne pour tracer une ligne dans le cerveau antérieur charnière du point de teindre avant selon un angle de 10-20 ° neuroépithélium (figure 1A). Cette région a été choisie parce qu'elle est le premier site et le plus visible de colorant s'échappe du neuro-épithélium de type sauvage.
- Sélectionnez l'outil de mesure pour calculer la longueur de la ligne.
- Répétez l'opération pour chaque point dans le temps.
- Calculer la distance nette que le front déplacé au fil du temps en soustrayant la distance à t = 0 à partir d'autres moments.
- Terrain surgraphique.
6. Les résultats représentatifs
Un exemple des résultats obtenus dans un essai de perméabilité neuroépithéliale utilisant des embryons de type sauvage est montré dans la figure 1B-D. Afin de bien différencier la perméabilité, il est utile de tester les colorants avec weightsto moléculaire différente identifier une taille qui est seulement légère fuite de type sauvage ou d'embryons de contrôle (Figure 2). Cela permet d'identifier des mutants génétiques ou les conditions environnementales qui augmentent ou diminution de la perméabilité (figure 1D, vert et lignes rouges respectivement). Pour le poisson-zèbre neuroépithélium 24 hpf, 70 kDa FITC Dextran fuites lentement en 2 heures, alors que 2.000 kDa ne fonctionne pas et 10 kDa presque immédiatement les fuites à l'extérieur. Donc de 70 kDa est le poids idéal moléculaire pour identifier des situations à la fois augmenter et diminuer la perméabilité neuroépithéliale.
Si l'aiguille manque la lumière ventriculaire, la fluorescence wmalades apparaissent en dehors du cerveau à l'instant t = 0 (pour un exemple, voir Gutzman et Sive, 2009 10). Ces embryons doivent être mis au rebut depuis le colorant injecté n'a pas été initialement contenue dans le cerveau et aucune conclusion claire concernant le mouvement de la teinture et de la perméabilité de la neuropeithelium peuvent être faites.
Enfin, si les embryons ont ventricules du cerveau ou ventricules petits non gonflés, pré-injection des ventricules avec une solution saline peut être fait avant l'injection du colorant fluorescent. Ce faisant gonfler les ventricules visualisation ultérieure des ventricules plus facile lors de l'injection avec le colorant fluorescent. Des contrôles appropriés doivent être effectués afin de déterminer si l'injection d'une solution saline normale perturbe le développement du tube neural.
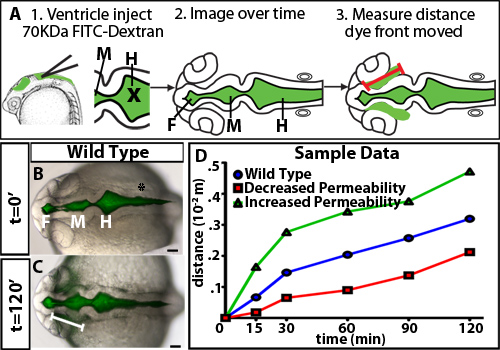
Figure 1. Évolution dans le temps des différents colorants poids moléculaire. (A) Schéma expérimental. Premier, Colorant fluorescent est injecté dans les ventricules. X = position de l'aiguille pour injection. Suivant dorsales images sont capturées au fil du temps. Enfin, la distance parcourue par le front de colorant à partir de la charnière du cerveau antérieur de consigne est mesuré (représenté par une ligne rouge). (Colombie-Britannique) Fusionné clair et images fluorescentes dorsales à 22 hpf (t = 0 min, B) et 24 hpf (t = 120 min, C). Ligne blanche indique la distance de la face de colorant à partir de cerveau antérieur ventricule. (D) hypothétiques données de perméabilité de l'échantillon. Bleu = type sauvage ou contrôles, rouge = échantillon avec diminution de la perméabilité par rapport au contrôle, et vert = échantillon avec une perméabilité accrue par rapport au contrôle.
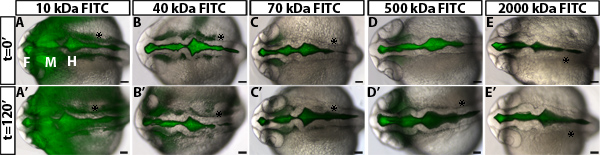
Figure 2. Mesure de la perméabilité à neuroépithéliale différents colorants poids moléculaire. (AE) sur fond clair dorsale issue de la fusion des images fluorescentes et d'embryons HPF 22 de type sauvage à t = 0 min après l'injection de FITC-dExtran des poids moléculaires suivants: 10 kDa (A), 40 kDa (B), 70 kDa (C), 500 kDa (D) et 2.000 kDa (E). (A'-E ') embryon même que dans (AE) à t = 120 min à 24 hpf. En avant de gauche. F = prosencéphale, mésencéphale M = H = rhombencéphale. Asterisk = oreille.
Discussion
Nous démontrons la capacité de quantifier la perméabilité du cerveau embryonnaire du poisson zèbre vivant tel que déterminé pour un produit de contraste injecté d'un poids moléculaire donné. Nous avons observé que le poisson-zèbre embryonnaire est neuroépithélium différentielle perméable aux colorants de différentes masses moléculaires indiquent que le colorant se déplace via la perméabilité paracellulaire. Cependant, nous ne pouvons pas exclure la possibilité d'une contribution à la perm?...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été soutenu par l'Institut national pour la santé mentale, et la National Science Foundation. Un merci spécial aux membres de laboratoire Sive pour de nombreuses discussions utiles et des critiques constructives, et à Olivier Paugois pour l'élevage de poissons d'experts.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| Dextrane, la fluorescéine, anionique, Lysine Fixable | Invitrogen | D7136, D7137, D1822, D1820, D1845 | |
| Tricaïne poudre | Sigma | A5040 | |
| Tubes capillaires | FHC Inc | 30-30-1 |
Références
- Harrington, M. J., Hong, E., Brewster, R. Comparative analysis of neurulation: first impressions do not count. Mol. Reprod. Dev. 76, 954-965 (2009).
- Lowery, L. A., Sive, H. Strategies of vertebrate neurulation and a re-evaluation of teleost neural tube formation. Mech. Dev. 121, 1189-1197 (2004).
- Salehi, Z., Mashayekhi, F. The role of cerebrospinal fluid on neural cell survival in the developing chick cerebral cortex: an in vivo study. Eur. J. Neurol. 13, 760-764 (2006).
- Martin, C. Early embryonic brain development in rats requires the trophic influence of cerebrospinal fluid. Int. J. Dev. Neurosci. 27, 733-740 (2009).
- Lehtinen, M. K. The cerebrospinal fluid provides a proliferative niche for neural progenitor cells. Neuron. 69, 893-905 (2011).
- Gato, A. Embryonic cerebrospinal fluid regulates neuroepithelial survival, proliferation, and neurogenesis in chick embryos. Anat. Rec. A. Discov. Mol. Cell Evol. Biol. 284, 475-484 (2005).
- Lowery, L. A., Sive, H. Totally tubular: the mystery behind function and origin of the brain ventricular system. Bioessays. 31, 446-458 (2009).
- Lowery, L. A., Sive, H. Initial formation of zebrafish brain ventricles occurs independently of circulation and requires the nagie oko and snakehead/atp1a1a.1 gene products. Development. 132, 2057-2067 (2005).
- Zhang, J. Establishment of a neuroepithelial barrier by Claudin5a is essential for zebrafish brain ventricular lumen expansion. Proc. Natl. Acad. Sci. U.S.A. 107, 1425-1430 (2010).
- Gutzman, J. H., Sive, H. Zebrafish brain ventricle injection. J. Vis. Exp. , (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev. Dyn. 203, 253-310 (1995).
- Westerfield, M., Sprague, J., Doerry, E., Douglas, S., Grp, Z. The Zebrafish Information Network (ZFIN): a resource for genetic, genomic and developmental research. Nucleic Acids Research. 29, 87-90 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon