Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Kératite herpétique récurrente stromale chez la souris, un modèle pour l'étude de l'homme HSK
Dans cet article
Résumé
La plupart des études de la maladie de la cornée herpétique utiliser un modèle d'infection primaire. Cependant, la primo-infection par le HSV-1 habituellement, n'aboutit pas à la maladie humaine. Nous décrivons ici un modèle récurrent de la maladie herpétique cornée, ce qui rapproche le plus de la maladie humaine.
Résumé
Maladie oculaire herpétique, appelée kératite herpétique stromal (HSK), est une infection potentiellement cécitante de la cornée qui se traduit par plus de 300.000 visites cliniques chaque année pour le traitement. Entre 1 et 2 pour cent de ces patients atteints de la maladie clinique constatez une perte de la vision de la cornée infectée. La grande majorité de ces cas sont le résultat d'une réactivation d'une infection latente par l'herpès simplex virus de type I et non en raison d'une maladie aiguë. Fait intéressant, l'infection aiguë est le modèle le plus souvent utilisé pour étudier cette maladie. Toutefois, il a été estimé que le modèle récurrent de HSK serait plus représentatif de ce qui se passe au cours de la maladie clinique. Les modèles animaux récurrents pour HSK ont employé deux lapins et des souris. L'avantage des lapins est qu'ils éprouvent la réactivation de la latence absence de tout stimulus connu. Cela dit, il est difficile d'étudier le rôle que de nombreux facteurs immunologiques jouer dans HSK récurrente parce que le modèle de lapin n'a pas l'immunitéressources méthodologiques et génétique de la souris a. Nous avons choisi d'utiliser le modèle de souris pour HSK récurrente car elle a l'avantage de l'existence de nombreuses ressources disponibles et aussi savoir quand aura lieu la réactivation parce réactivation est induite par l'exposition aux rayons UV-B. Jusqu'à présent, ce modèle a permis à ces laboratoires de l'utiliser pour définir plusieurs facteurs immunologiques qui sont importantes pour cette maladie. Il nous a également permis de tester à la fois thérapeutique et l'efficacité du vaccin.
Protocole
Remarque protection des animaux: Les analgésiques sont pas utilisées dans ce modèle car ils sont anti-inflammatoires et donc invalider le modèle.
1. Préparation de virus
- Cultiver HSV-1 sur des cellules Vero (80% de confluence) en utilisant une dilution à partir de 0,01 multiplicité d'infection (en fiole T-150, d'environ 5 x 10 5 unités formant plaque) pendant 3-4 jours jusqu'à ce que toutes les cellules ont une rafle et sont facilement délogés en frappant le ballon.
- Retirez le support pour tubes à centrifuger et centrifuger stériles dans Sorvall Legend RT à 4 ° C et 3500 rpm pendant 15 min. Après avoir retiré le surnageant (voir point 1.3), remettre en suspension grand culot de chaque tube de 50 ml avec 5 ml du total des médias. Ultrasons pendant 1 min en rafales deux 30 sec.
- Retirer le surnageant et mettre en tubes de 50 ml stériles Oak Ridge et centrifuger à 9000 tours par minute, pendant 1 h à 4 ° C dans un Beckman J2-21 centrifugeuse. Il s'agit de produire une petite pastille virale. Jeter le surnageant.
- Combinez une sonication de 1,2 esprith à granulés de 1,3 et soniquer à nouveau pendant 45 secondes. Centrifugeuse à Sorvall Legend RT à 1500 rpm pendant 5 min à 4 ° C. Enregistrez le surnageant. Ceci constitue le stock de virus qui est aliquoté et conservé à -70 ° C.
- Titre viral sur cellules Vero. J'ai l'habitude de plaque de 10 0 à 10 -8 à dilution (chacune étant une dilution de 10 fois) 2x à partir de 2 séries de dilution distincts. Titrage du virus est effectuée sur des plaques 12 puits stériles.
2. L'infection de la souris
- Injecter chaque souris avec 0,1 ml d'anesthésique cocktail/20 g de poids corporel de la souris (kétamine, 60 mg / kg de xylazine + 5 mg / kg, ce qui est dilué dans du HBSS). Ce cocktail est utilisé parce qu'il est l'un des moyens les plus sûrs de l'anesthésie lors de dosages appropriés sont utilisés et les effets de cette drogue sont de très courte durée.
- Lorsque les souris sont anesthésiées rayer la cornée de l'oeil droit avec une aiguille de calibre 30 à l'aide d'un microscope à dissection pour faire en sorte que la cornée n'est pas perforé.
- Chaque rece sourisIVED une injection intrapéritonéale de 1 ml de sérum humain mis en commun (Sigma, Temecula, en Californie, anti-HSV réactivité avec une dose efficace pour la neutralisation virale de 50% de 1:800) afin de protéger la cornée des dommages pendant la primo-infection.
- Nombre des souris avec des clips d'oreille à l'oreille l'un ou coup de poing.
- Après toutes les souris ont été numérotées; aide d'une pipette 20 ul, nous infecter chaque œil avec 10 6 PFU (5 pi). Nous infecter un seul œil et l'œil droit en général. Nous mettons également 5 ul de HBSS à l'autre oeil pour le garder humide pendant qu'ils sont anesthésiés. 5 ul est suffisant pour maintenir l'hydratation des yeux, car les procédures sont exécutées en moins de 10 min, et les animaux sont dosés avec un anesthésique en conséquence. L'infection est confirmée par écouvillonnage souris 3 jours post-infection avec un coton stérile qui a été hydraté dans 1 ml de milieu de Vero. Puis 100 ul est ajouté aux cellules Vero cultivées en plaques 48 puits. Ces plaques sont la surveillance quotidienne des effets cytopathiques (Cpe).
3. La réactivation de la latence de souris
- Les souris sont anesthésiées au moins 5 semaines après la primo-infection. Il convient de noter que nous avons réactivé la souris jusqu'à un an suivant la primo-infection et n'ont pas observé de différences significatives dans la réponse.
- Une fois anesthésié, ils sont placés TM20 Chromato-Vu transilluminateur, qui émet des UV-B à une longueur d'onde maximale de 302 nm de telle sorte que seulement un seul oeil est exposé à la lumière UV-B. Chaque souris est exposé à la lumière 250 cm mJ d'UV-B 2.
- La réactivation est déterminée par écouvillonnage yeux avec applicateur de coton stérile qui est d'abord placé dans 1 ml de milieu de Vero au jour 0 (avant l'exposition UV-B pour tenir compte des excréteurs spontanées), puis sur les jours 1 à 7 post-irradiation UV-B. Le matériau tampon est évaluée comme décrit dans l'2,5). Pour les prélèvements qui ont le virus infectieux de la quantité de virus est titré par une analyse de la plaque standard à l'aide plaques de 12 puits.
- Les souris sont évalués pour maladie de l'œil clinique par un observateur masquée à l'aide d'un microscope binoculaire de dissection.
- Opacité de la cornée est évalué sur une échelle de 0 à 4, où 0 indique clairement stroma, 1 indique une légère opacification stromale, 2 indique une opacité modérée avec des caractéristiques discernables iris, 3 indique une opacité dense, avec une perte de détails iris défini, sauf marges d'élèves, et 4 indique opacité la plus totale, sans vue postérieure.
- La néovascularisation est évalué sur une échelle de 1 à 8 en divisant la cornée en 4 quadrants égaux et déterminer l'étendue de la vascularisation dans chacun de ces quadrants.
- Blépharite est mesurée comme suit: 0, pas de lésions; 1, paupière gonflement minimal; 2, décharge modérée oculaire gonflement et croustillant; 3, un gonflement sévère, modérée perte de cheveux périoculaire, et des lésions cutanées, et 4, un gonflement sévère avec robinet yeux en croûte, sévère perte de cheveux périoculaire, et des lésions cutanées.
- Preuve de l'encéphalite included dos voûté, les cheveux ébouriffés, et des anomalies neurologiques évidentes. Les souris sont euthanasiées quand ils affichent des signes importants de l'encéphalite.
5. Les résultats représentatifs
Le modèle récurrent qui a été décrit ci-dessus a été publié par Shimeld, et al. 1-3. Ils ont testé et notre laboratoire a utilisé une version modifiée de ce modèle de publier de nombreux manuscrits sur les 4-15 ans. Le modèle a été utilisé pour définir le rôle que la cytokine interféron γ-jeux dans récurrente HSV-1 maladie 10. Comme le montre la figure 3, les souris dépourvues IFN affiché pire maladie de la cornée que ne souris de type sauvage 14. Il a également été utilisé avec succès pour définir la valeur thérapeutique du vaccin différent construit plusieurs 6,10,11. Notez que dans un cas, le vaccin testé a bien fonctionné prophylactique mais n'a pas prouvé pour être thérapeutiquement efficace 6. Cependant,quand un vaccin incompétent pour la réplication virale a été testé, il était non seulement efficace en prophylaxie, mais il était aussi très efficace thérapeutiquement 10,11, voir figure 5 dans la référence 10. Plus récemment, nous avons utilisé ce modèle pour déterminer si les différences entre les sexes étaient détectables chez des souris subissant HSK récurrente. Comme la figure 1 le montre, des souris mâles C57BL / 6 afficher l'opacité cornéenne beaucoup moins que ne le font C57BL / 6 femelles souris. De même, lorsque la néovascularisation cornéenne a été évaluée, les souris mâles ont démontré la croissance des vaisseaux beaucoup moins nouvelle dans la cornée que ne souris femelles (figure 2). Nous sommes en train de tester si ce phénotype est spécifique de la souche en effectuant une analyse similaire dans d'autres souches de souris. Nous allons également déterminer si la différence est due à l'absence de testostérone ou la présence d'œstrogènes.
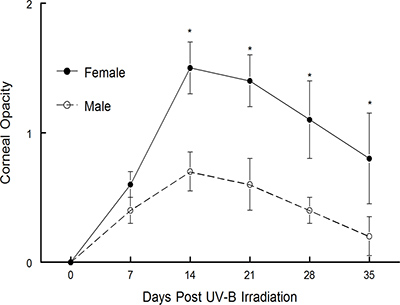
Figure 1. Maladie de la cornée des souris C57BL mâle et femelle / 6 souches de souris à la suite d'UV-B réactivation induite. Souris infectées de façon latente ont été amenés à réactiver avec UV-B et les souris ont été suivis pendant une opacité cornéenne pendant 35 jours. Le nombre de souris utilisées pour ces études étaient les suivants: hommes, n = 15; femmes, n = 15. Les résultats indiquent la moyenne ± SEM. * Il était significativement plus élevée induite par le virus maladie chez les souris C57BL / 6 femelles pour les jours de 14 à 35 (P = 0,001 à 0,01).
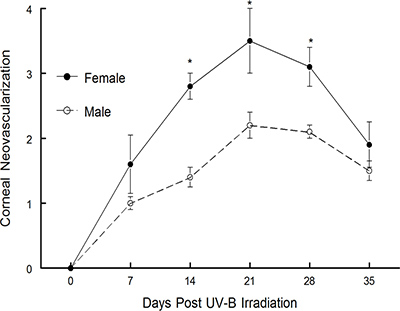
Figure 2. Maladie de la cornée des souris C57BL mâle et femelle / 6 souches de souris à la suite d'UV-B réactivation induite. Souris infectées de façon latente ont été amenés à réactiver avec UV-B et les souris ont été suivis pendant une néovascularisation cornéenne pendant 35 jours. Le nombre de souris utilisées pour ces études étaient les suivants: hommes, n= 15; femmes, n = 15. Les résultats indiquent la moyenne ± SEM. * Il était significativement plus élevée induite par le virus maladie chez les souris C57BL / 6 femelles pour les jours de 14 à 28 (P = 0,001 à 0,01).
Discussion
Le modèle récurrent de kératite stromale herpétique (HSK) décrit ici permet à l'enquêteur d'étudier HSK humain dans un modèle qui est plus conforme à ce qui est observé au cours de la maladie humaine. Ainsi, les forces du modèle sont que la maladie se produit dans le cadre d'un système immunitaire qui a déjà stimulé par la maladie pendant primaire. Étant donné que ces souris ont déjà une réponse immunitaire contre le HSV-1, les facteurs qui réactivent que la réponse immunitaire sont pr...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier le Dr Jay Pepose pour aider l'enseignement du modèle pour nous. Ce travail a été soutenu par des subventions des National Institutes of Health EY11885 (PMS), EY21247 (PMS) et une subvention sans restriction de Research to Prevent Blindness au Département d'ophtalmologie.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM | Sigma | D5796 | |
| Fetal Bovine Serum | Atlanta Biologicals | S11150 | |
| Human Serum | Sigma | S7023 | |
| L-Glutamine | Cellgro | 25-005-C1 | |
| Pen/ Strep | Sigma | P4333 | |
| Fungizone | Invitrogen | 15290018 | |
| Centrifuge | Sorvall | Legend RT | |
| Centrifuge | Beckman | 52-21 | |
| Transilluminatior | UVP | 95-0452-02 | |
| Sonicatior | Branson | Sonifier 450 | |
| Oak Ridge Tubes | Nalgene | Z 720410 | |
| Flasks- 7150 | Corning | 430823 | |
| Plates- 12 well | Corning | CLS 3513 | |
| Plates- 48 well | Corning | CLS 3548 | |
| Sterile Conical Tubes- 30 ml | Corning | CLS 430828 | |
| Sterile Cotton-tipped Applicators | Fisher | 23-400-125 | |
| 30G Needles | Becton-Dickinson | 305106 | |
| 25G Needles | BD | 305122 | |
| 10 ml Syringe | BD | 309602 | |
| 10 ml Syringe | BD | 309604 |
Références
- Shimeld, C., Hill, T. J., Blyth, B., Easty, D. An improved model of recurrent herpetic eye disease in mice. Curr. Eye Res. 8, 1193-1205 (1989).
- Shimeld, C., Hill, T. J., Blyth, W. A., Easty, D. L. Reactivation of latent infection and induction of recurrent herpetic eye disease in mice. J. Gen. Virol. 71, 397-404 (1990).
- Shimeld, C., Hill, T. J., Blyth, W. A., Easty, D. L. Passive immunization protects the mouse eye from damage after herpes simplex virus infection by limiting spread of virus in the nervous system. J. Gen. Virol. 71, 681-687 (1990).
- Laycock, K. A., Lee, S. F., Brady, R. H., Pepose, J. S. Characterization of a murine model of recurrent herpes simplex viral keratitis induced by ultraviolet B radiation. Invest. Ophthalmol. Vis. Sci. 32, 2741-2746 (1991).
- Keadle, T. L., Stuart, P. M. IL-10 ameliorates corneal disease in a mouse model of recurrent herpetic keratitis. Microbial Path. 38, 13-21 (2005).
- Keadle, T. L., Laycock, K. A., Miller, J. K., Hook, K. K., Fenoglio, E. D., Francotte, M., Slaoui, M., Stuart, P. M., Pepose, J. S. Efficacy of a recombinant glycoprotein D subunit vaccine on the development of primary and recurrent ocular infection with herpes simplex virus type 1 in mice. J. Inf. Dis. 176, 331-338 (1997).
- Keadle, T. L., Laycock, K. A., Pepose, J. S., Stuart, P. M. Proinflammatory cytokines IL-1 and TNF-a are required for recurrent herpetic keratitis in NIH mice. Invest. Ophth. Vis. Sci. 41, 96-102 (2000).
- Keadle, T. L., Usui, N., Laycock, K. A., Kumano, Y., Pepose, J. S., Stuart, P. M. Corneal cytokine expression in a murine model recurrent herpetic stromal keratitis. Ocular Immunol. Inflam. 9, 193-205 (2001).
- Keadle, T. L., Morris, J. L., Pepose, J. S., Stuart, P. M. CD4+ and CD8+ cells are key participants in the development of recurrent herpetic stromal keratitis in mice. Microbial Path. 32, 255-262 (2002).
- Keadle, T. L., Morrison, L. A., Morris, J. L., Pepose, J. S., Stuart, P. M. Therapeutic immunization with a virion host shutoff-defective, replication-incompetent herpes simplex virus type 1 strain limits recurrent herpetic ocular infection. J. Virol. 76, 3615-3625 (2002).
- Keadle, T. L., Laycock, K. A., Morris, J. L., Leib, D. A., Morrison, L. A., Pepose, J. S., Stuart, P. M. Therapeutic vaccination with vhs(-) herpes simplex virus reduces the severity of recurrent herpetic stromal keratitis in mice. J. Gen. Virol. 83, 2361-2365 (2002).
- Keadle, T. L., Morris, J. L., Stuart, P. M. The effects of aminoguanidine on primary and recurrent ocular herpes simplex virus infection. Nitric Oxide. 13, 247-253 (2005).
- Stuart, P. M., Morris, J. E., Sidhu, M., Keadle, T. L. CCL3 protects mice from corneal pathology during recurrent HSV-1 infection. Front. Biosci. 13, 4407-4415 (2008).
- Keadle, T. L., Alexander, D. E., Leib, D. A., Stuart, P. M. Interferon gamma is not required for recurrent herpetic stromal keratitis. Virology. 380, 46-51 (2008).
- Carr, D. J., Austin, B. A., Halford, W. P., Stuart, P. M. Delivery of Interferon-gamma by an adenovirus vector blocks herpes simplex virus Type 1 reactivation in vitro and in vivo independent of RNase L and double-stranded RNA-dependent protein kinase pathways. J. Neuroimmunol. 206, 39-43 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon