Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
En électroporation in ovo de miARN à base de plasmides dans le tube neural développement et l'évaluation des phénotypes par injection dans Dil livre ouvert préparatifs
Dans cet article
Résumé
Procédé par lequel l'expression du gène dans le tube neural peut être régulée à la baisse dans une cellule spécifique d'un type, est décrit de façon traçable. Nous montrons comment In ovo des microARN à base de plasmides qui suscitent spatio-temporellement contrôlée ARN interférence peut être utilisée pour étudier le guidage axonal commissurale dans le tube neural développement.
Résumé
Commissuraux EL1 neurones ont été étudiés afin d'élucider les mécanismes qui sous-tendent le guidage axonal pendant 1,2 développement. Ces neurones sont situés dans la moelle épinière dorsale et envoient leurs axones le long de trajectoires stéréotypées. Axones commissuraux d'abord projeter vers le ventre, puis à travers la plaque de sol. Après avoir traversé la ligne médiane, ces axones faire un virage serré rostrale et le projet longitudinalement vers le cerveau. Chacune de ces étapes est régie par les activités coordonnées de signaux de guidage attractives et répulsives. L'interprétation correcte de ces signaux est essentielle pour guider les axones le long de leur parcours délimité. Ainsi, la contribution d'une molécule physiologique particulier pour le guidage axonal commissure est idéalement étudiée dans le cadre de l'embryon vivant. En conséquence, inactivation génique in vivo doit être contrôlée avec précision afin de bien distinguer les activités de guidage des axones des gènes qui pourraient jouer multiplerôles au cours du développement.
Nous décrivons ici une méthode pour l'expression des gènes effet de choc dans le tube neural de poulet dans une cellule spécifique du type, de façon traçable. Nous utilisons de nouveaux vecteurs plasmidiques 3 Hébergement cellulaires spécifiques au type de promoteurs / amplificateurs qui alimentent l'expression d'un marqueur fluorescent protein, suivie directement par une transcription miR30-RNAi 4 (situé au sein de la 3'-UTR de l'ADNc codant pour la protéine fluorescente) ( Figure 1). Lorsque électroporation dans le tube neural en développement, ces vecteurs susciter la régulation négative de l'expression génique efficace et d'exprimer vives protéines marqueurs fluorescents pour permettre le traçage directe des cellules qui connaissent knockdown 3. Mélanger différents vecteurs d'ARNi avant l'électroporation permet l'effet de choc simultanée de deux ou plusieurs gènes dans les régions indépendantes de la moelle épinière. Cela permet de complexes interactions cellulaires et moléculaires qui seront examinées au cours du développement, d'une manière qui est rapide, smise, précis et peu coûteux. En combinaison avec Dil tracé des trajectoires des axones dans commissurales à livre ouvert préparations 5, cette méthode est un outil utile pour les études in vivo des mécanismes cellulaires et moléculaires de la croissance axonale commissurale et d'orientation. En principe, n'importe quel promoteur / amplificateur peut être utilisé, ce qui pourrait rendre la technique plus largement applicable pour les études in vivo de la fonction des gènes au cours du développement 6.
Cette vidéo montre d'abord comment manipuler et oeufs de fenêtres, l'injection de plasmides d'ADN dans le tube neural et la procédure d'électroporation. Pour étudier le guidage axonal commissurale, la moelle épinière est enlevée de l'embryon comme une préparation à livre ouvert, fixé, et injecté avec Dil pour permettre voies axonales à tracer. La moelle épinière est monté entre lamelles et visualisées par microscopie confocale.
Protocole
1. Préparation de l'ARNi ADN plasmidique pour Gene Silencing cellulaire spécifique de type
Plasmides (figure 1) sont synthétisés en utilisant des techniques de clonage moléculaire, comme décrit précédemment dans le détail 3,4.
1.1 Clonage dans les vecteurs: la conception oligonucelotide
- Nous utilisons les mêmes oligonucléotides et protocoles universels de clonage qui sont décrits dans l'information produit fournie avec le vecteur pRFPRNAiC 4 (ARK-génomique).
- Pour le clonage dans le site première épingle:
Amorce 5 'HP1:
5'-GGCGGGGCTAGCTGGAGAAGATGCCTTCCGGAGAGGTGCTGCTGAGCG
Amorce 3 'HP1:
5'-GGGTGGACGCGTAAGAGGGGAAGAAAGCTTCTAACCCCGCTATTCACCACCACTAGGCA - Pour le clonage dans le site deuxième épingle à cheveux:
HP2 amorce 5 ':
5'-GGCGGGACGCGTGCTGTGAAGATCCGAAGATGCCTTGCGCTGGTTCCTCCGTGAGCG
Amorce 3 'HP2: - 5'-CGCCGCGCATGCACCAAGCAGAGCAGCCTGAAGACCAGTAGGCA
- Pour le clonage dans le site première épingle:
- Nous utilisons Finder GenScript de siRNA cible pour sélectionner des séquences cibles spécifiques du gène: https://www.genscript.com/ssl-bin/app/rnai .
- Les amorces pour le clonage d'un miRNA spécifique du gène dans le site première épingle:
Un exemple pour l'extinction GFP est indiqué ci-dessous.
Séquence cible (22nt): 5'-GGCACAAGCTGGAGTACAACTA
GFP avant HP1 = 59mer 
GFP inverse HP1 = 58mer 
Il ya des séquences communes à ces oligos qui font partie des séquences flanquantes (miRNA spécifique de poulet), et communes de boucle / tige (à partir de séquences humaines miRNA30). Les séquences cibles spécifiques du gène sont soulignés. Notez qu'il n'y a amIsMatch à la base 5 'du brin avant (affiché en gras; G → A dans cet exemple) pour imiter le déséquilibre naturel dans miRNA30 à cette position.
- Les amorces pour le clonage d'un miRNA spécifique du gène dans le site deuxième épingle à cheveux:
Un exemple pour l'extinction LacZ est indiqué ci-dessous.
Séquence cible (22nt): 5'-CGCGCTGTATCGCTGGATCAAA
LacZ avant HP2: 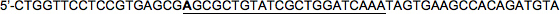
LacZ inverse HP2: 
Notez qu'encore une fois, la base 5 'de la séquence cible dans le brin avant a été changé (en gras: C → A dans cet exemple) de sorte qu'il correspond pas à la séquence antisens, imitant miRNA30.
1.2 Réaction PCR et sous-clonage
- Les oligos spécifiques du gène sommes noused avec les oligos universel dans une réaction de PCR pour générer l'épingle à cheveux en forme de miRNA30 poulet miRNA séquences flanquantes.
| Le clonage dans le site première épingle: 1 pl - 10 ng GFP Amorce HP1 1 pi - 100 ng amorce 5 'HP1 1 pi - 100 ng amorce 3 'HP1 1 ul de dNTP (10 mM) 5 pl de tampon 10x Pfu réaction 1 pi d'ADN polymérase Pfu (Promega) 39 ul PCR-Grade eau | OU | Le clonage dans le site deuxième épingle à cheveux: 1 pl - 10 ng LacZ Amorce HP2 1 pi - 100 ng amorce 5 'HP2 1 pi - 100 ng amorce 3 'HP2 1 ul de dNTP (10 mM) 5 pl de tampon 10x Pfu réaction 1 pi d'ADN polymérase Pfu (Promega) 39 ul PCR-Grade eau |
Cycles:
| 94 ° C | 94 ° C | 55 ° C | 72 ° C | 72 ° C | 4 ° C |
| 1 min | 30 sec | 30 sec | 1 min | 9 min | tenir |
| 30 cycles | |||||
- Purifier le produit de PCR, digestion avec des enzymes de restriction et clone dans le vecteur:
- Site première épingle: utilisation Nhel et MluI
- Site deuxième épingle à cheveux: utilisation MluI et SphI
- Suivez techniques standards pour la transformation de cellules bactériennes compétentes. Cellules de la plaque sur gélose LB (contenant de l'ampicilline) et l'ADN plasmidique récolte par midipreparation (par exemple Nucleobond Xtra Midi kit, Machery-Nagel).
- Suspendre concentré d'ADN plasmidiquedans des conditions stériles ddH 2 0 concentration mesure, par spectrophotométrie et conserver à -20 ° C.
1,3 plasmides miRNA séquençage
Dans des conditions standard de la réaction de séquençage échoue souvent à cause de la forte structure secondaire des épingles à cheveux. Pour améliorer cette 7:
- Effectuer réaction de séquençage dans 10 mM Tris-Cl avec 0,01 mM d'EDTA (pH 8,0) au lieu de l'eau. Ce qui augmente la conversion de l'ADN surenroulé à ADNsb, qui se prête mieux pour le séquençage.
- Ajouter une étape de dénaturation thermique (98 ° C, 5 min) avant le séquençage. Celui-ci transforme l'ADN plasmidique surenroulé d'ADN simple brin.
2. Électroporation
2.1 Manipulation des oeufs
- Placez les oeufs dans un incubateur réglé à 38,5 ° C et ~ 45% d'humidité.
- Incuber les oeufs jusqu'à ce que les embryons ont atteint le stade de développement souhaité. Pour étudier le guidage axonal des neurones commissurales, nous Typically électroporation d'embryons lorsqu'ils ont atteint Hamburger & Hamilton (HH) stade 17-18 (après environ 3 jours d'incubation) 8. Cependant, l'injection et l'électroporation doivent être faites avant que la protéine d'intérêt a accumulé, pour faire effet de choc efficace.
- Retirer les oeufs de l'incubateur et de les mettre dans une position horizontale stable pendant 20 min, pour repositionner l'embryon au-dessus du jaune à la face supérieure de l'oeuf. Remettre les œufs dans l'incubateur pendant cette période.
2.2 Préparation des réactifs et du matériel
- Préparer un tampon phosphate salin (PBS) et stériliser à l'autoclave ou passer la solution à travers un filtre de 0,2 um.
- Assurez micropipettes de verre en tirant capillaires (World Precision Instruments 1B120F-4, 1,2 / 0.68 OD / ID (mm)) dans un dispositif approprié de traction (par exemple Narishige PC-10). Casser la pointe d'une micropipette afin d'obtenir un diamètre de pointe de ~ 5 um et le connecter à un morceau de tuyau avecle diamètre approprié.
- Monter les électrodes de platine (0,5 cm de long) fermement dans un cadre portatif, avec une distance inter-électrode de 0,5 cm. Connecter les électrodes à un générateur d'impulsions d'onde carrée (BTX ECM 830).
- Réglez le générateur d'impulsions avec les paramètres suivants:
- Pour électroporation unilatérale: Tension: 25 V, nombre d'impulsions: 5, longueur d'impulsion: 50 ms, d'interruption d'intervalle: 1 sec
- Pour électroporation bilatérale: Tension: 18 V, nombre d'impulsions: longueur 5, de l'impulsion: 50 ms, d'interruption d'intervalle: 1 sec
- Préparer une seringue avec aiguille 18 G, un scalpel, une bouteille spritz d'éthanol à 70% et la bande.
- Faire fondre la cire de paraffine dans un bécher sur une plaque chauffante à 80 ° C.
2,3 fenêtrage
- Essuyez les oeufs à l'aide d'un tissu imbibé d'éthanol à 70%.
- Placer une bande de ruban le long de l'axe longitudinal de l'œuf.
- Faire deux petits trous dans la coquille aide d'un scalpel, l'un àl'extrémité émoussée de l'oeuf et l'autre à l'angle de la surface à une fenêtre.
- En utilisant une seringue, retirez environ. 3 ml d'albumine de chaque oeuf par l'insertion de l'aiguille à un angle de 45 ° dans le trou à l'extrémité émoussée de l'oeuf. Soigneusement éviter d'endommager le jaune.
- Découper une fenêtre dans la coquille à l'aide de petits ciseaux, qui s'est tenue à l'horizontale pour éviter d'endommager l'embryon. Si nécessaire, la position de l'embryon peuvent être vérifiées et marquées avec un crayon en maintenant une forte lumière contre l'extrémité émoussée de l'œuf. Une fenêtre de 1,5 à 2 cm de côté est utile pour la plupart des applications.
- Sceller le trou à l'extrémité émoussée de l'œuf et des fissures dans la coquille avec de la cire de paraffine fondue, appliqué avec un pinceau.
- Sceller la fenêtre avec du ruban adhésif transparent (Scotch Magic par exemple).
- Retour de l'œuf dans l'incubateur.
2,4 électroporation
- Préparer des outils stériles et essuyez la zone de travail avec de l'éthanol à 70%.
- Préparer le injection solution. La concentration d'ADN appropriée doit être déterminée par l'utilisateur et varie en fonction de l'amplificateur / promoteur utilisé pour diriger l'expression. A titre indicatif, nous utilisons généralement de 0,2 à 2,0 pg / pl (voir Discussion). Sur un total de 20 pl, le mélange d'injection doit contenir:
| ARNi ADN plasmidique (en H 2 0) | X ul |
| 20x PBS | 1 pl |
| 0,4% de bleu trypan | 2 pl |
| stériles ddH 2 0, pour un volume final de | 20 pi |
Utiliser une aspiration douce pour charger le mélange d'ADN dans le microcapillaire en verre attaché à la tubulure.
- Retirez le ruban adhésif de l'œuf et de fenêtres en scène l'embryon en fonction de Hamburger et Hamilton 8.
- Utilisez une pince et des ciseaux à ressort pour retirer délicatement le extraemembranes mbryonic de la moitié caudale de l'embryon. Les membranes peuvent être facilement décollée de l'embryon dans la région où le droit majeur et gauche veines vitellines entrer dans le coffre. Doucement déchirer ou couper les membranes et les tirer vers l'arrière. Si nécessaire, l'embryon peut être visualisé mieux en injectant une solution d'encre de Chine ou vert rapide entre le disque embryonnaire et le jaune d'œuf comme le montre une vidéo en Boulland et ses collègues 9.
- Injecter la solution d'ADN dans le canal central du tube neural, juste au-dessus des pattes arrières. Contrôler le volume d'injection par voie orale. Le colorant bleu devrait s'étendre à partir de l'extrémité de la queue vers le haut vers le ventricule du cerveau en développement.
- Ajouter quelques gouttes de PBS stérile au-dessus de l'embryon.
- Placer les électrodes parallèles à l'axe antéro-postérieur de l'embryon. Évitez de toucher l'embryon ou les vaisseaux sanguins.
- Maintenez les électrodes stable, et électroporation.
- Retirez délicatement les électrodes et les rincer à l'de l'eau stérile pour éliminer les protéines dénaturées du blanc d'oeuf.
- Pour l'électroporation bilatérale, changer la polarité des électrodes, repositionner les électrodes parallèles de l'embryon et de répéter l'électroporation. Rincer les électrodes à l'eau stérile.
- Déposer un peu plus de PBS stérile sur l'embryon. Refermer l'œuf avec du ruban adhésif et le retourner à l'incubateur jusqu'à ce que le niveau désiré de développement est atteint. Une bonne étanchéité est cruciale pour éviter la déshydratation de l'embryon.
3. Les préparatifs de la moelle épinière
3.1 La dissection d'embryons
- Au HH25-26 (jour 5 de l'incubation), retirer l'embryon de l'oeuf à l'aide de forceps ou d'une petite cuillère. Placez-le dans du PBS dans une boîte de Pétri enduit de silicone (élastomère Sylgard).
- Retirer les membranes extra-embryonnaires et de jeter l'embryon sur son dos. Le stabiliser sur la plaque par l'épinglant à travers le cou et de la queue (en utilisant les repères de 0,20 mm d'insectes), avec s douxtretching.
- Embryons entiers (pour la coupe plus tard) peut être fixé ici, en remplaçant le PBS avec du paraformaldéhyde 4% (PFA) et incuber pendant 1 heure à température ambiante. Pour rendre à livre ouvert préparatifs, continuer le protocole de tissu non fixé comme décrit ci-dessous.
3.2 Isolement de la moelle épinière d'embryons
- Épingler les branches, en veillant à ce que les broches sont insérées dans un angle s'écartant de l'embryon de façon à ne pas interférer avec la dissection. L'embryon doit être éclairée par en dessous pour permettre la densité des tissus à être perçue dans les étapes suivantes.
- Retirer le cœur et les organes internes à l'aide des ciseaux à ressort et grattant doucement avec une pince. Les vertèbres segmenté et la moelle épinière doit être visible si tous les organes ont été complètement supprimé.
- Avec des ciseaux à ressort, faire une coupe peu profonde à travers les vertèbres recouvrant la moelle épinière au niveau du cou. Tournez l'embryon à 180 ° et faire deux courtescoupes longitudinales à travers les vertèbres de chaque côté de la colonne vertébrale, du cou vers l'arrière. Utilisez une pince pour soulever le volet de vertèbres loin de la moelle épinière et le zeste de l'tissulaire (contenant toutes les vertèbres) dans une seule bande vers la queue.
- Étirez doucement et re-pin de l'embryon à travers la queue et les membres.
- Utilisez une amende de scalpel microchirurgical (par exemple, Grieshaber 68101) ou une aiguille de tungstène pour couper les méninges recouvrant la moelle épinière. Cherchez une ligne sombre dense de tissu entre le tube neural et les ganglions de la racine dorsale. Réglez l'angle d'éclairage, si nécessaire. Doucement couper longitudinalement le long de cette ligne de chaque côté de la colonne vertébrale, du cou à la queue. Les méninges devrait se séparer de la moelle épinière due à l'étirement doux de l'embryon épinglé.
- Couper à travers la moelle épinière au niveau du bourgeon caudal de l'aile et du bourgeon de membre, et soulever toute la moelle épinière de l'embryon dans une rostrale à caudale lisse mouvement, en utilisant une pince. Le cordon épinière isolée doit être maintenu immergé dans du PBS pendant cette étape. Ne pas sortir de la boîte.
3.3 Fixation des livres ouverts
- Passez le cordon médullaire isolé sur la spatule et le transférer à un nouveau doublé de silicone boîte de Petri contenant du paraformaldéhyde à 4% dans du PBS.
- Préparation d'un produit plat en prenant soin de montage épinglant la moelle épinière en six positions (rostrale, en dedans et vers le bas, de chaque côté, à l'aide d'insectes broches 0,10 mm). Nous étiqueter chaque préparation d'un peu «drapeau» qui identifie non seulement l'embryon mais il indique également l'extrémité antérieure de la préparation à livre ouvert.
- Incuber à température ambiante pendant 30 min à 1 h. Ouvrez les livres ne doivent pas être trop fixé car cela réduit l'efficacité de Dil diffusion de 10 et augmente de fond.
- Versez délicatement au large de la PFA à 4% et le remplacer par du PBS. Gardez les plats à 4 ° C jusqu'au moment de l'injection avec Dil ou de montage.
- Respecter les livres ouverts-sous microscopie à effet de fluorescence et de sélectionner le bon côté du livre ouvert à injecter Dil.
- Préparer rapide Dil (5 mg / ml dans l'éthanol) et aspirer la solution dans une micropipette de verre fixé au tube en plastique. Casser l'extrémité de la micropipette aussi finement que possible afin d'obtenir une pointe très petit diamètre. Insérez l'aiguille dans un plat de PBS et vérifier que le Dil ne pas fuir de l'aiguille. Si les fuites DiI, le diamètre de l'aiguille est trop grosse. Dans ce cas, préparez une nouvelle aiguille.
- Éclairer les préparations à livre ouvert par le bas. Comparer une bande longitudinale de tissu plus dense, situé à environ 1/5 de la largeur d'une hemibook à partir du bord latéral de la préparation. Cela correspond à des corps cellulaires des neurones commissurales, qui se trouvent juste à la plaque ventrale toit. Commençant à une extrémité de l'ouvrage ouvert, insérez l'aiguille dans le tissu de verre et, comme l'aiguille is retirée, souffler dans une petite quantité de DiI l'aide d'une pipette de bouche.
- Travailler rapidement, ce qui rend plusieurs injections sur la longueur de l'ouverture de bord à intervalles réguliers d'environ 0,5 mm. Si l'aiguille est bouchée, soigneusement nettoyer avec une pince. Si la pointe devient trop grand (et les fuites DII), remplacer l'aiguille.
- Lorsque vous avez terminé chaque livre ouvert, utilisez une pipette de transfert pour aspirer et éliminer tout excès, fuite Dil. Ne pas le faire se traduira par bruit de fond élevé.
- Laissez les préparatifs pour environ trois jours à 4 ° C pour permettre l'Dil se propager le long des axones.
3.5 Montage de l'imagerie
- Utiliser une seringue avec une aiguille de 18 G à répandre une mince bordure ininterrompue de graisse à vide (par exemple Dow Corning # 976V) autour des bords de la lamelle de verre de 24 mm x 24 mm. Ajouter quelques gouttes de PBS stérile pour le bien. Noter que milieu de montage contenant du glycérol avec du n-propyl gallate peut pas être compatible avec Dil 11. De même, graisse à vide de faible viscosité peut se mélanger avec le PBS et le résultat en bruit de fond élevé.
- Retirez les goupilles du livre ouvert et le transférer dans la goutte de PBS. Plonger le livre ouvert et le placer au milieu du puits.
- Placez délicatement une autre lamelle de 24 mm x 24 mm sur le dessus, en s'assurant que le livre ouvert reste ouvert. Si nécessaire, la lamelle peut être retiré, et le livre ouvert repositionné. Presser doucement sur les bords de la préparation pour créer une étanchéité totale de la graisse. Excès de PBS seront évincés lors de cette étape. Évitez les bulles d'air.
- Conserver les préparations dans l'obscurité à 4 ° C jusqu'au moment de l'inspection et de la documentation par microscopie à fluorescence. Cela devrait être fait rapidement (dans la semaine), afin de s'assurer que les préparatifs ne se dessèchent pas.
4. Les résultats représentatifs
Électroporation de plasmides et d'expression
Dans le cadre duconditions décrites ci-dessus, la protéine fluorescente doit être nettement détectable dans le type cellulaire appropriée, sans la nécessité d'une amplification supplémentaire du signal de marquage de l'anticorps. La protéine fluorescente ne doit être détectable dans le type cellulaire désiré / s. Des exemples représentatifs de préparation à livre ouvert et coupes d'embryons électroporées avec les différents plasmides sont présentés dans la figure 2.
Efficacité des miARN artificiels
MiARN artificiels contre un nouveau gène d'intérêt doivent d'abord être examinés pour l'efficacité et la spécificité de leurs effets knockdown. Nous constatons que les β-actine promoteur pilotés par des constructions, électroporation à 0,25 pg / pl, sont appropriées pour ce 3. Knockdown in vivo peut être testé par immunohistochimie ou hybridation in situ.
Dil étiquetage
Bien ciblées injections dans des embryons de type sauvage DiIdevrait produire plus de 80% des sites d'injection avec idéales, les trajectoires archétypales 3, comme le montre la figure 3. Des animaux à la variabilité des animaux devrait être faible.
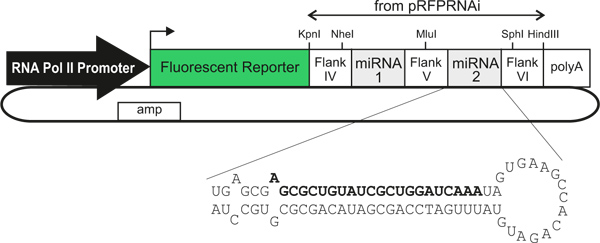
Figure 1. Schématique généralisée des vecteurs plasmidiques exprimant miARN-. L'utilisation de différents promoteurs d'ARN polymérase II / enhancers permet un type cellulaire spécifique d'expression. Les cellules transfectées sont identifiables par l'expression d'un rapporteur fluorescent qui est lié directement (d'un seul transcrit) à une ou deux miRNAs artificielles, qui abattre l'expression des gènes. Le texte en gras indique le brin sens d'un miARN artificiels contre LacZ, comme décrit dans le texte.
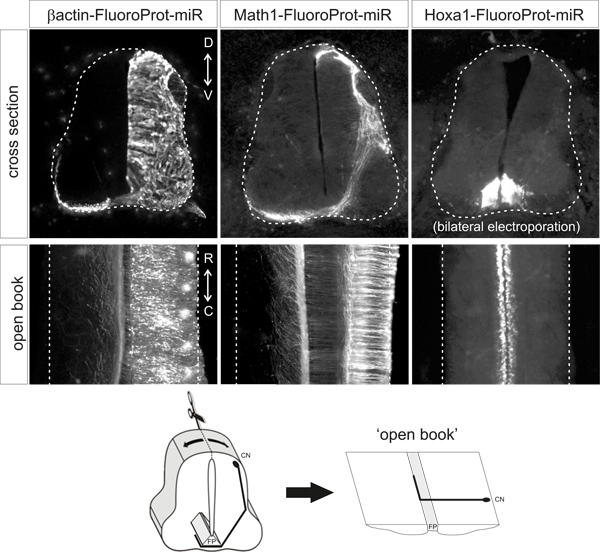
Figure 2. Représentant exemples of fluorescentes profils protéiques obtenus à la suite d'électroporation des vecteurs plasmidiques indiqués. Les coupes transversales et des livres ouverts sont à partir d'embryons de poulet HH25-26 qui ont été électroporation à HH18. β-actine promoteur dirige l'expression ubiquitaire, Math1 enhancer dirige l'expression dans les neurones et di1 HOXA1 enhancer entraîne l'expression spécifiquement dans la plaque de fond. CN, commissurale neurone; PF, plaque de sol.
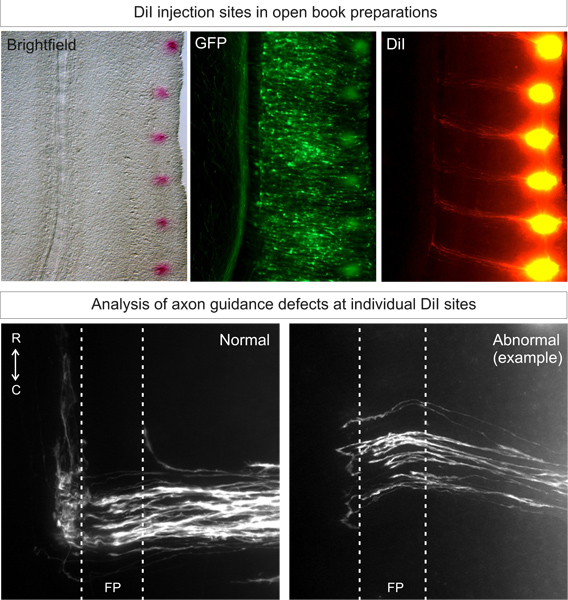
Figure 3. Application et analyse des sites d'injection DiI dans les préparations à livre ouvert. Dil doit être injecté dans un modèle ponctuée, à proximité de la marge latérale du livre ouvert, sur le côté électroporation (identifié par l'expression de protéines fluorescentes). Après 3 jours de diffusion, commissuraux trajectoires des axones doivent pouvoir être visualisés en microscopie fluorescente. Trajectoires des axones normaux se développera vers le rez-de-pfin, traverser la plaque de fond, puis tourner et pousser rostrale. Phénotypes anormaux résultant de coups bas gène peut être comparé à cette trajectoire archétype. Dans l'exemple, certains axones décrochage dans la plaque de fond ou de faire tourner des décisions erronées sur le côté controlatéral.
Discussion
Cette simple, basée sur un vecteur d'expression artificielle stratégie miRNA peut être utilisé pour l'expression du gène endogène effet de choc dans le tube neural poulet. Ces outils fonctionnels offrent gene silencing multiple, contrôle temporel et une spécificité de type cellulaire, afin de faciliter l'élucidation des voies de développement complexes. En particulier, nous avons démontré l'utilité de ces plasmides dans le guidage axonal commissurale, depuis les plasmides peuvent être util...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Travail dans le laboratoire de l'ES est soutenu par le Fonds national suisse de la science. Nous tenons à remercier le Dr Beat Kunz de l'aide pour le tournage.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| 0,5 mm capillaires en verre | World Precision Instruments | 1B120F-4 | |
| Verre aiguille extracteur | Narishige | PC-10 | |
| Electroporateur | BTX | ECM 830 | |
| Sylgard élastomère de silicone | World Precision Instruments | SYLG184 | |
| Fil de tungstène, 0,075 mm | World Precision Instruments | TGW0325 | |
| Broches d'insectes, 0,20 mm | Outils Fine Science | 26002-20 | |
| Broches d'insectes, 0,10 mm | Outils Fine Science | 26002-10 | |
| Ciseaux à ressort | Fin Pour la Scienceols | 15003-08 | |
| Dumont # 5 forceps | Outils Fine Science | 11252-20 | |
| Dumont # 55 pince | Outils Fine Science | 11255-20 | |
| Rapide Dil | Molecular Probes | D-7756 | |
| Microscopes à fluorescence | Olympe | SZX12, BX51 |
Références
- Chédotal, A. Further tales of the midline. Current Opinion in Neurobiology. 21, 68-75 (2011).
- Avraham, O., Hadas, Y., Vald, L., Zisman, S., Schejter, A., Visel, A., Klar, A. Transcriptional control of axonal guidance and sorting in dorsal interneurons by the Lim-HD proteins Lhx9 and Lhx1. Neural Development. 4, 21 (2009).
- Wilson, N. H., Stoeckli, E. T. Cell type specific, traceable gene silencing for functional gene analysis during vertebrate neural development. Nucleic Acids Research. 39, e133 (2011).
- Das, R. M., van Hateren, N. J., Howell, G. R., Farrell, E. R., Bangs, F. K., Porteous, V. C. A robust system for RNA interference in the chicken using a modified microRNA operon. Developmental Biology. 294, 554-563 (2006).
- Perrin, F. E., Stoeckli, E. T. Use of lipophilic dyes in studies of axonal pathfinding in vivo. Microscopy Research and Technique. 48, 25-31 (2000).
- Timmer, J., Johnson, J., Niswander, L. The use of in ovo electroporation for the rapid analysis of neural-specific murine enhancers. Genesis. 29, 123-132 (2001).
- Kieleczawa, J. Simple modifications of the standard DNA sequencing protocol allow for sequencing through siRNA hairpins and other repeats. Journal of Biomolecular Techniques. 16, 220-223 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Boulland, J., Halasi, G., Kasumacic, N., Glover, J. C. Xenotransplantation of Human Stem Cells into the Chicken Embryo. J. Vis. Exp. (41), e2071 (2010).
- Kim, B. G., Dai, H. -. N., McAtee, M., Vicini, S., Bregman, B. S. Labeling of dendritic spines with the carbocyanine dye DiI for confocal microscopic imaging in lightly fixed cortical slices. Journal of Neuroscience Methods. 162, 237-243 (2007).
- Murphy, M. C., Fox, E. A. Anterograde tracing method using DiI to label vagal innervation of the embryonic and early postnatal mouse gastrointestinal tract. Journal of Neuroscience Methods. 163, 213-225 (2007).
- Helms, A. W., Abney, A. L., Ben-Arie, N., Zoghbi, H. Y., Johnson, J. E. Autoregulation and multiple enhancers control Math1 expression in the developing nervous system. Development. 127, 1185-1196 (2000).
- Li, X., Lufkin, T. Cre recombinase expression in the floorplate, notochord and gut epithelium in transgenic embryos driven by the Hoxa-1 enhancer III. Genesis. 26, 121-122 (2000).
- Mauti, O., Baeriswyl, T., Stoeckli, E. T. G. e. n. e. Silencing by Injection and Electroporation of dsRNA in Avian Embryos. Cold Spring Harbor Protocols. , (2008).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Developmental Dynamics. 229, 433-439 (2004).
- Cullen, B. R. Enhancing and confirming the specificity of RNAi experiments. Nature Methods. 3, 677-681 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon