Method Article
Étude quantitative de la Locomotion librement Piscine Micro-organismes utilisant la diffraction laser
Dans cet article
Résumé
Organismes microscopiques comme le nématode nage libre C. elegans, De vivre et de se comporter dans un complexe environnement tridimensionnel. Nous rapportons une nouvelle approche qui fournit une analyse des C. elegans En utilisant des diagrammes de diffraction. Cette approche consiste à suivre la périodicité temporelle des spectres de diffraction générés par diriger la lumière laser à travers une cuvette.
Résumé
Des sols et des organismes aquatiques microscopiques vivent et se comportent dans un complexe environnement tridimensionnel. La plupart des études sur le comportement organisme microscopique, en revanche, ont été réalisées en utilisant un microscope approches, qui limitent le mouvement et le comportement d'un étroit champ focal de près de deux dimensions. 1, nous présentons une nouvelle approche analytique qui fournit en temps réel une analyse des nageant librement C. elegans dans une cuvette sans dépendance à l'égard microscope basé sur l'équipement. Cette approche consiste à suivre la périodicité temporelle des spectres de diffraction générés par diriger la lumière laser à travers la cuvette. Nous mesurons fréquences d'oscillation des nématodes librement natation.
L'analyse des spectres de diffraction en champ lointain révèle des indices sur les formes d'onde des nématodes. La diffraction est le processus de pliage lumière autour d'un objet. Dans ce cas, la lumière est diffractée par les organismes. Les ondes lumineuses interfèrent et peuvent former des annoncesmodèle iffraction. Un champ lointain, ou de Fraunhofer, le motif de diffraction est formé si la distance écran-objet est beaucoup plus grande que l'objet de diffraction. Dans ce cas, le diagramme de diffraction peut être calculé (modélisé) en utilisant une transformée de Fourier 2.
C. elegans sont libres de vie des nématodes vivant dans le sol qui naviguent dans les trois dimensions. Ils se déplacent à la fois sur une matrice solide comme le sol ou agar-agar dans un motif sinusoïdal locomoteur appelé l'exploration et à l'état liquide dans un schéma différent appelé la natation. 3 Les rôles joués par les informations sensorielles fournies par mécano, chimiosensorielle, et les cellules thermosensory qui régissent les changements plastiques dans locomoteur les modèles et les interrupteurs dans les habitudes commencent à peine à être élucidé. 4 Nous décrivons une approche optique pour la mesure de la locomotion des nématodes dans les trois dimensions ne nécessitant pas un microscope et va nous permettre de commencer à explorer les complexités de la locomotion des nématodes en co différentenditions.
Protocole
1. C. Préparation elegans pour l'analyse vidéo
- Déplacez 10-20 nématodes adultes gravides à de nouvelles NGM agar-remplis de boîtes de Pétri à l'aide d'une fine sélection aplati fil de platine. Les boîtes de Pétri remplies de gélose NGM contiennent une petite tache circulaire de E. coli (souche de croissance limitée, OP50, donne les meilleurs résultats) pour les nématodes à manger. Permettre aux nématodes à pondre pendant 3-5 heures, puis retirez les adultes, établissant ainsi une petite culture de développement synchronisé de 50-150 nématodes. Permettre aux nématodes de se développer à l'âge adulte par l'incubation des boîtes de Pétri à 20 ° C pendant 4-5 jours. Ces méthodes de culture sont basés sur les procédures établies (Stiernagle 2006) 5.
- Le jour de l'analyse vidéo, rincer une assiette de nématodes adultes jeunes avec 1 ml d'eau désionisée, eau distillée, recueillant ainsi les vers 50-150 de la culture synchronisée. Une solution tampon PBS comme M9 ou peuvent également être utilisés. Utilisez une microcentrifugeuse pour faire tourner le wORM à la partie inférieure du tube, ou les laisser se déposer par gravité pendant environ 15 min. Retirez la majorité de l'eau dans le tube et le remplacer par 1 ml d'eau désionisée, de l'eau distillée pour laver les bactéries adhérentes des nématodes.
- Transfert des nématodes dans de l'eau ou un tampon pour une cuve en quartz à l'aide d'une micropipette. Il est important de travailler avec un petit nombre, environ 5-10 nématodes au total à un moment ou encore moins pour qu'on nématode à la fois est susceptible d'être illuminé par le laser. Si le nombre de nématodes sur les plaques de culture est trop importante, la dilution des vers dans l'eau ou dans un tampon jusqu'à une densité souhaitée est atteinte. Il est également possible de choisir différents nématodes à une goutte d'eau ou un tampon sur une plaque de gélose fraîche de les laver et de transférer vers individuelles dans la cuvette. Dans notre étude, nous avons utilisé 1 mm, 2 mm et 5 tailles de cuve mm d'examiner les effets des contraintes physiques sur le comportement natatoire.
2. Configuration optique pour la analysi Vidéos
- Effectuez la configuration comme indiqué dans la figure 1 en utilisant un 543 nm (vert) Hélium-Néon (HeNe) laser, deux miroirs en aluminium avant de la surface, un porte-cuvette, un écran de projection, et une caméra haute vitesse (Casio High Speed Exilim) capables de filmer à ~ 240 fps. Les deux miroirs sont utilisés pour diriger le faisceau laser à travers la cuvette. Différentes tailles de cuves peuvent être utilisées en fonction de la nature de l'étude. A titre d'exemple, nous avons utilisé des cuvettes qui sont de 5 mm d'épaisseur pour montrer les effets des contraintes spatiales sur les fréquences de natation. Le faisceau laser doit satisfaire aux exigences de suréchantillonnage;. Ie, l'organisme doit gêner plus d'un tiers du faisceau laser. Pour C. elegans, le faisceau laser doit être d'environ 2 mm de diamètre quand il coopère avec un nématode. Le faisceau laser ne doit pas être supérieure à 5 mm de diamètre depuis le diagramme de diffraction sera difficile à localiser. La distance entre l'organisme de diffraction à l'écran doit être beaucoup plus grande quel'organisme lui-même.
- Parafilm lieu au-dessus de la cuvette et de l'inverser pour mélanger les nématodes dans la colonne d'eau. Placer la cuve dans un support de cuvette de sorte que les vers sont initialement dans la partie supérieure de la cuve. À l'aide des miroirs, diriger le faisceau laser à travers le centre de la cuvette. Parce que les nématodes sont plus denses que l'eau, ils tombent lentement jusqu'au fond de la cuvette, tandis que dans le même temps à l'intérieur de la piscine de colonne d'eau.
- Sur l'écran de projection, la couleur de la tache correspondant au faisceau laser émis noir pour réduire la dispersion en tant que faisceau transmis satisfait l'écran de projection (figure 2). Alternativement mis une ouverture dans l'écran de projection pour permettre au faisceau transmis de passer à travers l'écran. Éliminer ou réduire la diffusion du faisceau transmis gardera la matrice CCD de la caméra de saturation due à faisceau transmis.
- Pour capturer une mesure de la taille du motif de diffraction, tracer une ligne deenviron 5 cm sur l'écran de projection à côté de la trace du faisceau laser transmis sans interférer avec l'image de la lumière diffractée.
- Lancez l'enregistrement sur l'appareil photo lorsque la lumière ambiante est de telle sorte que la ligne de 5 cm est sur la même séquence que les images de diffraction. Désactiver l'éclairage de la pièce. Images de diffraction enregistrement sur l'écran avec la caméra que les vers traversent le faisceau laser.
3. Vidéo Préparation des données
- Installer le programme d'analyse vidéo (Logger Pro: http://www.vernier.com/products/software/lp/ ) sur l'ordinateur. Importez la vidéo dans le programme d'analyse vidéo
- Réglez l'origine pour coïncider avec le point laser transmis. Définition de l'échelle en utilisant la ligne de 5 cm sur l'écran de projection.
- Suivre le déplacement angulaire de l'image de diffraction formée par chaque nématode utilisant le logiciel d'analyse vidéo (Figure 3)
- Pour trouver l'angulationdéplacement r en prenant la arctan (y / x), copie et coller des données dans un tableur (Excel) et ajouter 180 ° ou π pour tous les angles négatifs pour produire un graphique continu (figure. 4).
4. Acquisition de données en temps réel pour l'observation instantanée des fréquences Piscine
- En utilisant la même configuration que pour l'analyse vidéo, placez une photodiode (DET10A de THORLABS) avec une petite zone (~ 1 mm 2) décentré dans le diagramme de diffraction juste en face de l'écran de projection.
- Branchez la photodiode à l'oscilloscope numérique (PicoScope faite par Pico Technology) qui se connecte à l'ordinateur via le port USB. Respectez les schémas raclée sur l'écran d'ordinateur.
- Enregistrer acquis des ensembles de données en format ASCII ou texte.
5. Analyse des données
- Importez les données acquises à l'aide de la photodiode vidéo ou dans un programme d'analyse de données capable de formes d'onde raccord à l'aide du chi-carré minimisation. Le programme utilisé ici est l'origine ( http://www.originlab.com/ ). Ajuster une courbe sinusoïdale pour déterminer la fréquence raclée (figures 4 et 5).
- Fréquences moyennes de natation différents échantillons et de déterminer la variance. Pour cette étude, les données ont été analysées statistiquement en utilisant une analyse de variance à un facteur suivie par le test de Bonferroni des comparaisons multiples. Une valeur de p <0,05 était considérée comme statistiquement significative.
6. Motifs de diffraction modèle en utilisant Mathematica comme un exemple
Remarque: les modèles de diffraction peut être modélisée à l'aide de nombreux outils de calcul. Cette procédure sera différente pour différents outils informatiques tels que MatLab, Excel, etc origine
- Créer l'image: Prenez des photos de nématodes sur une lame de microscope à l'aide d'un microscope traditionnel.
- Binariser l'image: Importer "Worm" de l'image ver into Mathematica en faisant glisser l'image dans Mathematica. Convertissez l'image en une image noir et blanc (binariser). Ceci peut être réalisé avec le «binariser 'ordre dans Mathematica: BlackandWhiteImage = binariser [Worm]. L'image peut alors être considérée comme une image en noir et blanc.
Vous pouvez également utiliser la commande 'EdgeDetect' pour créer un BlackandWhiteImage: EdgeDetect [Worm, 6.0,0.035], où les deux nombres de fuite de contrôler la grosseur des bords qui en résultent. - Convertir l'image en une matrice de zéros et de uns: Ceci peut être réalisé avec le «ImageData 'ordre dans Mathematica: Matrix = ImageData [BlackandWhiteImage].
- Matrice de transformée de Fourier: Utilisez la commande "Fourier dans Mathematica à transformée de Fourier de la matrice en utilisant les FourierParameters indiquées: FTransform = Fourier [Matrix, FourierParameters -> {0, -2}].
- Place module de la matrice pour obtenir la matrice de diffraction et d'améliorer le contraste d'image: Square de l'absoluvaleur de la matrice et afficher l'image résultante, qui est la figure de diffraction correspondant à l'image originale. Vous pouvez également utiliser le 'Journal' de fonction à l'échelle du contraste de l'image: ImageContrast = Image [Log [1 + (Abs [FTransform]) ^ 2] / 0,5].
- Redimensionner l'image pour une visualisation facile: Crop le diagramme de diffraction centrale et redimensionner comme vous le souhaitez: ImageResize [ImageContrast [y, 100], 500].
- Comparer les spectres de diffraction modélisés avec des motifs de diffraction obtenus à partir des vers de natation librement. (Figure 6)
Résultats
A titre d'exemple, nous avons étudié C. elegans dans une cuvette en quartz de 1 cm de large, 5 mm d'épaisseur et 4 cm de hauteur de cuve. L'échantillonnage d'une vis sans fin unique en utilisant une analyse vidéo, la fréquence moyenne obtenue à partir de natation analyse vidéo dans une cuvette de 5 mm d'épaisseur est d'environ 2,5 Hz (figure 4). De même, l'échantillonnage d'un seul ver en utilisant la méthode d'acquisition de données en temps réel, on obtient une fréquence de natation d'environ 2,7 Hz (figure 5), en utilisant l'oscilloscope numérique (PicoScope). Cette procédure peut être répétée pour de nombreux vers. Une étude détaillée de vers libre de natation révélé une fréquence moyenne de nage de 2,37 Hz dans une cuvette de 5 mm. 6 Comme prévu, la fréquence de la natation est plus élevée que celle d'un ver qui rampe (~ 0,8 Hz). 3 À l'aide de cette méthode de diffraction, la fréquences natation moyenne d'un C. elegans, qui se limite à une lame de microscope, s'est avérée correspondre à la valeur précédemment publié de 2 Hz. 1,7
ve_content "> En suivant les procédures 3.) puis 6.) permet la modélisation de la natation diagrammes de diffraction à l'aide d'images obtenues à vis sans fin avec un microscope conventionnel. Les diagrammes de diffraction modélisés sont utilisés pour simuler un cycle de natation de C. elegans ( Figure 6). Un modèle de réussite consiste physiquement réalisables modèles successifs de natation qui correspondent aux fréquences de natation. Le ver doit être dans le même état à la fin d'un cycle de natation comme il était au commencement d'un cycle de natation.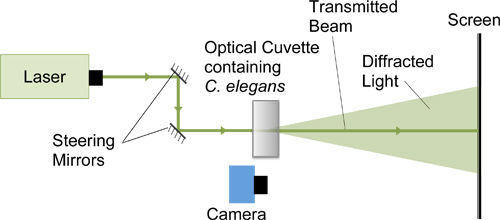
Figure 1. Un laser HeNe vert a été utilisé pour créer un diagramme de diffraction dynamique à l'aide en direct C. elegans. Ce diagramme de diffraction a été filmé à 240 fps.
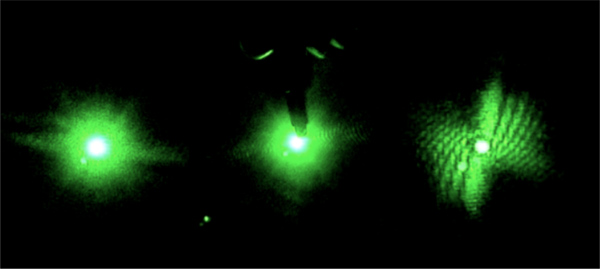
Figure 2. Dra l'aile d'un point noir augmente l'absorption du faisceau transmis. Saturation de la caméra grâce à la lumière diffusée est réduite et le motif de diffraction est visible.
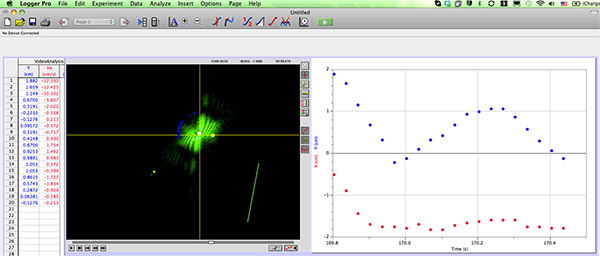
Figure 3. Capture d'écran du logiciel d'analyse vidéo (Logger Pro) avec un diagramme de diffraction ver qui est suivie. Cliquez ici pour agrandir la figure .
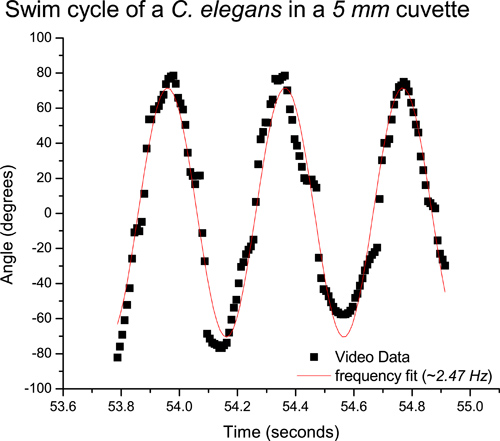
La figure 4. Données vidéo correspondant au cycle de bain d'un nématode dans une cuvette de 5 mm. L'ajustement de la courbe révèle une fréquence de nage de 2,5 Hz ~.
"/>
Figure 5. Données en temps réel correspondant au cycle de bain d'un nématode dans une cuvette de 5 mm. L'ajustement de la courbe révèle une fréquence de nage de 2,7 Hz ~.
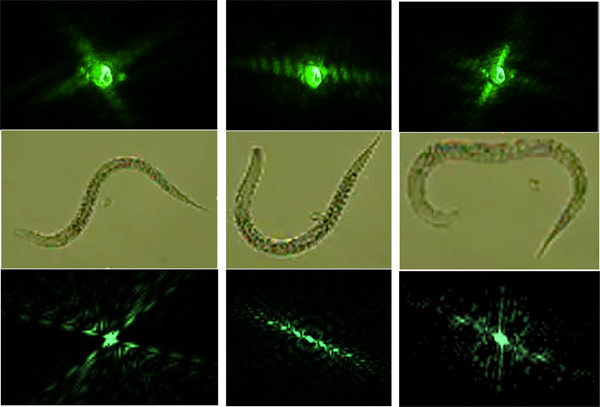
Figure 6. La rangée du haut représente les spectres de diffraction réelles et est adaptée aux schémas de diffraction modélisés dans la rangée du bas. Les diagrammes de diffraction ont été produits modélisés en utilisant des vers sur une lame de microscope (rangée du milieu).
Discussion
Nous avons développé une nouvelle approche pour la mesure en temps réel des mouvements et des comportements locomoteurs simples dans les organismes microscopiques comme les nématodes qui ne nécessitent pas l'utilisation de microscopes. 8 Cette approche méthodologique pourrait également être utilisé pour l'étude de nombreux organismes microscopiques comme les protistes. Cette méthode est uniquement limitée par la longueur d'onde de la lumière utilisée. L'organisme ne doit pas être inférieure à la longueur d'onde de la lumière. En plus de l'économie de coûts et la portabilité de l'équipement nécessaire, un avantage clé de cette approche est la possibilité de mesurer le comportement en temps réel et en trois dimensions, sans les contraintes étroites de plans images sous un microscope. Il est également possible avec cette technique pour examiner les influences des forces gravitationnelles ou de nombreuses autres conditions sur les comportements qui ne peuvent être étudiés en utilisant un microscope approches. 9 Ainsi, nous pouvons parvenir à une meilleure compréhension du micro-organisme naturel compor locomoteurviors libérés depuis les confins de gouttelettes lames de microscope ou spécialisés chambres microfluidiques (Park et al, 2008). 10
L'absence d'une information de phase dans un diagramme de diffraction ne permet pas la récupération directe de l'image correspondant à l'objet de diffraction depuis le diagramme de diffraction en champ lointain est proportionnelle au carré de la valeur absolue de la transformée de Fourier. Nous sommes donc le calcul des diagrammes de diffraction à partir d'images ver de sorte qu'ils peuvent être jumelés avec les diagrammes de diffraction des nématodes librement natation (figure 6).
Cette méthode a donné des résultats vraiment pour nager librement C. elegans et peut être appliqué à toutes les espèces microscopiques que les manœuvres dans un environnement optiquement transparent comme de l'eau ou de différentes solutions ioniques. Microscopes classiques ne permettent études avec une profondeur focale de l'ordre du micromètre. 11 C'est en raison de la faibleprofondeur de champ quand focalisation de la lumière:
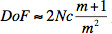
où le nombre f N est une relation réciproque avec le cercle de confusion (c) de sorte qu'une longueur focale courte est associée à un grand c. 12,13 Bien que cette méthode de diffraction n'est certainement pas un remplacement pour la microscopie conventionnelle, il est capable de fournir rapidement des résultats quantitatifs ainsi que les espèces peuvent même être manipulés en temps réel à faible coût. Les diagrammes de diffraction peut être obtenu avec un pointeur laser. Les diagrammes de diffraction peut être filmé avec une résolution réduite de temps en utilisant un appareil photo numérique ordinaire. Pendant que l'utilisateur ne peut pas avoir un microscope ou une photodiode facilement disponibles, des éléments essentiels de cette expérience comme la mesure des fréquences de fracas et de l'évaluation des diagrammes de diffraction peut être complété à très faible coût.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous remercions Tzlil Rozenblat, Alexandra Bello et Karl Spuhler pour l'assistance technique. Ce travail a été soutenu par le Vassar College Undergraduate Summer Research Institute (URSI), Lucy Maynard Fonds recherche sur le saumon et la NASA prix # NX09AU90A, la National Science Foundation Center pour l'excellence de la recherche en science et technologie (NSF-CREST) # 0630388 prix et la NSF # 1058385 prix.
matériels
| Name | Company | Catalog Number | Comments |
| Nom | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| Laser HeNe 543 nm | Melles Griot | LGX1 | Un laser dans le visible avec moins de 5 mW peut être utilisé. |
| 2 à l'avant en aluminium Miroirs de surface | Thorlabs | PF10-03-F01 | |
| High Speed Exilim caméra | Casio | ||
| Quartz Cuvette | Les cellules Starna | 21/G/5 | |
| LoggerPro (Software) | Vernier | http://www.vernier.com/products/software/lp/ | |
| Mathematica 8 | Wolfram | http://www.wolfram.com/ |
Références
- Korta, J., Clark, D. A., Gabel, C. V., Mahadevan, L., Samuel, A. D. T. Mechanosensation and mechanical load modulate the locomotory gait of swimming C. elegans. J. Exp. Biol. 210, (2007).
- James, J. F. . A student's guide to Fourier transforms with applications in physics and engineering. , (1995).
- Pierce-Shimomura, J. T., Chen, B. L., Mun, J. J., Ho, R., Sarkis, R., McIntire, S. L. Genetic analysis of crawling and swimming locomotory patterns in C. elegans. Proc. Natl. Acad. Sci. USA. 105, 20982-20987 (2008).
- Li, W., Feng, Z., Sternbert, P. W., Xu, X. Z. S. A C. elegans stretch receptor neuron revealed by a mechanosensitive TRP channel homologue. Nature. 440, 684-687 (2006).
- Stiernagle, T., ed, W. o. r. m. B. o. o. k. ,. Maintenance of C. elegans. WormBook. , (2006).
- Eells, R., Lueckheide, M., Magnes, J., Susman, K., Rozenblat, T., Kakhurel, R. Dynamic Diffraction Analysis and the Transformation of C. elegans. , (2011).
- Magnes, J., Raley-Susman, K. M., Melikechi, N., Sampson, A., Eells, R., Bello, A., Lueckheide, M. Analysis of Freely Swimming C. elegans using Laser Diffraction. O. J. Biphys. , (2012).
- Magnes, J., Raley-Susman, K. M., Sampson, A., Eells, R. Locomotive Analysis of C. Elegans through Diffraction, Control number: 348 Session: JTuA - Joint FiO/LS Poster Session I Pres. number: JTuA39. , (2010).
- Kim, N., Dempsey, C. M., Kuan, C. J., Zoval, J., O'Rourke, E., Ruvkun, G., Madou, M. J., Sze, J. Y. Gravity fource transduced by the MEC-4/MEC-10 DEG/EnaC channel modulates DAF-16/FoxO activity in Caenorhabditis elegans. Genetics. 177, 835-845 (2007).
- Park, S., Hwang, H., Nam, S. -. W., Martinez, F., Austin, R. H., Ryu, W. S. Enhanced Caenorhabditis elegans locomotion in a structured microfluidic environment. PLOS One. 3, e2550 (2008).
- Keller, H. E., Pawley, J. B. Objective Lenses for Confocal Microscopy. Handbook of Biological Confocal Microscopy. , 145-161 (2006).
- Martin, L. C. . TECHNICAL OPTICS. II, (1950).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon