Method Article
Préparation et inactivation des agents pathogènes des doubles produits Buffy Coat dose de plaquettes à l'aide du système sanguin INTERCEPT
Dans cet article
Résumé
Cet article décrit le processus utilisé par Örebro University Hospital pour produire des plaquettes à double couche leuco-plaquettaire dose des concentrés préparés à partir de dons de sang total et traitées avec INTERCEPT Blood System pour l'inactivation des agents pathogènes. La In vitro La qualité des unités finales plaquettes sont évaluées sur 7 jours de stockage.
Résumé
Les centres de transfusion sont confrontés à de nombreux défis, y compris le rendement de production de maximiser les dons de produits sanguins qu'ils reçoivent ainsi que d'assurer le plus haut niveau de sécurité possible pour les patients transfusés, y compris la protection contre les maladies transmissibles par transfusion. Cela doit être fait d'une manière financièrement responsable qui minimise les frais d'exploitation, y compris les consommables, les équipements, les déchets et les coûts de personnel, entre autres.
Plusieurs méthodes sont disponibles pour produire des concentrés de plaquettes pour transfusion. Un des plus commune est la méthode de la couche leuco-plaquettaire dans laquelle une seule unité thérapeutique de plaquettes (≥ 2,0 x10 11 plaquettes par unité ou par les réglementations locales) est préparé par la mise en commun de la couche leuco-plaquettaire à partir de six dons de sang total. Un procédé de production de "double dose" plaquettes dérivées du sang total n'a été que récemment mis au point.
Présenté ici est un nouveau procédé de préparationdeux plaquettes sanguines dose entière concentrés dérivés de pools de couches leucocytaires 7 et ensuite traiter les unités de dose double avec INTERCEPT Blood System pour l'inactivation des agents pathogènes. INTERCEPT a été développé pour inactiver les virus, les bactéries, les parasites et les cellules contaminantes donateurs blancs qui peuvent être présents dans les dons de sang. Jumelage avec INTERCEPT la méthode de la couche leuco-plaquettaire double dose en utilisant le traitement INTERCEPT Set avec Conteneurs de stockage doubles (le «jeu DS"), permet aux centres sanguins pour traiter chacune de leurs unités de dose double en une seule série de traitement d'inactivation des pathogènes, maximisant ainsi la sécurité des patients tout en minimisant les coûts. La méthode de double dose couche leuco-plaquettaire nécessite moins de couches leuco-plaquettaires et réduit l'utilisation de consommables de plus de 50% (par exemple, la mise en commun des ensembles, ensembles de filtre, la solution additive plaquettaire, et gaufrettes connexion stérile) par rapport à la préparation et au traitement des unités à dose unique couche leuco-plaquettaire . Autres économies comprennent moins de déchets, moins d'équipement Maintenance, demande en énergie, réduction du temps de personnel et les coûts de collecte inférieure par rapport à la technique d'aphérèse.
Protocole
1. Collection de sang total
- Prélever le sang entier de donneurs volontaires dans 450 ml haut / bas de collecte fixe en fonction de règles locales de collecte de sang.
- Le sang entier est stocké pendant au moins 2 heures sur une plaque de refroidissement avant la centrifugation et la séparation.
2. Préparation Buffy Coat
- Centrifuger le sang total en utilisant un spin difficile de séparer le sang en trois couches: les globules rouges appauvri en leucocytes et le plasma. Centrifugeuse paramètres utilisés étaient 4.880 RCF pendant 11 min à 22 ± 2 ° C.
- Utiliser un séparateur de sang automatisé pour exprimer le plasma dans la poche satellite haut et les globules rouges (RBC) dans la poche satellite bas, laissant la couche leuco-plaquettaire dans le récipient de collecte. Cibler signifie gammes de volumes et de l'hématocrite pour couches leucocytaires sont d'environ 48 ml et 37%, respectivement.
- Les leuco-couches sont conservés pendant une nuit sur un agitateur de plaquettes à 22 ± 2 ° C.
3. Buffy Coat mise en commun
- Stérile Connect 7 buffy coats et 300 ml de SSP + solution additive plaquettaire (PAS) dans une configuration de train avec des lignes parallèles afin de réduire la longueur du train, le PAS doit être au dessus du train. Fixer la ligne entre le PAS et la première couche leuco-plaquettaire.
- Ouvrez les connexions stériles entre les unités de couche leuco-plaquettaire et permettre au manteau buffy s'écouler dans le dernier conteneur.
- Ouvrez la soudure et la pince entre le PAS et la première couche leuco-plaquettaire. Permettre un tiers de la solution additive à rincer à travers chacun des récipients de couche leucocytaire séquentiellement. Répéter 2 fois plus de temps à l'aide de chaque moitié restante du PAS.
- Le volume moyen buffy coat piscine doit être d'environ 600 ml. Si le volume cible et de l'hématocrite des couches leucocytaires individuelles sont respectées, le ratio plasma sera de 32 à 47% selon les besoins pour le traitement d'inactivation des pathogènes INTERCEPT tard dans le processus.
- Jeter le vide SSP + et buffyconteneurs manteau.
- Pour la récupération des plaquettes optimales, la piscine sur l'agitateur pendant 1 h avant la centrifugation.
- Stérile connecter un conteneur de stockage de plaquettes avec filtre intégré la réduction leucocytaire à la piscine de la couche leucocytaire.
- Effectuer un "mouvement rotatif doux" de la piscine de la couche leucocytaire pour séparer les globules rouges à partir des plaquettes en suspension (462 RCF pendant 9 min, 20 sec). Exprimer la suspension de plaquettes à l'aide d'un séparateur de sang automatisé par l'intermédiaire du filtre de leucoréduction dans le récipient de stockage des plaquettes.
- Les exigences de traitement décrites précédemment veiller à ce que la suspension de plaquettes est conforme aux spécifications de traitement INTERCEPT de 300 ml - 420 ml de volume, de 2,5 à 7,0 x 10 11 plaquettes de dose et ≤ 4 x 10 6 / ml de globules rouges.
4. INTERCEPT traitement
- Effectuer le traitement INTERCEPT avant la fin du jour 1 après la collecte (jour 0 est le jour de la collecte).
- Déballez le kit de traitement INTERCEPTavec les réservoirs de stockage double de la pochette en plastique transparent.
- Connecter le récipient stérile suspension de plaquettes de la tubulure du récipient amotosalen sur le poste de traitement INTERCEPT.
- Étiqueter les contenants de traitement INTERCEPT ensemble de stockage avec l'identification du produit sanguin approprié selon les exigences locales.
- Accrocher les plaquettes et rompre la canule premier fond sur le récipient amotosalen, permettant à la solution amotosalen à s'écouler dans le récipient d'éclairage. Rompre la canule sur le récipient supérieur amotosalen permettre aux plaquettes de s'écouler à travers le récipient dans le récipient amotosalen illumination.
- Mélanger doucement le mélange de plaquettes et amotosalen et exprimer l'air du récipient dans le récipient d'éclairage amotosalen.
- Exprimer une petite quantité du mélange des plaquettes dans le tube, de remplissage d'environ 4 cm de la tubulure. Cela garantit plaquettes dans les tubes et conteneurs éclairage subir l'agent pathogène inactivatisur le traitement.
- Sceller le tuyau entre le réservoir et le récipient d'éclairage amotosalen. Laisser pas plus d'environ 4 cm de tube s'étendant à partir du récipient d'éclairage. Retirez et jetez la plaquette contenants vides amotosalen et fermer les pinces sur les sachets d'échantillonnage.
- Placer l'ensemble de traitement dans le dispositif d'éclairage avec le récipient d'éclairage dans le grand compartiment sur la gauche et l'organisateur dans le petit compartiment sur le côté droit.
- Utilisez le code-barres dispositif tenu à la main pour saisir l'ID don, code produit, numéro de lot et le traitement des jeux dans l'illuminateur. Fermez le couvercle de métal et lorsque vous êtes invité sur l'interface graphique d'éclairage, fermer le tiroir. Appuyez sur "Start" pour lancer l'illumination.
- Après illumination, retirez l'ensemble de traitement de l'illuminateur. L'illuminateur imprime automatiquement le rapport de l'unité de traitement de plaquette traité (s).
- Déballez les conteneurs de l'organisateur et accrocher le platelets et poste de traitement, rompre la canule au niveau de la sortie du récipient d'éclairage, et permettre aux plaquettes de s'écouler dans le dispositif composé d'adsorption (CAD) récipient.
- Prendre soin de ne pas plier la plaquette CAD, exprimer l'air du récipient CAD dans le récipient éclairage utilisant un extracteur de plasma.
- Sceller le tube à proximité de l'orifice d'entrée du récipient de CAO. Retirer et jeter le contenant vide éclairage.
- Placez le récipient CAD avec les conteneurs de stockage connectés sur un agitateur de plaquettes pendant au moins 6 heures, mais pas plus de 16 heures. Il en résultera une diminution de amotosalen résiduel à une concentration de ≤ 2 pM.
- Après le traitement CAO, retirez les unités de plaquettes de l'agitateur. Accrochez les plaquettes. Rompre la canule et permettre plaquettes de s'écouler dans le conteneur de stockage.
- Exprimer l'air à partir des récipients de stockage dans le récipient de CAO. Laissez le dos des plaquettes de flux résiduel concentré dans les conteneurs de stockage pargravité. Sceller le tube au-dessus du raccord en Y et retirez le récipient vide CAD.
- Redistribuer le volume entre les récipients de stockage en fonction des besoins. Réglage du volume est faite par pesée des conteneurs de stockage. Sceller le tube à chaque récipient de stockage de quelques centimètres au-dessus de l'orifice d'entrée du récipient de stockage, ce qui facilite l'obtention d'un échantillon stérile du produit final, comme décrit dans 5,2.
5. Échantillonnage des produits
- Pour les tests de contrôle qualité de routine, les conteneurs de stockage définitifs peuvent être échantillonnées une fois à l'aide de la poche d'échantillonnage sur les récipients de stockage. Pour ce faire, s'assurer que l'appareil est bien mélangé plaquettes, puis ouvrez la pince à la poche et presser plusieurs fois. Sceller le tube après le sachet rempli de plaquettes. Transférer l'échantillon dans un tube de plaquettes de laboratoire appropriées et d'effectuer des essais immédiatement.
- Pour obtenir des échantillons à différents moments au cours du stockage, comme par une étude de validation, connectez stérileun récipient d'échantillonnage à nouveau le tube du récipient de stockage des plaquettes. Faire en sorte que les plaquettes sont bien mélangés avant le transfert au récipient d'échantillonnage.
6. Fonction d'évaluation in vitro
- Pour cette étude de validation, évaluation in vitro a été réalisée après le traitement CAD (Jour 1 Jour 2 ou, selon le CAD durée) et de nouveau le Jour 4 (ou le jour 5) et le jour 7. Mesures in vitro inclus volume, numération plaquettaire, le pH, gaz du sang (pO 2, pCO 2), le glucose, le lactate, et tourbillonnant.
- Le volume a été déterminé par le poids en utilisant 1,01 g / ml comme le poids spécifique des plaquettes dans une solution additive.
- Contamination d'hémoglobine a été évaluée visuellement à l'aide par rapport à un nuancier.
- Tourbillonnant a été déterminée visuellement.
- Voir le "Tableau de matériel" pour la méthodologie des tests d'autres.
7. Les résultats représentatifs
Le procédé de production double dose couche leuco-plaquettaire des plaquettes commence avec la production de couches leucocytaires individuels qui répondent aux spécifications cibles pour le volume et l'hématocrite. Comme il n'est pas pratique de mesurer l'hématocrite de l'individu couches leuco-plaquettaire lors de la validation du procédé final, nous avons commencé par entreprendre une activité visant à optimiser notre buffy coats pour s'assurer que nous pourrions rencontrer régulièrement volume cible et de l'hématocrite. Comme le montre le tableau 1, nos optimisés couches leucocytaires se compare favorablement avec les valeurs cibles à la fois du volume et de l'hématocrite à 46 ± 2 ml et 37 ± 3%, respectivement.
Après la mise en commun, le volume et de l'hématocrite de la couche leuco-plaquettaire piscine doit être d'environ 600 ml et 20%, respectivement, avant la centrifugation mouvement rotatif doux. Comme l'illustre le tableau 2, nos piscines couche leuco-plaquettaire moyenne de 615 ± 5 ml; l'hématocrite moyenne de 19 ± 1%.
Les résultats douces de centrifugation de spin dans un concentré plaquettaire double doseentrate qui répondra aux exigences d'entrée pour l'inactivation des pathogènes en utilisant le système INTERCEPT sang DS traitement ensemble. Principaux paramètres d'entrée pour le traitement INTERCEPT comprennent le volume, la numération plaquettaire, taux plasmatique, et le contenu de RBC. En outre, nous cherchons à récupérer ≥ 75% des plaquettes dans le concentré de plaquettes par rapport au pool de couches leuco. Conformément aux exigences locales, le globule blanc du sang (WBC) la contamination doit être <1x10 6 / unité. Le concentrés plaquettaires dans notre validation a rencontré les principaux paramètres de traitement INTERCEPT ainsi que les objectifs de la contamination WBC et la récupération plaquettaire, comme indiqué dans le tableau 3.
Le processus INTERCEPT pour l'inactivation des agents pathogènes est réalisée sur le concentré plaquettaire dose double en utilisant un ensemble unique de traitement INTERCEPT. L'ensemble de traitement comporte deux réservoirs de stockage intégrés qui permettent à l'unité de traitement pour être divisé en deux doses thérapeutiques individuelles des plaquettes à la fin du trajetprocessus d'inactivation du fibrinogène. Directives européennes exigent que 75% des unités testées contiennent ≥ 200x10 9 plaquettes par dose1 thérapeutique, des exigences locales en Suède exigent que 75% des unités testées contiennent> 240x10 9 plaquettes par dose. Après le traitement INTERCEPT, la teneur moyenne en plaquettes était de 265 ± 22 x10 9 (n = 24). En outre, 88% des unités atteint ou dépassé 240x10 9 plaquettes par dose thérapeutique, ce qui est bien dans les deux directives et règlements européens suédois. Voir les figures 1 et 2 pour une illustration de la préparation couche leuco-plaquettaire double dose et procédés de traitement INTERCEPT respectivement.
Pour cette validation, nous avons mesuré le caractéristiques in vitro de la concentrés de plaquettes INTERCEPT après le traitement (après la scission dans les conteneurs de stockage individuels), les paramètres ont été mesurés sur 7 jours de stockage. Moyenne et l'écart type ont été recueillies pourdose de plaquettes, le pH, pO 2, pCO 2, la production de lactate et de la consommation de glucose.
La figure 3 montre la moyenne de la dose initiale du concentré plaquettaire double dose de plaquettes avant traitement INTERCEPT et la dose moyenne de plaquettes dans chacun des produits fractionnés après le traitement INTERCEPT plus de 7 jours de stockage. Perte de plaquettes pendant le stockage était d'environ 9%. Cette réduction n'est pas différent de la perte attendue des plaquettes pendant le stockage des plaquettes conventionnelles 2.
Le tableau 4 résume les caractéristiques in vitro sur des plaquettes INTERCEPT après le traitement et la séparation en unités individuelles.
Conformément aux exigences européennes, le pH des plaquettes doit rester au-dessus de 6.4 à la fin de la durée de vie. Au cours du traitement, le pH de la concentrés de plaquettes diminue légèrement en fonction de la concentration des plaquettes, le volume et la perméabilité aux gaz de la plaquette de storécipient rage. Figure 4 illustre le pH des produits fractionnés de plaquettes de plus de 7 jours de stockage. Pendant le stockage, le pH est stable et bien maintenue dans les conditions de traitement.
Comme le montre les figures 5A et 5B, la plaquette consommation d'O 2 et de la production de CO 2 indiquent la respiration poursuivi par les plaquettes INTERCEPT dans le conteneur PL2410 pendant 7 jours de stockage. Figures 6A et 6B montrent les taux de lactate et de glucose de plus de 7 jours de stockage . La consommation de glucose et la production de lactate plaquettes sont compatibles les uns avec les autres pendant les 7 jours de stockage. 5 unités avaient un niveau de glucose inférieur à 1,11 mmol / l (la limite inférieure pour le dosage du glucose).
La préparation de la couche leucocytaire et plaquettaire de validation mise en commun des concentrés produits qui répondaient aux critères d'entrée pour le traitement INTERCEPT, plus précisément, le volume, la numération plaquettaire, taux plasmatique et rouge blcontamination par les cellules ood. Les unités finales rencontré les critères de validation de plus de 7 jours de stockage, y compris dose de plaquettes et le pH.
| Paramètre | Fourchette cible | Résultats La moyenne ± écart-type |
| Volume (ml) | ~ 48 | 46 ± 2 |
| Hématocrite (%) | ~ 37 | 37 ± 3 |
| Tenez temps avant la mise en commun | Nuit sur l'agitateur | Nuit sur l'agitateur |
Tableau 1 Caractéristiques. Manteaux de l'individu Buffy (n = 19).
| Paramètre | Fourchette cible | Résultats La moyenne ± écart-type |
| Volume (ml) | ~ 600 | 615 ± 5 |
| Hematocrit (%) | ~ 20 | 19 ± 1 |
| Le temps de maintien avant centrifugation | 1 heure sur agitateur | 1 heure sur agitateur |
Tableau 2 Caractéristiques. Des Fonds couche leuco-plaquettaire (n = 12).
| Paramètre | Cible | Résultats La moyenne ± écart-type |
| Volume (ml) | 370 à 420 | 404 ± 8 |
| Numération plaquettaire (x10 9 / unité) | 250 à 700 | 577 ± 62 |
| Taux de récupération moyen des plaquettes (%) | ≥ 75 | 75 ± 4 |
| Rapport plasma (%) | 32 à 47 | 38 ± 1 |
| RBC (x10 6 / ml) | ≤ 4 | 1,2 ± 0,4 |
| WBC (x10 6 / unité) | ≤ 1 | 0,11 ± 0,1 |
| Tenez temps avant INTERCEPT (h) | ≤ fin du jour 1 | ≤ fin du jour 1 |
Caractéristiques Tableau 3. Du plaquettaire double dose Concentrés (n = 12).
| Moyenne ± SD | Min | Max | |
| Volume (ml) | 199 ± 16 | 182 | 236 |
| Numération plaquettaire (x10 9 / unité) | 265 ± 22 | 225 | 292 |
| pH (22 ° C) | 6,9 ± 0,1 | 6,8 | 7.0 |
| pO 2 (kPa) | 21,4 ± 4,8 | 12,8 | 27,3 |
| pCO 2 (kPa) | 4.3 & jusmn, 0,4 | 3,3 | 4,9 |
| Lactate (mmol / l) | 9,1 ± 1,7 | 6,8 | 12,4 |
| Glucose (mmol / l) | 5,3 ± 0,9 | 3,7 | 6,5 |
Caractéristiques Tableau 4. Du jour INTERCEPT plaquettes traitées 1/2 (unités uniques, n = 24).
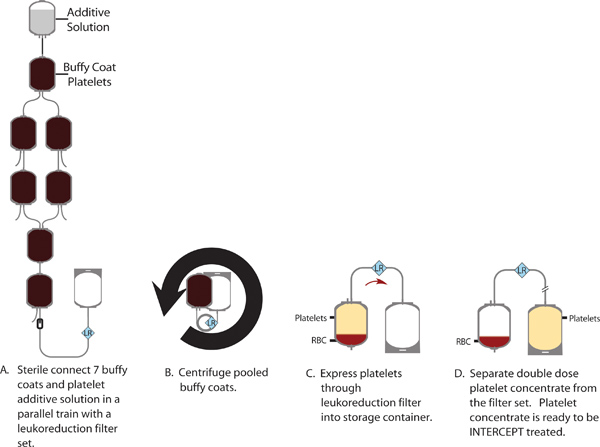
Figure 1. Production d'un concentré plaquettaire double dose d'un pool de 7 couches leucocytaires.
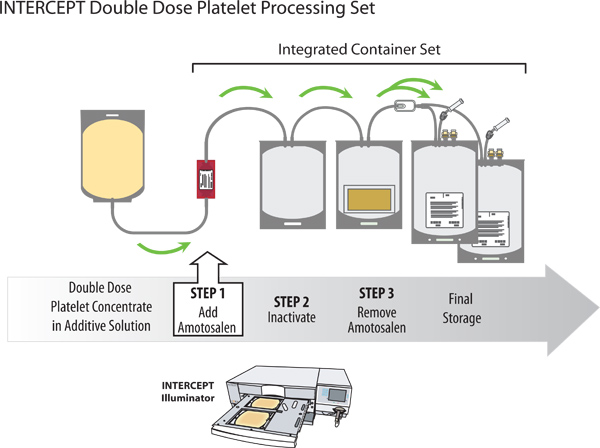
Figure 2. Inactivation des agents pathogènes d'un concentré plaquettaire double dose avec le système sanguin INTERCEPT.
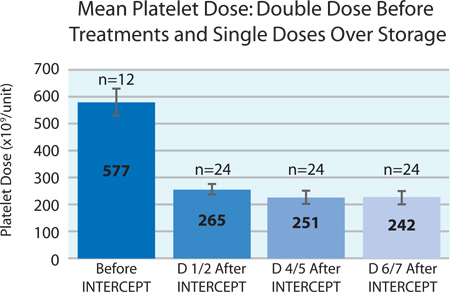
Figure 3. La dose moyenne plaquettes avant et pendant7 jours après le traitement INTERCEPT (n = 12 avant INTERCEPT, n = 24 après INTERCEPT).
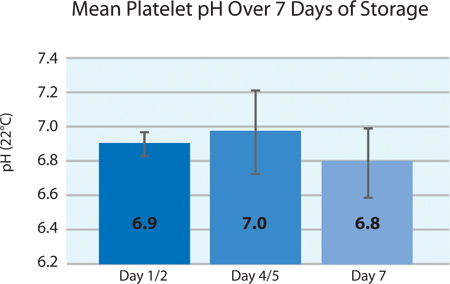
Figure 4. PH moyen ± écart-type plaquettaire après le traitement INTERCEPT (n = 24).
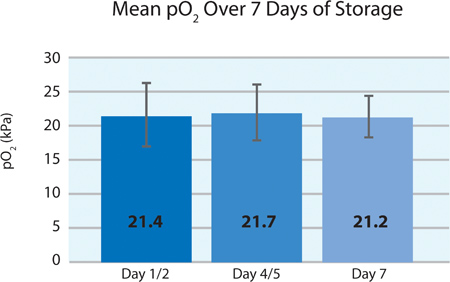
La figure 5A. Moyenne ± écart-type pO 2 après le traitement INTERCEPT (n = 24).
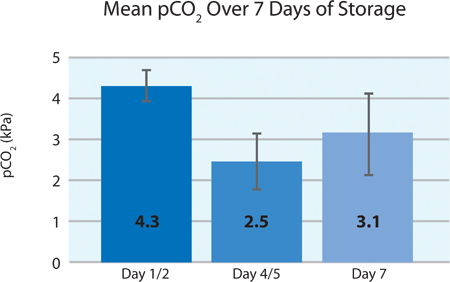
La figure 5B. Moyenne ± écart-type pO 2 après le traitement INTERCEPT (n = 24).
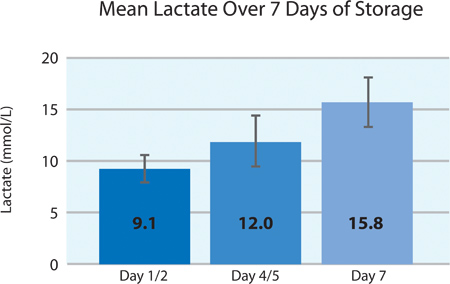
La figure 6A. Moyenne ± écart type des taux de lactate après le traitement INTERCEPT (n = 24).
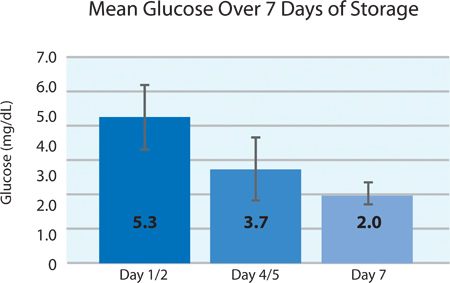
La figure 6B. Moyenne des niveaux de glucose etplusmn; SD après le traitement INTERCEPT (n = 24).
Discussion
Couche leuco-plaquettaire nécessitent plusieurs étapes de traitement qui résultent en post-collecte coûts, y compris le temps du personnel, les consommables, l'équipement et les déchets, qui doit être pris en compte dans le coût global de la production des unités de plaquettes. Amélioration du rendement des plaquettes de chaque couche leuco-plaquettaire (via l'optimisation du volume de la couche leucocytaire et de l'hématocrite) permet la production d'une unité à double couche leuco-plaquettaire dose de plaquettes à partir d'un pool de couches leuco-plaquettaires sept. Lorsque cette optimisation est réalisée, le nombre de couches leucocytaires nécessaire pour produire un nombre fixe de doses de plaquettes peut être réduite, ce qui améliore l'utilisation globale de la couche leuco et permettant la production de plaquettes supplémentaires de concentrés (PC). Temps du personnel ainsi que les coûts de consommables et d'équipements tels que des ensembles de mise en commun, la solution additive plaquettaire, plaquettes de connexion stériles, ensembles de filtre, et les procédures de centrifugation sont réduites jusqu'à 50%. En plus d'optimiser la production de plaquettes et de réduire les coûts associés, this la mise en commun méthode peut générer un concentré de plaquettes (CP) qui répond aux exigences d'entrée pour une utilisation avec l'ensemble INTERCEPT de stockage à double traitement des conteneurs, ce qui nous permet d'offrir une meilleure protection à nos receveurs de transfusions aussi bien.
Le système sanguin INTERCEPT pour l'inactivation des agents pathogènes utilise amotosalen et les rayons ultraviolets A (UVA) de façon covalente réticuler l'ADN et de l'ARN, la prévention de réplication des acides nucléiques et des agents pathogènes rendu incapables de provoquer une maladie. 3 Il inactive efficacement un large spectre d'agents pathogènes tels que les virus, les bactéries , les parasites et les contaminants cellules de sang blanches. 4-6 INTERCEPT fournit une alternative au paradigme actuel tests pour les pathogènes émergents, ce qui implique historiquement un retard considérable alors qu'un nouveau test est développé et exige finalement un investissement financier important pour mettre en œuvre lors d'un test devient disponible. 7,8 Il peut également fournir une alternative aux mesures de sécu redondanteres telles que la détection bactérienne 9 et irradiation gamma. 10-12 En outre, INTERCEPT nous permet de traiter doubles unités de plaquettes dose qui profite à l'efficacité de notre production et nous aide à respecter nos budgets.
INTERCEPT et la méthode de double dose couche leuco-plaquettaire peut être adapté à une multitude de tâches de sang du centre. À titre d'exemples, collectes de sang total peut être augmenté à 500 ml; collections pourraient aussi être stockée pendant la nuit à 22 ° C avant la séparation. En outre, un autre procédé de mise en commun de la couche leucocytaire est possible (par exemple un procédé de poulpe à la place d'un procédé de train) et / ou un dispositif automatique (par exemple TACSI) peuvent être utilisés pour la deuxième centrifugation et séparation de la suspension de plaquettes à partir des cellules restantes rouges .
Si augmentation de la teneur en plaquettes est nécessaire, plusieurs techniques sont disponibles, y compris de pré-sélection des donneurs sur la base de la numération plaquettaire, une nuit d'incubation du sang total, adjustement des paramètres de centrifugation, ou en utilisant un pool de couches leuco-plaquettaires 8 au lieu de 7.
En raison de la limitation de la mise en commun établit actuellement disponible et la capacité des pots à centrifuger, le volume total de la piscine de la couche leucocytaire doit être d'environ 600 ml. Le processus de centrifugation et les paramètres décrits dans le présent protocole ont été optimisés pour obtenir un produit qui répond aux paramètres INTERCEPT pour un pool de couches leuco-plaquettaires 7. Les paramètres de centrifugation doit être modifié si le nombre de couches leucocytaires dans la piscine est modifié.
Dans certains pays, la dose minimale des plaquettes est plus élevé et les exigences de CQ sont plus strictes que dans la Suède. Ainsi, nos résultats ne sont pas universellement applicables. Dans ces pays, le PC double dose avant le traitement INTERCEPT devra contenir un plus grand nombre de plaquettes afin de répondre aux exigences locales après traitement INTERCEPT et split. Parce que la teneur maximale des plaquettes et volume de traitement for INTERCEPT sont 7x10 11 plaquettes et 420 ml respectivement, le pourcentage d'unités qui dépassent les exigences de traitement INTERCEPT ou n'ont pas suffisamment de contenu plaquettaire être divisée en deux doses thérapeutiques, varieront en fonction de facteurs tels que les exigences locales de dose de plaquettes, les critères QC, résultats buffy coat optimisation et la stabilité de la production.
Si un PC double dose dépasse les exigences de traitement INTERCEPT, il peut être ajustée manuellement pour répondre aux exigences et ultérieurement traitées. Dans les rares occasions où le pool de couches leuco-7-plaquettes rendements insuffisants pour un produit double dose après INTERCEPT, nous choisissons de ne pas effectuer le traitement INTERCEPT. Alternativement, d'autres centres de transfusion peuvent choisir de traiter le PC avec un ensemble de traitement INTERCEPT dose unique (c'est à dire l'ensemble de grand volume) et stocker le PC en une seule dose thérapeutique plus large, réalisant ainsi l'inactivation des pathogènes sur toutes les unités. Afin de nous assurer de répondre à notreExigences et aux agents pathogènes QC inactiver le plus grand nombre de nos unités de plaquettes que possible, nous sélectionnons couches leucocytaires basées sur les comptes des bailleurs de fonds de plaquettes, qui, une fois regroupés, se traduira par une teneur minimale des plaquettes de 5.6x10 11 plaquettes dans la piscine. Cela garantit suffisamment le contenu des plaquettes pour produire deux doses thérapeutiques après traitement INTERCEPT.
Notre validation démontre que 7 unités dérivées de sang total couche leuco-plaquettaire peuvent être mises en commun et avec succès traité par le procédé INTERCEPT pour les plaquettes, résultant en 2 pathogènes inactivés produits plaquettaires qui répondent aux critères d'acceptation pour la fabrication (suédois exigences et les lignes directrices européennes) et pour le soutien des patients nécessitant des transfusions de plaquettes selon les lignes directrices de pratique clinique et les méthodes standards de perfusion de plaquettes en Suède.
Déclarations de divulgation
Production et le libre accès à cet article est sponsorisé par Cerus.
Remerciements
Le financement de la publication est assurée par Cerus Corp, le fabricant du système sanguin INTERCEPT.
matériels
| Name | Company | Catalog Number | Comments |
| Whole blood donation, primary separation, and platelet production | |||
| Blood collection pack | Fenwal | R6485 | Top/Bottom set |
| Automated component extractor | Fenwal | Optipress-II | |
| Blood mixer and balance system | Baxter | Easymix V3 | |
| Platelet leukocyte filtration set | Fenwal | K4R7042 | |
| Centrifuge | Hettich | Roto Silenta 63 RS | Version 5.5 |
| Platelet additive solution - SSP+ | MacoPharma | SSP2030U | 300 ml |
| Sterile tubing welder | Terumo | T-SCD | |
| INTERCEPT treatment & storage | |||
| INTERCEPT processing set |  Cerus Cerus | INT2503 | Dual Storage (DS) set |
| INTERCEPT Illuminator |  Cerus Cerus | INT100 | |
| PC sample pack | Fenwal | FTX 1122 | |
| Incubator | Helmer | PC2200/PC3200 | |
| Agitator | Helmer | PF48H/PF96H | |
| Evaluation of in vitro Platelet Function | |||
| Blood gas analyzer | Radiometer | ABL 735 | Used for pH, blood gases, and lactate measurement |
| Chemistry system | Ortho Clinical Diagnostic | Vitros 5.1 | Used for glucose measurement |
| Hematology analyzer | Boule Medical AB | Medonic CA620-Cellguard | Used for platelet count measurement |
| Flow cytometer | BD | FACSCanto | Used for white blood cell measurement |
Références
- . . Guide to the preparation, use and quality assurance of blood components. , (2010).
- Van Rhenen, D. J., Vermeij, J., Mayaudon, V., et al. Functional characteristics of S-59 photochemically treated platelet concentrates derived from buffy coats. Vox Sang. 79, 206-214 (2000).
- Wollowitz, S. Targeting DNA and RNA in pathogens: mode of action of amotosalen HCl. Transfus. Med. Rev. 31, 11-16 (2004).
- Irsch, J., Lin, L. Pathogen Inactivation of Platelet and Plasma Blood Components for Transfusion Using the INTERCEPT Blood SystemTM. Transfus. Med. Hemother. 38, (2011).
- Lin, L., Dikeman, R., Molini, B., et al. Photochemical treatment of platelet concentrates with amotosalen and long-wavelength ultraviolet light inactivates a broad spectrum of pathogenic bacteria. Transfusion. 44, 1496-1504 (2004).
- Lin, L., Hanson, C., Alter, H., et al. Inactivation of viruses in platelet concentrates by photochemical treatment with amotosalen and long-wavelength ultraviolet light. Transfusion. 45, 580-590 (2005).
- Allain, J. P., Cianco, C., Blajchman, A., et al. Protecting the blood supply from emerging pathogens: the role of pathogen inactivation. Transfus. Med. Rev. 19, 110-126 (2005).
- Stramer, S., Hollinger, F., Katz, L., et al. Emerging infectious disease agents and their potential threat to transfusion safety. Transfusion. 49, 1S-29S (2009).
- Nussbaumer, W., Allesdorfer, D., Grabmer, C., et al. Prevention of transfusion of platelet components contaminated with low levels of bacteria: a comparison of bacteria culture and pathogen inactivation methods. Transfusion. 47, 1125-1133 (2007).
- Schlenke, P. Protection against Transfusion-Associated Graft-versus-Host Disease in Blood transfusion: Is Gamma-Irradiation the Only Answer? Transfus. Med. Hemother. 31, 24-31 (2004).
- Lin, L., Corash, L., Osselear, J. C. Protection Against TA-GVHD Due to Platelet Transfusion By Using Pathogen Inactivation with the INTERCEPT Blood SystemTM - Gamma Irradiation is Not the Only Answer. Haematologica. 95 (Extra 1), 230-237 (2010).
- Corash, L., Lin, L. Novel processes for inactivation of leukocytes to prevent transfusion-associated graft-verus-host disease. Bone Marrow Transplant. 33, 1-7 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon