Method Article
Gradient de densité multicouche de polymérisation (DGMP): une nouvelle technique pour la création multi-compartiment, échafaudages personnalisables pour l'ingénierie tissulaire
Dans cet article
Résumé
Nous décrivons ici une stratégie unique pour créer des matrices biocompatibles, en couches avec des interfaces continues entre des couches distinctes pour l'ingénierie tissulaire. Un tel échafaudage pourrait fournir un environnement idéal personnalisable pour moduler le comportement cellulaire par différents indices biologiques, chimiques ou mécaniques
Résumé
Matrices complexes de culture de tissus, dans lequel les types et les concentrations de stimuli biologiques (par exemple des facteurs de croissance, des inhibiteurs ou des petites molécules) ou de la structure de matrice (par exemple la composition, la concentration ou la rigidité de la matrice) varient dans l'espace, permettrait à un large éventail d'enquêtes concernant la façon dont ces variables influent sur la différenciation cellulaire, la migration et d'autres phénomènes. Le défi majeur dans la création de matrices stratifiés est le maintien de l'intégrité structurale des interfaces des couches sans diffusion de composants individuels de chaque couche 1. Les méthodes actuelles pour atteindre cet objectif comprennent PHOTOSTRUCTURATION 2-3, lithographie 4, functionalization5 séquentiel, lyophilisation 6, microfluidique 7 ou centrifugation 8, dont beaucoup exigent une instrumentation sophistiquée et des compétences techniques. D'autres s'appuient sur la fixation séquentielle de couches individuelles, qui peuvent conduire à la délamination de couches 9 DGMP surmonte ces problèmes en utilisant un modificateur de la densité inerte tel que l'iodixanol de créer des couches de différentes densités 10. Depuis le modificateur de densité peut être mélangé à une autre molécule bioactive ou prépolymère, DGMP permet à chaque couche d'échafaudage à être personnalisés. Simplement varier la concentration du modificateur de densité empêche le mélange des couches adjacentes pendant qu'ils restent aqueuse. Subséquente seule étape de polymérisation donne lieu à une structure continue multicouche échafaudage, dans lequel chaque couche a chimique distincte et des propriétés mécaniques. Le modificateur de densité peut être facilement enlevée avec suffisamment de rinçage sans perturbation des couches individuelles ou de leurs composantes. Cette technique est donc bien adapté pour la création d'hydrogels de différentes tailles, formes et matériaux.
Un protocole de fabrication d'un 2D-polyéthylène glycol (PEG) du gel, dans lequel des couches alternées incorporer RGDS-350, est décrit ci-dessous. Nous utilisons PEG bomme il est biocompatible et inerte. RGDS, un peptide de 11 l'adhésion cellulaire, est utilisé pour démontrer restriction spatiale d'une information biologique, et la conjugaison d'un fluorophore (Alexa Fluor 350) nous permet de distinguer visuellement les différentes couches. Cette procédure peut être adaptée à d'autres matériaux (par exemple le collagène, l'acide hyaluronique, etc) et peut être étendue à fabriquer des gels 3D avec quelques modifications 10.
Protocole
1. Synthèse de l'marquées par fluorescence Acryloyl-PEG-RGDS
- Faire réagir le peptide RGDS avec acryloyl-PEG-succinimidyl ester carboxyméthylique (aPEG-SMC, PEG MW: 3400 g / mol) et NN diisopropyléthylamine (DIPEA) dans des rapports molaires 1.2:1:2 dans le diméthylsulfoxyde (DMSO), sous argon, à température ambiante pendant une nuit.
- Confirmer la conjugaison par laser assistée par matrice de désorption / ionisation de temps de vol (MALDI-TOF) par spectrométrie de masse. Ajouter 1 ml de solution réaction aPEG-RGDS à une tache d'échantillon sur la cible MALDI et sec. Préparer une solution saturée de Universal MALDI Matrix dans le tétrahydrofurane (THF) et le vortex pendant 1 min. Ajouter environ 1 ul de cette solution à l'endroit même échantillon. Répétez la procédure pour aPEG-SCM pour la comparaison. Charger et analyser. Le poids moléculaire de aPEG-RGDS doit être supérieure à aPEG-SCM (Figure 2).
- À conjuguer le fluorophore, ajouter une quantité équimolaire d'Alexa Fluor 350 acide carboxylique (ester succinimydyl), dissousdans un volume minimal de DMSO, à la solution réactionnelle aPEG-RGDS de 1,1 et à réagir sous atmosphère d'argon à température ambiante pendant une nuit.
- Purifier aPEG-RGDS-350 par dialyse (MW 3500 Da) contre DI-H 2 O à 4 ° C pendant 48 heures à rapport volumétrique 1000:1, l'échange de dialysat au moins deux fois par jour.
- Congelez sécher le purifiée aPEG-RGDS-350 dans un Labconco Freezone plus ou le système de gel équivalent sec et conserver à -20 ° C.
2. Préparation d'un moule de fabrication 2D et d'un gel de PEG 2D avec alternance Rgds-350 Couches
- Préparer des lames de verre hydrophobes. Placez lames de verre propres dans un plat en verre dans un four sous vide. La chaleur à 80 ° C pendant 30 min pour sécher complètement les surfaces. Lieu plat avec les diapositives d'une hotte et ajouter 250 ul Sigmacote à chaque diapositive, balançant doucement pendant 30 secondes à la surface de manteau tout entier. Bien rincer les lames recouvertes avec du méthanol à 100%, suivi d'un lavage à l'eau distillée, le trempage deux fois pendant 5 min dans au LEAt 10 ml.
- Couper entretoises en silicone (0,8 mm d'épaisseur) avec 10 poinçons de biopsie mm.
- Autoclaver les entretoises en silicone et des lames de verre Sigmacote traités.
- Formuler des solutions pour chaque couche respective dans des microtubes individuels par mélange PEG diacrylate (PEGDA) précurseur (concentration finale 15% v / v) avec différentes quantités de l'iodixanol (solution mère à 60% dans l'eau) pour obtenir des concentrations finales variant (par exemple 40%, 30%, 20% et 10%), complétant le volume restant avec du tampon phosphate salin (PBS) pour obtenir des solutions de densité à gradient. De la même manière, pour les couches alternées, mélange aPEG-RGDS-350 (concentration finale de 8 mM) avec iodixanol et PBS pour obtenir des concentrations différentes (par exemple, 35%, 25% et 15%).
- Ajouter photo-initiateur (2-hydroxy-4'-(2-hydroxyéthoxy)-2-méthylpropiophénone, stock 333mg/ml en N-vinylpyrrolidone) à chaque solution pour différentes couches (10 ul de solution mère par ml de chaque solution de couche). Photoinitiateur is ajouté en dernier pour éviter la polymérisation avant la superposition des gels dans le moule, car elle est sensible à la lumière.
- Les étapes suivantes de ce protocole sera effectué dans une enceinte de biosécurité pour garantir la stérilité.
- Filtrez-stériliser chaque solution à l'aide d'une seringue de 1 ml stérile et filtre de 0,2 um. Assembler le réglage de moule en prenant en sandwich l'élément d'espacement entre deux lames de verre imprégnées et Sigmacore avec des colliers de placer comme illustré à la figure 1.
- Jeter les gels couches en ajoutant la solution la plus dense (par exemple PEGDA avec iodixanol 40%) en premier, suivi par une solution moins dense (par exemple aPEG-RGDS-350 avec iodixanol 35%). Répétez la réalisation alternative de couches pour atteindre plusieurs couches de composition souhaitée et la densité comme le montre la figure 1.
- Irradier le moule avec de la lumière à 365 nm pendant 3 min en utilisant un portable UVR-9000 lampe. Laisser les gels polymérisés durcir pendant 5 min. Retirer les pinces, puis soulevez doucement le dessus en verretoboggan et le moule, les gels DGPM stratifiés restera sur les diapositives. En utilisant une spatule stérile, placer soigneusement les gels dans un tube de 50 ml contenant du PBS stérile ou milieu de culture pour le lavage.
- Laver les gels polymérisés dans du PBS à 1,000:1 rapport volumétrique, l'échange de tampon au moins deux fois par jour pour éliminer le modificateur de densité, photo-initiateur, et le polymère qui n'a pas réagi. En variante, PBS peut être échangé avec un milieu de croissance cellulaire. Stocker les gels DGPM dans du PBS ou un milieu de croissance pour l'expérience de culture cellulaire décrit à l'étape 3.
- Pour visualiser des couches alternées, organiser gel DGMP (ces gels ne seront pas utilisables pour la culture cellulaire) le long d'une règle sur le plateau d'échantillons d'une unité VersaDoc documentation de gel. Exposer les gels à 350 nm, le temps d'exposition varie en fonction de la concentration du fluorophore. Une alternance de bandes sombres et bleu dans l'hydrogel DGMP démontrer la formation de couches discrètes de composition chimique distincte (figure 3).
3. Culture cellulaire 2D sur gels DGPM
- Pour les gels incorporant peptide RGDS, utiliser des cellules d'adhérence dépendants, tels que myoblastes C2C12.
- Insérez doucement gels DGPM (stocké dans du PBS) dans les puits de plaques à 48 puits de culture cellulaire en utilisant un grattoir à cellules stérile dans une enceinte de sécurité biologique.
- Milieu de croissance pré-chaud (milieu de Dulbecco modifié Eagle ou DMEM supplémenté avec 10% v / v de sérum de veau fœtal et 1% v / v 100x solution de pénicilline-streptomycine) et de PBS dans un bain-marie réglé à 37 ° C.
- Laver une plaque 60% de confluence (10 mm) de cellules C2C12 trois fois avec du PBS. Aspirer PBS et les cellules de récolte en ajoutant 1 ml de 0,25% de trypsine-EDTA et incuber à 37 ° C pendant 2 min. Remettre en suspension les cellules dans un milieu de croissance et des cellules de comptage. Ensemencer la DGMP gel contenant de la culture cellulaire et avec des myoblastes C2C12 (20.000 cellules / cm 2). Incuber les cellules à 37 ° C dans 5% de CO 2/95% d'humidité relative. Moyen d'échange doucement au bout de 4 h, attention à ne pas redéplacer légèrement cellules adhérentes.
- Après 24 h, la fixation des myoblastes C2C12 sur les couches RGDS contenant des gels DGPM peut être confirmé par épifluorescence et microscopie à contraste de phase (Zeiss Axiovert 200).
Résultats
MALDI-TOF confirme la conjugaison du peptide RGDS à acryloyl-PEG (figure 2). Gel d'imagerie révèle alternance Rgds-350 (bleu) couches après photopolymérisation (figure 3A). Comme le montre la figure 3A, la taille 2D gel DGMP peut varier en fonction du diamètre des moules en silicone (10 mm, gauche, 8 mm, à droite), et donc sont facilement personnalisables pour une utilisation dans des essais multiples - dans ce cas, pour s'adapter à un 48 plaques à puits culture cellulaire (figure 3B). Épifluorescence et microscopie à contraste de phase de myoblastes C2C12 cultivées sur un gel de DGMP montre une fixation sélective sur RGDS-350-PEG contenant des couches (figure 4), ce qui démontre la compartimentation du peptide d'adhésion cellulaire (RGDS).
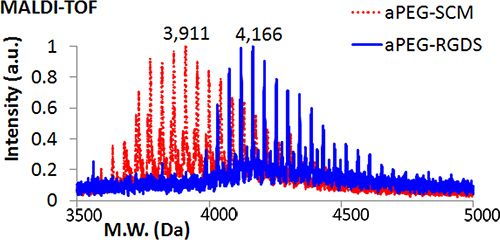
Figure 1. Moléculaire Weight analyse par MALDI-TOF comparant aPEG-SCM pour APEG-RGDS obtenus après conjugaison du peptide RGDS.
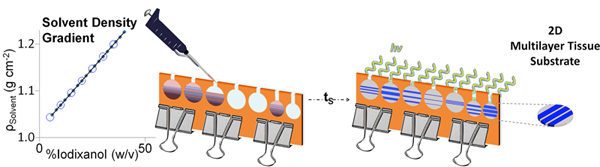
Figure 2. Représentation schématique de la DGMP gel de fabrication. Après les gradients sont superposés, ils peuvent être autorisés à s'installer pour des périodes de temps (t s) de créer des interfaces graduées, suivis par photopolymérisation. Stratifiés gels DGPM peut être facilement extraite du moule pour une utilisation ultérieure. Cliquez ici pour agrandir la figure .

Figure 3. A) 2D gels multicouches obtenus après photopolymérisation imagée en utilisant 350 nm et blancs canaux de lumière VersaDoc unité de documentation de gel. L'image noir et blanc montre une alternance de couches contenant RGDS en blanc. B) Insertion de gel DGMP dans 48 puits, boîtes de culture cellulaire.

Figure 4. Contraste de phase et l'image fusionnée à épifluorescence des myoblastes C2C12 cultivées sur des gels DGMP (échelle de bar 50 m).
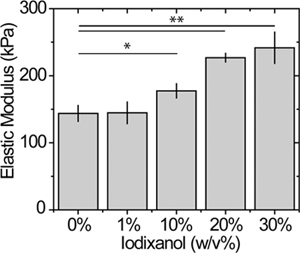
Figure 5. Effet de l'iodixanol sur l'élasticité de la surface du gel. Atomic mesures par microscopie à force d'échantillons statiques de substrats PEG réticulées en utilisant des méthodes déjà établies avec un déclencheur 2 nN vigueur 12. * P <0,05 et ** p <0,01.
Discussion
DGMP est une stratégie simple pour la préparation de gels multicouches qui ne repose pas sur une instrumentation coûteuse. Ce protocole peut être adapté pour créer des échafaudages en utilisant d'autres matériaux biocompatibles, tels que le collagène et l'acide hyaluronique. Petites molécules bioactives, par exemple de cellules de stimulation d'adhérence peptide RGDS, peut être attaché à la matrice de polymère pour empêcher le mélange de signaux entre les couches. Protéines peuvent être encapsulées dans des couches distinctes sans la nécessité d'une conjugaison chimique car ils en fonction de la taille de maille de matrice, sont moins sujettes à diffuser à travers les hydrogels 10. Ici, nous avons utilisé l'iodixanol (Nycoprep), un modificateur de la densité inerte, ce qui a déjà été utilisé pour des applications de cellules viables. Modificateurs de densité tels que le saccharose et le dextrose peuvent également être utilisés. En faisant varier le temps de décantation (t s), on peut peaufiner les interfaces entre deux couches pour produire des transitions en douceur ou tranchants besoin (temps de décantation donne plus des transitions plus douces) 10. Par exemple, des transitions plus douces entre les couches de gel DGPM peut être utilisé pour générer un gradient continu d'une information biologique pour l'étude des processus cellulaires tels que la chimiotaxie.
L'effet du modificateur de la densité sur la rigidité du gel est illustré à la figure 5 pour un gel de 15% aPEGda; une caractérisation plus complète de la rigidité et de la porosité en fonction de PEGDA et les concentrations iodixanol est actuellement en cours d'évaluation. Alors que la concentration PEGDA dans cet exemple est relativement élevé, nous avons observé un module élastique de 60% supérieure dans des gels avec iodixanol 30% par rapport aux gels sans. La variation de la rigidité du gel peut être réglée par modulation de la concentration ou la densité de réticulation macromère.
Nous avons également appliqué la technique DGMP pour créer en 3D en utilisant des gels de polyacrylamide multicouches et des précurseurs de PEG 10. Faire varier la concentration ou le degré de réticulation du prépolymère permet une variation structurelle dans leéchafaudages, qui peuvent être utilisées pour étudier le comportement des cellules telles que la croissance et la migration polarisée en 3D.
En résumé, DGMP est une technique adaptable qui peut être appliqué à fabriquer des échafaudages en 2D et 3D à partir d'une variété de matériaux biocompatibles pour une large gamme d'applications de recherche biomédicale et de base.
Déclarations de divulgation
Les auteurs n'ont pas de conflits d'intérêts à déclarer.
Remerciements
Les auteurs sont reconnaissants pour le soutien de bourses NIH Directeur de Innovator Nouvelles (1DP2 OD006499-01 à AA et 1DP2 OD006460-01 à AJE), et King Abdulaziz City pour la science et la technologie (UC San Diego Centre d'excellence en nanomédecine). Nous tenons à remercier Mme Jessica Moore pour ses commentaires critiques sur le manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Réactif ou instrument | Entreprise | Numéro de catalogue | |
| Polyéthylène glycol succinimydyl carboxyméthylcellulose (a-PEG-SCM) | Laysan | 120-64 | |
| Polyethelyene glycol diacrylate (PEGDA) | Labs Dajac | 9359 | |
| Arginine-glycine-acide aspartique-sérine (RGDS) | American Peptide | 49-01-4 | |
| N, N - diisopropyléthylamine (DIPEA) | Sigma | D125806 | |
| Diméthylsulfoxyde (DMSO) | Sigma | D2438 | |
| N, N-diméthylformamide (DMF) | Pêcheur | D119-4 | |
| Tétrahydrofurane (THF) | Pêcheur | T397 | |
| Cassette de dialyse (3500Da) | Thermo Scientific | 66330 | |
| Alexa Fluor 350 ester d'acide carboxylique succinimydyl | Life Technologies | A-10168 | |
| Sigmacote | Sigma | SL2 | |
| Entretoises en silicone | Grainger | 1MWA4 | |
| Pinces à biopsie | Acuderm | P1025 (10 mm) P850 (8 mm) | |
| Phosphate de Dulbecco saline tamponnée (DPBS) | Hyclone | SH30028 | |
| Iodixanol (NycoPrep) | Pêcheur | NC9388846 | |
| 2-hydroxy-4'-(2-hydroxyéthoxy)-2-méthylpropiophénone | Sigma | 410896 | |
| Dulbecco modifié Eagle (DMEM) | Life Technologies | 11054 | |
| Sérum de veau fœtal | Life Technologies | 10082 | |
| Pénicilline-streptomycine | Life Technologies | 15140 | |
| Myoblastes C2C12 | ATCC | CRL-1772 | |
| MALDI | Bruker | N / A | |
| UVR-9000 | Bayco | UVR-9000 | |
| VersaDoc | Bio-Rad | N / A |
Références
- Place, E. S., Evans, N. D., Stevens, M. M. Complexity in biomaterials for tissue engineering. Nat. Mater. 8, 457-470 (2009).
- Liu, V. A., Jastromb, W. E., Bhatia, S. N. Engineering protein and cell adhesivity using PEO-terminated triblock polymers. J. Biomed. Mater. Res. 60, 126-134 (2002).
- Sharma, B., et al. Designing zonal organization into tissue-engineered cartilage. Tissue Eng. 13, 405-414 (2007).
- Hahn, M. S., et al. Photolithographic patterning of polyethylene glycol hydrogels. Biomaterials. 27, 2519-2524 (2006).
- Kizilel, S., Sawardecker, E., Teymour, F., Perez-Luna, V. H. Sequential formation of covalently bonded hydrogel multilayers through surface initiated photopolymerization. Biomaterials. 27, 1209-1215 (2006).
- Harley, B. A., et al. Design of a multiphase osteochondral scaffold. II. Fabrication of a mineralized collagen-glycosaminoglycan scaffold. J. Biomed. Mater. Res. A. 92, 1066-1077 (2010).
- Cuchiara, M. P., Allen, A. C., Chen, T. M., Miller, J. S., West, J. L. Multilayer microfluidic PEGDA hydrogels. Biomaterials. 31, 5491-5497 (2010).
- Roam, J. L., Xu, H., Nguyen, P. K., Elbert, D. L. The formation of protein concentration gradients mediated by density differences of poly(ethylene glycol) microspheres. Biomaterials. 31, 8642-8650 (2010).
- Gleghorn, J. P., Lee, C. S., Cabodi, M., Stroock, A. D., Bonassar, L. J. Adhesive properties of laminated alginate gels for tissue engineering of layered structures. J. Biomed. Mater. Res. A. 85, 611-618 (2008).
- Karpiak, J. V., Ner, Y., Almutairi, A. Density gradient multilayer polymerization for creating complex tissue. Adv. Mater. 24, 1466-1470 (2012).
- Pierschbacher, M. D., Ruoslahti, E. Cell attachment activity of fibronectin can be duplicated by small synthetic fragments of the molecule. Nature. 309, 30-33 (1984).
- Kaushik, G., Fuhrmann, A., Cammarato, A., Engler, A. J. In Situ Mechanical Analysis of Myofibrillar Perturbation and Aging on Soft, Bilayered Drosophila Myocardium. Biophysical Journal. 101, 2629-2637 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon