Method Article
Conception et utilisation des tableaux chémostat multiplexés
Dans cet article
Résumé
Nous avons développé et validé un ensemble de petite empreinte de chemostats miniatures construits à partir de pièces facilement disponibles pour un faible coût. Évolution résulte physiologiques et expérimentales sont similaires à chemostats plus grand volume. Le tableau ministat fournit une plate-forme compacte, peu coûteux et accessible pour les expériences en chémostat traditionnels, la génomique fonctionnelle et les applications de criblage chimique.
Résumé
Chemostats sont des systèmes de culture continue dans laquelle les cellules sont cultivées dans un très contrôlé, environnement chimiquement stable où la densité de la culture est limitée par la limitation des nutriments spécifiques. 1,2 Les données de chemostats sont hautement reproductible pour la mesure des phénotypes quantitatifs car ils fournissent un taux de croissance constant et de l'environnement à l'état stationnaire. Pour ces raisons, chemostats sont devenus des outils utiles pour la caractérisation à échelle fine de la physiologie à travers l'analyse de l'expression génique 3-6 et d'autres caractéristiques des cultures à l'état stationnaire d'équilibre. 7 à long terme des expériences dans chemostats peut mettre en évidence des trajectoires spécifiques que les populations microbiennes adopter cours de l'évolution adaptative dans un environnement contrôlé. En fait, chemostats ont été utilisées pour l'évolution expérimentale depuis leur invention. 8 Un résultat commun des expériences évolution est pour chaque réplicat biologique d'acquérir un répertoire unique de mutations. 13.9 Cette diversité suggère que il reste encore beaucoup à découvrir en effectuant des expériences évolution avec un débit beaucoup plus important.
Nous présentons ici la conception et l'exploitation d'une relativement simple, array faible coût de chemostats-ou-miniatures Ministats et de valider leur utilisation dans la détermination de la physiologie et de l'évolution dans les expériences avec de la levure. Cette approche implique une croissance des dizaines de chemostats fonctionner sur un seul multiplex pompe péristaltique. Les cultures sont maintenues à un volume de 20 ml de travail, ce qui est pratique pour une variété d'applications. C'est notre espoir que d'augmenter le débit, la diminution des dépenses, et de fournir bâtiment et des instructions détaillées de fonctionnement peuvent également motiver les applications de recherche et industriel de cette conception comme une plate-forme générale pour la caractérisation fonctionnelle grand nombre de souches, les espèces et les paramètres de croissance, ainsi que génétique bibliothèques de drogue ou.
Introduction
La dynamique de la croissance microbienne et l'évolution sont essentiels à la microbiologie, l'écologie, la génétique et la biotechnologie. La méthode la plus commune de microbes culture est en mode batch, où les cellules sont ensemencées à faible densité en éléments nutritifs riches en bouillon et cultivées jusqu'à saturation. Bien que simple à réaliser en utilisant du matériel de laboratoire standard, des cultures en lots l'expérience d'un environnement chimique fluctuante et modification correspondante de la physiologie cellulaire. Cet environnement de croissance hétérogène peut entraîner des effets sur la croissance et le stress secondaires qui peuvent masquer des différences subtiles physiologiques. Évolution expérimentale par transfert par lots de série permet de sélectionner des mélanges complexes de croissance en phase sous-populations spécifiques, ce qui complique les tentatives de connexion des adaptations à des conditions sélectives. Mesure des phénotypes quantitatifs peut être difficile à cause du bruit de synchronisation des échantillons imprécis et variation des caractéristiques telles que le temps de latence. Cultures continues de fournir une alternativerégime de croissance, où les cellules peuvent être cultivées de façon reproductible dans un milieu chimiquement homogène à une vitesse de croissance définies pour atteindre un état physiologique régulier. En raison de ces avantages, les études d'évolution expérimentale et la caractérisation de l'état cellulaire utilisent souvent l'environnement contrôlé des cultures en continu comme le chemostat 14.
L'appréciation de ces avantages a conduit à un regain d'intérêt pour les cultures en chémostat 15. Depuis leur introduction en 1950, 1,2 en chémostat systèmes ont été développés pour fonctionner sur une variété d'échelles allant de litres d'microlitres et pour une variété d'applications 16. -19 Ces différents modèles, qui vont de bioréacteurs produits dans le commerce pour les navires à glassblown personnalisés plateformes microfluidiques, la part de principes généraux de conception. Enceinte de culture est agitée et aérée (en général en faisant barboter de l'air à travers celui-ci) et les microbes contenus dans celui-ci sont maintenus homogènely dispersées dans toute la chambre de culture à tout moment. Composition de milieu frais est ajouté continuellement définie et la vitesse d'addition contrôle le taux de croissance et influence de l'environnement chimique connu par la culture. Un débordement définit le volume de la culture dans le tube de la croissance, et à travers ce débordement de la culture seront échantillonnés à la même vitesse à laquelle pénètre un milieu frais. De cette manière, les cultures d'atteindre rapidement un état physiologique stable au cours de laquelle de nombreux paramètres biologiques restent constants. Malgré les avantages de chemostats et les rapports de ces différentes plates-formes dans la littérature, l'adoption généralisée a été limitée par des difficultés dans la construction et l'exploitation de ces systèmes et les coûts élevés liés aux options commerciales. En outre descriptions sur la façon de faire et d'utiliser ces appareils peut être opaque.
Nous présentons des dessins et des instructions pour l'utilisation d'un tableau de petite empreinte de chemostats miniatures construits à partir de pièces disponibles facilement à faible coût. Nous observez très uniformes paramètres expérimentaux et des résultats reproductibles lorsque l'on compare notre dispositif aux données déclarées pour les levures cultivées dans des bioréacteurs de grands volumes commerciaux. Cela inclut la reproductibilité de la physiologie cellulaire comme on le voit à travers atteint l'état d'équilibre équilibre en 10-15 générations et d'obtenir des densités de culture similaires à l'équilibre. En outre, les profils d'expression géniques sont compatibles entre Ministats et un plus grand volume commercial de la plateforme. Stabilité du taux de dilution, la densité optique et la reproductibilité de l'expression des gènes entre les trois cultures répétées démontrer la robustesse de notre plate-forme. Nous montrons également que les mêmes mutations adaptatives se posent sur l'évolution des délais similaires expérimentales avec chemostats plus grand volume.
Protocole
Utiliser une technique stérile appropriée tout au long du protocole.
1. Assemblage de pièces et la préparation de la baie Ministat
- Commander toutes les pièces.
- Nettoyer les tubes de verre. Marquez les tubes à 20 ml de volume.
- S'assurer que les assemblées de liège avec de l'air, les médias, et les ports d'effluents et de les placer en haut des tubes de culture en verre nettoyés.
- Préparer chambres d'humidification et d'organiser toutes les parties non-autoclavés.
- Assurez-air, des effluents, des médias et des tubes en utilisant des longueurs de tubes suffisantes et compatibles accouplements.
- Connectez chaque type de tuyauterie (air, des médias et des effluents) aux assemblées de liège et des filtres bandes et les médias raccord rapide pour les préparer à l'autoclave.
- Préparer une bonbonne pour la fabrication de support chémostat stérile.
- Préparer les bouteilles de prélèvement de la culture en insérant un bouchon de caoutchouc à deux trous avec des raccords appropriés. Feuille chaque filtre pour les préparer à l'autoclave.
- Fit l'ensemble monté facilement dans un ou plusieurs plateaux autoclave et toutes les parties.
- Marque et filtrer les médias chémostat en bonbonnes autoclave.
2. Configuration d'un test
- Remplir chaque flacon hydratation avec 700 ml ddH O. 2
- Placer les Ministats autoclave dans l'ensemble de blocs de chauffage à la température désirée.
- Placez les compagnies aériennes dans le collecteur 4-port et tourner sur la pompe à air.
- Raccorder les conduites d'effluents dans les bouteilles de 100 ml de collecte.
- Retirez le film de l'extrémité du tube médias et tourie médias et connectez le rapide de deux connecte. Enfilez chaque longueur de tuyau de la pompe à travers une cartouche pompe péristaltique et s'enclencher. Mettre la pompe de médias.
- Les chambres à combler. Arrêter la pompe médias.
- Vaporiser les assemblages en liège avec 70% d'éthanol et ensemencer les cultures à l'aide d'une seringue. Sauvegarder un échantillon de l'inoculum comme un stock de glycérol congeléssi on le désire. Laissez croître les cultures pendant 30 heures.
- Réglez la hauteur de l'aiguille des effluents jusqu'à ce que le volume de culture est réglé à 20 ml avec le flux d'air éteint. Cela peut prendre plusieurs ajustements au cours d'une heure. Lorsque vous avez terminé transformer le flux d'air en marche.
- Tourner la pompe sur les médias.
- Vider les bouteilles d'échantillonnage des effluents qui contiennent des médias recueillies pendant le réglage du volume de culture de travail, et enregistrer le temps.
- Pour prendre un point de mesure au temps zéro les lignes d'effluents dans les tubes de prélèvement stériles pour 15 min-2 h (en fonction de ce volume que vous souhaitez goûter à l'analyse génétique). Également faire un stock de glycerol congelé pour chaque culture à ce moment si désiré.
3. Les mesures quotidiennes
- Comme votre temps zéro de mesure, d'échantillonnage sur la glace pendant 15 min-2 h (selon les besoins de votre expérience) sur la glace et enregistrer le temps échantillonné pour l'ADN et des échantillons de mères congelées.
- Pour recueillir des échantillons d'ARN soit un petit volUme aide d'une seringue et 22G 5 "aiguille de la culture ou de déboucher chaque ministat de récolter toute la culture. échantillons doivent être prélevés rapidement, recueilli par filtration, et immédiatement congelés dans de l'azote liquide.
- Mesurer l'eau résiduaire collectée depuis le dernier échantillonnage pour chaque ministat de quantifier le taux de dilution. Ajuster les taux si nécessaire, par le réajustement du réglage de la pompe ou le réglage du réglage fin sur des lignes individuelles de la pompe.
- Remplacer les lignes d'effluents dans des bouteilles vides de collecte.
- Quantifier cellules / ml ainsi que d'autres paramètres d'intérêt et de faire un stock de glycerol congelé.
4. Post-expérience de nettoyage
- Placer tous les tubes dans des bacs séparés et rincer abondamment à l'ddH 2 O. Tube sec à l'aide d'une pompe d'aquarium.
- Nettoyez les assemblages en liège avec ddH 2 O et utiliser insert d'aiguille pour nettoyer les aiguilles, aspirer et distribuer de l'eau à son tour. Essuyez l'extérieur de l'aiguille et du liège pour éliminer toutemédias résiduels.
- Nettoyer le tube de verre avec de l'eau et de l'éthanol, et éliminer les contaminants physiques avec 3 en boule Kimwipes et des pinces.
- Rincer et sécher toutes les pièces avant de les utiliser à nouveau.
Résultats
Le tableau ministat décrit ci-dessus et (figure 1A, B) a été utilisé pour la culture d'une souche de laboratoire haploïde MATa de levure de boulanger (S288C) sous le sulfate de limitation de conditions telles que décrites précédemment. 10 Nous avons testé l'efficacité pour les applications en chémostat communs, y compris la détermination de la physiologie et de évolution expérimentale. Pour valider les Ministats, nous avons répété plusieurs expériences déjà réalisées dans des fermenteurs industriels modifiés pour l'usage chémostat. 10,20,21 Sixfors ATR fermenteurs ont été effectués à un volume de 300 ml de travail, plus de dix fois le volume des Ministats, et ont des modes très différents d'aération culture et de l'agitation. Nous avons tenté de reproduire la stabilité équipement, la physiologie état d'équilibre, les résultats expérimentaux évolution et l'expression des gènes obtenus avec ces fermenteurs.
L'uniformité des taux de dilution et l'aération sont des aspects importants de la conception chemostat, on measured le taux de dilution effectif à travers Ministats 32 après 15 générations de croissance et ont trouvé que, avec un taux de dilution de 0,17 cible vol / h (4-5 gouttes / min), on atteint un taux de dilution de 0,17208 moyenne avec un écart-type de 0,0075 à travers 32 répétitions. Cette gamme a été au sein de notre tolérance typique de + / -0,01 vol / h de différence à partir de la définition des objectifs, au-delà duquel changements à grande échelle dans l'expression des gènes ont été observées. 22-23 sur 4 Ministats le débit d'air a été établie à 307,5 ml / min avec un écart type de 9,57 ml / min. Ceci suggère que l'écoulement d'air dans les chambres est robuste et uniformément répartis entre les 4 chambres et est une valeur similaire à celle décrite pour l'aération dans des fermenteurs industriels 20.
Nous avons déjà observé une amplification récurrent de la sul1 haute affinité du transporteur de soufre-ion 08.08 expériences évolution du sulfate limitées dans la levure. 10 Compte tenu de la cohérence des résultats sous thiétat s, nous avons choisi de sulfate de limitation de tester la capacité de notre système. Un élément indispensable de la culture en chémostat est la nécessité de maintenir un environnement chimique constante. Les fluctuations de l'abondance d'une limitation des changements nutritionnels ou d'une autre dans l'environnement aboutissent généralement à un changement dans le nombre de cellules dans une culture donnée. Nous avons mesuré la densité optique comme un proxy pour le nombre de cellules (figure 2A) et la reproductibilité mesurée dans 16 cultures répétées, de trouver un moyen de 1,12 A600 (~ 10 9 cellules) après environ 15 générations de croissance avec un écart type de 0,057 unités, soit 5,1 %. A titre de comparaison, les mesures prises à partir de 4 cultures répétées cultivées dans des fermenteurs industriels ont montré un écart type de 2,5%. Les cellules sont bien mélangés dans la chambre de croissance: les mesures de DO et le nombre de cellules prélevées sur la piste des effluents étaient équivalentes à des échantillons prélevés directement sur le tube de culture (données non présentées). Ces résultats démontrent la robustesse de notre plate-forme d'unla capacité d pour maintenir un environnement chimique constante avec une tolérance similaire à celui du fermenteur industriel.
Comme une lecture plus sensible de la physiologie, nous avons comparé l'ensemble du génome expression régulière gène état des cultures cultivées dans du sulfate de limitation dans les Ministats et dans le fermenteur industriel. L'expression des gènes dans les Ministats ont montré un degré élevé de similitude entre trois biologique répétitions (figure 2B). Nous avons déjà noté que pour l'ARN dérivé de deux chemostats Sixfors répétés et co-hybridé à une puce à ADN, l'expression de 99% des gènes est tombé dans une fourchette de 1,5 fois, ce qui permet l'utilisation de 1.5X comme une coupure signification empirique 21. L'expression des gènes de Ministats trois répétitions, deux à deux par rapport a montré, 99% des gènes est tombé dans une fourchette 1.5 à 1.7 fois, comparable aux résultats des fermenteurs industriels. Les trois échantillons ont été hybridées à des tableaux individuels et les ratios calculés par paires après, de sorte que ces vasyphilis comprennent inter-matrices de bruit en plus du bruit biologique, ce qui pourrait surestimer la variation entre les répétitions par rapport aux publications, co-hybridés résultats. 138 gènes sont exprimés de façon différentielle> 1,5-pli dans tous ministat trois répétitions par rapport à un échantillon prélevé à partir d'une culture cultivée identifié dans le fermenteur industriel. Les gènes ont diminué dans l'expression dans les Ministats ont été fortement enrichi pour le métabolisme du fer. Cette signature peut refléter la composition de chaque métal différent configuration de l'appareil: l'appareil Sixfors comprend une turbine métallique et l'assemblage d'aération immergé dans la culture, des médias et de la bonbonnes précédemment utilisé également nécessaire quincaillerie métallique. Le ministat utilise des aiguilles en acier inoxydable, mais pas de composants métalliques. Les gènes présentant une expression accrue ont été largement associés avec les membranes cellulaires, bien que la signification biologique de cette association n'est pas claire.
Enfin, nous avons testé unde évolution expérimentaler ces conditions. Après 250 générations de sulfate de croissance limitée, 4/4 clones testés à partir de 4 populations indépendantes ont montré l'évolution amplification de sul1 détectée par hybridation génomique comparative (CGH, figure 2C). Ce résultat est cohérent avec les résultats des chemostats des quantités plus importantes sur des intervalles de temps similaires 10.
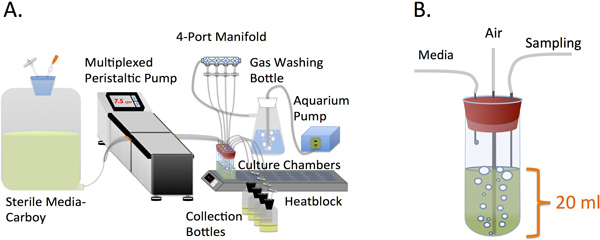
Figure Design 1. A. Conception et agencement de l'ensemble ministat. B. de la chambre de culture.
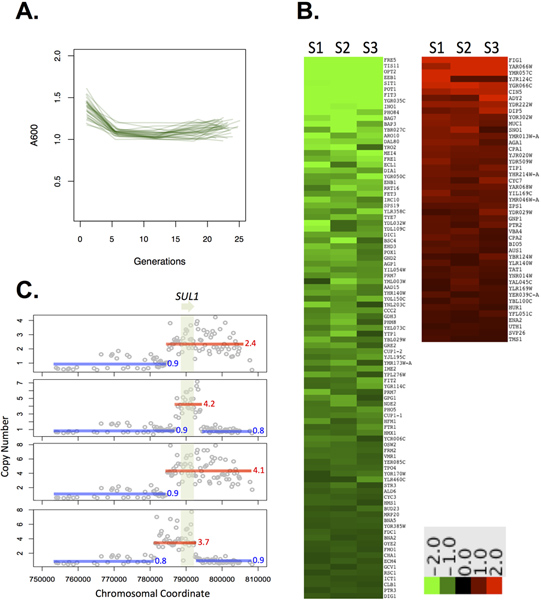
Figure 2. A. ExperimeNTAL données montrant que les cultures atteignent un équilibre dans les dix générations de croissance (n = 16). B. Les données d'expression pour trois réplicats biologiques S1-3 échantillonné pendant l'état d'équilibre avec une limitation de sulfate par rapport à une référence commune cultivé dans un appariement de sulfate limitée chémostat Sixfors C. amplifications. sul1 récupéré dans Ministats après 250 générations de croissance dans un environnement sulfate limitée. L'ADN génomique de chaque clone évolué a été comparé à l'ADN ancestral par CGH comme décrit. 21 Moyenne du nombre de copies a été calculé pour chaque région amplifiée et est indiqué à côté de chaque amplicon. Toutes les données de biopuces sont déposés dans la base de données GEO dans l'adhésion GSE36691. Cliquez ici pour agrandir la figure.
Discussion
Culture chemostat dans les Ministats, comme avec n'importe quel chémostat, exige de la minutie et le dépannage. Depuis la contamination est très préoccupante dans les expériences de culture continue, nous recherchent généralement via microscope pour la contamination bactérienne et fongique après inoculation et tous les 50 générations lors des expériences évolution à long terme. À ce jour, nous n'avons pas observé de contamination dans 96 expériences évolution de plus de 300 générations (données non présentées). Pour tester la contamination croisée entre les Ministats et le potentiel pour les microbes de coloniser la chambre de culture par le biais de la ligne d'effluent nous avons couru 16 Ministats telles que chaque ministat autre a été inoculé avec de la levure comme ci-dessus et le reste n'ont pas été inoculés avec une culture. Les cultures ont été prélevés dans un conteneur à déchets communaux, qui a été vidé tous les deux jours. Ainsi, s'il était possible pour les contaminants de pénétrer à travers la ligne d'effluent que nous aurions probablement observé que dans cette expériment. Pendant trois semaines et plus de 100 générations de la croissance de ce motif en damier de cultures inoculées et non inoculées, nous n'avons pas observé la croissance non inoculés tubes de culture MINISTAT, ce qui suggère que la contamination de la levure à l'extérieur ou d'autres microbes est peu probable de se produire dans des expériences de des délais similaires.
Bien que les Ministats ont été conçus pour fonctionner dans un mode analogue à chemostats commerciaux, la nature modulaire de cet arrangement permet une optimisation en fonction des besoins des utilisateurs et du budget. La pompe péristaltique utilisée dans le présent protocole peut atteindre des débits compris entre 0,0186 vol / h à 3,6 vol / h (données non présentées). Un contrôle accru des taux de dilution peut être réalisée avec les modèles de pompe de rechange. Noter que le fonctionnement à taux de dilution inférieur peut exiger la substitution d'une aiguille de calibre supérieur pour obtenir la même fréquence de réception de gouttelettes. Taille de la population est un facteur important pour une bonne conception des expériences d'évolution.Le taux de dilution standard et la concentration nutritive utilisée ici fournit une taille de population relativement importante (~ 10 9 cellules) du même ordre de grandeur que les études publiées évolution. 11 populations plus petites ou plus pourrait être maintenue en changeant le volume de travail ou de limiter la concentration en nutriments. Alimentation mutation accrue pourrait également être obtenus en travaillant avec des souches avec des taux de mutation élevés.
Les Ministats pourrait également être améliorée au cours de notre conception actuelle. Pour la condensation par exemple peuvent se déposer sur les parois des tubes de culture et peut être considérablement réduite en utilisant une profonde bain-marie, un incubateur ou une chambre à température constante. Bien que l'agglutination et la croissance mur de sulfate de cultures limitées semble être relativement rare, apparaissant dans des expériences évolution 5/48 par 300 générations (données non présentées), une variété de tensioactifs sont disponibles qui peuvent aider à diminuer ou retarder cette caractéristique. Dans le cas où agglutination interfère avec la culture adéquatle mélange, sous agitation accrue peut être obtenue en réduisant le nombre de voies de chaque pompe à air est divisée, ou en ajoutant un dispositif d'agitation. Sondes supplémentaires pour la concentration en gaz dissous, le pH ou d'autres paramètres peuvent également être inclus, comme dans quelques autres conceptions 17.
Malgré les modifications possibles, en utilisant les Ministats telles que décrites dans ce protocole, nous avons observé très uniformes paramètres expérimentaux et des résultats reproductibles lorsque l'on compare notre dispositif aux données déclarées pour chemostats grand volume commerciales. Cela comprenait la reproductibilité de la physiologie cellulaire comme on le voit par atteindre l'état stationnaire d'équilibre dans les 10-15 générations (figure 2A) et d'obtenir des densités de culture similaires à l'équilibre. Profils d'expression génique sont compatibles entre trois biologique réplique dans Ministats et entre Ministats et commerciaux à grand volume de plates-formes (figure 2B), à l'exception des gènes du métabolisme du fer. Ces expression différences sont probablement causés par des changements dans la teneur en métaux des deux dispositifs ou d'améliorations dans la qualité des ingrédients médias. Nos données suggèrent que Ministats sera utile pour les expériences de physiologie ou de la compétition où un environnement cohérent est nécessaire.
Pour tester si la conception ministat est suffisante pour des applications expérimentales évolution nous évolué cultures sous limitation de sulfate pour 250 générations et utilisé pour caractériser CGH amplification au niveau du locus sul1 -. Marque distinctive de l'évolution à long terme dans ces conditions dans chemostats grand volume 10 Nous observée amplification de sul1 dans les clones de 04.04 expériences évolution indépendants en sulfate limitées médias (figure 2C). Pris dans leur ensemble, ces données suggèrent que Ministats sont une plate-forme robuste qui peut être utile pour une variété d'applications chémostat traditionnels. Bien que nous ont manifesté leur utilisation dans la culture de levure bourgeonnante, les Ministats devraitégalement être compatible avec d'autres organismes et des conceptions similaires ont en fait été utilisé pour la culture des bactéries et d'autres espèces de levures. 16,17,25 En outre, le plus petit volume de la culture et de corrélation réduction du besoin de médias peuvent apporter Ministats une alternative intéressante pour des expériences nécessitant coûteux ou exotiques réactifs comme cela peut être le cas dans l'industrie chimique ou cribles génétiques.
Déclarations de divulgation
Les auteurs déclarent n'avoir aucun conflit d'intérêt.
Remerciements
Création de la vidéo a été soutenue par des subventions du National Center for Research Resources (5P41RR011823-17) et l'Institut national des sciences médicales générales (8 P41 GM103533-17) du National Institutes of Health. Ce travail a également été soutenu par la NSF subvention 1120425. MJD est une Fondation Rita Allen Scholar. MN est soutenu en partie par le NIH T32 HG00035. Nous remercions Anna soleil de l'aide pour l'amélioration des protocoles. En outre, nous reconnaissons Sara DiRienzi, Celia Payen, et Amy Sirr que les premiers utilisateurs des Ministats.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| 3/32 "x 7/32" tubes en silicone | VWR | 63009-260 | Tuyau: Commande: (pack bobine 50 ') |
| Tuyau 1/2 "x 5/8" de silicone (extra large) | VWR | 63009-299 | Tuyau: Commande: (pack bobine 50 ') |
| 1/4 "x 3/8" tube en silicone (support) | VWR | 63009-279 | Tuyau: Commande: (pack bobine 50 ') |
| Orange vert tuyau de la pompe Marprène | Watson-Marlow | 978.0038.00 + | Tuyau: Order: 6x (pack de 6) |
| Luer femelle, 1/8 "cannelé | Cole Parmer | HV-45500-04 | Connecteurs: Ordre: 4x (pack de 25) |
| Luer lock mâle, 1/8 "cannelé | Cole Parmer | HV-45503-04 | Connecteurs: Ordre: 1x (pack de 25) |
| Réduction, PVDF, 1/4 "à 1/8" | Cole Parmer | EW-30703-50 | Connecteurs: Ordre: 1x (pack de 10) |
| Barbed connecteur Y, 1/8 "ID | Cole Parmer | HV-30703-92 | Connecteurs: Ordre: 3x (pack de 10) |
| Brides de tube à moyen | VWR | 63022-405 | Pinces: Ordre: 1x (pack de 12) |
| Jour Robinet à serrage (pince en métal pour tubes) | VWR | 21730-001 | Pinces: Ordre: 1x (pack de 10) |
| Ligne Homme à clapet raccord rapide, Adaptés aux tuyaux: 1/4 po | Pêcheur | 05-112-39 | Connecteurs: Ordre: 1x (pack de 25) |
| Femme en ligne à clapet raccord rapide, Adaptés aux tuyaux: 1/4 po ID, Polypropylène | Pêcheur | 05-112-37 | Connecteurs: Ordre: 1x (pack de 5) |
| Pompes à air silencieux | Aquarium Guys.com | 212422 | Donner de l'air: Ordre: 4 pompes |
| Filtres en PTFE, 0,45 um, pour la filtration de l'air | Cole Parmer | HV-02915-22 | Donner de l'air: Commande: 1x (boîte de 100) |
| Flacon 1L avec arme de poing | Pêcheur | 10-181F | Donner de l'air: Commande: 2x (pack de 6) |
| N ° 8 bouchon en silicone, 3/8 dans le trou, pour des flacons arme de poing | Pêcheur | K953715-0801 | Donner de l'air: Commande: 8 bouchons |
| 4-Port collecteur | Cole Parmer | EW-06464-85 | Donner de l'air: Commande: 8 collecteurs |
| 55 ml tubes bouchon à vis de la culture | Corning Life Sciences | 9825-25 | Chambre Culture: Commande: 2x (pack de 48) |
| Régulière hypodermique blanc moyeu d'aiguille, 16G, 5 po de longueur pour conduite d'amenée | Pêcheur | 14-817-105 | Chambre Culture: Commande: 1x (pack de 100) |
| Aiguille ponction lombaire | VWR | BD40836 | Chambre Culture: Commande: 4x (pack de 10) |
| Aiguille hypodermique régulière rose | Pêcheur | 14-817-104 | Chambre Culture: Commande: 1x (pack de 100) |
| Mousse bouchon en silicone taille "2", rose | Cole Parmer | EW-06298-06 | Chambre Culture: Commande: 2x (pack de 20) |
| Support tube de 8-Eh bien | VWR | 82024-452 | Chambre Culture: Ordre: 4 racks |
| Bouteille réservoir 10L avec sortie de tuyau en bas: coffre-fort vide | VWR | 89001-530 | Médias: Ordre: 2 ou plus |
| Jaune bouchon de mousse de silicone, non-standard taille 12 | Cole Parmer | EW-06298-22 | Médias: Ordre: 2 ou plus |
| Bonbonne de ventilation Filtre | Pêcheur | SLFG 050 10 | Médias: Ordre: 1x (pack de 10) |
| Ruban électrique, vert | Amazon.com | 10851-BA-10 | Médias: Commander 1 rouleau. |
| Filtre, embouts, 1L, 0,2 um, 45 mm | VWR | 29442-978 | Médias: Ordre: (1 cas sur 12) |
| Bouteille de 5000 ml avec réservoir vidange de fond: vacueuh sécurité | VWR | 89003-384 | Média: (Facultatif) |
| Bleu bouchon en silicone, mousse nonstandardsize 10 1/2 | Cole Parmer | EW-06298-18 | Média: (Facultatif) |
| 205S/CA16, 16 pompe cartouche | Watson-Marlow | 020.3716.00A | Pompe Média: commande: 1 |
| 16-canaux tête de pompe d'extension 205CA | Watson-Marlow | 023.1401.000 | Pompe médias: Commande: têtes de pompe 2 de vulgarisation |
| Scellant silicone d'aquarium | Pêcheur | S18180B | Pompe Média: commande: 1 |
| 6-bloc bain sec | VWR | 12621-120 | Heatblock: Commande: 2 pour 32 Ministats ou 1 pour 16. |
| Bloc pour drybath, 6 tubes à essai x 25 mm par bloc | VWR | 12621-120 | Heatblock: commande: 12 pour 32 Ministats ou 6 pour 16. |
| Filtres à membrane en nylon, 0,45 um Taille des pores; Dia: 25 mm. | Pêcheur | R04SP02500 | Récolte: Commande: 1x (pack de 100) (en option) |
| Filtres à membrane en nylon, 0,45 um Taille des pores de 45 mm; | Pêcheur | R04SP04700 | Récolte: Commande: 1x (pack de 100) (en option) |
| 47 mm, un appareil grand filtre | Pêcheur | XX10 047 30 | Récolte: commande: 1 (en option) |
| Glass porte-filtre, 25 mm, petit appareil filtrant | VWR | 26316-692 | Récolte: commande: 1 (en option) |
| Vase Dewar, 1L pour l'azote liquide | VWR | 63380-052 | Récolte: commande: 1 (en option) |
Références
- Monod, J. Récherches sur la Croissance des Cultures Bacteriennes. Ann. I. Pasteur. 79, 390-410 (1950).
- Novick, A., Szilard, L. Description of the chemostat. Science. 15, 715-716 (1950).
- Daran-Lapujade, P., Daran, J. -. M., van Maris, A. J. A., de Winde, J. H., Pronk, J. T. Chemostat-based micro-array analysis in baker's yeast. Adv. Microb. Physiol. 54, 257-311 (2009).
- ter Linde, J. J. M., Pronk, J. T., et al. Genome-wide transcriptional analysis of aerobic and anaerobic chemostat cultures of Saccharomyces cerevisiae. J. Bacteriol. 181, 7409-7413 (1999).
- Boer, V., de Winde, J., Pronk, J., Piper, M. The genome-wide transcriptional responses of Saccharomyces cerevisiae grown on glucose in aerobic chemostat cultures limited for carbon, nitrogen, phosphorus, or sulfur. J. Biol. Chem. 278, 3265-3274 (2003).
- Wu, J., Zhang, N., Hayes, A., Panoutsopoulou, K., Oliver, S. Global analysis of nutrient control of gene expression in Saccharomyces cerevisiae during growth and starvation. 101, 3148-3153 (2004).
- Diderich, J. A., Kruckeberg, A. L., et al. Glucose Uptake Kinetics and Transcription of HXT Genes in Chemostat Cultures of Saccharomyces cerevisiae. J. Biol. Chem. 274, 15350-15359 (1999).
- Novick, A., Szilard, L. Experiments with the Chemostat on spontaneous mutations of bacteria. Proc. Natl. Acad. Sci. U.S.A. 36, 708-719 (1950).
- Kubitschek, H. E., Bendigkeit, H. E. Mutation in continuous cultures. I. Dependence of mutational response upon growth-limiting factors. Mutation Res. 1, 113-120 (1964).
- Gresham, D., Dunham, M. J., et al. The Repertoire and Dynamics of Evolutionary Adaptations to Controlled Nutrient-Limited Environments in Yeast. PLoS Genet. 4, e1000303 (2008).
- Kao, K. C., Sherlock, G. Molecular characterization of clonal interference during adaptive evolution in asexual populations of Saccharomyces cerevisiae. Nat. Genet. 40, 1499-1504 (2008).
- Kvitek, D. J., Sherlock, G. Reciprocal Sign Epistasis between Frequently Experimentally Evolved Adaptive Mutations Causes a Rugged Fitness Landscape. PLoS Genet. 7, e1002056 (2011).
- Helling, R. B., Adams, J. Evolution of Escherichia coli during Growth in a Constant Environment. Genetics. 116, 349-358 (1987).
- Dunham, M. J. Experimental Evolution in Yeast: A Practical Guide. Methods Enzymol. 470, (2010).
- Hoskisson, P. A., Hobbs, G. Continuous culture - making a comeback. Microbiology. 151, 3153-3159 (2005).
- Nanchen, A., Schicker, A., Sauer, U. Nonlinear dependency of intracellular fluxes on growth rate in miniaturized continuous cultures of Escherichia coli. Appl. Environ. Microbiol. 72, 1164-1172 (2006).
- Klein, T., Schneider, K., Heinzle, E. A system of miniaturized stirred bioreactors for parallel continuous cultivation of yeast with online measurement of dissolved oxygen and off-gas. Biotechnol. and bioeng. , (2012).
- Balagadde, F. K., You, L., Hansen, C. L., Arnold, F. H., Quake, S. R. Long-term monitoring of bacteria undergoing programmed population control in a microchemostat. Science. 309, 137-140 (2005).
- Groisman, A., Lobo, C., Cho, H., Campbell, J. K., Dufour, Y. S., Stevens, A. M., Levchenko, A. A microfluidic chemostat for experiments with bacterial and yeast cells. Nat. Methods. 2, 685-689 (2005).
- Brauer, M. J., Botstein, D., et al. Homeostatic Adjustment and Metabolic Remodeling in Glucose-limited Yeast Cultures. Mol. Biol. Cell. 16, 2503-2517 (2005).
- Torres, E. M., Amon, A., et al. Effects of Aneuploidy on Cellular Physiology and Cell Division in Haploid Yeast. Science. 317, 916-924 (2007).
- Regenberg, B., Nielsen, J., et al. Growth-rate regulated genes have profound impact on interpretation of transcriptome profiling in Saccharomyces cerevisiae. Genome Biology. 7, R107 (2006).
- Castrillo, J. I., Oliver, S. G., et al. Growth control of the eukaryote cell: a systems biology study in yeast. Journal of Biology. 6, 4 (2007).
- Brauer, M. J., Botstein, D., et al. Coordination of growth rate, cell cycle, stress response, and metabolic activity in yeast. Molecular Biology of the Cell. 19, 352-367 (2008).
- Ferenci, T. Bacterial physiology, regulation and mutational adaptation in a chemostat environment. Adv. Microb. Physiol. 53, 169-229 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon