Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Protocole pour l'évaluation hydrodynamique relative de Vannes polymères tri-leaflet
Dans cet article
Résumé
Il ya eu un regain d'intérêt dans le développement de valves polymères. Ici, les objectifs sont de démontrer la faisabilité de la modification d'un duplicateur d'impulsion commerciale pour accueillir géométries tri-leaflet et de définir un protocole de présenter des données hydrodynamiques de soupape polymères par rapport aux données de valve native et prothétique recueillies dans des conditions quasi-identiques.
Résumé
Limitations de valves prothétiques actuellement disponibles, les xénogreffes, et homogreffes ont suscité une résurgence récente des développements dans le domaine de la vanne à trois dépliant polymère prothèses. Cependant, l'identification d'un protocole pour l'évaluation initiale de la fonctionnalité hydrodynamique de la vanne polymère est primordiale durant les premières étapes du processus de conception. Traditionnelle dans les systèmes de duplication impulsions in vitro ne sont pas configurés pour utiliser des matériaux tri-feuillets flexibles, en outre, l'évaluation de la fonctionnalité de valve polymère doit être faite dans un contexte par rapport aux valves cardiaques natives et prothétiques dans des conditions d'essai identiques de sorte que la variabilité des mesures de différents instruments peuvent être évités. En conséquence, nous avons effectué une évaluation hydrodynamique i) natif (n = 4, diamètre moyen, D = 20 mm), ii) bi-feuillet mécanique (n = 2, D = 23 mm) et iii) les vannes polymère (n = 5, D = 22 mm) via l'utilisation d'un système de duplication d'impulsion disponible dans le commerce (ViVitro LabsInc, Victoria, C.-B.) qui a été modifié pour tenir compte des géométries de valve à trois folioles. Valves en silicone Tri-dépliant développés à l'Université de Floride composent le groupe de vannes polymère. Un mélange dans un rapport de 35:65 glycérine à de l'eau a été utilisé pour reproduire les propriétés physiques du sang. Débit instantané a été mesurée à l'interface du ventricule gauche et l'aorte alors que les unités de pression a été enregistré au niveau des positions ventriculaires et aortiques. Données de valve native de la littérature Bi-dépliant et a permis de valider l'écoulement et de la pression. Les paramètres hydrodynamiques suivants ont été rapportés: chute de pression d'écoulement vers l'avant, la racine de l'aorte taux carré avant de débit, fermeture aortique, la fuite et le volume de régurgitation, fermeture transaortique, les fuites et les pertes d'énergie totale moyenne. Résultats de la représentante a indiqué que les paramètres hydrodynamiques des trois groupes de vannes pourraient être obtenus avec succès en incorporant un montage sur-mesure dans un système de duplication d'impulsion disponible dans le commerce et subsequently, par rapport objectivement pour donner un aperçu sur les aspects fonctionnels de la conception polymère valve.
Introduction
valvulopathie cardiaque est souvent due à dégénérative calcification de la valve 1, la fièvre rhumatismale 2, endocardite 3,4 ou malformations congénitales. Lorsque des dommages de valve se produit, provoquant une sténose et / ou régurgitation prolapsus de la valve et ne peut être chirurgicalement réparé la valve native est généralement remplacé par une prothèse valvulaire. Actuellement options disponibles incluent les valves mécaniques (vannes cage sphérique, vannes de disque pendulaires, etc.), Homogreffes et bioprothèses (porcine et bovine vannes). Les valves mécaniques sont souvent recommandés pour les patients plus jeunes en fonction de leur durabilité, mais le patient doit rester sous traitement anticoagulant pour prévenir les complications thrombotiques 5. Prothèses valvulaires homogreffes et biologiques ont été des choix efficaces pour éviter sang thérapie plus mince, mais ces valves présentent un risque élevé pour la fibrose, la calcification, la dégénérescence et les complications immunogènes menant à la défaillance de la vanne 6. Valves de l'ingénierie tissulaire sont à l'étude comme une technologie émergente 7-9, mais il reste encore beaucoup à découvrir. , Vannes alternatifs durables, biocompatibles prothèses sont nécessaires pour améliorer la qualité de vie des patients atteints de maladies des valves cardiaques. Encore une fois, cette conception de la valve pourrait remplacer la bioprothèse utilisés dans la technologie de valve percutanée, avec des approches de cathétérisme montrant le potentiel pour transformer le traitement des patients sélectionnés atteints de la maladie de la valvule cardiaque 10.
Comme indiqué par les normes actuelles, un succès remplacement de valve cardiaque devrait avoir les caractéristiques de performance suivantes: «1) permet d'avancer débit avec suffisamment faible chute de différence moyenne de pression; 2) empêche l'écoulement rétrograde avec suffisamment faible régurgitation; 3) résiste embolisation; 4) résiste hémolyse; 5) résiste à la formation de thrombus; 6) est biocompatible; 7) est compatible avec des techniques de diagnostic in vivo, 8) est livrable et implantable dans le corps ciblepopulation; 9) reste fixée une fois placé, 10) a un niveau de bruit acceptable; 11) a une fonction reproductible; 12) conserve sa fonctionnalité pour une durée de vie raisonnable, conformément à sa classe générique; 13) maintient sa fonctionnalité et sa stérilité pour une durée raisonnable la vie avant l'implantation. "11. Certaines des lacunes de prothèses valvulaires existants peuvent potentiellement être surmontés par une vanne polymère. polymères biocompatibles ont été considérés comme les meilleurs candidats sur la base biostabilité, anti-hydrolyse, anti-oxydation et des propriétés mécaniques intéressantes telles que haute résistance et visco-élasticité. En particulier, les polymères élastomères peuvent prévoir la déformation du matériau ressemblant à la dynamique de valve native. élastomères peut être adapté pour imiter les propriétés des tissus mous, et ils peuvent être les seuls matériaux artificiels disponibles qui sont bio-tolérants et capables de résister aux couplé, in vivo, les contraintes induites par le fluide, la flexion et à la traction, pour l'instant, se déplacent d'une manière ressemblant à la santé,mouvement de la valve native. En outre, les élastomères peut être produit en masse dans une variété de tailles, stockées en toute simplicité, devraient être des dispositifs rentables et peuvent être structurellement augmenté avec renfort fibreux.
Le concept de l'utilisation de matériaux polymères à monter une vanne à trois dépliant n'est pas nouvelle et a fait l'objet de plusieurs enquêtes de recherche au cours des 50 dernières années 12, qui ont été abandonnés en grande partie en raison de la longévité de la vanne limitée. Cependant, avec l'avènement de nouvelles méthodes de fabrication 13,14, le renforcement des matériaux polymères 15,16 et l'intégration transparente de polymère potentiellement remplacer des soupapes avec la technologie de valve percutanée, il ya eu récemment un regain d'intérêt et d'activité dans le développement de valves polymère comme potentiellement alternative viable aux valves commerciales actuellement disponibles. Dans cette optique, un protocole pour permettre l'essai de ces vannes pour évaluer la fonctionnalité hydrodynamique est la première étapedans le processus d'évaluation; encore les systèmes de simulateurs d'impulsions disponibles dans le commerce ne sont généralement pas équipés pour accueillir des modèles de vannes à trois folioles et contiennent un espace annulaire d'insérer des valves cardiaques disponibles dans le commerce (par exemple, les valves cardiaques mécaniques bi-feuillet disque d'inclinaison). Deuxièmement, les vannes de polymère sont une technologie émergente dont l'hydrodynamique ne peut être évaluée dans un contexte relatif. Même si les données de flux et de pression de la valve cardiaque native est disponible, il est important d'effectuer des tests de valves porcines de l'aorte indigènes, qui sont biologiquement similaire à soupapes humains, en utilisant le même simulateur pulsatile qui est utilisé pour évaluer les vannes polymère de manière à tenir compte des différences de mesure qui peuvent être dépendant du système. Ainsi, l'objectif de cette étude était de démontrer comment un simulateur d'impulsion disponible dans le commerce peut être équipé d'un ensemble pour accueillir des constructions de vannes à trois folioles et d'évaluer systématiquement polymères paramètres hydrodynamiques de soupape dans un cont rapportposte par rapport à leurs homologues de valve cardiaque mécanique et porcines indigènes. Dans notre cas, les vannes de polymère de silicone tri-feuillet nouvelles précédemment développé à l'Université de la Floride 13 composé le groupe de vannes polymère.
Protocole
1. Préparation
- Concevoir et fabriquer un assemblage pour accueillir une géométrie de valve tri-feuillet. Ce sera au minimum inclure un support de soupape de suture dans les feuillets de la valve et un tube pour loger le support de la vanne et les accessoires environnants pour fixer l'ensemble sur le système duplicateur impulsion. Dans notre cas, nous avons utilisé un système de duplication d'impulsion disponible commercialement disponible auprès ViVitro Labs Inc. (Victoria, BC). conception de support de la vanne ainsi que des configurations pré et post-assemblage sont représentés sur la figure 1.
- La boucle entière devra être amorcée avant l'utilisation. Ceci s'effectue en deux étapes: i) le nettoyage de l'ensemble du système en boucle en utilisant une solution de savon et de l'eau, y compris le remplacement de tout tube dégradées avant l'utilisation et ii) l'étalonnage des appareils raccordés à la boucle, à savoir la pompe en cours d'utilisation, la sonde d'écoulement, et les transducteurs de pression (généralement mesurée à des emplacements auriculaire, l'aorte et ventricule). Le calibrage peut initialisationially être effectuée en utilisant une solution saline à 1% et doit être répétée avant d'utiliser la solution de glycérine sang-analogique.
2. Valve dissection aortique native
- Obtenir 4 coeurs de porc frais avec l'aorte intacte d'un abattoir agréé USDA (protection des animaux et du Comité institutionnel utilisation (IACUC) l'approbation peut être nécessaire). Dans notre cas, notre protocole de dissection a été approuvé par le IACUC à la Florida International University (Protocole Numéro d'agrément: 11-020). Rincer le cœur avec de l'eau déminéralisée et le placer dans un récipient rempli avec le 1% de phosphate antimycosique / antibiotique et stérile (PBS) et le transport saline tamponnée sur la glace au laboratoire d'essais hydrodynamiques.
- Placez cœurs dans une casserole dissection et retirer délicatement le péricarde. Placez le cœur de telle sorte que la face ventrale est face à vous. Inspecter visuellement et identifier les quatre cavités du cœur et de localiser l'arche aortique sur l'aorte intacte.
- Séparer le cœur en two moitiés en coupant à travers à peu près horizontalement en dessous de 0,75 dans l'espace annulaire, c'est à dire la jonction entre l'aorte et le ventricule gauche. Isoler soigneusement l'aorte intacte encore attaché au segment de tissu ventriculaire gauche.
- Examinez la valve aortique situé dans la racine de l'aorte, la région entre l'aorte ascendante et l'anneau inférieur, en s'assurant qu'il n'y ait aucun dommage ni aucun signe de calcification.
- Fractionner l'aorte à ~ 1 ci-dessus dans l'espace annulaire et séparer le segment de tissu ventriculaire gauche au-dessous de l'espace annulaire afin d'isoler la valve aortique (figure 2a).
3. Processus de suture valve native polymère et
- Placer la valvule cardiaque à l'intérieur du support de soupape de telle sorte que la base de chaque vanne s'aligne avec la base du support après. Fixez le robinet en place à chaque poste temporaire avec un trombone, mais attention à ne pas endommager les commissures ou les points de rebroussement.
- Insérez le fil de suture dans leaiguille. Commencer suture au fond du support de soupape faisant passer l'aiguille à travers le premier trou, de l'extérieur vers l'intérieur telle que l'aiguille peut facilement être retirée de la partie inférieure. Dans un mode de bouclage, commencer à suture de la valve en place verticalement les poteaux de la retenue de la soupape.
- Progrès avec suture (Figure 2b) le long de la circonférence de la porte et sûr suture supplémentaire autour des pointes des postes de titulaires. trombones (figure 2c) peuvent être retirés lorsque la vanne est complètement fixée à l'aide de fils de suture des trois postes et à la circonférence du porte-clapet (figures 2d et 2e).
4. Evaluation hydrodynamique
Note: protocole réel variera selon le système de duplication d'impulsion spécifique utilisé. Toutes les informations caontained utilisé ici le ViVitro Pulse Duplicator Sysytem (ViVitro Labs, Inc., Vancouver, BC).
- VA Bi-dépliantsustentent
- Réglez la fréquence cardiaque du système duplicateur impulsion à 70 battements / min.
- Sélectionner une forme d'onde de débit pour entraîner la pompe (dans le cas du système de la forme d'onde ViVitro S35 a été choisi pour tous les essais hydrodynamiques). La forme d'onde spécifique utilisé dans nos expériences est illustrée par 17 Lim et al. (2001).
- Allumez l'amplificateur et la pompe à piston. Echauffez-vous pendant 15 min.
- Vanne bi-feuillet place (Figure 2f) en position aortique.
- graisse à vide de diffamation sur toutes les jonctions de l'appareil où des fuites pourraient se produire.
- Verser la glycérine / liquide salin dans le compartiment auriculaire. Notez que le système duplicateur pulsatile fonctionne sur 2 L de liquide: 35% / 0,7 L glycérine et 65% / 1,3 L de solution saline. La solution saline est préparée en utilisant du sel ordinaire bien dissous dans de l'eau déionisée à une concentration de 9 mg / ml (poids / volume).
- Allumer le transducteur de débit qui a été placé en position aortique.
- Calibrer ee pompe.
- Procéder à l'étalonnage du transducteur d'écoulement suivi par les transducteurs de pression. De même à la pompe, il suffit de suivre les instructions données par le logiciel ViVitest (ViVitro Labs Inc.) pour chaque débit et la pression sous l'onglet calibrer.
- Une fois le calibrage terminé, démarrer la pompe à vitesse lente jusqu'à ce que le fluide remplit le compartiment de l'aorte. Vérifier les fuites. Utilisez de la graisse à vide supplémentaire si nécessaire.
- Tournez les deux robinets d'arrêt (aortique et transducteurs ventriculaires) en position ouverte.
- Augmenter la vitesse de rotation de la pompe jusqu'à ce que le volume d'éjection systolique atteint 80 ml / battement.
- Permettre au système de fonctionner pendant 10 min jusqu'à ce que le flux s'est stabilisé. la stabilisation du débit peut être vérifiée en observant le débit et la pression signaux affichés à l'écran. Faible ou nulle variation entre les cycles est un bon indicateur de stabilisation du système.
- Dans le logiciel ViVitest sélectionner le mode acquérir.
- Cliquez sur collecter 10 cycles.
- A partir du mode analyser, clécher sur la table et enregistrez le fichier. Également enregistrer une image de la forme d'onde en utilisant l'option photo-snap dans ViVitest.
- Valves natives et Polymer
- Pour les vannes polymères et animale, suivez les mêmes étapes 3.1.1 - 3.1.3 des instructions de la vanne bi-feuillet.
- Placer le support de soupape à la soupape suturée à l'intérieur du tube de verre à partir de l'assemblage sur mesure. Sandwich le tube avec les pièces supérieure et inférieure et sécurisées en place avec des vis et des écrous latéraux.
- Ensemble de place entre la chambre de l'aorte et le porte-original de la valve aortique.
- Passez aux étapes 3.1.5 - 3.1.16 des instructions de la vanne bi-feuillet.
5. Post-traitement
- Débit et courbes de pression
- Moyen des données collectées pour chacun des signaux collectés, c'est à dire la pression aortique (AP), la pression ventriculaire (VP), et le débit (Q).
- Pour chaque groupe de valve (polymère, porcine nvalve aortique ative et bi-feuillet), l'intrigue de l'AP correspondant, vice-président et Q par rapport à des relations de temps sur la même parcelle.
- Pour l'AP, superposer valve normale, natif aortique 18 et bi-feuillet valve prothétique 19 parcelles de la littérature à des fins de validation.
- Paramètres hydrodynamiques
- Pour chaque vanne testée, les paramètres hydrodynamiques suivants doivent être calculés: a) chute de l'écoulement de pression et transvalvulaire maximale (TVP), b) la racine de l'aorte carré taux (RMS) d'écoulement normal, c) aortique écoulement vers l'avant, de clôture, de fuite signifie et le volume régurgitant tout, d) zone de soupape de fin d'orifice (EOA), e) transaortique écoulement vers l'avant, fermeture, les fuites et les pertes d'énergie totales.
- Avant la chute de pression d'écoulement est calculée à partir des lectures TVP et peuvent être classés en 3 intervalles de temps p: intervalle qui commence et se termine avec 0 TVP, F: intervalle avec écoulement vers l'avant et H: intervalle en commençant par 0 TVP et se terminant par 0 flux. TVP maximale est la MAgradient de pression ximum enregistré dans la vanne de l'aorte et de la pression ventriculaire.
- Le taux d'écoulement avant RMS (Q rms) fournit une mesure utile pour quantifier l'ampleur du débit en avant comme suit:

Où «n» est le nombre total de points de temps recueillis, «Q i» est la mesure de débit instantané recueillies afin 'i'. - Volumes aortique avant, fermeture et les fuites sont calculées sur la base des intervalles de temps suivants, à terme: début de l'écoulement vers l'avant à travers la soupape (t o), à la fin de l'écoulement vers l'avant (t 1); clôture: à partir de t 1 jusqu'à l'instance fermeture de soupape (T 2); fuite: à partir de t 2 jusqu'à la fin du cycle cardiaque (t 3). Le volume total de régurgitation est simplement la somme des ClosING et les volumes de fuite.
- L'EOA basé sur les propriétés du sang peut être calculée pour les intervalles de 3, P, F et H de la TVP moyenne au cours de chacune de ces périodes comme 20:
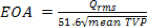
- Les pertes d'énergie sont définies comme suit 21:
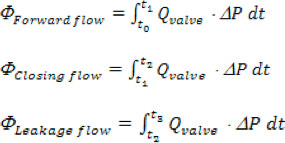
- Pour chaque vanne testée, les paramètres hydrodynamiques suivants doivent être calculés: a) chute de l'écoulement de pression et transvalvulaire maximale (TVP), b) la racine de l'aorte carré taux (RMS) d'écoulement normal, c) aortique écoulement vers l'avant, de clôture, de fuite signifie et le volume régurgitant tout, d) zone de soupape de fin d'orifice (EOA), e) transaortique écoulement vers l'avant, fermeture, les fuites et les pertes d'énergie totales.
Résultats
flux de représentant et courbes de pression sont présentés dans les figures 3, 4 et 5. Les parcelles ont été moyennées sur la taille de l'échantillon de vannes testées pour chaque groupe, ce qui était, n = 5, 4 et 2 soupapes de polymère, porcine indigène et groupes bi-feuillet, respectivement. Les paramètres hydrodynamiques moyennes et l'erreur standard de la moyenne de ces échantillons sont présentés dans le tableau 1.
Discussion
Dans cette étude, nous avons démontré l'utilité de la modification d'une unité de duplication pulsatile disponible dans le commerce pour accueillir des géométries de soupape tri-leaflet sorte que les essais hydrodynamique du polymère et de valves porcines indigènes peut être effectuée. Plus précisément, dans notre cas, le système modifié était un cœur gauche ViVitro et système de simulation systémique (Figure 1a), contrôlée par le système d'acquisition de données ViViT...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Une subvention de démarrage de l'Université de Floride - College of Medicine est grandement appréciée. Études supérieures (Manuel Salinas) ont été soutenus par une des possibilités des minorités dans les programmes de recherche biomédicale - Initiative de recherche pour l'amélioration scientifique (MBRS-RISE) bourses: NIH / NIGMS R25 GM061347. Le soutien financier de la Fondation Wallace H. Coulter à travers Florida International University de, Département de génie biomédical est également appréciée. Enfin, les auteurs remercient les étudiants suivants pour leur aide au cours des différentes étapes du processus expérimental: Kamau Pier, Malachi Suttle, Kendall Armstrong et Abraham Alfonso.
matériels
| Name | Company | Catalog Number | Comments |
| Pump | ViVitro Labs | http://vivitrolabs.com/products/superpump/ | |
| Flow Meter and Probe | Carolina Medical | Model 501D | http://www.carolinamedicalelectronics.com/documents/FM501.pdf |
| Pressure Transducer | ViVitro Labs | HCM018 | |
| ViVitro Pressure Measuring Assembly | ViVitro Labs | 6186 | |
| Valve holder | WB Engineering | Designed by Florida International University. Manufactured by WB Engineering | |
| Pulse Duplicator | ViVitro Labs | PD2010 | http://vivitrolabs.com/wp-content/uploads/Pulse-Duplicator-Accessories1.pdf |
| Pulse Duplicator Data Acquisition and Control System, including ViViTest Software | ViVitro Labs | PDA2010 | http://vivitrolabs.com/products/software-daq |
| Porcine Hearts and Native Aortic Valves | Mary's Ranch Inc | ||
| Bi-leaflet Mechanical Valves | Saint Jude Medical | http://www.sjm.com/ | |
| High Vacuum Grease | Dow Corning Corporation | http://www1.dowcorning.com/DataFiles/090007b281afed0e.pdf | |
| Glycerin | McMaster-Carr | 3190K293 | 99% Natural 5 gal |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | MT21031CV | 100 ml/heart |
| Antimycotic/Antibiotic Solution | Fisher Scientific | SV3007901 | 1 ml in 100 ml of PBS/heart; 20 ml for ViVitro System |
| NaCl | Sigma-Aldrich | S3014-500G | 9 g/L of deionized water |
| Deionized Water | EMD Millipore Chemicals | Millipore Deionized Purification System. 1.3 L for ViVitro System, 200 ml for heart valve dissection process |
Références
- Rajamannan, N. M., et al. Calcific aortic valve disease: not simply a degenerative process: A review and agenda for research from the National Heart and Lung and Blood Institute Aortic Stenosis Working Group. Executive summary: Calcific aortic valve disease-2011 update. Circulation. 124, 1783-1791 (2011).
- Marijon, E., Mirabel, M., Celermajer, D. S., Jouven, X. Rheumatic heart disease. Lancet. 379, 953-964 (2012).
- Karaci, A. R., et al. Surgical treatment of infective valve endocarditis in children with congenital heart disease. J. Card. Surg. 27, 93-98 (2012).
- Knirsch, W., Nadal, D. Infective endocarditis in congenital heart disease. Eur. J. Pediatr. 170, 1111-1127 (2011).
- Korossis, S. A., Fisher, J., Ingham, E. Cardiac valve replacement: a bioengineering approach. Biomed. Mater. Eng. 10, 83-124 (2000).
- Ghanbari, H., et al. Polymeric heart valves: new materials, emerging hopes. Trends Biotechnol. 27, 359-367 (2009).
- Mol, A., Smits, A. I., Bouten, C. V., Baaijens, F. P. Tissue engineering of heart valves: advances and current challenges. Expert Rev. Med. Devices. 6, 259-275 (2009).
- Ramaswamy, S., et al. The role of organ level conditioning on the promotion of engineered heart valve tissue development in using mesenchymal stem cells. Biomaterials. 31, 1114-1125 (2010).
- Sacks, M. S., Schoen, F. J., Mayer, J. E. Bioengineering challenges for heart valve tissue engineering. Annu. Rev. Biomed. Eng. 11, 289-313 (2009).
- Zamorano, J. L., et al. EAE/ASE recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease. J. Am. Soc. Echocardiogr. 24, 937-965 (2011).
- ANSI/AAMI/ISO. Cardiovascular Implants - Cardiac Valve Prostheses. Assoc. Adv. Med. Instrum. 71, (2005).
- Gallocher, S. L. . Durability Assessment of Polymer Trileaflet Heart Valves PhD thesis. , 313 (2007).
- Carroll, R., Boggs, T., Yamaguchi, H., Al-Mously, F., DeGroff, C., Tran-Son-Tay, R. Blood Cell Adhesion on Polymeric Heart Valves. , (2012).
- Pierre, K. K., Salinas, M., Carroll, R., Landaburo, K., Yamaguchi, H., DeGroff, C., Al-Mousily, F., Bleiweis, M., Ramaswamy, S. Hydrodynamic Evaluation of a Novel Tri-Leaflet Silicone Heart Valve Prosthesis. , (2012).
- Cacciola, G., Peters, G. W., Schreurs, P. J. A three-dimensional mechanical analysis of a stentless fibre-reinforced aortic valve prosthesis. J. Biomech. 33, 521-530 (2000).
- De Hart, J., Cacciola, G., Schreurs, P. J., Peters, G. W. A three-dimensional analysis of a fibre-reinforced aortic valve prosthesis. J. Biomech. 31, 629-638 (1998).
- Lim, W. L., Chew, Y. T., Chew, T. C., Low, H. T. Pulsatile flow studies of a porcine bioprosthetic aortic valve in vitro: PIV measurements and shear-induced blood damage. J. Biomech. 34, 1417-1427 (2001).
- Gutierrez, C., Blanchard, D. G. Diastolic heart failure: challenges of diagnosis and treatment. Am. Fam. Physician. 69, 2609-2616 (2004).
- Shi, Y., Yeo, T. J., Zhao, Y., Hwang, N. H. Particle image velocimetry study of pulsatile flow in bi-leaflet mechanical heart valves with image compensation method. J. Biol. Phys. 32, 531-551 (2006).
- Chandran, K. B., Yoganathan, A. P., Rittgers, S. E. . Biofluid Mechanics: The Human Circulation. , 277-314 (2007).
- Akins, C. W., Travis, B., Yoganathan, A. P. Energy loss for evaluating heart valve performance. J. Thorac. Cardiovasc. Surg. 136, 820-833 (2008).
- Fung, Y. C. . Biomechanics: Circulation. , (1997).
- Keener, J., Sneyd, J. . Mathematical Physiology, II: Systems Physiology. , (1998).
- Quick, C. M., Berger, D. S., Noordergraaf, A. Apparent arterial compliance. Am. J. Physiol. 274, H1393-H1403 (1998).
- Wang, Q., Jaramillo, F., Kato, Y., Pinchuk, L., Schoephoerster, R. T. Hydrodynamic Evaluation of a Minimally Invasive Heart Valve in an Isolated Aortic Root Using a Modified In Vitro Model. J. Med. Devices. 3, 011002.1-011002.6 (2009).
- Baldwin, J. T., Campbell, A., Luck, C., Ogilvie, W., Sauter, J. Fluid dynamics of the CarboMedics kinetic bileaflet prosthetic heart valve. Eur. J. Cardiothorac. Surg. 11, 287-292 (1997).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon