Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure intracellulaire de Ca
Dans cet article
Résumé
Intracellulaire de Ca 2 + Dynamique est très importante dans le sperme physiologie et Ca 2 + Sensibles à des colorants fluorescents constituent un outil polyvalent pour les étudier. expériences de la population (fluorimétrie et arrêté fluorometrie de flux) et des expériences de cellules individuelles (cytométrie en flux et l'imagerie cellulaire unique) sont utilisés pour suivre spatio-temporelle [Ca 2 +] Changements dans les cellules du sperme humain.
Résumé
Les spermatozoïdes sont des cellules reproductrices mâles spécialement conçues pour atteindre, à reconnaître et fusionner avec l'ovule. Pour effectuer ces tâches, les spermatozoïdes doivent être prêts à faire face à un environnement en constante évolution et de surmonter plusieurs obstacles physiques. Être en essence transcription et translation silencieuse, ces cellules mobiles comptent profondément sur divers mécanismes de signalisation de s'orienter et se baigner dans un mode scène et à composer avec des conditions environnementales difficiles au cours de leur voyage pour trouver l'œuf. En particulier, le Ca 2 + signalisation médiée est essentiel pour plusieurs fonctions de sperme: activation de la motilité, la capacitation (un processus complexe qui prépare le sperme pour la réaction de l'acrosome) et la réaction de l'acrosome (un événement exocytotique qui permet la fusion de sperme oeuf). L'utilisation de colorants fluorescents pour suivre les fluctuations intracellulaires de cet ion est d'une importance remarquable en raison de leur facilité d'application, la sensibilité et la polyvalence de detection. L'utilisation d'un protocole colorant charge unique, nous utilisons quatre techniques différentes fluorimétriques pour surveiller sperme Ca 2 + dynamique. Chaque technique fournit des informations distincte qui permet une résolution spatiale et / ou temporelle, la génération de données, tant au niveau des populations cellulaires cellule unique et.
Introduction
Ca 2 + est un second messager universel de voies de transduction de signaux dans les cellules eucaryotes. Ca2 + intracellulaire (Ca 2 + i) participe à la régulation de nombreux processus physiologiques fondamentaux dans les cellules excitables à la fois et non excitable. L'importance et l'universalité de Ca 2 + comme second messager pendant les événements de transduction du signal est dérivé de sa polyvalence spatio-temporelle dans la transmission des informations au sein de la cellule. Alors que Ca 2 + ne peut pas être synthétisé de novo ou dégradés au sein de la cellule, sa concentration intracellulaire ([Ca 2 +] i) est maintenue dans des limites très strictes à travers différents mécanismes cellulaires tampon en continu, séquestrer, compartimenter et / ou accumuler Ca 2 +. Les variations de la concentration de cet ion peuvent se produire dans des zones très localisées à l'intérieur de la cellule 1, et à déchiffrer ces fluctuations est essentielle pour avoir une decompréhension de l'EPER (1) de leur rôle dans le mécanisme de signalisation, (2) leur signification physiologique, et (3) les mécanismes généraux de la signalisation cellulaire. Ca 2 + signalisation médiée revêt une importance particulière dans la physiologie de sperme 2. La motilité des spermatozoïdes est l'une des fonctions les plus importantes pour la réussite de la fécondation, et, en fait, plusieurs anomalies de la motilité des spermatozoïdes peut causer la stérilité 3-5. L'importance de Ca 2 + dans le mouvement du flagelle est reconnu depuis longtemps 6, mais le mécanisme de la façon Ca 2 + contrôle la forme spécifique de flagelles flexion n'est pas entièrement comprise.
Avant de fusionner avec l'ovule, les spermatozoïdes doivent subir la capacitation, un processus complexe dépendant de résidence de spermatozoïdes dans le tractus génital féminin. Au cours de capacitation, lipides l'architecture et l'organisation du sperme membrane sont modifiés, principalement en raison de l'élimination du cholestérol de la membrane plasmique. En outre, plusieurs protéines sont tyrosine-phosphoreylated 7. Fait important, au cours de capacitation il ya une augmentation du pH intracellulaire (pH i) et de [Ca 2 +] i, et le potentiel de membrane hyperpolarise chez certaines espèces 2. Capacitation n'a lieu que dans une sous-population de spermatozoïdes (20-40%), et les mécanismes impliqués dans toutes ces modifications cellulaires sont loin d'être claires. Il est généralement admis que seule une sous-population de spermatozoïdes capacités subir la réaction de l'acrosome (AR) lorsqu'ils sont exposés à des inducteurs physiologiques. L'AR est aussi un événement + 2 réglementé Ca nécessaire pour la fécondation chez toutes les espèces possédant un acrosome (organite spécialisé avec membranes externes et internes). Au cours de ce processus, les fusibles de la membrane acrosomique externe avec la membrane plasmique du spermatozoïde, libérant des enzymes hydrolytiques qui permettent au spermatozoïde de pénétrer dans la matrice glyco-protéique qui entoure l'ovule (zone pellucide, ou ZP). Le RA expose également une nouvelle surface de la cellule de sperme fusogène qui interagit avecde la membrane plasmique des oeufs pour la fusion finale des deux gamètes. Il ya plusieurs ligands cellulaires qui induisent l'AR, la progestérone est l'un des plus étudiés parmi eux.
Dans ce travail, nous présentons quatre différentes techniques impliquant l'utilisation d'un 2 colorant fluorescent + sensible Ca à mesurer [Ca 2 +] i changements dans le sperme humain provoqué par la progestérone (à l'exception de la cytométrie de flux, dans laquelle nous avons mesuré la [Ca 2 + ] i augmentation induite pendant le processus de capacitation in vitro). Dans ce cas particulier, nous avons utilisé Fluo-3 AM (Life Technologies, Grand Island, NY), un colorant membrane perméable avec un Kd = 325 nM. In vitro, nous avons suivi les changements de fluorescence en fonction du temps avec trois des méthodologies, et avec la quatrième technique, nous avons mesuré des valeurs de fluorescence en un seul point donné dans le temps. Ces différentes approches se complètent les uns les autres, car ensemble, ils fournissent res spatiales et temporellesolution, tant au niveau de la population cellulaire de la cellule unique et.
Population cellulaire ou expériences en vrac
Techniques en vrac sont largement utilisés non seulement parce que les instruments dont ils ont besoin sont disponibles, mais aussi parce qu'ils sont simples, bien établi, et permettent l'étalement de l'information à partir de mesures effectuées sur des millions de cellules en une seule expérience.
Technique n ° 1. Fluorimétrie conventionnel
Cette technique surveille les variations de la fluorescence en fonction du temps, et les expériences sont réalisées dans des cuves en verre avec des volumes d'échantillon allant de 200 à 1000 pl. Un bon mélange de réactifs ont été ajoutés nécessite une agitation magnétique, et donc la résolution temporelle obtenue est de l'ordre de quelques secondes. La gamme de concentration cellulaire typique des échantillons analysés est de 10 5 -10 8 cellules / ml.
Technique n ° 2. Fluorimétrie Flow arrêté
Tsa technique surveille également les variations de la fluorescence en fonction du temps, mais les réactifs sont rapidement mélangés ensemble (en utilisant la pression) dans une cuvette d'enregistrement contenant un très faible volume de l'échantillon (allant de 25 à 100 pl). Par conséquent, l'homogénéisation des réactifs est instantané, ce qui permet une haute résolution temporelle de l'ordre de millisecondes. L'analyse des traces de fluorescence en fonction du temps qui en résultent sont aptes à déterminer les taux de réaction, l'élucidation de la complexité du mécanisme de réaction, d'obtenir des informations sur les intermédiaires de réaction de courte durée, etc La gamme de concentration cellulaire commun des échantillons analysés est de 10 5 -10 7 cellules / ml.
Simples expériences sur des cellules
Expériences en vrac signalent le comportement moyen d'un grand nombre de cellules, mais une population peut souvent présenter des propriétés hétérogènes qui sont négligés au cours de ce type de mesures. Techniques unicellulaires sont donc utilisés pour compléter èmeinformation e obtenu avec les expériences des populations cellulaires.
Technique n ° 3. cytométrie en flux
Malgré l'importance de l'information découlant de mesures de cellules simples, il est important d'analyser un grand nombre de cellules afin d'éviter l'extrapolation erronée des propriétés spécifiques des cellules d'une population entière. Pour cette raison, des techniques à haut débit sont favorisés et la méthode la plus populaire est la cytométrie de flux, dont 10.000 cellules par état sont classiquement analysées. Cette méthode permet une analyse multi-paramétrique de populations hétérogènes, car elle classe les cellules en fonction de leur taille (diffusion vers l'avant (FSC)), la granularité (diffusion latérale (SSC)) et de l'intensité de fluorescence (marquage spécifique avec un anticorps, un marqueur de viabilité, etc) , fournissant ainsi des informations sur la répartition des paramètres d'un groupe de cellules. La cytométrie en flux permet instant plutôt que de l'information dépendant du temps 8. Avant et sur le côté des valeurs disperser are aussi utile pour sélectionner une porte qui comporte des cellules, mais discrimine les débris cellulaires, la poussière, etc Pour des mesures de fluorescence, les contrôles de fluorescence négatifs et positifs doit également être inclus. Si plus d'un canal de fluorescence est utilisé, un processus connu sous le nom compensation doit être effectué (voir détails http://www.bdbiosciences.com/resources/protocols/setting_compensation.jsp ). Compensation permet de chevauchement spectral discrimination entre les fluorophores. La cytométrie en flux permet en outre la discrimination de cellules mortes, généralement au moyen d'iodure de propidium coloration.
Technique n ° 4. Imagerie cellulaire unique
La microscopie est une autre méthode commune pour étudier le comportement de cellules individuelles, il est bien adapté pour les études en fonction du temps et il fournit également la résolution spatiale. Un inconvénient majeur est que l'analyse à haut débit est seulement à ses débuts à l'heure actuelle 9.
Access restricted. Please log in or start a trial to view this content.
Protocole
Dans cet article, nous présentons l'utilisation des quatre techniques mentionnées ci-dessus pour mesurer [Ca 2 +] i changements dans les cellules du sperme humain. Nous avons utilisé la progestérone pour déclencher une réponse Ca 2 +, car il est bien établi que ce stéroïde produit transitoire [Ca 2 +] i augmenter dans les spermatozoïdes. En particulier, dans le sperme humain, de la progestérone active directement un canal de Ca 2 + (à savoir CatSper) exprimé exclusivement dans la membrane plasmique des cellules spermatiques 10,11. Nous avons également mesuré repos [Ca 2 +] i avant et après capacitation étant donné qu'il est largement admis qu'une augmentation de la [Ca 2 +] i se produit au cours de capacitation. Pour les techniques nécessitant un contrôle positif, nous avons utilisé un Ca2 + ionophore ionomycine pour induire maximal Ca 2 + absorption dans la cellule, et donc, la réponse fluorescence maximale, la valeur minimale de fluorescence, nous avons utilisé Mn 2 + pour étancher fluorescence.
1. Sperme préparation d'échantillons par la méthode Swim-up (voir la figure 1)
Utilisez uniquement éjaculé échantillons (obtenus par masturbation) dont les caractéristiques respecter les paramètres établis par la dernière édition du manuel Organisation laboratoire mondiale de la santé (disponible à http://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf ) pour l'examen et traitement de la semence humaine.
- Obtenir l'échantillon de sperme dans un récipient stérile et placez-la (avec bouchon dévissé) dans un incubateur à 37 ° C et CO 2 5% / air 95% pendant 30 min. Cette étape est pour l'échantillon liquéfaction.
- Placer les 500 aliquotes de l'échantillon de sperme liquéfié sur le fond de tubes à essai en verre propres (1,0 x 7,5 cm). Environ huit tubes à essai sont nécessaires pour un échantillon de taille moyenne (4 ml).
- Couche avec précaution 1 ml de F-10 de milieu de Ham (su. pplemented avec 2 mM CaCl 2 et 5 mg / ml de sérum albumine bovine à promouvoir la capacitation in vitro) sur le dessus de chaque aliquote de sperme (Voir Figure 1) CONSEIL: Appuyez sur la paroi du tube à l'extrémité de la micropipette, et passer doucement le support au-dessus de l'échantillon. Il est crucial de le faire lentement que le mélange des deux couches (échantillon et moyennes) doit être évité.
- Pencher attentivement les tubes à un angle de 30 ° environ. Cela permettra d'accroître la zone de surface entre les deux liquides, améliorant ainsi le déplacement (piscine) de cellules humaines à partir de l'échantillon dans le milieu au cours de l'incubation.
- Placer le groupe de tubes à essais se pencha à l'intérieur d'un incubateur à 37 ° C et 5% CO2 / 95% air pendant 1 h.
- Avec une micropipette retirer soigneusement la pl 700 supérieure de F-10 de milieu de HAM (contenant maintenant spermatozoïdes mobiles) de chaque tous les échantillons prélevés tube et piscine dans un seul tube en verre propre (1,0 x 7,5 cm; pour les grands volumes utilisent un 15 mlTube Falcon), en évitant la formation de bulles. Placer 10 ul d'échantillon groupé sur le verre plat optique d'un Makler comptage base de la chambre, puis placez le couvercle en verre (une fois que le couvercle est en place, éviter d'arracher ou de couvrir à nouveau de maintenir la diffusion uniforme de l'échantillon de sperme). Veillez à éviter la formation de bulles à l'intérieur de la chambre car cela conduirait à une numération cellulaire inexactes.
- Observez au microscope composé (l'utilisation d'un objectif 20X est recommandé). Le verre de couverture de la Chambre de comptage de Makler a un grand carré composé de 100 petits carrés (soit 10 par 10 grille). Compter les cellules dans une bande de 10 cases. Ce nombre représente leur concentration dans des millions de cellules / ml. Répétez le comptage dans deux bandes de 10 carrés supplémentaires, et de calculer la moyenne des trois chefs d'accusation. REMARQUE: Si une chambre de comptage de Makler (qui est spécialement conçu pour compter les spermatozoïdes) n'est pas disponible, une chambre de hémocytomètre peut être utilisé.
- Ajustez la FINA de l'échantillonl concentration de 1x10 7 cellules / ml dans complétée F-10 de milieu de Ham. Lorsque cela est nécessaire, incuber l'échantillon à 37 ° C et CO 2 5% / Air 95% pendant 5 heures à promouvoir la capacitation.
2. Colorant fluorescent chargement pour Ca 2 + Mesures
Il ya plusieurs colorants fluorescents disponibles pour mesurer intracellulaire de Ca 2 +, l'un approprié doit être choisi en fonction de son Kd, et ses longueurs d'onde d'émission et d'excitation (pour les mesures qualitatives et quantitatives, longueurs d'onde d'émission et d'excitation simples et doubles, respectivement, doit être utilisé) plus d'informations). Pour l'application qualitative présent nous avons utilisé Fluo-3 AM, un colorant cellulaire perméant avec un Kd = 325 nM et longueurs d'onde de 506/526 nm émission unique et d'excitation, respectivement 12.
- Préparer 50 pi d'un 1 mM Fluo-3h solution en dissolvant le contenu d'un flacon de 50 mg de colorant (MW = 1130 g / mol) dans 44 ul de DMSO anhydre.
- En utilisant un tube à centrifuger de 1,5 ml mélanger le volume requis de suspension de spermatozoïdes (voir quantité requise pour chaque technique spécifique ci-dessous) avec suffisamment de 1 mM Fluo-3h solution mère pour obtenir une concentration finale de 2 pm Fluo-3 AM (soit 1 pl d' Stock Fluo-3 AM est ajouté pour chaque 500 pi de suspension de spermatozoïdes).
- Incuber pendant 30 min à 37 ° C et à l'abri de la lumière.
- Centrifuger le tube à 750 g pendant 5 min à l'aide d'une micro-centrifugeuse, aspirer et jeter le surnageant et remettre le culot dans le volume approprié (voir concentration requise pour chaque technique spécifique ci-dessous) du sperme humain moyen (HSM; mM: NaCl 120, 15 NaHCO3 , 4 KCl, 1,8 CaCl2, 1 MgCl2, 10 HEPES, 10 Na lactate, 5 D-glucose, 1 pyruvate de Na, pH = 7,4) NOTE: La formation d'un nuage plutôt que d'une pastille indique que les cellules sont en bon état.
- Les cellules sont maintenant chargées avec le colorant, ils restent viables (maintenue à 37 ° C et à l'abri de la lumière) pendant environ deux heures, et peuvent être utilisés dans l'une des techniques suivantes.
3. Technique n ° 1. Fluorimétrie conventionnel (Informations moyen d'une grande population de cellules)
Equipement: Pour notre population de spermatozoïdes [Ca 2 +] i les mesures que nous utilisons un Aminco spectrofluoromètre SLM exploité par le logiciel Olis (Bogart, GA, USA) avec contrôle de l'agitateur magnétique (SIM Aminco), et couplé à une LED bleue (Luxeon étoile LXHL- LB3C, de LUMILEDS) et un filtre de 465 à 505 nm passe-bande (Chroma Technology Corp) pour Fluo-3 heures excitation. La LED est contrôlé par une alimentation sur mesure (700 mA). L'émission de lumière est mesurée en réglant la longueur d'onde d'émission (λ Em) à 525 nm sur le monochromateur de la spectrofluoromètre.
- Lieu 570 pi de HSM et 30 pl de suspension de spermatozoïdes (précédemment chargé avec Fluo-3 AM et remises en suspension dans HSM pour obtenir 1x10 8 cellules / ml) dans un tube de verre à fond plat (ID 8 x 50 mm). Placer un barreau magnétique à l'intérieur du tube et insérer le tube dans la chambre de lecture de la spectrofluoromètre (préchauffé à 37 ° C), mélanger l'échantillon pendant tout le temps la d'acquisition.
- Commencez l'expérience en utilisant le logiciel de l'équipement (logiciel Olis dans ce cas) et de procéder à l'acquisition de valeurs de fluorescence à une fréquence de 0,5 Hz pendant 300 sec. Appliquer les composés à tester souhaités par injection d'un volume approprié d'une solution de stock (généralement 100X plus concentrée que la concentration finale souhaitée) à l'aide d'un Hamilton micro-seringue comme suit:
- Acquérir fluorescence basale pendant 30 sec.
- ajouter 4 progestérone uM (Pg).
- A 100 sec ajouter 20 pM ionomycine (en tant que contrôle positif, pour obtenir la valeur maximale de fluorescence).
- Exécutez un contrôle négatif en répétant les étapes 3.1 à 3.2.3 ci-dessus, mais en ajoutant au lieu de Pg seulement le solvant utilisé pour dissoudre (HSM avec 0,01% de DMSO anhydre).
- Exporter des valeurs d'intensité de fluorescence premières à Microsoft Excel et normaliser au moyen de l'équation suivante: (f/f0) - 1. Où F est l'intensité de fluorescence mesurée à un instant donné (t), et F0 est la fluorescence basale moyenne prise au cours de la période initiale de 30 sec. Tracer la série totale de (f/f0) - 1 valeurs en fonction du temps (figure 2A). Mesurer la différence entre les valeurs d'intensité de fluorescence avant et après l'addition des composés de test (AF), les tracer sur un graphique à barres et traiter les données en appliquant les méthodes d'analyse statistique appropriée (figure 2B).
4. Technique n ° 2. Arrêté Flow Fluorimétrie (information à haute résolution temporelle d'une grande population de cellules)
Equipement: intracellulaire [Ca 2 +] changements sont mesurés avec une haute résolution temporelle en utilisant un SFM-20 stopped-flow mélangeur couplé à un système optique MOS-200 rapide cinétique, à la fois des instruments de sciences biologiques (Grenoble, France). Toutes les données sont analysées avec le logiciel Bio-Kine32 de la même entreprise.
- Fixer les conditions appropriées à l'équipement; la source d'éclairage doit être allumé au moins 15 min avant de commencer l'expérience, régler filtres d'excitation et d'émission, réglez le photomultiplicateur à une valeur de tension dans la fourchette établie par le fabricant stopped-flow, et définir la température du bain à 37 ° C.
- Remplissez un des seringues de l'instrument avec 1 ml de Fluo-3 spermatozoïdes AM-chargés (1X10 7 cellules / ml) et la seconde seringue de 1 ml du composé à tester, soit HSM (contrôle négatif),10 ionomycin uM (contrôle positif) ou 10 pg de iM dissous dans HSM. Remarque: Dans cette étape, il est essentiel d'éviter la formation de bulles tout en attirant les liquides dans les seringues.
- Soulevez les deux pistons de l'instrument jusqu'à ce qu'ils touchent le bout des pistons de seringue.
- Régler le taux de débit à la valeur minimale qui fournira une réponse mesurable, afin de minimiser les dommages cellulaires. Le débit que nous utilisons dans le système SFM-20 est de 1 ml / sec 13.
- Régler la fréquence (dans ce cas 10 msec) et la durée totale d'échantillonnage (dans ce cas 50 sec).
- Déclencher le mélange des réactifs. REMARQUE: Si un seul déclenchement à la fois peut être faite manuellement, un ensemble de déclencheurs automatiques consécutifs peut être pré-programmé ainsi.
- La trace de fluorescence brute (unités arbitraires) en fonction du temps est affiché sur l'écran de l'ordinateur.
- Le mélange des réactifs en soi va générer une trace qui n'est pas une ligne droite. Ainsi, afin d'obtenir la réelle [Ca2 +] changement dérivé d'un stimulus, la trace de commande obtenue à partir de cellules de mélange avec un milieu (témoin négatif) doit être soustraite de chacune des traces expérimentales. Analyser les données selon les besoins; certains paramètres cinétiques peuvent également être obtenus avec le logiciel d'acquisition de Bio-Kine32. Traces brutes sans soustraction sont présentés dans la figure 1 supplémentaire pour la comparaison.
- Pour changer le réactif dans la seringue composé de test, nettoyez-le soigneusement avec de l'eau distillée. Puis remplissez la seringue à son volume maximum avec de l'eau distillée, placez-le dans le piston correspondant de l'Fluorimètre stopped-flow et pousser l'eau à travers le mécanisme interne (l'eau de rinçage doit être dirigée vers le conteneur de déchets). Répétez cette étape deux fois plus.
- Répéter les étapes 4.2 à 4.9, le remplissage de la seconde seringue avec le composé d'essai souhaitée suivante.
- A la fin de l'expérience, rincer tout l'équipement avec de l'eau distillée, drainant complètement l'eau dutuyaux internes.
5. Technique n ° 3. cytométrie en flux (Single Informations cellulaire obtenue à partir d'un grand nombre de cellules)
Equipement: Cette technique permet la mesure simultanée de plusieurs paramètres en un seul moment dans le temps, mais contrairement aux techniques précédentes, il ne mesure pas les changements au fil du temps, il prévoit plutôt les valeurs des paramètres au moment de la mesure. Par conséquent, au lieu d'ajouter Pg pour déclencher la réponse, dans ce cas, nous avons mesuré la concentration intracellulaire de Ca 2 + niveaux de spermatozoïdes avant et après l'induction de capacitation. Nous avons utilisé un cytomètre FACSCanto (Becton Dickinson) et les données ont été analysées avec le logiciel FlowJo (Arbre Étoile 9.3.3).
- Préparer les échantillons expérimentaux dans des tubes de cytométrie en plaçant 500 pl de suspension cellulaire (4x10 6 cellules / ml) par tube dans chaque condition à tester (dans ce cas, dix conditions, voir le tableau 1). Recueillir des données de fluorescence from 10.000 événements par échantillon.
- Pour mettre en place une expérimentation utiliser le logiciel de l'appareil à:
- Créer un nouveau: dossier, d'expérimentation, spécimen et le nombre de tubes.
- Sélectionnez les paramètres de cytomètre appropriées pour Fluo-3 AM (utiliser FITC-isothiocyanate de fluorescéine-filtre) et PI (PI-utiliser l'iodure de propidium-filtre).
- Exécutez les tubes de contrôle non colorées 1 et 2 dans le cytomètre. Recueillir FCS et SSC données afin de vérifier que les paramètres de seuil sont appropriées et pour créer la porte correspondante afin de discriminer les débris de cellules.
- Pour créer des contrôles de compensation, exécuter les échantillons de contrôle suivantes, la collecte de données de fluorescence maximale (PI et canaux FITC) (NOTE: cette tâche est généralement effectuée par le technicien de l'équipement) et auto:
- Cellules non colorées (tubes 1 et 2).
- Cellules chargées avec Fluo-3 AM (2 M) (tubes 3 et 4).
- Les cellules mortes (spermatozoïdes en suspension dans 0,1% de Triton X-100 dans HSM pendant 10 min à température ambiante)tachée de PI (1,2 um PI; soit 0,25 ul de 2,4 mM PI est ajouté à 500 pi de suspension de sperme) pendant 30 min à 37 ° C, à l'abri de la lumière (tubes 5 et 6).- Voir les données enregistrées et sélectionnez la porte pour les populations souhaitées.
- Ajustez la porte et sélectionnez "Appliquer" pour tous les contrôles de la rémunération.
- Sélectionnez expérience> Configuration de compensation> calculer l'indemnité.
- Renommer la configuration de rémunération et le lien et économiser.
- Exécuter tous les tubes expérimentaux (dans ce cas, les tubes 7-10). A la fin, exporter toutes les données pour les logiciels disponibles pour l'analyse (voir l'étape 5.6).
- Analyser les résultats de chaque expérience en utilisant le logiciel de l'équipement, le logiciel FlowJo disponible dans le commerce ou logiciel Cytobank libre ( http://www.cytobank.org/ ).
6. Technique n ° 4. Imagerie cellulaire Simple (Simple informations de cellules à haute résolution spatiale)
Equipement:. Imaging sur plan set-up Notre imagerie set-up est composé d'un inversé Nikon Diaphot 300 microscope équipé d'un régulateur de température (Medical System Corp, Greenvale, NY), un Nikon PlanApo 60X (1.4 NA immersion d'huile) objectif. Éclairage par fluorescence est assurée par un V Star Lambertian Cyan LED Luxeon partie # LXHL-LE5C (Lumileds Lighting LLC, San Jose, CA) attaché à un boîtier de contrôle stroboscopique sur mesure. La LED a été monté dans un ensemble FlashCube40 avec miroir dichroïque M40-DC400 (Rapp optoélectroniques, Hambourg, Allemagne) (bande passante: excitation 450-490 nm, miroir dichroïque 505 nm et émission 520-560 nm). Sortie LED a été synchronisé avec le signal de sortie d'exposition d'une caméra CCD Snap frais via la boîte de commande pour produire un seul éclair de 2 msec par l'exposition individuelle. Le temps d'exposition de l'appareil a été mis équivalente à la durée flash (2 ms). Les images sont recueillies toutes les 250 msec (ou peuvent être ajustées en fonction dela résolution temporelle désiré) en utilisant le logiciel IQ (Andor Bioimaging, Wilmington, NC).
- Préparer des lamelles rondes (diamètre = 25 mm) en appliquant une baisse de 5 pi de solution de poly-L-lysine (0,01% p / v) sur le centre. Laisser reposer pendant au moins 1 heure (il peut sécher). L'utilisation d'un vaporisateur rincer la zone traitée avec de l'eau avant utilisation. Cette procédure permettra aux spermatozoïdes de se conformer à la lamelle de leur tête, tandis que leur flagelle peut encore bouger.
- Préparer les composés à tester en les dissolvant dans HSM selon le tableau 2. Les composés sont ajoutés successivement dans la même chambre de l'enregistrement, en prenant soin de toujours ajouter le même volume, et à régler la concentration de la solution de réserve en tenant compte de la dilution, il aura lorsqu'il est mélangé avec le volume déjà présent dans la chambre (comme indiqué dans Tableau 2). Gardez toutes les solutions d'essai dans un bain à 37 ° C jusqu'à ce qu'ils soient utilisés.
- Assemblez la lamelle à l'intérieur de la recording chambre et lieu 10 pi de Fluo-3 AM cellules chargées (1 x10 7 cellules / ml) dans le centre. Couvrir les cellules avec 200 pi de pré-chauffé HSM.
- Placer la chambre sur la platine du microscope pré-chauffée à 37 ° C, voir les cellules (en utilisant le contraste de phase) et de sélectionner une zone de formation d'image. Il est important de choisir une zone où la densité cellulaire est approprié (voir la figure 5A); trop de cellules rendent l'analyse difficile en raison de signaux qui se chevauchent NOTE: Les cellules doivent être solidement fixés à la lamelle par leur tête, mais présentant mouvement du flagelle, ce qui confirme. viabilité.
- Acquérir les images de fluorescence en mode direct à ajuster le focus et la luminosité.
- Commencez l'expérience en activant le logiciel d'acquisition d'images de séries chronologiques (IQ dans ce cas). Typiquement quatre images sont acquises par seconde avec un éclairage de 2 millisecondes par image.
- Utiliser une micropipette pour ajouter soigneusement (goutte à goutte), le composé de test (Pg dans ce cas), continuent imagl'acquisition de l'e selon les besoins et d'effectuer deux additions de commandes séquentielles dans la même chambre: (1) 20 pM ionomycine d'obtenir la fluorescence maximale, et (2) 5 mM de MnCl2 pour obtenir de fluorescence minimum. Alternativement, les composés peuvent être ajoutés à l'aide d'une chambre de perfusion qui offre les avantages de permettre le retrait du stimulus, et la possibilité de se baigner uniformément les cellules avec le composé. Dans le même temps, il ne les inconvénients de nécessiter de grandes quantités de solution, et de rendre le contrôle de la température plus problématique.
- Répétez l'acquisition d'une nouvelle chambre avec chaque composé de test désiré.
- Effectuer l'analyse d'images en ligne en utilisant le logiciel de l'équipement ou hors ligne utilisant le logiciel IQ ou Image J freeware. Dessiner les régions d'intérêt (ROI) autour de chaque cellule (ou une partie de la cellule) et aussi sélectionner une zone acellulaire (pour le fond soustraction automatique par le logiciel). Une série d'intensité temps-fluorescence est alors obtenue pour chaque ROI et ces machines donnéesy être exporté vers Microsoft Excel pour une analyse ultérieure. On normalise les valeurs d'intensité de fluorescence à l'aide de l'équation suivante: (f/f0) - 1. Où F est l'intensité de fluorescence mesurée à un instant donné (t) et F0 est la moyenne de fluorescence lors de la prise initiale de 30 sec. Tracer la série totale de (f/f0) - 1 en fonction du temps (figure 5B). Les valeurs peuvent aussi être normalisées en utilisant la valeur de fluorescence obtenue après addition de ionomycin à 100%.
- Analyse de l'image peut également être effectuée en utilisant l'image J logiciels libres.
Technique n ° 1. Fluorimétrie conventionnel
La progestérone est l'un des inducteurs connus AR et, comme prévu, elle provoquer une passagère [Ca 2 +] i augmentation de sperme humain (figure 2). Ajout d'un ionophore de calcium (ionomycin) provoque le maximum [Ca 2 +] i augmentation, qui ne renvoie pas à des niveaux de base.
Technique n ° 2. SFluorimétrie Flow sommet
La progestérone induit [Ca 2 +] i augmentation a été mesurée avant (fluorimétrie conventionnel), mais cette fois avec une plus grande résolution temporelle; dans ce cas, la fréquence d'acquisition était de 0,1 Hz. Comme le montre la figure 3, les deux progestérone (transitoire, ligne rouge) et de l'ionomycine (soutenue, ligne bleue) ont provoqué une très rapide [Ca 2 +] i augmenter. L'absence d'un retard dans l'augmentation de la progestérone induit [Ca 2 +] i est cohérent avec les rapports précédents suggèrent que la progestérone active directement le canal Ca 2 + CatSper, sans intermédiaire signalisation 10,14.
Technique n ° 3. cytométrie en flux
[Ca 2 +] i a été mesurée dans le sperme humain capacitation et non capacitation. Comme rapporté précédemment chez la souris 15, le sperme bovin 16 et 17 sperme humain, nous avons également observé une augmentation [Cun 2 +] i dans capacitation du sperme humain par rapport à non-capacitation. Baldi, et al. (1991) 17 a rapporté plus basale [Ca 2 +] i dans capacitation que dans le sperme humain non-capacitation en utilisant fluorimétrie conventionnel. Dans ce travail, nous avons utilisé la cytométrie en flux pour mesurer [Ca 2 +] i avant et un après dans la capacitation in vitro. La cytométrie en flux permet de voir que la distribution des valeurs de fluorescence pour les spermatozoïdes capacités (figure 4D, trace bleue) est décalée vers des valeurs plus élevées par rapport au sperme non-capacitation (figure 4D, trace rouge). Les valeurs de fluorescence de chaque cellule individuelle peuvent être observés dans les parcelles de points en deux dimensions indiquées dans la figure 4G, surtout, le signal issu de cellules mortes (15% environ) peut être éliminé (figure 4G, quadrants supérieurs).
Technique n ° 4. Imagerie cellulaire unique
La progestérone induired [Ca 2 +] i le changement a été mesurée dans les spermatozoïdes isolés. Outre la progestérone provoque une augmentation de la [Ca 2 +] i la fois dans la tête du spermatozoïde et dans le flagelle. Comme observé dans les expériences de la population, l'analyse de la cellule unique a révélé une passagère et une augmentation soutenue de la progestérone et de l'ionomycine, respectivement.
Access restricted. Please log in or start a trial to view this content.
Résultats
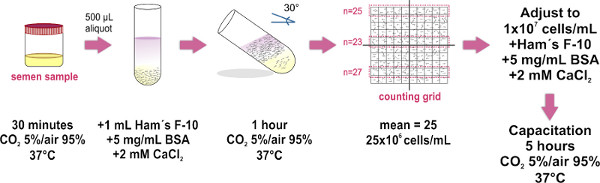
Figure 1. Schéma du protocole expérimental pour le sperme préparation d'échantillons par la méthode swim-up. Les principales étapes de la séparation de spermatozoïdes mobiles et pour l'ajustement de leur concentration sont illustrés. La dernière étape d'incubation est effectuée uniquement lorsque...
Access restricted. Please log in or start a trial to view this content.
Discussion
Signalisation intracellulaire est vital pour la plupart des activités cellulaires; Ca 2 + est un messager ubiquitaire qui accompagne les cellules de mammifères pendant toute leur durée de vie, de leur origine à la fécondation, à la fin de leur cycle de vie. En réponse à différents stimuli, [Ca 2 +] i augmente, oscille et diminue avec la codification spatio-temporelle, en conséquence, divers procédés sont activés, modulés ou résilié par le Ca 2 + messages codés. Ca2 ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous n'avons rien à révéler.
Remerciements
Les auteurs remercient Jose Luis De la Vega, Erika Melchy et le Dr Takuya Nishigaki pour l'assistance technique. Ce travail a été soutenu par Consejo Nacional de Ciencia y Tecnología (CONACyT-Mexique) (99333 et 128566 pour CT); Dirección General de Asuntos del Personal Académico / Universidad Nacional Autónoma de México (IN202212-3 CT).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Ham's F-10 | Sigma-Aldrich | N-6013 | |
| Bovine Serum Albumin | Sigma-Aldrich | A-7906 | |
| Calcium Chloride Dihydrate approx. 99% | Sigma-Aldrich | C-3881 | |
| Makler Counting Chamber | SEFI Medical Insruments LTD | SEF-MAKL | |
| Fluo-3 AM | Invitrogen | F-1242 | 20 vials/50 μg each |
| Ionomycin | Alomone | I-700 | |
| Progesterone | Sigma-Aldrich | P0130 | |
| Sodium chloride | Sigma-Aldrich | S-9888 | Reagents for human sperm medium (HSM) |
| Potassium chloride | Sigma-Aldrich | P-3911 | Reagents for human sperm medium (HSM) |
| Sodium bicarbonate | JT Baker | 3506 | Reagents for human sperm medium (HSM) |
| Magnesium chloride | Sigma-Aldrich | M-2670 | Reagents for human sperm medium (HSM) |
| Calcium chloride anhydrous | Sigma-Aldrich | C-1016 | Reagents for human sperm medium (HSM) |
| HEPES | Sigma-Aldrich | H-3125 | Reagents for human sperm medium (HSM) |
| D-Glucose | JT Baker | 1906-01 | Reagents for human sperm medium (HSM) |
| Sodium pyruvate | Sigma-Aldrich | P-2256 | Reagents for human sperm medium (HSM) |
| Sodium L-lactate (aprox. 99%) | Sigma-Aldrich | L- 7022 | Reagents for human sperm medium (HSM) |
| Propidium Iodide | Invitrogen | L-7011 | Component B |
| Triton X-100 (t-Octylphenoxypolyethoxyethanol) | Sigma- Aldrich | X-100 | 2.4 mM solution in water |
| Round coverslip | VWR | 48380 080 | 25 mm diameter |
| Poly-L-lysine solution | Sigma-Aldrich | P8920 | |
| Manganese chloride | Sigma-Aldrich | M-3634 | |
| Attofluor; Cell Chamber, for microscopy | Life technologies | A-7816 | |
| Dimethyl Sulphoxide | Sigma-Aldrich | D2650 | 5x5 ml |
Références
- Bouschet, T., Henley, J. M. Calcium as an extracellular signalling molecule: perspectives on the Calcium Sensing Receptor in the brain. Comptes Rendus Biologies. 328, 691-700 (2005).
- Darszon, A., Nishigaki, T., Beltran, C., Trevino, C. L. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91, 1305-1355 (2011).
- Esposito, G., et al. Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect. Proc. Natl. Acad. Sci. U.S.A. 101, 2993-2998 (2004).
- Avenarius, M. R., et al. Human male infertility caused by mutations in the CATSPER1 channel protein. American Journal of Human Genetics. 84, 505-510 (2009).
- Carlson, A. E., et al. Pharmacological targeting of native CatSper channels reveals a required role in maintenance of sperm hyperactivation. PLoS ONE. 4, e6844(2009).
- Brokaw, C. J. Calcium and flagellar response during the chemotaxis of bracken spermatozoids. J. Cell. Physiol. 83, 151-158 (1974).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121, 1139-1150 (1995).
- Svahn, H. A., van den Berg, A. Single cells or large populations. Lab on a chip. 7, 544-546 (2007).
- Pepperkok, R., Ellenberg, J. High-throughput fluorescence microscopy for systems biology. Nat. Rev. Mol. Cell Biol. 7, 690-696 (2006).
- Strunker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P., et al. The Control of Male Fertility by Spermatozoan Ion Channels. Annu. Rev. Physiol. , (2011).
- Kao, J. P., Harootunian, A. T., Tsien, R. Y. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J. Biol. Chem. 264, 8179-8184 (1989).
- Kilic, F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. Journal of the American Chemical Society. 131, 4027-4030 (2009).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Xia, J., Ren, D. The BSA-induced Ca2+ influx during sperm capacitation is CATSPER channel-dependent. Reprod. Biol. Endocrinol. 7, 119(2009).
- Galantino-Homer, H. L., Florman, H. M., Storey, B. T., Dobrinski, I., Kopf, G. S. Bovine sperm capacitation: assessment of phosphodiesterase activity and intracellular alkalinization on capacitation-associated protein tyrosine phosphorylation. Mol. Reprod. Dev. 67, 487-500 (2004).
- Baldi, E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 12, 323-330 (1991).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon