Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Milliseconde conformationnels changements dans les protéines résolues par Photothermal déviation du faisceau
Dans cet article
Résumé
Nous rapportons ici l'application de la technique de déflexion de faisceau photothermique en combinaison avec un composé de calcium mis en cage, DM-nitrophen, pour surveiller microsecondes et une milliseconde dynamique et énergétique des changements structurels associés à l'association de calcium à une sonde calcique neuronal, Regulatory Element aval Antagoniste Modulator .
Résumé
déviation du faisceau photothermique avec photo-acoustique de la calorimétrie et réseau thermique appartient à la famille des méthodes photothermiques qui surveillent les temps un profil de volume et d'enthalpie changements de lumière induit des changements conformationnels de protéines sur microseconde à la milliseconde des échelles de temps qui ne sont pas accessibles à l'aide traditionnelle d'arrêt -flux instruments. En outre, étant donné que les changements globaux dans le volume et / ou l'enthalpie sont sondés, ces techniques peuvent être appliquées à des protéines et d'autres macromolécules biologiques qui n'ont pas un fluorophore et une étiquette ou d'un chromophore. Pour suivre la dynamique et de l'énergétique de changements structurels associés à Ca 2 + se lier à des transducteurs de calcium, de tels capteurs calciques neuronaux, un composé de calcium en cage, DM-nitrophen, est utilisé pour la photo-déclenchement d'une augmentation rapide (τ <20 ps) en calcium libre concentration et le volume associé et enthalpie changements sont sondés en utilisant une technique de déviation du faisceau photothermique.
Introduction
méthodes de photo-thermique tels que la calorimétrie photoacoustique, déviation du faisceau photothermique (APB), et des réseaux transitoires couplé avec une excitation laser nanoseconde représentent une alternative puissante aux transitoires spectroscopies optiques pour les études résolues en temps de courte durée intermédiaires 1,2. Contrairement aux techniques optiques, tels que l'absorption transitoire et la spectroscopie IR, qui contrôlent le profil temporel des changements d'absorption dans le chromophore environnante; techniques photothermiques détecter la dépendance temporelle de l'évolution de la chaleur / volume et donc sont des outils précieux pour l'étude des profils de temps de optiquement processus «silencieux». Jusqu'à présent, la calorimétrie photoacoustique et réseau transitoire a été appliquée avec succès pour étudier la dynamique de conformation des processus photo-induites, y compris la migration de ligand diatomique dans globines 3,4, interactions ligand avec la protéine du capteur d'oxygène FixL 5, électronique et le transport des protons dans l'hème-cuivre oxydases 6 une photosystème II ainsi que photo-isomérisation dans la rhodopsine 7 et dynamique conformationnelle de cryptochromes 8.
Pour étendre l'application des techniques photothermiques de systèmes biologiques qui manquent un chromophore interne et / ou fluorophore, la technique PBD a été combiné avec l'utilisation du composé en cage à photo-déclenchement d'une augmentation de la concentration de ligand / substrat à l'intérieur de quelques microsecondes ou plus rapide, en fonction de sur le composé encagé. Cette approche permet la surveillance de la dynamique et de l'énergétique de changements structurels associés à la liaison ligand / substrat de protéines qui manquent un fluorophore interne ou chromophore et sur l'échelle de temps qui ne sont pas accessibles par des instruments arrêt flux commerciaux. Ici, une demande de PBD pour surveiller la thermodynamique du composé de cage, Ca 2 + DM-nitrophen, photo-clivage, ainsi que la cinétique de liaison de Ca 2 + pour le domaine C-terminal de la sonde calcique neuronal vers le basflux réglementation élément antagoniste Modulator (DREAM) est présenté. Le Ca2 + est libéré par photo-Ca 2 + DM-nitrophen à moins de 10 microsecondes et lie de nouveau à une cage unphotolysed avec une constante de temps d'environ 300 microsecondes. D'autre part, en présence d'un apoDREAM cinétique supplémentaire se produisant sur l'échelle de temps d'une milliseconde est observée et reflète la liaison à la protéine ligand. L'application de PBD pour sonder les transitions conformationnelles dans les systèmes biologiques a été quelque peu limitée en raison des difficultés instrumentales; alignement par exemple difficile de la sonde et du faisceau pompe pour obtenir un signal fort PBD et reproductible. Cependant, une conception minutieuse d'une instrumentation mise en place, un contrôle précis de la température, et un alignement précis de la sonde et la pompe faisceau fournissent un signal cohérent et robuste PBD qui permet de contrôler le volume en temps résolu et changements d'enthalpie sur un large échelle de temps de 10 microsecondes à environ 200 ms. En outre, modifications de la procédure expérimentale pour assurer la détection d'échantillon et de référence traces sous température identique, la composition du tampon, de l'orientation de la cellule optique, la puissance du laser, etc réduit sensiblement l'erreur expérimentale dans les volumes et les enthalpies de réaction mesurés.
Access restricted. Please log in or start a trial to view this content.
Protocole
Une. Préparatifs exemples
- Effectuer la préparation des échantillons et toutes les manipulations échantillon dans une pièce sombre pour prévenir une uncaging indésirables.
- Solubiliser nitrophen DM-((1 - (2-nitro-4 ,5-diméthoxyphényl) - N, N, N ', N'-tétrakis [(oxy-carbonyl)-méthyl] -1,2-éthanediamine) dans 50 mM d'HEPES tampon, mM KCl, pH 7,0 à une concentration finale de 400 pM (100 350 nm ε = 4330 M -1 cm -1 9).
- Ajouter CaCl2 partir de la solution 0,1 M d'atteindre un ratio souhaitable de [Ca 2 +]: [DM-nitrophen]. Pour les protéines ayant une valeur de Kd pour la liaison du Ca 2 + supérieure à 10 uM, le rapport de [Ca 2 +]: [DM-nitrophen] de 1:1 est préférable d'empêcher la liaison de photo-libéré de Ca 2 + à uncaged DM-nitrophen . En effet, compte tenu de la valeur de K d de DM-nitrophen être 10 nM et la concentration totale de DM-nitrophen et Ca 2 + à 400 mM, ~ 90% d'une protéine de liaison de calciumavec K d = 10 uM seront dans la apoform. D'autre part, pour l'étude de Ca 2 + se lier à des protéines avec des Kd <10 uM, il est préférable de diminuer la [Ca 2 +]: rapport [DM-nitrophen] de 0,95 à empêcher Ca 2 + complexation avec l'apo- protéine avant la cage photo-dissociation.
- Solubiliser le composé de référence, K 3 [Fe (III) (CN) 6] ou Na 2 CrO 4, dans le même tampon que pour l'échantillon.
2. Mise en place de l'Expérience
- La configuration expérimentale de base est représentée sur la figure 2.
- Utiliser un trou de broche (P 2) pour ajuster le diamètre du faisceau de sonde (632 de sortie de nm d'un laser He-Ne, ~ puissance laser de 5 mW) à 1 mm et de propager le faisceau sonde à travers le centre d'une cellule placée dans une température contrôlée support de cellule à l'aide d'un miroir M 1.
- Utiliser un miroir (M 2) en arrière de l'échantillon pour centrer le faisceau de sondesur un centre du détecteur sensible à la position.
- Focaliser le faisceau sonde sur le centre du détecteur de telle manière que la différence de tension entre les deux premières diodes et de fond de deux diodes ainsi que la différence de tension entre les deux diodes sur le côté gauche et droit du détecteur est zéro.
- Par la suite, la forme d'un diamètre du faisceau de pompage, une sortie de 355 nm de Q-switched laser Nd: YAG, 5 ns FWHM) en utilisant un trou d'épingle de 3 mm (P 1) placé entre deux miroirs de laser de 355 nm.
- Copropagate le faisceau de pompage à travers le centre de la cuve comme l'illustre la figure 2. Il est important que les deux faisceaux laser se propagent à travers le centre de la cellule optique de manière à peu près colinéaires afin d'obtenir un angle de déviation mesurable et donc une grande amplitude du signal de PBD. Dans des conditions expérimentales, l'angle de l'intersection des faisceaux sonde et pompe est inférieur à 15 °.
- Utilisez un composé de référence pour aligner la sonde et la pompefaisceau pour obtenir un signal PBD satisfaisante, c'est à dire un bon rapport S / N et stable amplitude PBD sur des échelles de temps plus longues (~ 100 ms).
- Ajuster la position du faisceau de pompage par rapport au faisceau sonde par un ajustement incrémentiel de miroirs laser 355 nm.
- Mesurer l'amplitude du signal de référence PBD comme une différence entre les deux photodiodes en haut et en bas sur le détecteur sensible à la position. Le signal PBD doit présenter une augmentation rapide de l'amplitude sur une échelle de temps rapide (<10 ps) et reste stable sur 100 calendrier ms comme le montre la figure 3. Le tir à la variabilité tiré de l'amplitude APB est à moins de 5% de l'amplitude du signal et la reproductibilité du signal est principalement affectée par les vibrations.
- Vérifier la linéarité de l'amplitude du signal PBD par rapport à l'énergie thermique dégagée par la mesure de la dépendance linéaire du signal PBD sur la puissance du laser d'excitation et le nombre de Einstein absorbé, E un= (10.01-A), où A correspond à l'absorbance de référence à la longueur d'onde d'excitation.
- Maintenir la puissance laser inférieure à environ 1 000 pJ et l'absorbance du composé échantillon / de référence à la longueur d'onde d'excitation inférieur à 0,5 pour éviter une absorption multiphotonique et une diminution de la puissance du faisceau de pompage, respectivement, et d'assurer la linéarité du signal PBD.
3. Mesures PBD
- Commencez par la mesure des traces PBD pour la référence. Placer la solution du composé de référence dans une cellule de quartz de 0,5 cm x 1,0 cm x 1,0 cm ou 1,0 cm et la position de la cellule dans le support à température contrôlée. Les deux longueurs de trajet fournissent amplitude PBD comparable.
- Détecter le signal de PBD de référence en fonction de la température dans la plage de températures 16-35 ° C avec l'augmentation de température de 3 ° C.
- A chaque changement de température, vérifier la position du faisceau de la sonde sur le détecteur sensible à la position et à nouveauajuster la position du centre du détecteur, si nécessaire.
- Vérifier la linéarité du signal PBD en fonction de la [(dn / dt) / ρ p C] terme conformément à l'équation 2.
- Placer la solution d'échantillon dans la même cellule optique que pour le composé de référence en conservant la même orientation de la cellule optique pour la mesure de référence.
- Détecter les traces de PBD de l'échantillon dans la même gamme de température que pour la référence et vérifier la linéarité de l'amplitude de l'échantillon PBD à l'égard de la [(dn / dt) / C p ρ] terme.
4. Analyse des données
L'amplitude de la déviation est directement proportionnelle à la variation de volume due à l'échauffement de l'échantillon (AV th) et de changement de volume non thermique (AV de nonth) selon l'équation 1: 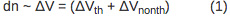
L'amplitude de l'échantillon (A S) Et de référence (A r) signal de PBD peut être décrit en utilisant les équations 2 et 3, respectivement. 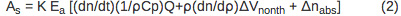
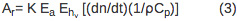
Le signal PBD est directement proportionnelle au paramètre de réponse de l'instrument (K) et le nombre d'Einstein absorbée (E a). Le premier terme de l'équation 2, (dn / dt) (1/ρC p) Q, correspond à la variation du signal due à la chaleur dégagée dans le solvant. Le dn / dt terme représente la variation dépendant de la température de l'indice de réfraction, ρ est la masse volumique du solvant, C p est la capacité calorifique. Tous les paramètres sont connus de l'eau distillée et peut être déterminée pour une solution de tampon en comparant un signal de PBD pour le composé de référence dans de l'eau distillée et dans un tampon approprié. Q est la quantité de returne de chaleurd pour le solvant. Le ρ (dn / d ρ) est un terme constant en unités de moins que est indépendante de la température dans la plage de température de 10-40 ° C 10. Terme abs An correspond à la variation de l'indice de réfraction due à la présence d'espèces absorbantes dans la solution et il est négligeable si la longueur d'onde du faisceau de sonde est déplacé par rapport au spectre d'absorption d'une espèce dans la solution. Le signal issu du composé de référence (A r) est exprimée par l'équation 3 h ν où E est l'énergie des photons à la longueur d'onde d'excitation, E h ν = 80,5 kcal / mol pour 355 nm excitation.
- Prendre l'amplitude du signal de PBD de référence comme la différence entre la pré-déclenchement et le signal de PBD poste de déclenchement comme illustré dans la figure 3. De la même manière, déterminer l'amplitude de la vitesse (A s rapide) et la phase lente (A s lent) Du signal échantillon de PBD.
- Pour éliminer le paramètre de réponse de l'instrument, K, l'échelle de l'amplitude du signal échantillon de PBD par l'amplitude du signal pour le PBD référence. Le rapport entre le signal d'échantillonnage au signal de référence et donne l'équation 4 peut être écrite comme:

- En utilisant cette équation, déterminer la chaleur libérée dans la solution (Q) et le changement de volume non thermique (AV de nonth) associée à une réaction de photo-initiée à partir de la pente et l'interception, respectivement, d'un terrain de [(A s / A r) E h ν] terme fonction de la température terme dépendant [(dn / dt) (1/ρCp)].
- Pour déterminer le volume de réaction et changement d'enthalpie pour le rapide et le lent processus, à l'échelle du volume observé et changement d'enthalpie pour le rendement quantique appropriée selon les équations 5-7.

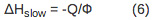
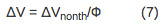
Pour un procédé en plusieurs étapes avec une cinétique se produisant sur l'échelle de temps comprise entre 10 ps ~ 200 ms, le volume et les variations d'enthalpie associées aux différentes étapes de la réaction peuvent être déterminées. Les amplitudes et les durées de vie pour les étapes individuelles sont analysées par ajustement des données à la fonction F (t), qui décrit l'évolution temporelle du volume et de changements d'enthalpie.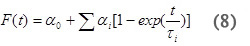
où α 0 correspond à la Une s rapide et α i correspond à une lente s pour chaque processus individuel et τ i sont la durée de vie des différentes étapes de réaction. De la dépendance en température de la constante de vitesse de for processus individuels (k i = 1 / τ i) les paramètres d'enthalpie d'activation et d'entropie peut être facilement déterminée en utilisant des parcelles Eyring.
Access restricted. Please log in or start a trial to view this content.
Résultats
Un exemple représentatif de PBD retrace pour Ca 2 + photo-libération de Ca 2 + DM-nitrophen est représenté dans la figure 3. La phase rapide correspond à la photo-clivage de Ca 2 + DM-nitrophen et la libération de Ca 2 +, tandis que la phase lente reflète la liaison du Ca 2 + à la cage nonphotolysed. Le tracé de l'échantillon PBD amplitude pour la phase rapide et lente à l'échelle de l'amplitude du composé de référence en ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le principe physique derrière procédés photothermiques qui est une molécule de photo-excité dissipe de l'énergie en excès par relaxation vibrationnelle à l'état de base, ce qui entraîne un chauffage thermique de la 1,12 solvant environnant. Pour les solvants tels que l'eau, ce qui produit une expansion de volume rapide (AV th). Molécules à l'état excité peuvent également subir des processus photochimiques qui entraînent des changements de volume non thermiques (AV
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu par la National Science Foundation (MCB 1021831, JM) et J. & E. Programme de recherche biomédicale (Floride ministère de la Santé, JM).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1-(4,5-Dimethoxy-2-Nitrophenyl)-1,2-Diaminoethane-N,N,N',N'-Tetraacetic Acid | Life Technologies | D-6814 | DM-nitrophen, cage calcium compound, keep stock solutions in dark to prevent photodissociation |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid, N-(2-Hydroxyethyl)piperazine-N′-(2-ethanesulfonic acid) | Sigma Adrich | 0909C | HEPES buffer |
| Potassium ferricyanide (III) | Sigma Aldrich | 702587 | reference compound for PBD measurements |
| Sodium chromate | Sigma Aldrich | 307831 | reference compound for PBD measurements |
| He-Ne Laser Diode 5 mW 635 nm | Edmund Optics | 54-179 | use as a probe beam for PBD measurements |
| Oscilloscope, | LeCroy | Wave Surfer 42Xs | 400 MHz bandwith |
| Nd:YAG laser | Continuum | ML II | pump beam for PBD measurements |
| M355; Nd:YAG laser mirror | Edmund Optics | 47-324 | laser mirror for 355 nm laser line |
| M1 and M2; Laser diode mirror | Edmund Optics | 43-532 | visilbe laser flat mirror, wavelength range 300-700 nm |
| P1 and P2; Iris Diaphragm | Edmund Optics | 62-649 | pin hole to shape the probe and pum beams |
| L1; bi-convex lens | Thorlabs | LB1844 | a lens to focus the probe beam at the detector, EFL 50 mm, wavelength range 350-2,000 nm |
| DM, dichroic mirror | Thorlabs | DMLP505 | a longpass dichroic mirror with a cutoff wavelength of 505 nm |
| F1; Edge filter | Andower | 500FH90-25 | a long pass filter with a cutoff wavelength of 500 nm |
| Temperature-controlled cuvette holder | Quantum Northwest | FLASH 300 |
Références
- Gensch, T., Viappiani, C. Time-resolved photothermal methods: accessing time-resolved thermodynamics of photoinduced processes in chemistry and biology. Photochem. Photobiol. Sci. 2, 699-721 (2003).
- Larsen, R. W., Mikšovská, J. Time resolved thermodynamics of ligand binding to heme proteins. Coord. Chem. Rev. 251 (9-10), 1101-1127 (2007).
- Westrick, J. A., Peters, K. S. A photoacoustic calorimetric study of horse myoglobin. Bioph. Chem. 37 (1-3), 73-79 (1990).
- Belogortseva, N., Rubio, M., Terrell, W., Miksovska, J. The contribution of heme propionate groups to the conformational dynamics associated with CO photodissociation from horse heart myoglobin. J. Inorg. Biochem. 101 (7), 977-986 (2007).
- Mikšovská, J., Suquet, C., Satterlee, J. D., Larsen, R. W. Characterization of Conformational Changes Coupled to Ligand Photodissociation from the Heme Binding Domain of FixL. Biochemistry. 44 (30), 10028-10036 (2005).
- Miksovska, J., Gennis, R. B., Larsen, R. W. Photothermal studies of CO photodissociation from mixed valence Escherichia coli cytochrome bo3. FEBS Lett. 579 (14), 3014-3018 (2005).
- Losi, A., Michler, I., Gärtner, W., Braslavsky, S. E. Time-resolved Thermodynamic Changes Photoinduced in 5,12-trans-locked Bacteriorhodopsin. Evidence that Retinal Isomerization is Required for Protein Activation. Photochem. Photobiol. 72, 590-597 (2000).
- Kondoh, M., et al. Light-Induced Conformational Changes in Full-Length Arabidopsis thaliana Cryptochrome. J. Mol. Biol. 413 (1), 128-137 (2011).
- Kaplan, J. H., Ellis-Davies, G. C. Photolabile chelators for the rapid photorelease of divalent cations. Proc. Natl. Acad. Sci. U.S.A. 85 (17), 6571-6575 (1988).
- Eisenberg, H. Equation for the Refractive Index of Water. J. Chem. Phys. 43 (11), 3887-3892 (1965).
- Ellis-Davies, G. C., Kaplan, J. H., Barsotti, R. J. Laser photolysis of caged calcium: rates of calcium release by nitrophenyl-EGTA and DM-nitrophen. Biophys. J. 70, 1006-1016 (1996).
- Miksovska, J., Larsen, R. W. Structure-function relationships in metalloproteins. Methods Enzymol. 360, 302-329 (2003).
- Miksovska, J., Norstrom, J., Larsen, R. W. Thermodynamic profiles for CO photodissociation from heme model compounds: effect of proximal ligands. Inorg. Chem. 44 (4), 1006-1014 (2005).
- Dhulipala, G., Rubio, M., Michael, K., Miksovska, J. Thermodynamic profile for urea photo-release from a N-(2-nitrobenzyl) caged urea compound. Photochem. Photobiol. Sci. 8, 1157-1163 (2009).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon