Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mener des expériences de Miller-Urey
Dans cet article
Résumé
L'expérience de Miller-Urey était une étude pionnière en ce qui concerne la synthèse abiotique de composés organiques avec pertinence possible aux origines de la vie. Gaz simples ont été introduites dans un appareil de verre et soumis à une décharge électrique, simulant les effets de la foudre dans le système atmosphère-océan de la Terre primordiale. L'expérience a été menée pendant une semaine, après quoi, les échantillons prélevés ont été analysés pour qu'il les blocs de construction chimiques de la vie.
Résumé
En 1953, Stanley Miller a rapporté la production de biomolécules à partir de matériaux de départ gazeux simples, utilisant un appareil construit pour simuler le système atmosphère-océan primordial de la Terre. Miller a introduit 200 ml d'eau, 100 mm de Hg de H 2, 200 mm de Hg, de CH 4 et de 200 mm de Hg de NH 3 dans l'appareil, puis soumis ce mélange au reflux, à une décharge électrique pendant une semaine, tandis que l'eau était simultanément chauffée. Le but de ce manuscrit est de fournir au lecteur un protocole expérimental général qui peut être utilisé pour effectuer un essai de décharge d'étincelle de type Miller-Urey d', en utilisant un ballon de 3 litres simplifié de la réaction. Depuis l'expérience consiste à exposer des gaz inflammables à une décharge électrique à haute tension, il convient de souligner les étapes importantes qui réduisent le risque d'explosion. Les modes opératoires généraux décrits dans ces travaux peuvent être extrapolés à concevoir et à réaliser une grande variété d'expérience à décharge électriques simulant des environnements planétaires primitifs.
Introduction
La nature des origines de la vie sur Terre reste l'une des questions scientifiques les plus impénétrables. Dans les années 1920 biologiste russe Alexander Oparin et de la Colombie évolution biologiste et généticien John Haldane proposé le concept d'une "soupe primordiale" 1,2, décrivant les océans terrestres primitives contenant des composés organiques qui ont pu faciliter l'évolution chimique. Cependant, il a fallu attendre les années 1950, lorsque les chimistes ont commencé à mener des études de laboratoire délibérées visant à comprendre comment les molécules organiques auraient pu être synthétisés à partir de matières premières simples sur la Terre primitive. L'un des premiers rapports à cette fin est la synthèse de l'acide formique à partir de l'irradiation de deux solutions aqueuses de CO en 1951 3.
En 1952, Stanley Miller, un étudiant de troisième cycle à l'Université de Chicago, Harold Urey approché de faire une expérience pour évaluer la possibilité que les composés organiquesimportant pour l'origine de la vie peut avoir été formé abiologically sur la Terre primitive. L'expérience a été effectuée en utilisant un appareil en verre sur mesure (Figure 1A) conçu pour simuler la Terre primitive. L'expérience de Miller foudre imité par l'action d'une décharge électrique sur un mélange de gaz représentant la première atmosphère, en présence d'un réservoir d'eau liquide, ce qui représente le début des océans. L'appareil simule aussi l'évaporation et la précipitation à l'aide d'une enveloppe chauffante et d'un condenseur, respectivement. Des détails précis sur l'appareil utilisé Miller peuvent être trouvés ailleurs 4. Après une semaine de production d'étincelles, le contenu du ballon a été visiblement transformées. L'eau s'est un trouble, couleur rougeâtre 5 et matériel jaune-brun accumulée sur les électrodes 4. Ce travail de pionnier est considéré comme le premier délibéré, synthèse efficace de biomolécules dans des conditions terrestres primitives simulées.
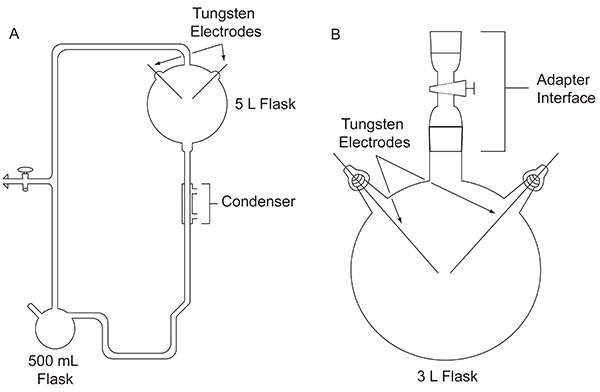
Figure 1. La comparaison entre les deux types d'appareils décrits dans ce document. L'appareil classique utilisé pour l'expérience originale de Miller-Urey (A) et l'appareil simplifié utilisé dans le protocole décrit ici (B). Cliquez ici pour agrandir l'image .
Après la publication 1953 de résultats d'expérience classique de Miller, de nombreuses variantes de l'expérience de décharge d'étincelle, par exemple en utilisant d'autres mélanges gazeux, ont été effectuées pour étudier la plausibilité des éléments de production de composés organiques importants pour la vie sous une variété de conditions éventuelles de la terre au début. Par exemple, un CH 4 / H 2 O / NH 3 / H 2 gazeux en mélange S a été testé pour sa capacité à produire des acides α-aminés contenant du soufre codées, même si ceux-ci n'ont pas été détectés 6. chromatographie-spectrométrie de masse en phase gazeuse (GC-MS) analyse d'un CH 4 / NH 3, le mélange est soumis à une décharge électrique a montré la synthèse d'α-aminonitriles, qui sont des précurseurs d'acide aminé 7. En 1972, en utilisant un appareil simple, d'abord introduit par Oró 8 (figure 1B), Miller et ses collègues ont démontré la synthèse de tous les acides codés d'α-amino-9 et les acides aminés non protéiques 10 qui avaient été identifiées dans la météorite Murchison à jour, en soumettant le CH 4, N 2, et de petites quantités de NH 3 à une décharge électrique. Ensuite, en utilisant ce même protocole expérimental simplifié, des mélanges gazeux contenant H 2 O, N 2 et CH 4, CO 2, CO ou ont été déclenchées à étudy le rendement en cyanure d'hydrogène, le formaldéhyde et les acides aminés en fonction de l'état des espèces de carbone dans l'atmosphère 11 d'oxydation.
En plus de l'exploration de modèles expérimentaux d'autres au cours des années, des progrès analytiques importantes ont eu lieu depuis expérience classique de Miller, qui a récemment aidé des enquêtes d'approfondissement de décharge électrique échantillons expérimentaux archivées par Miller, celui qui aurait été facilité par les techniques Miller a eu accès à dans les années 1950. Volcanique expérience de Miller 12, la première fois en 1955 4, et un 1958 H 2 S contenant expérience 13 ont été montrés pour avoir formé une plus grande variété et une plus grande abondance, de nombreux acides aminés et les amines de l'expérience classique, y compris beaucoup qui n'avaient pas été précédemment identifiée dans les expériences de décharge d'étincelle.
L'expérience décrite dans le présent document peut être réalisée en utilisantune variété de mélanges de gaz. En général, à tout le moins, ces expériences contiennent un gaz C-palier, un gaz N porteuses, et de l'eau. Avec un peu de planification, presque n'importe quel mélange de gaz peut être exploré, cependant, il est important de tenir compte de certains aspects chimiques du système. Par exemple, le pH de la phase aqueuse peut avoir un impact significatif sur la chimie qui se produit là 14.
La méthode décrite ici a été adapté pour instruire les chercheurs la façon de mener des expériences de décharge d'étincelles qui ressemblent à l'expérience de Miller-Urey en utilisant un récipient de 3 L de réaction simplifiée, comme décrit dans 1 972 publications de Miller 9,10. Etant donné que cette expérience implique un arc électrique à haute tension agissant sur les gaz inflammables, il est essentiel d'éliminer O 2 à partir du ballon de réaction pour éliminer le risque d'explosion, ce qui peut se produire lors de la combustion de gaz contenant du carbone réduits tels que le méthane ou le monoxyde de carbone, ou réaction of H 2 avec de l'oxygène.
Il ya des détails supplémentaires qui doivent être gardés à l'esprit lors de la préparation pour mener l'expérience discutée ici. Tout d'abord, lorsque vous travaillez avec des lignes à vide de verre et de gaz sous pression, il existe le danger inhérent à la fois de l'implosion et sur-pression. Par conséquent, des lunettes de sécurité doit être porté en tout temps. Deuxièmement, l'expérience est généralement effectuée au moins à la pression atmosphérique. Cela réduit le risque de sur-pression sur le collecteur et ballon de réaction. Verrerie peut être évalué à ou au-dessus de la pression atmosphérique, cependant, des pressions supérieures à 1 atm ne sont pas recommandés. Les pressions peuvent augmenter dans ces expériences comme insoluble dans l'eau H 2 est libéré de gaz réduits (tels que CH 4 et NH 3). Sur-pression peut conduire à des fuites d'étanchéité, ce qui peut permettre O 2 atmosphérique pour entrer dans le ballon de réaction, ce qui permet d'induire la combustion, ce qui entraîne une explosion. En troisième lieu,il convient de garder à l'esprit que la modification de ce protocole pour mener des variations de l'expérience nécessite une planification rigoureuse pour assurer des conditions dangereuses ne sont pas créés. Quatrièmement, il est fortement recommandé que l'expérimentateur prospective lire à travers l'ensemble du protocole soigneusement plusieurs fois avant de tenter cette expérience pour être sûr qu'il ou elle connaît les pièges potentiels et que tout le matériel nécessaire est disponible et en place. Enfin, des expériences impliquant des conducteurs gaz combustibles exigent le respect des lignes directrices du ministère de la santé et de la sécurité de l'environnement de l'établissement d'accueil de l'expérimentateur. S'il vous plaît respecter ces recommandations avant de procéder à des expériences. Toutes les étapes décrites dans le protocole ici sont en conformité avec les directives institutionnelles accueil santé et la sécurité de l'environnement de l'auteur.
Protocole
Une. Établir un système de collecteur d'admission / à vide
- Utiliser un collecteur de verre pour introduire des gaz dans le ballon de réaction. Ce collecteur peut être acheté ou construit par une installation de soufflage de verre, mais il doit comporter des orifices d'aspiration étanche qui peuvent être connectés à un système d'aspiration, des bouteilles de gaz, une jauge à vide, et le récipient de réaction.
- Utilisez des joints en verre dépoli et des bouchons de verre avec des vannes sur le collecteur. Assurez-vous que tous les joints toriques sur les bouchons sont capables de faire les joints nécessaires. Si l'on utilise des joints en verre, d'une quantité suffisante de graisse à vide peut être appliqué pour aider à faire un joint d'étanchéité, si nécessaire. graisse à vide en silicone peut être utilisé pour éviter la contamination organique potentiel.
- Utilisez les robinets de verre sur le collecteur. Appliquer le montant minimum de la graisse à vide nécessaire de faire un joint.
- Mesurez le volume du collecteur. Ce volume sera utilisé pour les calculs relatifs à des pressions de gaz final dans le ballon de 3 litres de réaction et doit être connue aussi précisément que possible.
- À moins que le collecteur a suffisamment de connexions pour accueillir toutes les bouteilles de gaz simultanément, connectez un cylindre à la fois pour le collecteur. Inclure, à cet égard, d'un robinet permettant le collecteur à être isolé de l'atmosphère ambiante.
- Utilisez convenable, propre, inerte, et chimique et de fuite tuyau résistant et raccords pour le vide ultratorr pour relier les bouteilles de gaz au collecteur. Raccords Ultratorr, lorsqu'ils sont utilisés, doivent être serré manuellement.
- Connectez-vous au collecteur, une pompe à vide capable d'établir un vide de <1 mmHg. Les gaz d'échappement de la pompe à vide doit être situé à l'intérieur de la hotte, ou bien ventilée par d'autres moyens.
- Pour assurer la réalisation rapide de vide et pour protéger la pompe, un piège à insérer entre le collecteur et la pompe à vide. Un anti-pincement azote liquide est recommandée car elle permet d'éviter les substances volatiles telles que NH 3, CO 2, H 2 O et de pénétrer dans la pompe. Il faut prendre soin, comme volatiles piégés, sur warmer, peut surpression du collecteur et entraîner la rupture de verre.
- Connectez-vous au collecteur, un manomètre ou un autre indicateur de vide capable d'une résolution de 1 mmHg ou plus. Bien que divers appareils peuvent être utilisés, un manomètre à mercure, ou jauge MacLeod, est préférable que le mercure est assez non réactif.
- Mesurer et enregistrer la température ambiante à l'aide d'un thermomètre adapté.
2. Préparation du ballon de réaction
- Chauffer toute la verrerie à 500 ° C pendant au moins 3 heures dans l'air avant de l'utiliser, pour éliminer les contaminants organiques.
- Nettoyer les électrodes de tungstène en lavant délicatement avec des lingettes de laboratoire propres et du méthanol, et séchage à l'air.
- Verser 200 ml d'eau ultra-pure (18,2 cm MQ, COT <5 ppb) dans le ballon de 3 litres de réaction.
- Introduire un barreau d'agitation magnétique préalablement nettoyé et stérilisé, ce qui assurera une dissolution rapide des gaz solubles et le mélange des réactifs au cours de l'exrience.
- Attacher les électrodes de tungstène de la 3 L ballon de réaction en utilisant une quantité minimale de graisse à vide, avec des bouts séparés par environ 1 cm à l'intérieur du flacon. Fixer avec des clips.
- Insérer un adaptateur avec un robinet d'arrêt intégré dans le col de la fiole 3 L de réaction et fixer avec un clip.
- Attacher le ballon de 3 litres de réaction au collecteur de gaz par l'intermédiaire de l'adaptateur. Utilisez une pince ou pince pour aider à sécuriser le ballon.
- Graisser légèrement toutes les connexions pour assurer une bonne étanchéité à vide.
- Ouvrez toutes les vannes et robinets du collecteur, sauf Valve 6 et le robinet d'arrêt 1 (figure 4), et tourner sur la pompe à vide pour évacuer le collecteur. Une fois la lecture de vide stable de <1 mmHg a été atteint, fermer le robinet 1 et permettre au collecteur de s'asseoir pendant ~ 15 min pour vérifier les fuites de vide. Si aucun n'est détecté, passez à l'étape 2.8. Sinon résoudre les différentes connexions jusqu'à ce que les fuites peuvent être identifiés et corrigés.
- Appliquez agitation magnétique dans le récipient de réaction. Ouvrir la vanne 1 et le robinet d'arrêt 1 (figure 4) pour évacuer l'espace de tête du ballon de 3 litres de réaction jusqu'à ce que la pression a atteint <1 mmHg.
- Fermer une vanne (figure 4) et de surveiller la pression à l'intérieur du ballon de 3 litres de réaction. La pression mesurée devrait augmenter à la pression de vapeur d'eau. Pour garantir l'absence de fuite existent, attendre ~ 5 min à ce stade. Si la pression (en lecture sur le manomètre) augmente alors que la vanne 1 est fermée au cours de cette étape, vérifier les fuites dans le robinet d'arrêt 1 et les différentes connexions du ballon de réaction. Si aucune fuite n'est trouvé, passez à l'étape suivante.
3. Introduction d'gazeux NH 3
- Calcul de la pression nécessaire de NH 3 gazeux à introduire dans le collecteur de telle sorte que 200 mm de Hg de NH 3 sont introduits dans le ballon de réaction. Détails sur la façon de faire sont fournies dans la section Discussion.
- Fermer les vannes1 et 6, et le robinet d'arrêt 1 (figure 4) avant d'introduire tout gaz dans le collecteur. Laissez les autres vannes et robinet ouvert.
- Introduire du NH 3 dans le collecteur jusqu'à une faible pression (environ 10 mmHg) soit atteinte, puis à évacuer le collecteur à une pression de <1 mm de Hg, en ouvrant une vanne (figure 4). Répétez 3x.
- Introduire du NH 3 dans le collecteur pour atteindre la pression déterminée à l'étape 3.1.
- Ouvrir le robinet d'arrêt 1 (figure 4) à introduire 200 mmHg de NH 3 dans le ballon de 3 litres de réaction. Le NH 3 va se dissoudre dans l'eau dans le ballon de réaction et la pression va diminuer lentement.
- Une fois que la pression cesse tomber, près Robinet 1 (figure 4) et enregistrer la pression lue par le manomètre. Cette valeur représente la pression à l'intérieur du flacon, qui sera utilisée pour calculer les pressions pour d'autres gaz qui seront introduits plus loin dans le collecteur.
- Ouvrir la vanne 1 (figure 4) pour évacuer le collecteur à une pression de <1 mm de mercure.
- Fermez la vanne 2 (figure 4) et débrancher la bouteille de gaz NH 3 du collecteur.
4. Présentation de CH 4
- Calcul de la pression nécessaire de CH 4 pour être introduit dans le collecteur de telle sorte que 200 mm de Hg de CH 4 sont introduits dans le ballon de 3 litres de réaction. Exemples de calcul sont présentés dans la section Discussion.
- Raccorder la bouteille de gaz CH 4 au collecteur.
- Ouvrir toutes les vannes et robinets, à l'exception de vanne 6 et le robinet d'arrêt 1 (figure 4), et évacuer le collecteur à une pression de <1 mm de mercure.
- Fermer la vanne 1 fois le collecteur a été évacuée (figure 4).
- Présentez-CH 4 dans le collecteur jusqu'à une faible pression (environ 10 mmHg) est obtenu. Cette purge la ligne de tout gaz de contaminants from étapes précédentes. Ouvrez la vanne 1 (figure 4) pour évacuer le collecteur à <1 mmHg. Répétez 2x plus.
- Présentez-CH 4 dans le collecteur jusqu'à ce que la pression calculée à l'étape 4.1, est atteint.
- Ouvrir le robinet d'arrêt 1 (figure 4) à introduire 200 mmHg de CH 4 dans le ballon de 3 litres de réaction.
- Fermer le robinet d'arrêt une fois que la pression prévue de CH 4 a été introduit dans le ballon à réaction de 3 L (Figure 4) et enregistrer la pression mesurée par le manomètre.
- Ouvrez la vanne 1 (figure 4) pour évacuer le collecteur à <1 mmHg.
- Fermez la vanne 2 (figure 4) et débranchez le CH 4 cylindre du collecteur.
5. Introduction d'autres gaz (par exemple N 2)
- A ce stade, il n'est pas nécessaire d'introduire des gaz supplémentaires. Cependant, si on le souhaite, il est recommandé d'ajouter 100 mmHg de N 2. Dans ce cas, le calcul de la pression nécessaire de N 2 pour être introduit dans le collecteur de telle sorte que 100 mm de Hg de N 2 sont introduits dans le ballon de 3 litres de réaction. Exemples de calcul sont présentés dans la section Discussion.
- Raccorder la bouteille de gaz N 2 dans le collecteur.
- Ouvrir toutes les vannes et robinets, à l'exception de vanne 6 et le robinet d'arrêt 1 (figure 4), et évacuer le collecteur à une pression de <1 mm de mercure.
- Fermer la vanne 1 fois le collecteur a été évacuée (figure 4).
- Introduire N 2 dans le collecteur jusqu'à une faible pression (environ 10 mmHg) est obtenu. Ouvrez la vanne 1 (figure 4) pour évacuer le collecteur à <1 mmHg. Répétez 2x plus.
- Introduire N 2 dans le collecteur jusqu'à ce que la pression calculée dans l'étape 5.1 est atteint.
- Ouvrir le robinet d'arrêt 1 (figure 4) à introduire 100 mmHg de N 2 dans le ballon de réaction.
- Fermer le robinet d'arrêt une fois que la pression prévue du N 2 a été introduit dans le ballon de réaction, (figure 4) et enregistrer la pression à l'aide du manomètre.
- Ouvrez la vanne 1 (figure 4) pour évacuer le collecteur à <1 mmHg.
- Fermez la vanne 2 (figure 4) et débranchez le N 2 cylindre du collecteur.
6. Début de l'Expérience
- Détacher le ballon de réaction à partir du collecteur, en fermant le robinet d'arrêt et une vanne 1 (figure 4) une fois que tous les gaz ont été introduits dans le ballon de réaction, de sorte que l'air ambiant peut pénétrer dans le collecteur et pour apporter le collecteur d'admission jusqu'à la pression ambiante.
- Après avoir débranché soigneusement le ballon de réaction du collecteur, mettre le flacon quelque part, il ne sera pas perturbé (par exemple l'intérieur d'une hotte vide).
- Débranchez la pompe à vide et retirez soigneusement le piège froid et permettre la ventilation à l'intérieur entièrementopérationnelle hotte.
- Fixer la bobine Tesla reliée au générateur haute fréquence d'allumage.
- Connecter l'électrode en tungstène opposée à une masse électrique pour permettre le passage efficace de courant électrique à travers l'intervalle entre les deux électrodes.
- Régler la tension de sortie du générateur d'étincelles à environ 30 000 V, tel que décrit par les documents fournis par le fabricant.
- Avant de lancer l'étincelle, fermer la ceinture de la hotte, pour servir comme un bouclier de sécurité entre l'appareil et l'expérimentateur. Tournez la bobine de Tesla à commencer l'expérience, et de permettre la formation d'étincelles de continuer pendant 2 semaines (ou autre période souhaitée) en 1 heure sur les cycles marche / arrêt.
7. Fin de l'expérience
- Arrêter le test en désactivant la bobine Tesla.
- Ouvrir le robinet d'arrêt 1 (figure 4) pour introduire l'air ambiant lentement dans le ballon de réaction et faciliter le retrait de l'adaptateur et les électrodes de tungstène de sorte SAmples peuvent être collectées. Si on le désire, un vide peut être utilisé pour évacuer le ballon à réaction de gaz de réaction nocifs.
8. Collecte échantillon liquide
- En utilisant une pipette en verre pyrolyse, prélever des échantillons de liquide de la fiole de réaction, en veillant à minimiser l'exposition aux contaminants, tels que ceux qui pourraient être introduites par toucher la pipette à la graisse à vide ou d'autres surfaces non stériles.
- Transférer l'échantillon dans un récipient stérile en plastique ou en verre. Récipients en plastique sont moins sujettes à la fissuration ou la rupture lors de la congélation, par rapport à des récipients en verre.
- conteneurs d'échantillons de Seal et stocker dans un congélateur capable d'atteindre des températures de -20 ° C ou moins, que les produits insolubles peuvent empêcher la solution de l'échantillon de gel à 0 ° C.
9. Nettoyage de l'appareil
- Utilisez laboratoire propre lingettes pour retirer soigneusement la graisse à vide du col de l'appareil, l'adapterer et le robinet, et le verre entourant les électrodes de tungstène.
- Nettoyer soigneusement les mêmes surfaces décrites à l'étape 9.1 avec du toluène pour éliminer totalement la graisse à vide organique de la verrerie. Si vous utilisez de la graisse silicone, la graisse haute vide peut rester sur la verrerie après pyrolyse, créant des problèmes futurs, comme indiqué dans la section Discussion.
- Nettoyer soigneusement le ballon de réaction avec une brosse et les solvants suivants dans l'ordre: l'eau ultra-pure (18,2 MQ cm, COT <5 ppb), de l'eau ultra-pure (18,2 MQ cm, COT <5 ppb) avec 5% de détergent, le méthanol, le toluène, méthanol, d'eau ultra-pure (18,2 MQ cm, COT <5 ppb) avec 5% de détergent et de l'eau ultra-pure enfin (18,2 MQ cm, COT <5 ppb).
- Couvrir tous les orifices ouverts du ballon de réaction avec une feuille d'aluminium et envelopper l'adaptateur et de ses composantes dans une feuille d'aluminium.
- Une fois toute la verrerie a été enveloppé dans une feuille d'aluminium, la pyrolyse pendant au moins 3 heures dansl'air à 500 ° C.
- Électrodes nettoyer en douceur avec du méthanol et laissez sécher à l'air.
10. Analyse des échantillons
Remarque: Lors de la préparation des échantillons pour l'analyse, l'utilisation d'un protocole d'hydrolyse acide tel que l'a été décrit en détail par ailleurs 15, est utile pour l'obtention de plusieurs acides aminés. L'hydrolyse d'une partie de l'échantillon récupéré offre la possibilité d'analyser à la fois des acides aminés libres, ainsi que leurs précurseurs labiles aux acides qui sont synthétisés dans des conditions abiotiques.
- Pour l'analyse d'acides aminés, en utilisant une technique appropriée (telle que la Chromatographie liquide et des méthodes basées sur la spectrométrie de masse ou d'autres méthodes appropriées). De telles techniques d'analyse comprennent la Chromatographie liquide à haute performance avec détection de fluorescence (HPLC-FD) de 14, et la Chromatographie liquide à haute performance ultra élevé avec détection par fluorescence en parallèle avec la spectrométrie positif (UHPL de temps-de-vol de masse à ionisation électrosprayC-FD/ToF-MS) 12,13. Ce manuscrit décrit l'analyse par spectrométrie de masse à l'aide d'analyses par un spectromètre de masse quadripolaire triple (QqQ-MS), en liaison avec HPLC-FD.
Résultats
Les produits synthétisés dans les expériences de décharge électrique peut être assez complexe, et il ya de nombreuses approches analytiques qui peuvent être utilisés pour les étudier. Certaines des techniques les plus couramment utilisées dans la littérature pour l'analyse des acides aminés sont discutés ici. Méthodes de spectrométrie de masse et chromatographie sont des techniques très instructifs pour l'analyse de mélanges complexes de produits chimiques produites par des expériences de déch...
Discussion
De nombreuses étapes dans le protocole décrit ici sont essentielles pour la réalisation de Miller-Urey expériences de type sûre et correcte. Tout d'abord, tous les verres et la manipulation des échantillons des outils qui viendront en contact avec le ballon de réaction ou de l'échantillon doivent être stérilisés. La stérilisation est obtenue en rinçant abondamment les articles en question avec de l'eau ultra-pure (18,2 MQ cm, COT <5 ppb), puis les envelopper dans du papier d'aluminium, av...
Déclarations de divulgation
Les auteurs déclarent aucun intérêt financier concurrents.
Remerciements
Ce travail a été financé conjointement par la NSF et le programme d'astrobiologie de la NASA, dans le cadre du Centre de la NSF pour l'évolution chimique, CHE-1004570, et le Centre Goddard pour l'astrobiologie. ETP tient à remercier financement supplémentaire fourni par le Programme de stages de biologie planétaire de la NASA. Les auteurs souhaitent également remercier le Dr Asiri Galhena de l'aide inestimable dans la mise en place des installations de laboratoire initiales.
matériels
| Name | Company | Catalog Number | Comments |
| Glass Plugs for Manifold | Chemglass | CG-983-01 | |
| High Vacuum Grease | Apiezon | N/A | Type M/N |
| Silicon High Vacuum Grease | Dow Corning | 1597418 | |
| Teflon PFA Tubing | McMaster-Carr | 51805K54 | |
| Ultra-Torr Vacuum Fittings | Swagelok | SS-4-UT-6 | |
| Dry Scroll Vacuum Pump | Edwards | A72401905 | |
| U-Tube Manometer | Alta-Robbins | 100SS | |
| Tungsten Electrodes | Diamond Ground Products | TH2-1/16 | 2% thoriated |
| Methanol | Alfa Aesar | N/A | Ultrapure HPLC Grade |
| Teflon-Coated Magnetic Stir Bar | McMaster-Carr | 5678K127 | |
| Gaseous NH3 | Airgas | AMAHLB | 99.99% purity |
| Gaseous CH4 | Airgas | ME UHP300 | 99.99% purity |
| Gaseous N2 | Airgas | NI UHP300 | 99.999% purity |
| Tesla Coil | Electro-Technic Products | 15001 | Model BD-50E |
| 24 hr Plug-in Basic Timer | General Electric Company | 15119 | |
| Cleaning Detergent | Alconox | 1104 | |
| Toluene | Thermo Fisher Scientific | N/A | Optima Grade |
| Luna Phenyl-Hexyl HPLC Column | Phenomenex | 00G-4257-E0 | Brand: Luna |
| Formic Acid | Sigma-Alrich | F0507 | Used to make 50 mM ammonium formate |
Références
- Oparin, A. I. . The Origin of Life. , (1924).
- Haldane, J. B. The origin of life. Rationalist Annu. 148, 3-10 (1929).
- Garrison, W. M., Morrison, D. C., Hamilton, J. G., Benson, A. A., Calvin, M. Reduction of Carbon Dioxide in Aqueous Solutions by Ionizing Radiation. Science. 114, 416-418 (1951).
- Miller, S. L. Production of Some Organic Compounds under Possible Primitive Earth Conditions. J. Am. Chem. Soc. 77, 2351-2361 (1955).
- Miller, S. L. A Production of Amino Acids Under Possible Primitive Earth Conditions. Science. 117, 528-529 (1953).
- Heyns, H. K., Walter, W., Meyer, E. Model experiments on the formation of organic compounds in the atmosphere of simple gases by electrical discharges (Translated from German). Die Naturwissenschaften. 44, 385-389 (1957).
- Ponnamperuma, C., Woeller, F. α-Aminonitriles formed by an electric discharge through a mixture of anhydrous methane and ammonia. Biosystems. 1, 156-158 (1967).
- Oró, J. Synthesis of Organic Compounds by Electric Discharges. Nature. 197, 862-867 (1963).
- Ring, D., Wolman, Y., Friedmann, N., Miller, S. L. Prebiotic Synthesis of Hydrophobic and Protein Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 765-768 (1972).
- Wolman, Y., Haverland, W. J., Miller, S. L. Nonprotein Amino Acids from Spark Discharges and Their Comparison with the Murchison Meteorite Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 809-811 (1972).
- Roscoe, S., Miller, S. L. Energy Yields for Hydrogen Cyanide and Formaldehyde Syntheses: The HCN and Amino Acid Concentrations in the Primitive Ocean. Orig. Life. 17, 261-273 (1987).
- Johnson, A. P., et al. The Miller Volcanic Spark Discharge Experiment. Science. 322, 404 (2008).
- Parker, E. T., et al. Primordial synthesis of amines and amino acids in a 1958 Miller H2S-rich spark discharge experiment. Proc. Natl. Acad. Sci. U.S.A. 108, 5526-5531 (2011).
- Cleaves, H. J., Chalmers, J. H., Lazcano, A., Miller, S. L., Bada, J. L. A reassessment of prebiotic organic synthesis in neutral planetary atmospheres. Orig. Life Evol. Biosph. 38, 105-115 (2008).
- Glavin, D. P., et al. Amino acid analyses of Antarctic CM2 meteorites using liquid chromatography-time of flight-mass spectrometry. Meteorit. Planet. Sci. 41, 889-902 (2006).
- Zhao, M., Bada, J. L. Determination of α-dialkylamino acids and their enantiomers in geologic samples by high-performance liquid chromatography after a derivatization with a chiral adduct of o-phthaldialdehyde. J. Chromatogr. A. 690, 55-63 (1995).
- Strecker, A. About the artificial formation of lactic acid and a new Glycocoll the homologous body Justus Liebigs Annalen der Chemie. 75, 27-45 (1850).
- Miyakawa, S., Yamanashi, H., Kobayashi, K., Cleaves, H. J., Miller, S. L. Prebiotic synthesis from CO atmospheres: implications for the origins of life. Proc. Natl. Acad. Sci. U.S.A. 99, 14628-14631 (2002).
- Kobayashi, K., Kaneko, T., Saito, T., Oshima, T. Amino Acid Formation in Gas Mixtures by Particle Irradiation. Orig. Life Evol. Biosph. 28, 155-165 (1998).
- Sagan, C., Khare, B. N. Long-Wavelength Ultraviolet Photoproduction of Amino Acids on the Primitive Earth. Science. 173, 417-420 (1971).
- Harada, K., Fox, S. W. Thermal Synthesis of Natural Amino-Acids from a Postulated Primitive Terrestrial Atmosphere. Nature. 201, 335-336 (1964).
- Ponnamperuma, C., Lemmon, R. M., Mariner, R., Calvin, M. Formation of Adenine by Electron Irradiation of Methane Ammonia, and Water. Proc. Natl. Acad. Sci. USA. 49, 737-740 (1963).
- Bar-Nun, A., Bar-Nun, N., Bauer, S. H., Sagan, C. Shock Synthesis of Amino Acids in Simulated Primitive Environments. Science. 168, 470-473 (1970).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon