Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une méthode d'extension cGMP applicable pour les agrégats de neurones humains des cellules souches et progénitrices dérivées de cellules souches pluripotentes ou fœtale tissu cérébral
Dans cet article
Erratum Notice
Résumé
Ce protocole décrit un procédé de découpage mécanique nouvelle qui permet l'expansion de souches et de cellules progénitrices neurales agrégats sphériques sans dissociation d'une suspension cellulaire unique. Maintenir le contact cellule / cellule permet une croissance rapide et stable depuis plus de 40 passages.
Résumé
Une technique d'expansion cellulaire d'amasser un grand nombre de cellules à partir d'un seul échantillon pour des expériences de recherche et d'essais cliniques bénéficierait grandement de la communauté sur les cellules souches. De nombreuses méthodes d'expansion actuels sont laborieuses et coûteuses, et ceux qui impliquent la dissociation complète peuvent provoquer plusieurs types de souches et de cellules progénitrices à subir une différenciation ou la sénescence précoce. Pour surmonter ces problèmes, nous avons mis au point une méthode de repiquage mécanique automatisé dénommé "hachage" qui est simple et peu coûteux. Cette technique évite la dissociation chimique ou enzymatique dans les cellules simples et place permet l'expansion à grande échelle de suspension, cultures sphéroïde qui maintiennent le contact cellule / cellule constante. Le procédé de hachage a été utilisée principalement pour les cellules cérébrales fœtales dérivé progénitrices neurales ou des neurosphères, et a été récemment publiée pour une utilisation avec des cellules souches neurales dérivées de cellules souches embryonnaires pluripotentes et induits. La procédure impliquantes semis neurosphères sur une culture de tissu boîte de Pétri, puis en passant une lame tranchante, stérile à travers les cellules automatiser efficacement le processus fastidieux de la main dissocier mécaniquement chaque sphère. Mise en suspension des cellules en culture fournit une surface rapport favorable surface sur volume; que plus de 500 000 cellules peuvent être cultivées dans un seul neurosphères de moins de 0,5 mm de diamètre. Dans un flacon T175, plus de 50 millions de cellules peuvent se développer dans des cultures en suspension contre seulement 15 millions en cultures adhérentes. Surtout, la procédure de hachage a été utilisé dans les bonnes pratiques de fabrication (cGMP), permettant la production de la quantité de masse de produits de cellules de qualité clinique.
Introduction
Il ya une longue histoire de l'expansion des cellules souches neurales rongeurs en culture soit une monocouche 1-3 ou 4-7 neurosphères globales. En outre, les cellules progénitrices neurales humaines (hNPCs) isolés à partir de différentes régions du développement du système nerveux central 8-17 ont été élargies in vitro. Ces cellules sont bi-puissant, capable de se différencier en astrocytes et les neurones les deux et ont été un outil très utile pour étudier le développement neural 18,19 et 20,21 mécanisme maladie. hNPCs ont également été transplantées dans de nombreux modèles de la maladie du système nerveux central des animaux différents avec différents niveaux d'intégration, à la survie et les effets fonctionnels 22-24.
Traditionnellement, les rongeurs ou NPC foetales humaines dérivées sont exposés à des facteurs de croissance épidermique - souvent facteur de croissance (EGF) et / ou le facteur de croissance des fibroblastes-2 (FGF-2) et 25 à 28 - 29 à la fois adhérent et troisSystèmes de sphéroïdes dimensions sont généralement soumises à des passages en utilisant la dissociation enzymatique dans une suspension à cellule unique 30-34. La méthode standard pour développer des cellules pour la recherche ou l'utilisation clinique est comme une monocouche adhérente raison d'une manipulation facile. Cependant, nous avons montré que des passages monocouches et neurosphères hNPCs avec des solutions chimiques ou enzymatiques ont donné lieu à la sénescence précoce 35. En outre, la dissociation enzymatique peut entraîner une augmentation des niveaux de différenciation et des anomalies caryotypiques d'après les données démontré avec des cellules souches embryonnaires de 36 à 38. Bien que la méthode standard de hNPCs de passages a produit les bonnes pratiques de fabrication (BPF) des produits de qualité qui sont passés en phase 1 des essais cliniques (cellules souches Inc., Neuralstem Inc.), la méthode autorisée seulement quelques cycles d'amplification cellulaire, ce qui limite la potentiel bancaire.
De toute évidence, les grandes expériences de recherche et d'essais cliniques futurs pourraient bénéficier de la capacité depropager des cellules en vrac et à la sénescence retardée pour permettre la croissance à grande échelle et de banques de cellules. Pour répondre à ce besoin, nous avons développé une façon nouvelle et automatisé de neurosphères intactes mécaniquement passages par "couper" en petits groupes pour maintenir le contact de cellule à cellule. Ce procédé augmente considérablement leur durée de vie et la culture en suspension 39 permet une utilisation plus efficace de l'espace de l'incubateur par rapport aux cultures en monocouche, comme on le voit avec une méthode de culture 3D de bioréacteur alternatif 40. Le protocole permet de hachage prévu pour la production de banques à grande échelle d'un échantillon foetal supérieur passage 10, un exploit peu probable en utilisant des procédés standards de repiquage. Bien que cette méthode pour hNPCs de repiquage n'est pas conventionnelle, il est de plus en plus en popularité et a été récemment publié avec d'autres types tels que les cellules souches neurales dérivées de l'embryon humain et les cellules souches pluripotentes induites cellulaires, permettant l'expansion à grande échelle pour diverses applications, notamment dans vITRO modélisation de la maladie 41-46. Surtout, un hNPC banque de cellules cGMP de qualité a déjà été produit avec le procédé de hachage, ce qui démontre que la technique peut être appliquée à de futures applications cliniques.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Déclaration et de la sécurité éthique
- Cette procédure implique l'utilisation de produits de la culture de cellules dérivées d'êtres humains ou d'animaux. Tous les tissus dérivés doivent être approuvées avant l'utilisation par le Conseil d'examen institutionnel approprié (s) et / ou le soin et l'utilisation des animaux Comité (s) institutionnelle.
- Tous les déchets biologiques dangereux doivent être éliminés conformément à la réglementation en matière de sécurité décidées par l'institution concernée. Connaître et suivre toutes les consignes de sécurité et d'élimination Apposite tout au long de cette procédure.
2. Préparation du matériel, des fournitures, réactifs, et observations
- Préparation
- Obtenir une boîte de Pétri en verre, des cercles de papier filtre de 8,5 cm et lames de préparation à double tranchant.
- Placez un morceau de papier filtre dans la boîte de Pétri et transférer plusieurs lames dégainées sur le papier filtre dans la boîte de Pétri.
- Plusieurs reprises papier et lames de filtre couche jusqu'à ce que la boîte de Petri est à peu près 75% de la pleine, la couverture d'esprith boîte de Pétri couvercle et autoclave. Stocker dans un environnement stérile ou clos pour préserver la stérilité.
- Autoclave 18 cm pince et un écrou-pilote autoclave dans un sachet de stérilisation. Pour la production cGMP, autoclave plusieurs disques de calage en acier inoxydable dans des sachets de stérilisation. Pour plus d'informations concernant le disque de cale, voir l'étape 3.5.
- Désinfectez le cabinet de sécurité biologique (BSC) avec 70% d'alcool isopropylique (IPA).
- Toutes les procédures doivent être effectuées dans un BSC pour maintenir la stérilité. Aseptique transférer le suivant dans le BSC:
- McIlwain Tissue Chopper (chopper). Essuyez toutes les surfaces avec 70% d'IPA, notamment le bras de hacheur (figure 1B). L'ensemble hacheur peut être décontaminée avec de l'oxyde d'éthylène, si nécessaire.
- Un écrou-pilote autoclave ou écrou-clé (inclus avec le hachoir, figure 1I), un 18 cm pince, un jeu de micropipettes de taille standard (20 pi-1, 000 pi), un pipetaid et supports de tubes.
- Stériles pipettes sérologiques jetables, des conseils barrière de pipettes, tubes de 15 ml coniques, 60 mm boîtes de Pétri, lames de préparation à double tranchant et flacons T de taille appropriée. ATTENTION: Ne manipulez les lames tranchantes avec une pince.
- Réactifs
- Développer hNPCs en Maintenance des médias (MM), comprenant des souches neurales moyen d'expansion cellulaire, FEM à 100 ng / ml et facteur inhibiteur de leucémie (LIF) à 10 ng / ml. Transférer les réactifs et dispositif (s) de filtration nécessaires pour préparer les médias dans le BSC.
- Re-suspendre le FEM lyophilisée en utilisant Neural expansion des cellules souches à moyen et préparer aliquotes à 100 pg / ml pour stocker à -80 ° C pendant 1 an. FRV est stocké comme achetés à 4 ° C pendant jusqu'à 6 mois ou la date de péremption indiquée par le fabricant.
- Transfert réactifs MM dans le BSC. Mélanger tous les réactifs dans un dispositif de filtration de dimensions appropriées et un filtre en utilisant un appareil à vide. Stocker à 4 ° C pendant 3 semaines.
- hNPC Observations
- Les deux facteurs les plus importants à traiter avant de les hacher est diamètre sphère et le conditionnement des médias ou de la couleur. Le milieu conditionné (CM) est définie en tant que milieu qui a été métabolisé par les hNPCs en culture dans des conditions d'incubateur (37 ° C, 5% CO 2, 95% d'humidité). Comme les cellules métabolisent les médias la composante rouge de phénol se passer d'une rose de couleur jaune signifie un environnement plus acide (figure 5D).
- Tenez le flacon (s) de hNPCs à la lumière pour traiter la couleur du support (voir la discussion pour plus de détails).
- Parcourez le ballon avec un microscope pour observer les cellules. Utilisez un réticule à examiner taille sphère. Si de nombreuses sphères ont un diamètre de 300 um ou plus, poursuivre le processus de découpage. Hacher les cellules tous les 7-10 jours.
- Si une côtelette n'est pas justifiée, l'échange 25-75% de la CM du milieu frais tous les 3-4 jours en fonction de la rapidité avec laquelle les cellules métabolisent les médias. Concontinuer à échanger des médias jusqu'à ce que les sphères sont assez grand pour passage.
- hNPCs sont généralement coupés en un rapport de 1:2, à partir de petits flacons à des flacons plus grands. Utilisez le tableau 1 comme un guide de référence pour la taille et de volume ballon recommandations.
| Ballon | Volume total des médias | Pré-Chop | → | Post-Chop |
| 1 T12.5 | 5 ml | 1 T12.5 | → | 1 T25 |
| 1 T25 | 10 ml | 1 T25 | → | 1 T75 |
| 1 T75 | 20 ml | 1 T75 | → | 1 T175 |
| 1 T175 | 40 ml | 1 T175 | → | 2 T175s |
| 2 T175s | 80 ml | 2 T175s * | → | 4 T175s |
| * 2 T175s est le nombre maximum de flacons qui peuvent être hachées à la fois. Hacher en ensembles de 2 T175s et se référer à l'étape 7. | ||||
Tableau 1. HNPC dilatation paradigme. Description d'un schéma typique d'expansion pour hNPCs. La norme est de développer deux fois volumétrique tous les 7-10 jours.
3. Configuration Chopper
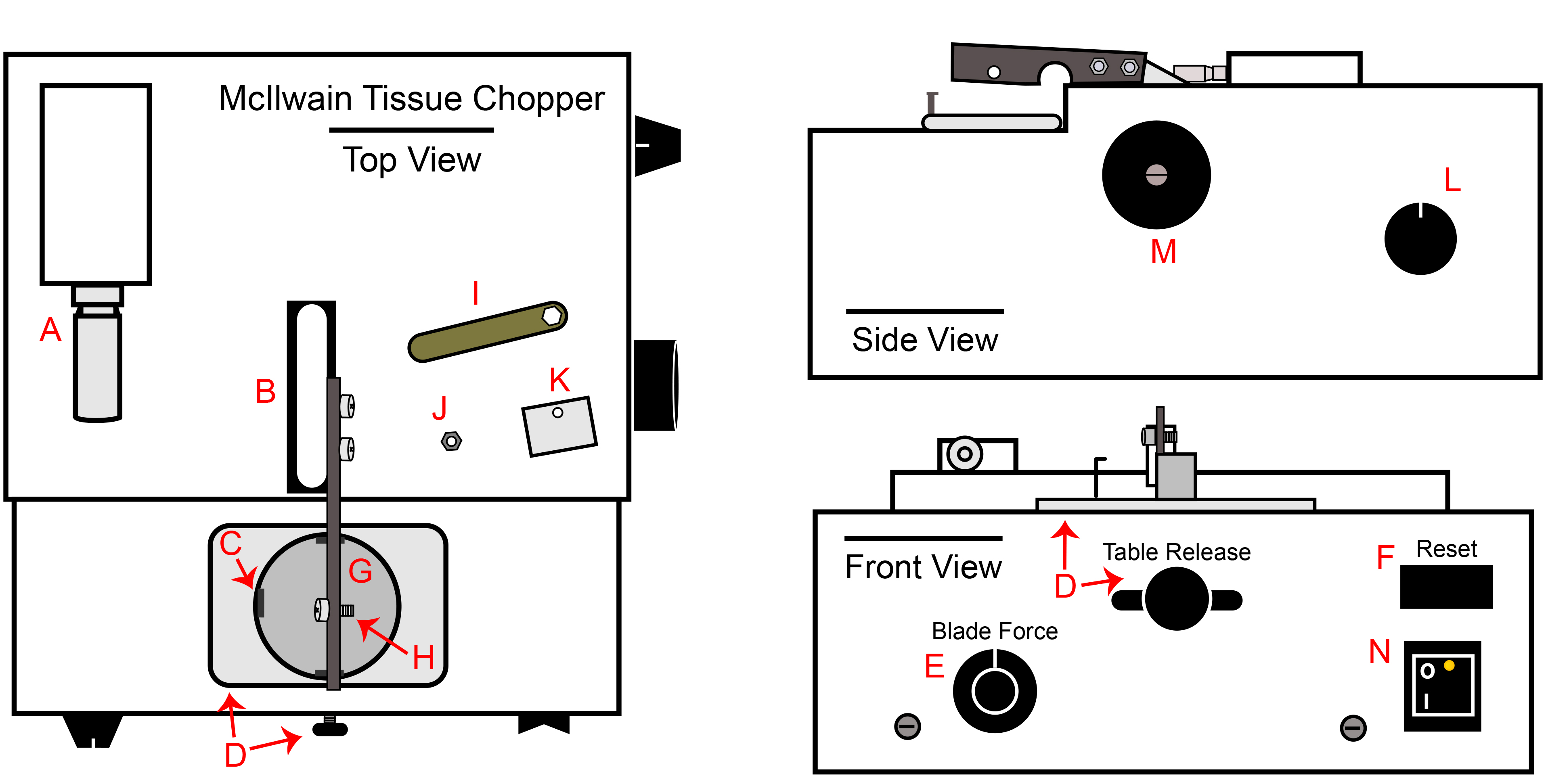
Figure 1. Chopper tissu McIlwain. A) Hacher épaisseur micrométrique d'ajustement, B) Chopper base de bras et bras attaché, C) Accrocher le support de plaque pour boîte de Pétri, D) Tableau relâchez le bouton et plateau, E) Bouton de commande de la force de la lame, F) Interrupteur de réinitialisation, G) Support de plaque, l'attachement H) Bolt pour la lame, agrafe et écrou, I) clé écrou inclus avec le découpeur, J) écrou de lame / fermoir, K) Lame fermoir, L ) bouton de réglage de la vitesse de coupe automatique, M) bouton de commande du bras de coupe manuelle, N) Interrupteur d'alimentation.
- Branchez le couperet dans une prise dans le BSC et allumez l'interrupteur d'alimentation (Figure 1 N). Réglez la distance de coupe de 200 um (figure 1A). Réglez la pression de la lame à 270 ° ou 09h00 si le bouton était une horloge (figure 1E). Assurez-vous que le bouton de vitesse automatique est tourné autant que possible dans le sens antihoraire. (Figure 1L).
- Déplacez la table de presse tout le chemin vers la droite confirmer le support de plaque est stable (figure 1D).
- Tournez le fabricantal bras manipulateur dans le sens horaire pour augmenter le bras à son niveau maximum (figure 1M). Le bras manipulateur manuel ne doit être tourné dans le sens horaire.
- Aseptique transférer, une lame à hacher double tranchant stérile sur le boulon de bras de découpage à l'aide d'une paire de pinces (figure 1H).
- Effectuer cette étape que pour le GMPc passages, comme la boîte de Pétri seule est suffisante pour le traitement de recherche de qualité. Comme il est indiqué dans l'étape 2.1.4, les disques de calage placés à l'intérieur de la base de boîte de Pétri sont nécessaires pour le GMPc. Le disque de la cale empêche les fragments de matière plastique à partir de l'incorporation dans les sphères au cours de la procédure de découpage. Pour chaque côtelette prévu, transférer un disque de cale dans le fond de chaque boîte de Pétri et le couvercle.
- Aseptique placer le fermoir (figure 1K) sur la lame à l'aide des pinces. La partie incurvée de l'agrafe doit être au-dessus de l'arête supérieure du bras. Le fermoir ne restera pas sur le bras jusqu'à ce que l'écrou a été correctement façonné. Utilisez la pince pour tenir les clasp sur le bras et fixer l'écrou (figure 1J) sur le boulon de l'écrou-pilote stérile. Laisser l'écrou d'un quart de tour lâche.
4. Procédure de pré-chop
- Transférer le volume proposé de MM dans le nouveau flacon (s) selon le tableau 2, colonne C.
- Aseptique transférer les cellules de l'incubateur dans le BSC. Incliner le flacon (s) sur un support de tube (figure 2A) et permettent aux sphères de s'installer dans le flacon (s).
- Une fois installés, aspirer jusqu'à 12 ml de surnageant avec 5 ml ou 10 ml de pipettes sérologiques et rincer toutes les sphères faiblement adhérentes à la surface du flacon (s). Répéter au besoin et de régler les domaines entre les rinçages.
- Transférer le volume proposé de CM dans le nouveau flacon (s) selon le tableau 2, colonne D. Si repiquage deux ou plusieurs flacons T175, voir l'étape 7.1.
- Transférer tout en restant CM et sphères dans un nouveau tube de 15 ml conique. Autoriser les sphères de soiTTLE et jeter le flacon (s) utilisé.
- Étape: transférer lentement les sphères du tube de 15 ml conique sur la boîte de Pétri de 60 mm ou d'un disque de cale dans le volume le plus faible possible; 0,1-0,5 ml est recommandée (figure 2B). Gardez le volume restant de CM car elle sera utilisée pour rincer les cellules de la boîte de post-chop. Essayez de minimiser la surface couverte par les médias et des sphères sur le plat (figure 2C).

Figure 2. Préparation Sphère pour hacher. A) Incliner le flacon (s) contre un support de tube ou un objet similaire pour régler les sphères dans le coin de la fiole. B) Transférer les sphères aussi dense que possible du tube conique au Petri plat. C) Réunir les sphères de tube conique en til milieu de la boîte de Pétri. D) Retirer le maximum de surnageant que possible du haut des sphères communs. E) Répartir les sphères à l'aide du côté de la pointe de micropipette plastique. F) déplacer délicatement les sphères d'un côté de la piscine sphères. G) Exemple de domaines qui ont été déplacés d'un côté de la piscine pour faciliter l'enlèvement des médias. H) condensés étalés sur la boîte de Pétri, prêt à découper. Cliquez ici pour agrandir l'image.
- Ensuite, les sphères ont besoin d'être condensé en éliminant le surnageant a été transféré au cours de l'étape 4.6. Transférer le surnageant dans le tube conique de 15 ml avec une barrière à pointe micropipette d'aérosol (Figure 2D), d'éviter le retrait de sphères. Commencez par enlever autant les médias que possible du haut de la piscine médias / cellulaire. Quand il n'est pas possibleenlever le support sans sphères, passez à l'étape suivante.
| La colonne A | Colonne B | Colonne C | La colonne D | Colonne E | Colonne F | |
| Pré-Chop Flacon Taille | → | Poster Chop-Flacon (s) Taille | Le volume proposé de MM transférer à nouveau flacon (s) pré-chop | Le volume proposé de CM de transférer à nouveau flacon (s) pré-chop | Le volume proposé de sphères / médias de transférer dans un nouveau flacon (s) post-chop | Volume final ensemencée / Flacon |
| T12.5 | → | T25 | 5 ml | 0 ml | 5 ml | 10 ml |
| T25 | → | T75 | 10 ml | 0 ml | 10 ml | 20 ml |
| T75 | → | T175 | 20 ml | 10 ml | 10 ml | 40 ml |
| 1 T175 | → | 2 T175s | 20 ml par fiole | 15 ml par fiole | 5 ml par fiole | 40 ml |
| 2 T75s | → | 4 T175s | 20 ml par fiole | 17,5 ml par fiole | 2,5 ml par fiole | 40 ml |
Tableau 2. Guide de transfert des médias pré / post-chop. Volumes suggérés à utiliser pendant le processus de découpage.
- Étaler la piscine à l'aide du côté de la pointe de la pipette pour augmenter la surface (figure 2E).
- Étape: Astuce de la boîte de Pétri légèrement vers vous et utilisez le côté de la pointe de la pipette à doucement slide toutes les sphères d'un côté de la piscine (figure 2F, G).
- Étape: Lorsque toutes les cellules ont été déplacés, basculer lentement la boîte de Pétri la direction opposée. Au cours du processus, les seuls médias iront loin des sphères. Transférer les médias dans le tube conique de 15 ml. Retrait minimal de la sphère est acceptable.
- Utilisez le côté de la pointe de la pipette à glisser doucement toutes les sphères de nouveau au centre de la boîte de Pétri, la piscine a un diamètre de 0,5 à 2,4 cm (de la figure 2H). Il est important de garder la profondeur de la piscine peu profonde de la sphère. Si la piscine est trop profonde, les sphères seront simplement mises de côté lors de la coupe. REMARQUE: Le diamètre de la piscine de la sphère ne peut pas être supérieure à 2,5 cm ou la lame en contact avec les bords de la boîte de Pétri, manquant les cellules.
5. Procédure Chop
- Transférer la boîte de Pétri sur le support de plaque (figure 1G) et assurer le platest fixé sous le support de plaque crochets (figure 1C).
- Le bouton table de presse comporte des encoches où il s'adaptera à la vitesse. Utilisez le bouton table de presse pour faire glisser le support de plaque à la gauche de sorte que la lame est claire des sphères et verrouillé à la vitesse (figure 1D).
- Étape: Abaissez le bras de chopper en tournant le bouton de manipulation manuelle (figure 1M) dans le sens horaire jusqu'à ce que la lame se mette à plat sur la boîte de Pétri. Utilisez une main pour appuyer sur la monture de bras (figure 1B) tout en resserrant l'écrou avec la clé à douille.
- Appuyez sur le bouton de remise à zéro une fois (figure 1F). Stabiliser la boîte de Pétri avec une main tout en tournant le bras manipulateur automatique bouton (figure 1L) dans le sens horaire à la position 90 ° ou 12h00 si le bouton était une horloge. ATTENTION: Ne pas toucher la lame mobile à tout moment.
- Passez la lame entièrement par la piscine de sphères. Faites pivoter le support de plaque90 °.
- Desserrer le boulon et répétez l'étape 5.3 à 5.5.
- Aseptique transférer la boîte de Pétri du support de plaque sur un espace de travail dans le BSC.
6. Post-chop procédure
- Premier d'une pipette 10 ml sérologique avec le CM dans le tube conique de l'étape 4.6, puis transférer 1 ml sur les sphères hachées. Doucement remettre en suspension et transférer dans un nouveau tube de 15 ml conique. Éviter les bulles et répéter autant de fois que nécessaire pour collecter les sphères hachées.
ASTUCE: Réduire grattant le plat comme fragments de plastique peuvent soulever. Ce n'est pas un problème si vous utilisez les disques de cales en acier inoxydable. Méfiez-vous des cellules de fixation à l'intérieur de la pipette sérologique plastique. Si cela se produit, les bulles aspirer par intermittence par les médias dans la pipette pour détacher les cellules. - Mesurez le volume de CM et sphères hachées. Ajouter le volume approprié de MM pour atteindre le volume indiqué dans le tableau 2, colonne E.
- Triturer l'sphères 2-3x pour briser les sphères lâche fusionnés.
- Étape: Aliquoter la suspension de la sphère dans chaque nouveau flacon. Seulement transférer la suspension de la sphère dans un flacon à la fois, et re-suspendre les domaines entre les transferts. Aliquotage plusieurs flacons à la fois en résulte un nombre disproportionné de sphères dans chaque flacon. Le volume final dans chaque flacon doit être égale les volumes dans le tableau 2, colonne F. Voir étape 7.2 lorsque l'ensemencement de plus de deux flacons T175.
- Retirer l'écrou avec l'écrou-pilote et le fermoir avec les pinces stériles. Décontaminer appropriée avec 70% d'IPA ou l'équivalent. ATTENTION: Retirer le couteau utilisé uniquement avec une pince et jeter dans un contenant pour objets pointus bio-risque.
- Décontaminer toutes les surfaces de l'hélicoptère avec 70% d'IPA.
. 7 Variations de process - Ballons multiples
Il existe plusieurs différences quand passages plus de deux T175s. L'étapes ci-dessous sont des altérations de l'étape référencée.
- Références à l'étape 4.4:
- Quand repiquer deux T175s, combiner tous les médias et des sphères en des flacons T175. Laissez les sphères de s'installer puis aliquote le volume approprié de CM dans chacun des nouveaux flacons comme indiqué dans le tableau 2, colonne D. Passez à l'étape 4.5.
- Quand repiquer plus de deux T175s, obtenir un nouveau flacon et l'étiquette T175 comme le ballon de CM. Étape complète 7.1.1 mais transférer le CM dans le ballon de CM. Stocker le récipient sur le côté de la BSC à être utilisé pour recueillir le CM de tous les flacons jusqu'à ce que tous les flacons ont été haché. Ensuite, le CM sera également répartie dans chacun des nouveaux flacons.
- Référence étape 6.4 - Pour hacher la même lignée de cellules à plusieurs reprises, de transférer la suspension de la sphère haché dans un nouveau flacon T75 sphères marquées post-chop et enregistrer le volume transféré. Continuer à combiner les cellules de cetteflacon après chaque côtelette et stocker le flacon dans l'incubateur à 37 ° C, 5% de CO 2, 95% d'humidité. Après tous les côtelettes ont été achevés, aliquoter la suspension de la sphère de volume dans chaque nouveau flacon. Passez à l'étape 6.5.
8. Cryoconservation
Le protocole suivant est pour la préservation cryogénique hNPCs.
- Décongeler cellule milieu de congélation dans un bain d'eau propre à 37 ° C et ensuite le stocker sur la glace. Cellule milieu de congélation peut être aliquote et stocké à -80 ˚ C pendant 6 mois.
- Feu verre poli pipettes Pasteur en tournant l'ouverture de la pipette dans une flamme. Préparer au moins deux grandes et deux pipettes poli au feu petit calibre (figure 3). Les sphères seront dissociées par le déplacement de grand à petit pipettes de forage.
- Placer TrypLE Select dans le bain d'eau à 37 ° C pendant 5 min. Retirer et conserver à la température ambiante jusqu'à utilisation.

Figure 3. Verre incendie polissage pipettes Pasteur. A) Tenir la pipette dans la partie supérieure de la flamme et de spin pour uniformément sur les bords de la pipette de verre. B) Exemple d'une poli-feu pipette en verre de gros calibre. C) Exemple d'une poli-feu pipette de verre de petit calibre.
- Transférer de manière aseptique les neurosphères dans le BSC. Laissez les sphères de s'installer en s'appuyant le flacon (s) contre un support de tube et rincer le fond du flacon pour éliminer toutes les sphères faiblement adhérentes. Autoriser les sphères à se réinstaller.
- Transférer tous mais 5-10 ml de CM dans un flacon stérile et mesurer le volume total. Placez les sphères restantes et les médias dans un tube conique.
- Après toutes les cellules sont installés, transférer tout mais un petit ménisque de CM dans la bouteille et sommer le volume.
- Transfert aseptique 5-10 ml de réchauffé TrypLE Sélectionnez dans le tube conique et remettre en suspension le culot cellulaire. Transférer le tube conique dans le bain d'eau à 37 ° C pendant de 15 à 20 min. Après 7,5-10 min, secouer doucement le tube conique pour mélanger.
- Utiliser le volume de la CM mesurée à partir de l'étape 8.5 et de préparer un volume égal de MM. Combiner et filtrer le CM et 50% MM solution à 50% (solution CM / MM).
- Transférer de manière aseptique un tamis de 40 um dans un tube conique de 50 ml.
- Lorsque l'incubation est terminée, tourner les tubes 15 ml coniques pendant 15 secondes à 100 x g.
- Aspirer délicatement et jeter le TrypLE Sélectionner tout substrat filandreuse. Laisser un petit ménisque. Ajouter délicatement 2 - 4 ml de CM / MM pour diluer le restant TrypLE Sélectionnez sans perturber le culot. Laissez toutes les cellules délogées re-régler avant de jeter le lavage.
- Ajouter 2-5 ml CM / MM solution aux sphères du tube. Dissocier les sphères avec une pipette de 5 ml en triturant un maximum de 10x. Laissez le nonsphères dissociées s'installent pendant 1-2 min. Transférer la suspension cellulaire dissociée sur le tamis de 40 pm pour éliminer les grappes entièrement non dissociées.
- Répétez l'étape 8.12 avec un gros calibre pipette en verre poli au feu et une pipette en verre de petit calibre.
- Rincer la crépine avec 2-5 ml de solution CM / MM.
- Mélanger la suspension de cellules et de prélever des échantillons pour l'analyse de la viabilité.
- Diluer les échantillons avec du bleu trypan à un facteur de dilution approprié et compter. Utiliser l'équation ci-dessous norme pour calculer la concentration moyenne des cellules viables et de calculer les cellules viables totales.

- Calculer le volume total de congélation de cellules support requis pour remettre en suspension les cellules à 5,0 x 10 6 cellules / ml. 1 ml de cellules seront ensemencées dans chaque tube cryogénique. Transférer les tubes cryogéniques dans le BSC.
- Centrifuger la suspension de cellules à 200 xg pendant 5 min à 4 ° C à 15 mtubes l coniques pour le meilleur rendement. Si 50 ml tubes coniques sont utilisés pour un gel à grande échelle vers le bas, augmenter le taux et l'heure à 400 g pendant 10 min.
- Re-suspendre le culot de cellules en utilisant le milieu de congélation de cellules à 5,0 x 10 6 cellules / ml. Aliquote de 1 ml de suspension cellulaire dans chaque tube cryogénique. Pour une même distribution aspiration 6 ml de suspension et aliquotes 5 cryotubes x 1 ml. Transférer les 1 ml restants de suspension dans la piscine de cellules. Répétez jusqu'à ce que tous les flacons ont été remplis.
- Sceller de façon aseptique tous les tubes cryogéniques graines et de les transférer sur de la glace pendant 5-10 min.
- Utilisez l'une des options suivantes pour les stratégies de cryoconservation pour préserver les hNPCs: isopropylique Chambre alcool
- Remplir le nombre requis de chambre (s) avec 100% d'IPA à la température ambiante.
- Transférer les tubes cryogéniques graines de glace dans la chambre (s) et transférer la chambre (s) en un congélateur à -80 ° C pendant la nuit. Les cellules sont stables pendant jusqu'à une semaine à -80 ° C, cependantil est suggéré de transférer les flacons de stockage d'azote liquide à long terme le jour suivant.
Congélateur vitesse contrôlée
- Envoyez un programme de congélation approprié pour le logiciel du congélateur à vitesse contrôlée. Un exemple de programme est répertorié dans le tableau 3. Figure 4 montre une courbe typique de congélation pour hNPCs. Toutefois, le programme exact variera pour chaque modèle de congélateur. Le taux d'échantillonnage global norme devrait être proche de -1 ° C / min jusqu'à atteindre -40 ° C, où le taux de gel peut être sensiblement augmenté à au moins 80 ° C.
| Étape | Taux (° C) | Fin Température (° C) | Hold (min sec) | Trigger |
| 1 | - | - | 5 min 0 sec | Chambre |
| 2 | - 1.3 | - 5 | - | Échantillon |
| 3 | - | - | 1 min 0 sec | Chambre |
| 4 | - 45 | - 58 | - | Chambre |
| 5 | + 10 | - 26 | - | Chambre |
| 6 | 3 + | - 23 | - | Chambre |
| 7 | - 0,8 | - 40 | - | Échantillon |
| 8 | - 10 | - 100 | - | Chambre |
| 9 | - 35 | - 160 | - | Chambre |
Tableau 3. Étapes de congélation hNPCs dans un r contrôléemangé congélateur. Programme proposé pour hNPC cryoconservation sur un congélateur à vitesse contrôlée.

Figure 4. Courbe de congélation de l'échantillon. Courbe de congélation typique pour hNPCs sur un congélateur à vitesse contrôlée.
- Transférer les tubes cryogéniques de la glace dans les paniers liés à la congélation de taux de contrôle. Assurez-vous de charger un cryovial avec seulement la cellule de congélation médias à utiliser pour la sonde de température de l'échantillon. Transférer les paniers dans la chambre de congélation et placer la sonde de prélèvement dans le flacon de la sonde. Démarrez le programme.
- Lorsque le protocole s'est terminé, transférer les flacons dans de l'azote liquide stockage à long terme.
9. Procédure de décongélation
Le protocole suivant est pour la décongélation cryogénique phNPCs réservés.
- Transférer les tubes cryogéniques de stockage d'azote liquide immédiatement sur de la glace sèche. ATTENTION: Les flacons peuvent avoir des fissures ou des couvercles en vrac permettant l'azote liquide pour entrer dans le flacon. Lorsqu'ils sont retirés de conditions de surgélation, le liquide peut bouillir, explosant immédiatement le flacon. Utilisez EPI approprié lors du retrait des flacons.
- Préparer tous les réactifs et les livraisons inférieures à l'avance. Une fois le processus de décongélation a commencé, il est essentiel de suivre à travers efficacement.
- Transfert Neural expansion des cellules souches moyen, MM, un tube de 15 ml conique, un 2 ml et 10 ml d'une pipette sérologique de chaque tube cryogénique dans le BSC.
- Un minimum de 9 ml de Neural Stem Cell Expansion moyenne et 5 ml de MM est nécessaire pour chaque flacon. Préparez plus de chaque support si nécessaire.
- Seulement décongeler un flacon de hNPCs à la fois. Transférer les cellules congelées de glace sèche dans un endroit propre 37 ° C bain d'eau et agiter le flacon dans le bain d'eau en permanence. Contrôler le volume desglace qui a fondu. Quand il ya un morceau de glace d'environ 0,5 cm à gauche dans le flacon, pulvériser et essuyer avec 70% d'alcool isopropylique et transférer dans le BSC.
- Transférer le contenu du tube cryogénique dans un tube conique de 15 ml avec une pipette sérologique de 2 ml. Ajouter 1 ml de Neural expansion des cellules souches moyen à la cryovial vide et ensuite transférer 8 ml de Neural expansion des cellules souches moyenne sur les cellules décongelées dans un lent, déposer manière sage en agitant doucement le tube. Ceci est fait pour réduire le risque de choc osmotique.
- Transférer le liquide de rinçage à partir du tube cryogénique à 9 ml de suspension cellulaire. Transférer le tube conique sur de la glace et répétez les étapes 9.4 à 9.5 pour tous les flacons restants.
- Centrifuger les tubes coniques à 200 xg pendant 5 min à 4 ° C. Pendant la centrifugation, préparer le nombre approprié de flacons pour semis basés sur le tableau 4.
| Nombre de flacons | Volume total d'amorçage (ml) | Ballon |
| 1 | 5 | T12.5 |
| 2 | 10 | T25 |
| 3 | 15 | T75 |
| 4 | 20 | T75 |
| 5 | 25 | T75 |
| 6 | 30 | T175 |
| 7 | 35 | T175 |
| 8 | 40 | T175 |
| 8 + | - | Combinaison de flacons |
Tableau 4. Tailles de ballons en fonction du nombre de tubes cryogéniques décongelés. Le volume proposé et la taille de flacon pour ensemencer hNPCs post-dégel.
- Re-suspendre et de combiner tous les tubes dans le volume approprié de MM basé sur le tableau 4. Bien mélanger et redéplacer un échantillon de viabilité comptage. Voir les étapes 8.15 à 8.16 pour compter plus de détails. La gamme de semis norme est entre 160,000-320,000 cellules / cm 2.
- Mélanger les cellules bien et aliquoter les cellules dans des flacons. Transférer les flacons à un CO de 5% 2/37 ° C/95% d'humidité incubateur. Mélanger le ballon en agitant doucement d'avant en arrière pour répartir uniformément les cellules.
- Les cellules forment des sphères en 24-48 heures. Parfois, les cellules adhèrent à la surface de la matière plastique et former une distribution de colonie nid d'abeilles. Si cela se produit, laissez les cellules pendant 3 jours avant de rincer les cellules lâche, contribuant à la formation de la sphère. Rincez tous les 1-3 jours jusqu'à ce qu'il n'y a pas de cellules adhérentes. Si nécessaire, le transfert des cellules dans un nouveau flacon.
- Bourse 25-75% des médias avec MM tous les 3-4 jours jusqu'à ce que les cellules sont prêts à hacher, habituellement 7-14 jours après le dégel.
Access restricted. Please log in or start a trial to view this content.
Résultats
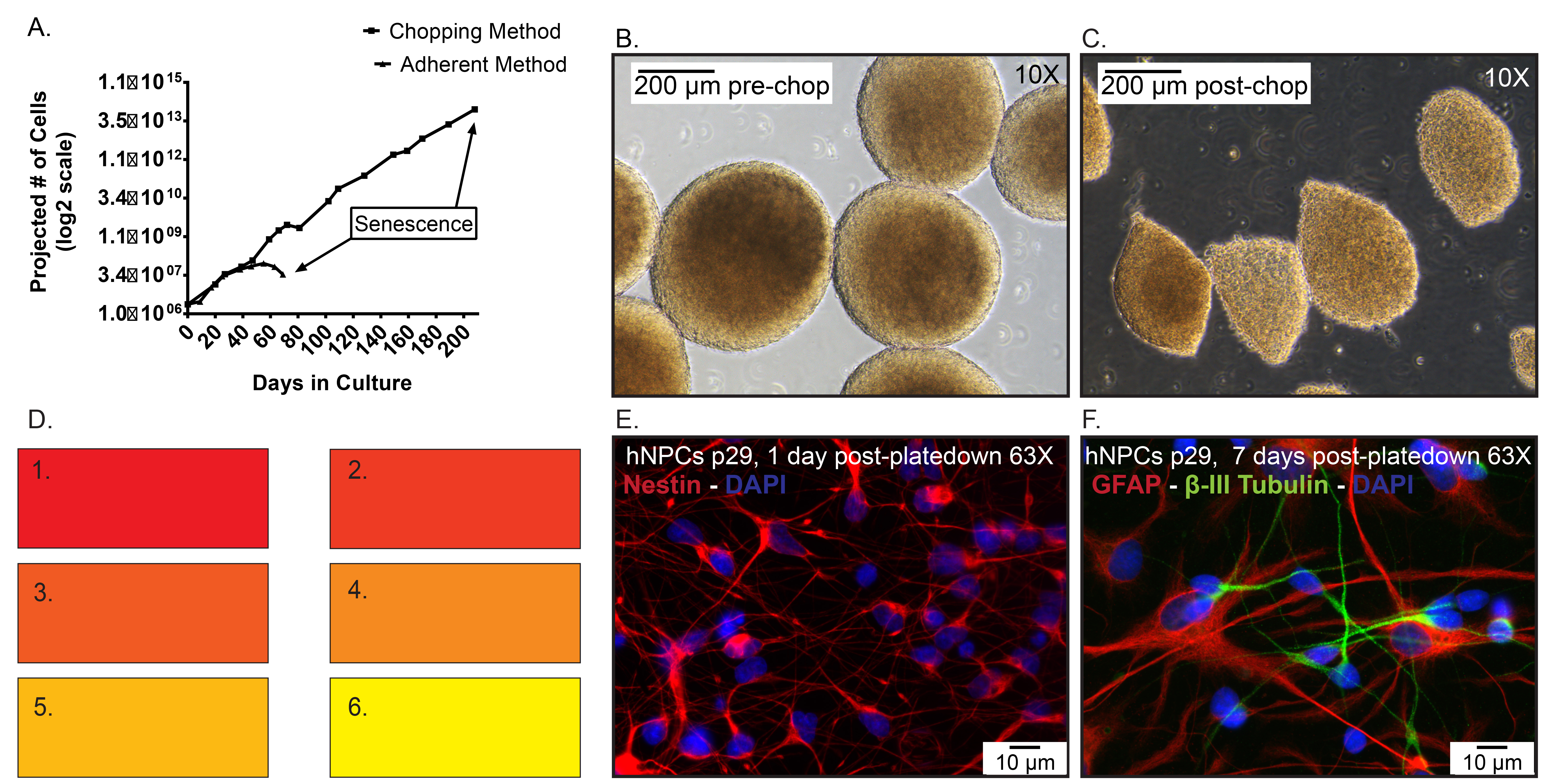
Le nombre de cellules Figure 5. Des données représentatives. A) prévues de hNPCs congelés à p19, puis décongelés et élargis comme monocouche adhérente utilisant dissociation enzymatique par rapport à neurosphères à des passages par la méthode de hachage. Jour 0 représente lorsque les cellules ont été décongelées à p20. B)
Access restricted. Please log in or start a trial to view this content.
Discussion
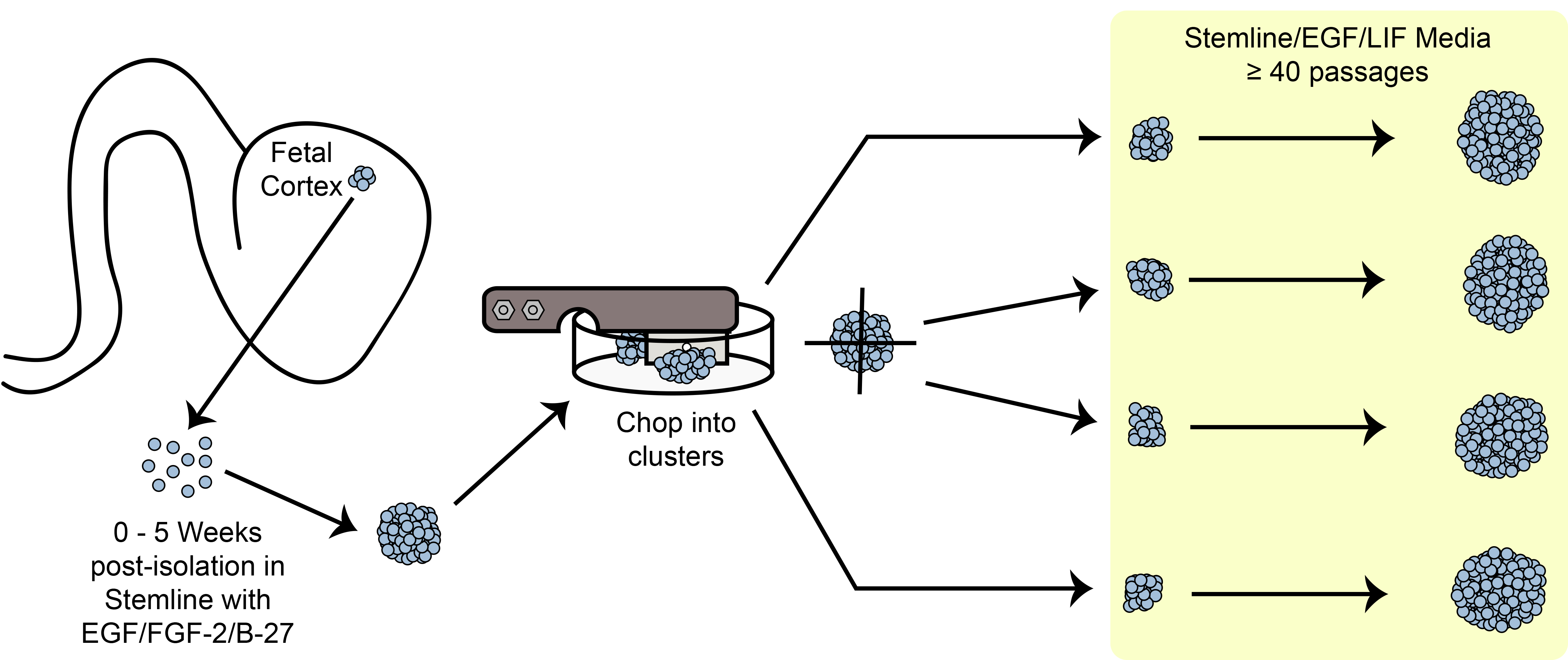
Figure 6. Schéma découper. L'expansion des cellules souches du sphéroïde / progénitrices en culture selon la méthode de découpage mécanique.
Étapes critiques
Un aperçu du paradigme de l'expansion de coupe est représentée sur la figure 6. HNPC taille de la sphè...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Nous remercions le Dr Soshana Svendsen à la critique et l'édition de ce rapport. Ce travail a été fourni par le NIH / NINDS 1U24NS078370-01 et le CIRM DR2A-05320.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Beaker, 50 ml | Fisherbrand | FB-100-50 | multiple manufacturers/suppliers |
| Bio-Safety Cabinet, class II | Baker | SG-603A | 4 ft. or 6 ft. model. 6 ft. model recommended; multiple manufacturers/suppliers |
| Blades, Double-edge Prep | Personna | 74-0002 | multiple manufacturers/suppliers. CAUTION: Sharp |
| Cell Freezing Media | Sigma-Aldrich | C6295-50ML | DMSO, serum-free |
| Centrifuge, swing-bucket with 15 ml inserts | Eppendorf | 5810 R | multiple manufacturers/suppliers |
| Conical Tubes, 15 ml | Fisherbrand | S50712 | multiple manufacturers/suppliers |
| Conical Tubes, 50 ml | BD Falcon | 352074 | multiple manufacturers/suppliers |
| Controlled Rate Freezer | Planer | Kryo 750 | multiple manufacturers/suppliers |
| Cryovials, 2 ml | Corning | 430488 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T12.5 | BD Falcon | 353107 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T25 | BD Falcon | 353081 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T175 | BD Falcon | 353045 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T75 | BD Falcon | 353110 | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 1 L | Millipore | SCGPU11RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 150 ml | Millipore | SCGVU01RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 500 ml | Millipore | SCGPU05RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 50 ml | Millipore | SCGP00525 | multiple manufacturers/suppliers |
| Filter Paper, 8.5 cm circles | Whatman/GE | 1001-085 | |
| Forceps, Standard Pattern - Serrated/Curved/18 cm | Fine Science Tools | 11001-18 | |
| Freezing Chamber, Isopropyl Alcohol | Nalgene | 5100-0001 | "Mr. Frosty" |
| Incubator, 37 °C/5% CO2 | Forma | 370 series | multiple manufacturers/suppliers |
| Hemacytometer, Phase | Hausser Scientific | 1475 | multiple manufacturers/suppliers |
| McIlwain Tissue Chopper | Lafayette Instruments | TC752-PD | Petri dish modification required. CAUTION: Moving, sharp blade. |
| Micropipettor, 1-10 μl | Gilson | F144562 | multiple manufacturers/suppliers |
| Micropipettor, 100-1,000 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 2-20 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 20-200 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Nutdriver, Autoclavable, 5/16" | Steritool | 10302 | |
| Pasteur Pipets, cotton-plugged | Fisherbrand | 13-678-8B | multiple manufacturers/suppliers |
| Petri Dish, Glass, Autoclavable | Corning | 3160-100 | |
| Pipet Aid | Drummond | 4-000-101 | multiple manufacturers/suppliers |
| Shim disc | McMaster-Carr | VARIABLE | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 10 μl | AvantGuard | AV10R-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 1,000 μl | AvantGuard | AV1000 | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 20 μl | AvantGuard | AV20-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 200 μl | AvantGuard | AV200-H | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 10 ml | Fisherbrand | 13-676-10J | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 2 ml | Fisherbrand | 13-675-3C | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 25 ml | Fisherbrand | 13-676-10K | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 5 ml | Fisherbrand | 13-676-10H | multiple manufacturers/suppliers |
| Sterilization Pouches, 19 x 33 cm | Crosstex | SCL | multiple manufacturers/suppliers |
| Strainer, 40 µm | BD Falcon | 352340 | |
| Tissue Culture Dishes, 60 mm | BD Falcon | 351007 | |
| Tube Racks, Interlocking Four-Way | Fisherbrand | 03-448-17 | |
| Water Bath | Fisherbrand | S52602Q | multiple manufacturers/suppliers |
| Neural Progenitor Cell-Specific Processing Reagents | |||
| Neural Stem Cell Expansion Medium (Stemline) | Sigma-Aldrich | S3194-500ML | Important to use the Stemline brand |
| Recombinant Human Epidermal Growth Factor (EGF) | Millipore | GF316 | multiple manufacturers/suppliers |
| Recombinant Human Leukemia Inhibitory Factor (LIF) | Millipore | LIF1010 | multiple manufacturers/suppliers |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| TrypLE Select (1x) | Life Technologies | 12563-011 |
Références
- Cattaneo, E., McKay, R. Proliferation and differentiation of neuronal stem cells regulated by nerve growth factor. Nature. 347, 762-765 (1990).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Molecular and cellular neurosciences. 8, 389-404 (1997).
- Wu, Y., Liu, Y., Chesnut, J. D., Rao, M. S. Isolation of neural stem and precursor cells from rodent tissue. Methods in molecular biology. , 438-4339 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Svendsen, C. N., Fawcett, J. W., Bentlage, C., Dunnett, S. B. Increased survival of rat EGF-generated CNS precursor cells using B27 supplemented medium. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. , 102-407 (1995).
- Laywell, E. D., Kukekov, V. G., Steindler, D. A. Multipotent neurospheres can be derived from forebrain subependymal zone and spinal cord of adult mice after protracted postmortem intervals. Experimental neurology. , 156-430 (1999).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. 45 (45), (2010).
- Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature. 340, 471-473 (1989).
- Chalmers-Redman, R. M., Priestley, T., Kemp, J. A., Fine, A. In vitro propagation and inducible differentiation of multipotential progenitor cells from human fetal brain. Neuroscience. 76, 1121-1128 (1997).
- Ostenfeld, T., et al. Regional specification of rodent and human neurospheres. Brain research. Developmental brain research. 134, 43-55 (2002).
- Carpenter, M. K., et al. et al. In vitro expansion of a multipotent population of human neural progenitor cells. Experimental neurology. 158, 265-278 (1999).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nature. 9, 439-447 (2003).
- Piao, J. H., et al. Cellular composition of long-term human spinal cord- and forebrain-derived neurosphere cultures. Journal of neuroscience research. 84, 471-482 (2006).
- Barami, K., Zhao, J., Diaz, F. G., Lyman, W. D. Comparison of neural precursor cell fate in second trimester human brain and spinal cord. Neurological research. 23, 260-266 (2001).
- Walder, S., Ferretti, P. Distinct neural precursors in the developing human spinal cord. The International journal of developmental biology. 48, 671-674 (2004).
- Buc-Caron, M. H. Neuroepithelial progenitor cells explanted from human fetal brain proliferate and differentiate in vitro. Neurobiology of. 2, 37-47 (1995).
- Becq, H., Jorquera, I., Ben-Ari, Y., Weiss, S., Represa, A. Differential properties of dentate gyrus and CA1 neural precursors. Journal of. 62, 243-261 (2005).
- Keenan, T. M., Nelson, A. D., Grinager, J. R., Thelen, J. C., Svendsen, C. N. Real time imaging of human progenitor neurogenesis. PloS one. 5, (2010).
- Kim, H. J., McMillan, E., Han, F., Svendsen, C. N. Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1. Stem cells. 27, 390-398 (2009).
- Windrem, M. S., et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse. Cell stem cell. 2, 553-565 (2008).
- Kitiyanant, N., Kitiyanant, Y., Svendsen, C. N., Thangnipon, W. B. D. N. F. - IGF-1- and GDNF-secreting human neural progenitor cells rescue amyloid beta-induced toxicity in cultured rat septal neurons. Neurochemical research. 37, 143-152 (2012).
- Dutta, S., et al. Cell therapy: the final frontier for treatment of neurological diseases. CNS neuroscience & therapeutics. 19, 5-11 (2013).
- Lindvall, O., Barker, R. A., Brustle, O., Isacson, O., Svendsen, C. N. Clinical translation of stem cells in neurodegenerative disorders. Cell stem cell. 10, 151-155 (2012).
- Wang, S., et al. Long-term vision rescue by human neural progenitors in a rat model of photoreceptor degeneration. Investigative ophthalmology & visual science. 49, 3201-3206 (2008).
- Kitchens, D. L., Snyder, E. Y., Gottlieb, D. I. FGF and EGF are mitogens for immortalized neural progenitors. Journal of. 25, 797-807 (1994).
- Craig, C. G., et al. In vivo growth factor expansion of endogenous subependymal neural precursor cell populations in the adult mouse brain. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 2649-2658 (1996).
- Ciccolini, F., Svendsen, C. N. Fibroblast growth factor 2 (FGF-2) promotes acquisition of epidermal growth factor (EGF) responsiveness in mouse striatal precursor cells: identification of neural precursors responding to both EGF and FGF-2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7869-7880 (1998).
- Kelly, C. M., et al. EGF and FGF-2 responsiveness of rat and mouse neural precursors derived from the embryonic CNS. Brain research bulletin. 68, 83-94 (2005).
- Sun, Y., et al. Long-term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and cellular neurosciences. 38, 245-258 (2008).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Gritti, A., et al. Multipotential stem cells from the adult mouse brain proliferate and self-renew in response to basic fibroblast growth factor. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 1091-1100 (1996).
- Chojnacki, A., Weiss, S. Production of neurons, astrocytes and oligodendrocytes from mammalian CNS stem cells. Nature. 3, 935-940 (2008).
- Ferrari, D., Binda, E., De Filippis, L., Vescovi, A. L. Isolation of neural stem cells from neural tissues using the neurosphere technique. Current protocols in stem cell biology. Chapter. 2, 10-1002 (2010).
- Ebert, A. D., McMillan, E. L., Svendsen, C. N. Isolating, expanding, and infecting human and rodent fetal neural progenitor cells. Current protocols in stem cell biology. Chapter 2, Unit 2D 2, doi:10.1002/9780470151808.sc02d02s6. , (2008).
- Svendsen, C. N., et al. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson's disease. Experimental neurology. 148, 135-146 (1997).
- Draper, J. S., et al. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nature. 22, 53-54 (2004).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nature biotechnology. 22, 381-382; author reply 382. , 10-1038 (2004).
- Mitalipova, M. M., et al. Preserving the genetic integrity of human embryonic stem cells. Nature. 23, 10-1038 Forthcoming.
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of neuroscience. 85, 141-152 (1998).
- Baghbaderani, B. A., Mukhida, K., Hong, M., Mendez, I., Behie, L. A. A review of bioreactor protocols for human neural precursor cell expansion in preparation for clinical trials. Current stem cell research & therapy. 6, 229-254 (2011).
- Ebert, A. D., et al. EZ spheres: A stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem cell research. 10, 417-427 (2013).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457, 277-280 (2009).
- Consortium, H. D. iP. S. C. Induced pluripotent stem cells from patients with Huntington's disease show CAG-repeat-expansion-associated phenotypes. Cell stem cell. 11, 264-278 (2012).
- Gamm, D. M., Nelson, A. D., Svendsen, C. N. Human retinal progenitor cells grown as neurospheres demonstrate time-dependent changes in neuronal and glial cell fate potential. Annals of the New York Academy of Sciences. , 1049-10107 (2005).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell biology international. 37, 191-196 (2013).
- Sareen, D., et al. Inhibition of apoptosis blocks human motor neuron cell death in a stem cell model of spinal muscular atrophy. PloS one. 7, (2012).
- Chang, M. Y., Park, C. H., Lee, S. H. Embryonic cortical stem cells secrete diffusible factors to enhance their survival. Neuroreport. 14, 1191-1195 (2003).
- Sareen, D., et al. Chromosome 7 and 19 trisomy in cultured human neural progenitor cells. PloS one. 4, (2009).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: A cGMP-applicable Expansion Method for Aggregates of Human Neural Stem and Progenitor Cells Derived From Pluripotent Stem Cells or Fetal Brain Tissue
Posted by JoVE Editors on 9/01/2014. Citeable Link.
A correction was made to A cGMP-applicable Expansion Method for Aggregates of Human Neural Stem and Progenitor Cells Derived From Pluripotent Stem Cells or Fetal Brain Tissue. The corresponding author was changed from:
Brandon C. Shelley
to:
Clive Svendsen
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon