Method Article
Démonstration de protéolytique activation du canal sodique épithélial (ENaC) en combinant les mesures actuelles avec la détection de fragments de clivage
Dans cet article
Résumé
Activation protéolytique du canal sodique epithelial (ENaC) hétérologue exprimé dans des ovocytes de Xenopus laevis peut être démontrée par la combinaison des mesures de courant avec une approche de biotinylation pour étudier l'apparition des canaux ioniques des produits de clivage à la surface de la cellule. Des sites de clivage fonctionnellement importants peuvent être identifiés en utilisant une mutagenèse dirigée.
Résumé
The described methods can be used to investigate the effect of proteases on ion channels, receptors, and other plasma membrane proteins heterologously expressed in Xenopus laevis oocytes. In combination with site-directed mutagenesis, this approach provides a powerful tool to identify functionally relevant cleavage sites. Proteolytic activation is a characteristic feature of the amiloride-sensitive epithelial sodium channel (ENaC). The final activating step involves cleavage of the channel’s γ-subunit in a critical region potentially targeted by several proteases including chymotrypsin and plasmin. To determine the stimulatory effect of these serine proteases on ENaC, the amiloride-sensitive whole-cell current (ΔIami) was measured twice in the same oocyte before and after exposure to the protease using the two-electrode voltage-clamp technique. In parallel to the electrophysiological experiments, a biotinylation approach was used to monitor the appearance of γENaC cleavage fragments at the cell surface. Using the methods described, it was demonstrated that the time course of proteolytic activation of ENaC-mediated whole-cell currents correlates with the appearance of a γENaC cleavage product at the cell surface. These results suggest a causal link between channel cleavage and channel activation. Moreover, they confirm the concept that a cleavage event in γENaC is required as a final step in proteolytic channel activation. The methods described here may well be applicable to address similar questions for other types of ion channels or membrane proteins.
Introduction
Les proteases sont des enzymes qui sont impliquées dans diverses réactions physiologiques allant de la dégradation protéolytique connue de protéines, dans le contexte de la digestion, de cascades de protéase hautement sophistiqués impliqués dans la régulation des voies de signalisation complexes. Les proteases sont classés en sept groupes en fonction de leur site catalytique actif: l'aspartate, l'asparagine, la cystéine, l'acide glutamique, la métalloprotéase, de la sérine, la thréonine et de protéases. Différentes protéases ciblent des sites de clivage distincts qui ne sont pas toujours faciles à prévoir à partir de la structure primaire d'une protéine. La base de données MEROPS ( http://merops.sanger.ac.uk/ ) fournit de l'information détaillée sur une grande gamme de protéases et de leurs sites de clivage préférentiel. Des sites de clivage fonctionnellement pertinents peuvent être identifiés en utilisant une mutagenèse dirigée.
Il est bien établi que le traitement protéolytique de ENaC est un mécanisme important de l'activation de thest notamment le 1,2 de canal ionique. Fait intéressant, il est démontré que la fonction du canal ionique de l'acide 1a détection associée (ASIC1a) peut également être modifié par des proteases 3-5. À l'heure actuelle, il reste une question ouverte si la voie de clivage protéolytique joue un rôle physiologique utile dans la réglementation de l'activité d'autres canaux ioniques ou transporteurs. Toutefois, il est bien établi que le clivage protéolytique active un groupe de G récepteurs couplés aux protéines, les récepteurs de la protéase activée (FER) 6. Plusieurs des sérine-protéases (par exemple, les protéases activant canal (CAP1-3), la chymotrypsine, la trypsine, la furine, plasmine, élastase neutrophile, et la kallicréine) ont été montré pour activer protéolytique ENaC 2. En plus des sérine-protéases, les autres groupes de protéases peuvent être impliqués dans l'activation protéolytique ENaC. En effet, les données récentes montrent que la métalloprotéinase meprin-β 7 et la cystéine protéase cathepsine S-8 peut aussi activate ENaC. Toutefois, les (patho-protéases) physiologiquement pertinents pour l'activation ENaC restent à déterminer et peuvent différer d'un tissu à.
Les proteases sont connues pour cliver préférentiellement à des sites particuliers dans la séquence d'acides aminés. Par exemple, la serine protease chymotrypsine montre un motif de clivage spécifique de clivage après l'amino-acide aromatique résidus phenylalanine et la tyrosine. En revanche, la serine protease trypsine clive préférentiellement les résidus après la lysine ou l'arginine base. Utilisation de constructions mutantes de γENaC humain générés par mutagenèse dirigée sur un site, des sites de clivage fonctionnellement pertinents de ENaC exprimées de manière hétérologue dans le système d'expression d'oocytes ont pu être identifiés 8-13.
Par l'injection de l'ARNc pour les trois sous-unités (ENaC de αβγ) dans des ovocytes isolés, ENaC peut être exprimée fonctionnellement dans ces cellules et l'activité des canaux présents sur la membrane plasmatique peut être mesurée paren utilisant la technique du voltage-clamp à deux électrodes. En utilisant le diurétique amiloride, un inhibiteur de l'ENaC spécifique, l'ENaC médiée composante de courant de cellule entière sensible à l'amiloride (ami ΔI) peut être séparé de courants de fuite ou des courants non spécifiques réalisées par d'autres canaux ioniques. Ainsi, les valeurs de ΔI IAM reflètent l'activité globale de ENaC et peuvent être déterminées en soustrayant les courants de cellules entières mesurées en présence d'amiloride à partir des courants de cellules entières correspondants enregistrés en l'absence de l'amiloride. Pour tester si une protease a un effet stimulant sur ENaC, ΔI ami est mesurée deux fois dans le même ovocyte, à savoir avant et après l'incubation de l'ovule dans une solution contenant de la protéase. Une augmentation de ΔI ami de la première à la seconde mesure indique l'activation de ENaC protéolytique. La chymotrypsine ou la trypsine sont connus pour stimuler au maximum ENaC dans le système d'expression de l'ovocyte et 2,14 peuvent être utilisés pour confirm que l'activation protéolytique ENaC est détectable dans un lot donné des ovocytes.
Parallèlement aux mesures actuelles de cellules entières, une approche de biotinylation 9 a été utilisé afin de déterminer si l'augmentation de ΔI ami détectée lors de l'exposition des ovocytes aux protéases en corrélation avec l'apparition de ENaC clivage des fragments à la surface de la cellule. Les protéines à la surface des cellules sont marquées avec de la biotine et peuvent être séparées de protéines intracellulaires par liaison des protéines biotinylées à des billes d'agarose neutravidine-étiquetés. Les protéines biotinylées peuvent être analysés par western blot. fragments de clivage γENaC à la surface des cellules peuvent être détectés en utilisant un anticorps spécifique dirigé contre un épitope à l'extrémité C-terminale de la γENaC. Pour identifier le site de clivage fonctionnel pertinent (s), les sites de clivage prédits peuvent être mutées en utilisant la mutagenèse dirigée sur un site. canaux de type sauvage et mutantes sont comparés dans des expériences parallèles en utilisant des ovocytes à partir des slot ame.
Avec cette approche méthodologique il a été démontré pour la première fois que l'activation protéolytique de courants de cellules entières ENaC médiées est en corrélation avec l'apparition en fonction du temps de ENaC clivage des fragments à la surface des cellules. Ces résultats suggèrent un lien de causalité entre le clivage de canal et l'activation du canal. En outre, en utilisant la mutagenèse dirigée de sites de clivage putatifs, en combinaison avec la technique à deux électrodes voltage-clamp, des sites de clivage fonctionnellement pertinents pour la plasmine, la chymotrypsine et la cathepsine 13 S-8 ont été identifiés.
Protocole
1. Isolement des ovocytes de Xenopus et micro-injection d'ARNc
- Obtenir des ovocytes de femelles adultes Xenopus laevis. Anesthésier des animaux à 0,2% MS222, et réséquer lobes ovariens à travers une petite incision abdominale.
- Isoler les ovocytes à partir des lobes ovariens par digestion enzymatique à 19 ° C pendant 3-4 heures avec 600 à 700 U / ml de collagénase de type 2 à partir de Clostridium histolyticum dissous dans une solution d'OR2 de calcium libre (recette dans le tableau 1).
- Pour la sélection, placez les ovocytes défolliculés dans une boîte de Pétri sous un microscope binoculaire dans une haute teneur en sodium contenant une solution (ND96: recette dans le tableau 1).
- Sélectionnez V-VI ovocytes de stade et de les placer dans un autre boîte de Pétri avec une pipette Pasteur. NOTE: pipette Pasteur Blunt à la flamme pour éviter les blessures de l'ovocyte.
- Injecter de l'ARNc des ovocytes (par exemple 0,2 ng par αβγENaC sous-unité). Dissoudre ARNc dans l'eau sans RNase. REMARQUE: Totalvolume injecté dans chaque ovocyte est de 46 nl.
- Magasin ovocytes injectés à 19 ° C dans une solution à faible teneur en sodium pour empêcher le chargement en sodium des ovocytes (ND9: recette dans le tableau 1). Compléter la solution avec de la pénicilline à 100 U / ml de sodium et 100 pg / ml de sulfate de streptomycine à empêcher la croissance bactérienne. Manipuler avec soin les ovocytes de limiter la quantité d'ovocytes mortes ou endommagées et de les maintenir en petits groupes individuels dans un 12 puits de plaques puits remplis de solution de bain pendant les deux jours après l'injection d'ARNc.
2. Exécution de deux électrodes expériences voltage-clamp
- Mesurer la ovocytes deux jours après l'injection.
- Remplir une seringue d'un système d'alimentation par gravité de perfusion avec une solution ND96 et une autre seringue avec une solution contenant ND96 amiloride (2 uM). Mont seringues 50 cm au-dessus de la chambre de bain de l'ovocyte. REMARQUE: La concentration de l'inhibiteur de l'amiloride ENaC a été choisi pour être 20 fois plus élevée que sa CI50 (100 nM).
- Allumez une source de lumière froide 150 W halogène et l'ajuster à 10 cm au-dessus de la chambre de bain d'ovocytes permettant une bonne visualisation au microscope binoculaire. Puis mettre en marche l'aspiration et ajuster le tube d'aspiration à l'extrémité de la chambre de bain de l'ovocyte. Localiser tube d'aspiration opposée à surfusion tubes 'adaptateur entrer dans le bain de l'ovocyte. REMARQUE: La puissance d'aspiration doit être suffisante pour soutenir le flux continu de la solution superfusing l'ovocyte.
- Régler la vitesse de surfusion de chaque solution à 3-5 ml / min à l'aide du dispositif de commande d'écoulement par gravité iv. Connecter les tubes de surfusion avec un adaptateur pour la chambre de bain de l'ovocyte.
- Tirez capillaires en verre avec un extracteur micropipette pour obtenir des diamètres <1 um de pointe. Ensuite, remplissez capillaires à ~ 1/4 avec 3 M de KCl. REMARQUE: Assurez-vous que la partie chloré du fil d'argent du porte-électrode est immergée dans une solution de KCl. Vérifiez bulles d'air dans la pointe du capillaire. Les bulles d'air nuisent à la mesurement en augmentant la résistance capacité parasite.
- Insérez les capillaires dans les supports d'électrodes de courant et l'électrode de tension et placez-les dans ND96 contenant amiloride (2 M) solution utilisant les micro-manipulateurs.
3. Mesure des courants de cellules entières sensible à l'amiloride
- Zéro le potentiel d'électrode de l'électrode de tension (V m) et de l'électrode de courant (V e) en réglant la m V et V e décalées boutons. REMARQUE: La résistance doit être de 1-2 MQ pour l'électrode de mesure V m et 0,5 -1 MQ pour l'électrode d'injection de courant.
- Placer l'ovocyte dans la chambre de bain à proximité de l'électrode de détection de tension. NOTE: Ne pas endommager l'ovocyte au cours d'une de ces étapes de transfert. Utiliser une pipette Pasteur pour transférer l'ovocyte. Pour éviter d'endommager l'ovocyte les bords de la pipette devrait être émoussé par flambage.
- Empaler oocytes délicatement avec les deux microélectrodes.
- Réglez le potentiel de maintien à l'amplificateur à -60 mV et allumez l'enregistreur. Mettez l'amiloride (2 M) contenant une solution. NOTE: Le courant devrait être d'environ 0 ± 0,5 uA. Grandes courants de fuite indiquent un empalement fuite. Par conséquent, ces ovocytes doivent être rejetés. En outre, les courants de fuite mesurés en présence d'amiloride (2 uM) doivent être similaires à αβγ ovocytes exprimant WT-à ceux mesurés dans αβγ-mutant ENaC ovocytes exprimant. Ceci indique que les mutations n'altèrent pas l'amiloride-sensibilité du canal.
- Commencer l'enregistrement. Si nécessaire, ajuster le gain.
- Après le courant mesuré atteint un plateau stable, changer de solution sans l'amiloride. REMARQUE: les déviations actuelles à la baisse dans les traces de courant correspondent aux courants entrants, à savoir le mouvement de charge positive (Na +) du côté extracellulaire dans la cellule.
- After un plateau de courant est atteinte (après ~ 60 sec), passer la surfusion revenir à la solution contenant l'amiloride. Après que le courant de l'ovocyte atteint le courant de référence initial, désactiver le verrouillage de tension et retirer les électrodes doucement.
- Pour permettre refermeture de la membrane plasmatique dans les sites d'empalement, placer l'ovocyte dans un puits d'une plaque à 96 puits contenant 100 à 150 ul de solution de protease de ND96 libre.
- Après 5 min, transférer ovocyte à une solution contenant la protease ou à une solution témoin sans protease pendant un temps d'incubation de 30 min. NOTE: Le temps d'incubation dépend de la protéase et le canal étudié.
- Après l'étape d'incubation répéter la mesure en cours (voir 3.2 et suivantes). NOTE: Il est possible de mesurer> 90% des ovocytes après incubation dans une solution de protéase.
4. Biotinylation Assay
- Sélectionner et jeter ovocytes défectueux sous le microscope binoculaire. REMARQUE: Utilisez injectioned ovocytes provenant du même lot pour les mesures de courant et pour les expériences de biotinylation.
- Conserver à la température ambiante de la biotine pendant au moins 20 minutes avant son utilisation dans l'expérience.
- Préparer les solutions: ND96 et ND96 contenant la protéase appropriée. Préparer pipettes Pasteur en les étiquetant et en flamber brièvement leurs conseils pour éviter les blessures des ovocytes. NOTE: Ici, la protease chymotrypsine 2 ug / ml dans ND96 est utilisé. Traiter chaque groupe avec une pipette différente pour éviter la contamination croisée de solutions.
- Remplir chaque puits d'une plaque à 6 puits avec 2,5 ml de contrôle ND96 ND96 ou contenant une protéase à température ambiante. Puis déposer 30 ovocytes par puits et incuber pendant 30 min à température ambiante. REMARQUE: Pour les procédures ultérieures, il est important de conserver des échantillons sur la glace en tout temps. Toutes les étapes de centrifugation sont à effectuées à 4 ° C.
- Remplir chaque puits d'une nouvelle plaque à 6 puits avec 2,5 ml ND96 (chaque groupe a besoin de 3 puits pour les étapes de lavage) et peser la biotine. NOTE: 2,5 mg de biotine per puits (1 mg / ml) est nécessaire. Dissoudre la biotine dans le tampon de biotinylation (soit 25 mg de biotine (pour les 10 groupes) dans 25 ml de tampon biotinylation (recette dans le tableau 1).
- Transférer chaque groupe d'ovocytes à un bien remplie avec 2,5 ml ND96. Transfert ovocytes successivement dans deux puits supplémentaires avec ND96 pour laver toute la protéase restant. Incuber les ovocytes pendant 5 min dans ND96.
- Transférer les ovocytes dans 2,5 ml d'une solution contenant de la biotine et ainsi de les incuber sous agitation douce ('shaker') pendant 15 min. REMARQUE: Réduire la ND96 transféré à la pipette pour éviter la dilution de la solution de biotine.
- Transférer chaque groupe d'ovocytes dans un puits contenant 2,5 ml de tampon de trempe (recette dans le tableau 1) pour arrêter la réaction de biotinylation. Ensuite, le transfert de chaque groupe d'ovocytes dans un second puits contenant également 2,5 ml de tampon étancher et incuber pendant 5 minutes sous agitation douce.
- Retirer ovocytes mortes ou endommagées. Remarque:Choisissez le même nombre d'ovocytes par groupe pour la procédure suivante.
- Transférer chaque groupe d'ovocytes dans un tube à centrifuger en plastique de 1,5 ml. REMARQUE: Réduire la quantité de tampon de refroidissement qui est transféré.
- Par la suite, lyser les ovocytes en les faisant passer à travers une aiguille de 27 G dans 1 ml de tampon de lyse (recette voir tableau 1) additionné d'inhibiteurs de protéase.
- Centrifuger les lysats pendant 10 min à 1500 x g.
- Aspirer le surnageant et le transférer dans un tube de 1,5 ml contenant 0,5% de Triton-X-100 et 0,5% de NP40. Jeter le culot restant. NOTE: Le surnageant contient plasma biotinylé protéines membranaires et des protéines intracellulaires non biotinylés.
- Incuber les tubes à centrifuger pendant 20 min sur la glace. À plusieurs reprises vortex les tubes pendant cette période pour dissoudre complètement les protéines de NP40 et Triton-X-100.
- Centrifugeuse de 100 pl de billes d'agarose par groupe d'ovocytes pendant 3 min à 1500 x g. Après l'Retirer le surnageant de centrifugation de la solution de billes et laver trois fois avec du tampon de lyse pour équilibrer les billes avec du tampon.
- Ajouter 100 ul de billes lavées dans chaque tube à centrifuger contenant le détergent-solution de protéine préparée en 4.13 pour permettre la liaison des protéines biotinylés aux billes.
- Incuber les tubes à centrifuger avec rotation de tête O / N à 4 ° C.
- Centrifuger les tubes à centrifuger pendant 3 min à 1500 x g. Puis transférer le surnageant dans un nouveau tube. REMARQUE: les protéines intracellulaires ne sont pas étiquetés avec de la biotine. Le surnageant peut être conservé à -20 ° C. Ne pas aspirer les billes.
5. Détection de ENaC clivage fragments à la surface de la cellule par Western Blot analyse
- Laver les billes trois fois avec du tampon de lyse et ajouter 100 ul de 2 x tampon d'échantillon SDS-PAGE. NOTE: Les échantillons peuvent être conservés à -20 ° C ou immédiatement préparés pour l'analyse western blot.
- Faire bouillir sexemples de 5 min à 95 ° C puis placer les tubes sur la glace.
- Centrifuger les échantillons pendant 3 min à 20 000 xg et la pipette le surnageant dans un nouveau tube. NOTE: Ce surnageant contient les protéines de membrane de plasma biotinylés à partir de la surface cellulaire de l'ovocyte.
- Analyser 30 ul de ce surnageant par western blot pour étudier des fragments de clivage à la surface de la cellule.
- Séparer les protéines biotinylées par SDS-PAGE (électrophorèse sur gel de sodium dodécyl sulfate polyacrylamide) en utilisant un gel approprié (8%, 10%, 12%, selon le poids moléculaire des fragments de clivage étudiées).
- Transférer les protéines de polyfluorure de vinylidène (PVDF) par transfert de membranes semi-sec.
- Sonder la membrane avec un anticorps spécifique contre γENaC humain dirigé contre un épitope à l'extrémité C-terminale (voir la figure 3 et 13).
- Utilisez raifort chèvre marqué à la peroxydase anticorps anti-lapin comme anti secondairecorps.
- Détecter les signaux de chimioluminescence.
Résultats
Afin de déterminer si la plasmine sérine protéase peut activer courants ENaC médiation, ΔI ami de particuliers ovocytes ENaC exprimant a été déterminée avant et après 30 min d'incubation des ovocytes en libre protéase (contrôle) (figure 2A) ou une solution de plasmine contenant (figure 2B) en utilisant la technique du voltage-clamp à deux électrodes (voir figure 1). L'exposition à la plasmine augmenté ΔI ami dans chaque ovocyte mesurée. En revanche, dans des expériences de contrôle, 30 min d'incubation des ovocytes exprimant ENaC dans une solution exempte de protease a un effet négligeable (Figure 2 C, D). Ainsi, en utilisant ce procédé, un courant de stimulation à médiation ENaC par la plasmine peut être détectée.
Pour étudier les effets de la mutation des sites de clivage putatifs sur l'activation des courants médiés ENaC, ainsi que sur le canal de clivage, l'effet de la chymotrypsine sur WT-ENaC a été comparée avec celle surun mutant avec ENaC prostasine muté et des sites de clivage de la plasmine (γ de RKRK178AAAA; K189A). L'évolution dans le temps de l'activation du canal par la chymotrypsine, ainsi que l'apparition de produits de clivage ENaC à la surface cellulaire a été étudiée à l'aide de différents temps d'incubation protease (figure 4A). Il a été démontré que les retards de canaux mutants et réduit l'activation du courant ENaC médiée par la chymotrypsine. Cette s'accompagne d'une apparition tardive d'un poids γENaC clivage fragment inférieur moléculaire de 67 kDa correspondant à la sous-unité totalement clivé. fragments de clivage ont été détectés en utilisant un anticorps γENaC dirigé contre un épitope dans la terminaison C (figure 3). Cette approche méthodologique démontre que l'évolution dans le temps de l'activation protéolytique de courants médiés ENaC est en corrélation avec l'apparition d'un produit de clivage de 67 kDa γENaC à la surface cellulaire (Figure 4 B, C). Cela corrobore l'idée d'unelien de causalité entre le clivage protéolytique de canal et l'activation du canal 13. De plus, en combinant les mesures de courant et de la détection de fragments γENaC à la surface cellulaire, il a été démontré que les sites de clivage mutés sont fonctionnellement pertinente pour l'activation du canal protéolytique.

Figure 1. Procédure de détermination de l'effet stimulant d'une protease sur ENaC exprimé de manière hétérologue dans des ovocytes de Xenopus laevis. Activité de ENaC est estimée par la mesure de la cellule entière composante de courant sensible à l'amiloride ΔI ami.
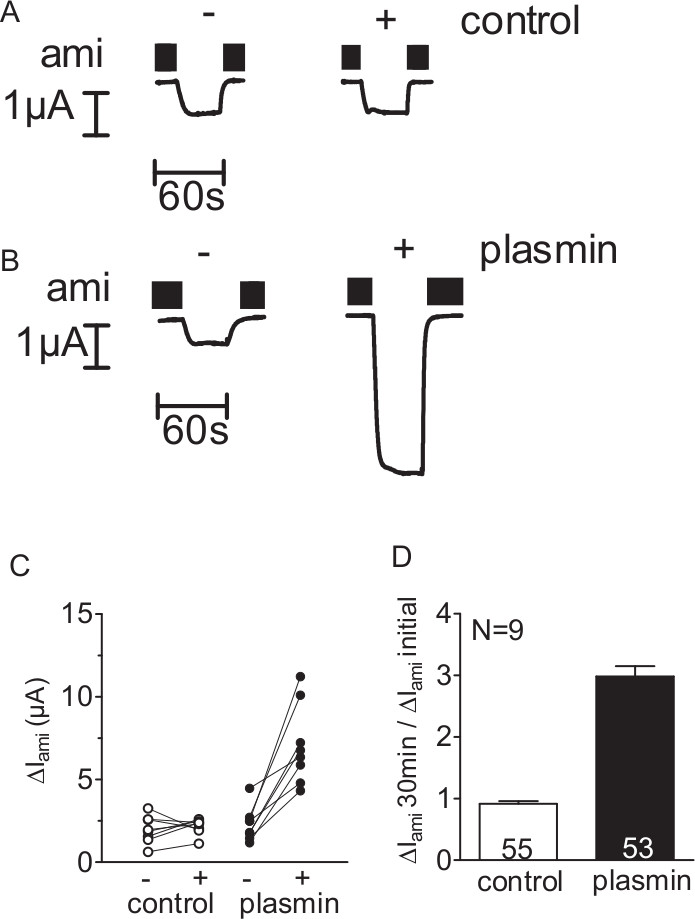
Figure 2. Plasmine stimule devises ENaC médiationts dans des ovocytes exprimant ENaC. (Ad) Les ovocytes exprimant ENaC humain ont été incubées pendant 30 min dans une solution exempte de protease (témoin) ou dans une solution contenant de la plasmine (10 pg / ml). Pour déterminer ΔI ami avant (-) et après (+) l'incubation, les ovocytes ont été serrées à un potentiel de maintien de -60 mV (A, B) de quatre cellules entières des traces de courant représentatif d'un lot d'ovocytes.. L'amiloride (ami) était présent dans la solution de bain d'inhiber spécifiquement ENaC, comme indiqué par les barres noires. (C) Les points de données obtenus à partir d'un ovocyte individuels sont reliés par une ligne (D). Résumé des expériences similaires, comme indiqué en C. Les colonnes représentent effet stimulant rapport sur ΔI ami calculé comme le rapport de ΔI ami mesurée après une incubation de 30 min (ΔI ami de 30 min) à la première ΔI ami (ΔI ami initiale) mesurée avant incubation. Chiffres à l'intérieur des colonnes indiquent lenombre d'ovocytes individuels mesurés. N indique le nombre de différents lots d'ovocytes. (Ce chiffre a été modifié depuis [Haerteis et al 2012 J Gen Physiol 140, 375-389, doi:. 10.1085/jgp.201110763])
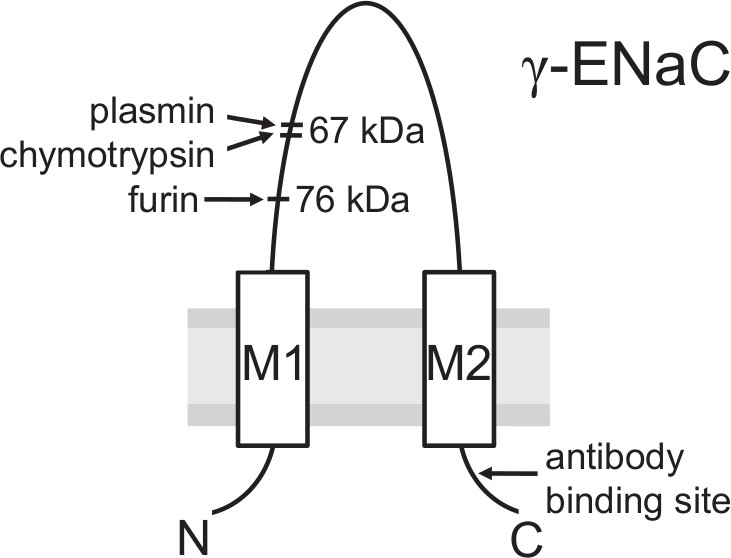
Figure 3. Modèle de la sous-unité montrant des sites de clivage γENaC pour l'activation protéolytique et le site de liaison de l'anticorps utilisé. Clivage protéolytique par la furine convertase Golgi-associé est important pour ENaC maturation dans la voie de biosynthèse avant que le canal atteint la membrane plasmique. Après clivage par la furine un fragment de 76 kDa peut être détectée à la surface de cellules en utilisant une approche de biotinylation et un anticorps dirigé contre un épitope à l'extrémité C-terminale de la sous-unité γ-. La dernière étape charnière dans protéolytique FRactivation aC a probablement lieu à la membrane plasmique où γENaC est clivée par des protéases extracellulaires (par exemple, de la plasmine ou de la chymotrypsine) dans une région distale au site de la furine pour résultat un fragment de clivage de 67 kDa. (Ce chiffre a été modifié depuis [Haerteis et al 2012 J Gen Physiol 140, 375-389, doi:. 10.1085/jgp.201110763])
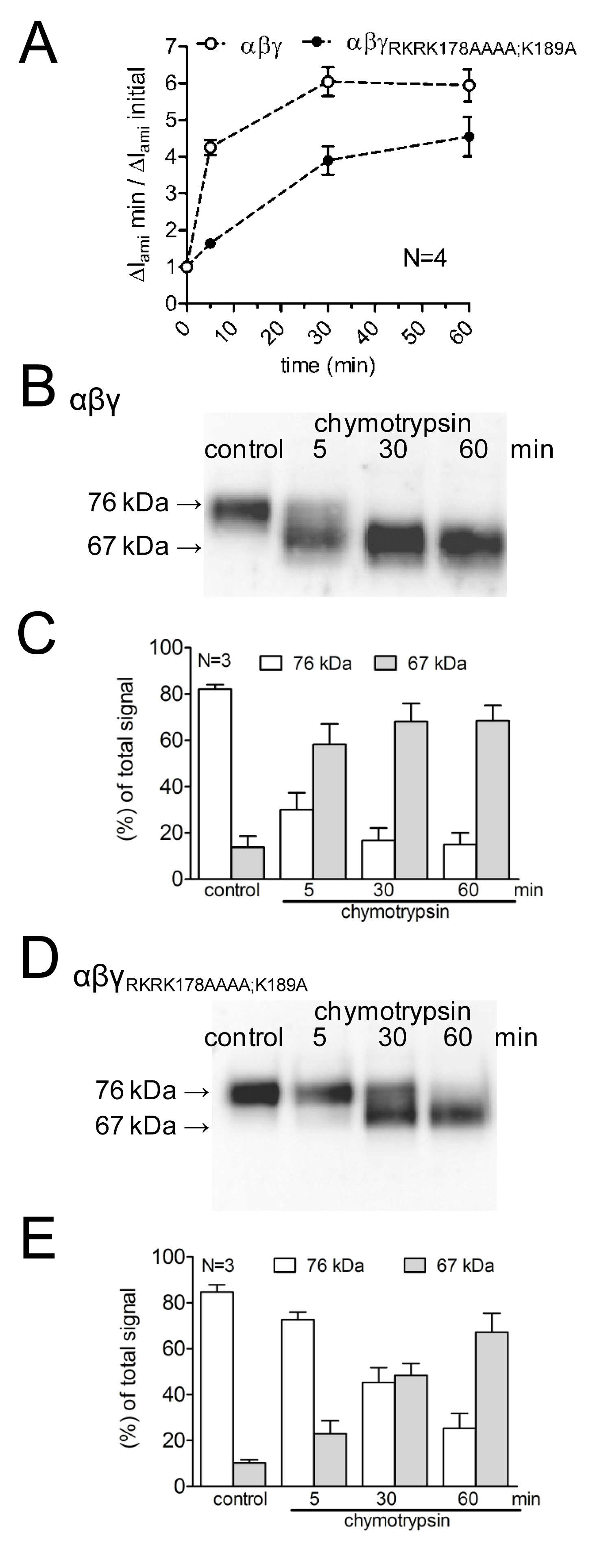
Figure 4:. Mutating fois la plasmine (K189) et le site de clivage de la prostasine (RKRK178) retarde l'activation de courants ENaC médiées et l'apparition d'un produit de clivage de 67 kDa de la γ-unité du canal ovocytes exprimant WT (symboles ouverts) et γ RKRK178AAAA; canal mutant K189A ENaC (symboles pleins) ont été incubées pendant 30 min dans une solution exempte de protease (témoin) ou de 5, 30 ou 60 min dans une solution contenant de la chymotrypsine (2 pg / ml). (A) Pour déterminer ΔI ami avant et après l'incubation, les ovocytes ont été serrée à un potentiel de maintien de -60 mV. Les cercles représentent le rapport entre ΔI ami mesurée après 5, 30, ou 60 minutes d'incubation (ΔI ami min) à la première ΔI ami (ΔI ami initiale) mesurée avant incubation. Chaque point de données représente la moyenne ΔI ami mesurée dans 22-24 ovocytes individuels des quatre lots différents. (BD) en parallèle à la détection de ΔI ami, l'expression de γENaC biotinylé à la surface des cellules a été analysé par SDS-PAGE. γENaC a été détectée avec un anticorps dirigé contre un épitope à l'extrémité C-terminale de γENaC humain. Western blots représentatifs d'un lot d'ovocytes sont présentés. (CE) Analyse densitométrique de trois transferts Western similaires à ceux représentés sur B ou D. Pour chaque voie, les signals détectés dans les régions de 76 kDa (colonnes vides) et 67 kDa (colonnes grises) ont été déterminés et normalisé à la somme du signal total détecté. N indique le nombre de différents lots d'ovocytes. Cliquez ici pour agrandir l'image.
Discussion
Dans ce manuscrit une approche méthodologique qui a été appliquée avec succès pour étudier les mécanismes sous-jacents de l'activation d'ENaC par des protéases est décrite 8,13. Le système d'expression bien établie Xenopus laevis des ovocytes a été utilisé pour fonctionnellement express ENaC. ENaC fonction a été évaluée par la technique classique du voltage-clamp à deux électrodes. La mutagenèse dirigée a été utilisée pour identifier les sites de clivage de protéase fonctionnellement pertinents. expériences de biotinylation effectuées en parallèle avec les mesures électrophysiologiques ont permis de corréler l'apparition de produits de clivage ENaC à la surface cellulaire avec une activation protéolytique de courant. Une corrélation entre le déroulement dans le temps de l'activation de courant et l'apparition de fragments de clivage protéolytique à la surface cellulaire soutient le concept de l'activation du canal protéolytique.
Deux électrodes enregistrements de potentiel imposé nécessitent l'empalement d'un oocyte avec deux microélectrodes. Cette procédure est habituellement effectuée une seule fois dans un ovocyte individu. Cependant, il était possible de supprimer les microélectrodes après un enregistrement en cours cellule entière initiale sans dommage apparent à l'ovocyte. En effet, la membrane plasmatique dans les sites de impalements semble refermer l'espace de quelques minutes. Ainsi, après avoir effectué une première de deux électrodes de mesure de tension de serrage, il est possible de transférer l'ovocyte à partir de la chambre d'écoulement expérimentale de l'installation voltage-clamp à deux électrodes dans un tube de centrifugeuse ou un puits d'une plaque à 96 puits remplie de un petit volume de solution d'essai ou de contrôle. Par la suite, le même ovocyte peut être transférée de nouveau à la chambre d'écoulement et peut être empalé à nouveau pour effectuer une seconde mesure du voltage-clamp à deux électrodes. Fait étonnant, les courants médiés ENaC ne varient pas beaucoup entre la première et la deuxième mesure où l'ovocyte a été maintenue dans la solution de contrôle. En revanche, l'incubation de l'ovule dans un sol contenant la protéaseution après la première mesure a donné lieu à une augmentation de courant ENaC médiation dans la deuxième mesure (Figure 2). Cette constatation indique l'activation du canal protéolytique.
Effectuant deux mesures du courant distincts dans un seul ovocyte offre l'avantage que l'ovocyte peut être exposée à des proteases ou d'autres agents pharmacologiques entre les deux mesures pour une longueur de temps variable dans un petit volume de solution d'essai. Ceci est important lors de l'utilisation d'agents qui sont coûteux et / ou n'est pas disponible en grandes quantités, par exemple des préparations de proteases purifiées. La disponibilité limitée des agents, il peut être impossible (ou hors de prix) pour les utiliser dans des enregistrements de potentiel imposé à deux électrodes continues en raison des grands volumes de solution d'essai requis pour superfusing permanence les ovocytes avec des taux de plusieurs millilitres par minute d'écoulement. En outre, deux électrodes de mesures en continu de potentiel imposé sont limitées par le phénomène bien connunomène de diminution des effectifs de canal spontanée également décrit pour ENaC 15. En revanche, l'exposition des ovocytes à tester des solutions entre deux mesures séparées jusqu'à une heure ou plus ne pose généralement pas un problème (voir la figure 4A). Enfin, deux mesures successives effectuées en un même ovocyte permettent d'observations appariées effets des médicaments. Ceci présente un avantage par rapport à des mesures non appariées provenant de deux groupes distincts d'ovocytes (protease-traités et traités avec le véhicule), car elle réduit le problème de la forte variabilité entre les ovocytes, habituellement observées dans l'expression des canaux ioniques. Avec observations appariées et la possibilité pour normaliser les données de la première mesure, moins d'ovocytes sont nécessaires pour chaque groupe expérimental de démontrer un effet significatif d'un agent pharmacologique. Normalisation des données rend également facile à résumer les données provenant de différents lots d'ovocytes avec différents niveaux d'expression de canaux ioniques et donc différents courants de référence (figure 2D). De toute évidence, les expériences de contrôle sont nécessaires pour cette approche de démontrer que l'activité de canal ionique d'intérêt reste stable dans des ovocytes de contrôle traités avec le véhicule de la première à la deuxième mesure (voir figure 2).
Pour démontrer que l'activation protéolytique de courant en corrélation avec l'apparition de produits de clivage ENaC à la surface cellulaire, une approche de biotinylation décrit initialement par Harris et al. 9 peuvent être utilisés. Cette procédure (tel que détaillé dans la section de protocole et représenté sur la figure 4) a été adapté afin de démontrer que l'exposition des canaux de protéases et l'activation subséquente des courants médiés ENaC est mis en parallèle par l'apparition en fonction du temps de fragments de clivage. Procédé de biotinylation permet également l'analyse de l'augmentation ou de la diminution globale de protéines membranaires à la surface des cellules. Ainsi, cette méthode est adaptée pour étudier l'effet des protéases et autres pharagents pharmacologiques lors de l'insertion de canal dans la membrane plasmique ou moment de la recherche de canal. En outre, l'analyse western blot des protéines de la membrane de plasma biotinylés permet la détection de fragments de protéines (par exemple des fragments protéolytiques ENaC) ou des changements dans le motif de glycosylation qui peuvent être fonctionnellement pertinents.
En conclusion, la combinaison des méthodes utilisées pour étudier l'effet stimulateur de protéases sur les courants de cellules entières ENaC médiation et de démontrer une corrélation avec l'apparition de ENaC produits de clivage à la surface cellulaire peut être utile pour un large éventail d'applications. En particulier, ces méthodes peuvent être adaptées pour répondre aux questions similaires concernant la réglementation des autres canaux ioniques, les transporteurs ou récepteurs transmembranaires (par exemple les récepteurs de la protéase activée FER).
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The expert technical assistance of Céline Grüninger, Christina Lang, Sonja Mayer, and Ralf Rinke is gratefully acknowledged. We thank Dr. Morag K. Mansley for carefully reading the manuscript. This project was supported by a grant of the Deutsche Forschungsgemeinschaft (Grant SFB 423: Kidney Injury: Pathogenesis and Regenerative Mechanisms, to C. Korbmacher), grants of the Interdisziplinäres Zentrum für Klinische Forschung (to S. Haerteis and M. Krappitz), the ELAN program (to S. Haerteis) of the Friedrich-Alexander-Universität Erlangen-Nürnberg, and the University Library of Erlangen-Nürnberg.
matériels
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Bath clamp headstage for OC-725C-V | Warner Instrument Corporation | ||
| Cold light source - Schott KL 1500 LCD | Schott | #SCOC150200EU | brightness 4; mechanical aperture: D; color temperature: 3,000 K |
| E Series electrode holder (Str, Vent, Ag Wire, 1.2 mm) | ADinstruments | #ESW-F10v | |
| Left micromanipulator; MM-33L | Warner Instrument Corporation | #64-0055 | |
| LIH 1600 - computer interface | HEKA | ||
| Magnetic valve system (ALA BPS-8) in combination with a TIB14 interface (HEKA) | ALA Scientific Instruments, HEKA | ||
| OC-725C amplifier for two-electrode voltage-clamp recordings | Warner Instrument Corporation | ||
| P-97 FLAMING/BROWN Micropipette Puller | Sutter Instruments | heat = 550; velocity = 22; time = 200 | |
| Right micromanipulator; MM-33R | Warner Instrument Corporation | #64-0056 | |
| Series electrode holder (45°, Vent, Handle, Ag Wire, 1.2 mm) | ADinstruments | #E45w-f10vh | |
| STAT 2 IV gravity flow controller | Conmed | #P-S2V-60 | |
| Vacuum generator ejector SEG - for suction to remove bath solution | Schmalz | ||
| INFUJECT 60 ml pump syringes for solutions | Braun | #22050 | |
| Injekt-F for lysing the oocytes | Braun | #9166033V | |
| Standard wall borosilicate tubing with filament | Sutter Instruments | #BF150-86-10 | outside diameter: 1.5 mm; inside diameter: 0.86 mm; length: 10 cm |
| Complete, Mini, EDTA-free protease inhibitor cocktail tablets | Roche Applied Science | #11836170001 | |
| EZ-Link Sulfo-NHS-Biotin | Thermo Scientific | #21217 | |
| Horseradish peroxidase-labeled secondary goat anti-rabbit antibody | Santa Cruz Biotechnology | #sc-2004 | |
| NeutrAvidin Agarose | Thermo Scientific | #29200 | Neutravidin-labeled agarose beads |
| NP40 (Nonidet P-40) | Sigma-Aldrich | #I8896 | |
| Roti-Load 1 (2x SDS-PAGE sample buffer) | Carl Roth | #K929.2 | |
| SuperSignal West Femto Chemiluminescent Substrate for detection of chemiluminescent signals | Thermo Scientific | #34095 | |
| Triton-X-100 | Sigma-Aldrich | #T8787 |
Références
- Kleyman, T. R., Carattino, M. D., Hughey, R. P. ENaC at the cutting edge: regulation of epithelial sodium channels by proteases. The Journal of Biological Chemistry. 284, 20447-20451 (2009).
- Rossier, B. C., Stutts, M. J. Activation of the epithelial sodium channel (ENaC) by serine proteases. Annu Rev Physiol. 71, 361-379 (2009).
- Poirot, O., Vukicevic, M., Boesch, A., Kellenberger, S. Selective regulation of acid-sensing ion channel 1 by serine proteases. The Journal of Biological Chemistry. 279, 38448-38457 (2004).
- Vukicevic, M., Weder, G., Boillat, A., Boesch, A., Kellenberger, S. Trypsin cleaves acid-sensing ion channel 1a in a domain that is critical for channel gating. The Journal of Biological Chemistry. 281, 714-722 (2006).
- Clark, E. B., Jovov, B., Rooj, A. K., Fuller, C. M., Benos, D. J. Proteolytic cleavage of human acid-sensing ion channel 1 by the serine protease matriptase. The Journal of Biological Chemistry. 285, 27130-27143 (2010).
- Ossovskaya, V. S., Bunnett, N. W. Protease-activated receptors: contribution to physiology and disease. Physiological reviews. 84, 579-621 (2004).
- Garcia-Caballero, A., et al. Activation of the epithelial sodium channel by the metalloprotease meprin β-subunit. Channels (Austin. 5, 14-22 (2011).
- Haerteis, S., et al. Proteolytic activation of the epithelial sodium channel (ENaC) by the cysteine protease cathepsin-S. Pflügers Archiv: European Journal of Physiology. 464, 353-365 (2012).
- Harris, M., Firsov, D., Vuagniaux, G., Stutts, M. J., Rossier, B. C. A novel neutrophil elastase inhibitor prevents elastase activation and surface cleavage of the epithelial sodium channel expressed in Xenopus laevis oocytes. The Journal of Biological Chemistry. 282, 58-64 (2007).
- Passero, C. J., Mueller, G. M., Rondon-Berrios, H., Tofovic, S. P., Hughey, R. P., Kleyman, T. R. Plasmin activates epithelial Na+ channels by cleaving the γ-subunit. The Journal of Biological Chemistry. 283, 36586-36591 (2008).
- Svenningsen, P., et al. Plasmin in nephrotic urine activates the epithelial sodium channel. Journal of the American Society of Nephrology : JASN. 20, 299-310 (2009).
- Patel, A. B., Chao, J., Palmer, L. G. Tissue kallikrein activation of the epithelial Na channel. American Journal of Physiology. Renal Physiology. 303, (2012).
- Haerteis, S., Krappitz, M., Diakov, A., Krappitz, A., Rauh, R., Korbmacher, C. Plasmin and chymotrypsin have distinct preferences for channel activating cleavage sites in the γ-subunit of the human epithelial sodium channel. The Journal of General Physiology. 140, 375-389 (2012).
- Chraibi, A., Vallet, V., Firsov, D., Hess, S. K., Horisberger, J. D. Protease modulation of the activity of the epithelial sodium channel expressed in Xenopus oocytes. The Journal of General Physiology. 111, 127-138 (1998).
- Volk, T., Konstas, A. A., Bassalay, P., Ehmke, H., Korbmacher, C. Extracellular Na+ removal attenuates rundown of the epithelial Na+-channel (ENaC) by reducing the rate of channel retrieval. Pflügers Archiv: European Journal of Physiology. 447, 884-894 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon