Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Transfection génique vers les cellules Spheroid sur microélectrodes plaques de culture destinés à la transplantation de cellules génétiquement modifiées
Dans cet article
Résumé
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Résumé
Pour améliorer l'efficacité thérapeutique de la transplantation de cellules, un système de transplantation, de sphéroïdes injectables génétiquement modifiés a été développé. Les sphéroïdes de cellules sont préparés dans un système de culture sur des plaques de microélectrodes recouvertes d'un polymère thermosensible. Un certain nombre de sphéroïdes sont formées sur les plaques, correspondant aux zones d'adhésion cellulaire de 100 um de diamètre, régulièrement disposés de manière bidimensionnelle, entourées par des zones non adhésives qui sont recouvertes par un polyéthylène glycol de matrice (PEG). Les sphéroïdes peuvent facilement être récupérés sous forme d'une suspension liquide en abaissant la température des plaques, et leur structure est bien maintenu en les faisant passer à travers des aiguilles d'injection avec un calibre suffisamment grand (plus de 27 G). La modification génétique est obtenue par transfection des gènes en utilisant le support d'origine non virale gène, nanomicelle polyplexe, qui est capable d'introduire des gènes dans des cellules sans perturber la structure du sphéroïde. Pour primsphéroïdes d'hépatocytes aires transfectées avec un gène de la luciférase exprimant la luciférase est durablement obtenus chez les animaux transplantés, ainsi que la fonction des hépatocytes conservés, comme indiqué par l'expression de l'albumine. Ce système peut être appliqué à une variété de types de cellules comprenant des cellules souches mésenchymateuses.
Introduction
La thérapie cellulaire de la transplantation a attiré l'attention généralisée pour le traitement de diverses maladies incurables. L'activité et la demi-vie de facteurs bioactifs qui sont sécrétées par les cellules transplantées sont essentiels pour améliorer l'efficacité thérapeutique d'un système de greffe de cellules. La modification génétique des cellules avant transplantation est une technique utile pour réguler et manipuler les fonctions cellulaires, y compris la sécrétion de facteurs bioactifs. Il est également important de maintenir un micro-environnement favorable pour les cellules pour éviter la mort cellulaire ou la perte de l'activité cellulaire. Three-dimensional culture (3D) de cellules de sphéroïde, dans laquelle les interactions cellule-cellule sont bien conservés, est prometteuse à cet effet, par exemple, pour améliorer la sécrétion d'albumine à partir des hépatocytes primaires et favoriser la différenciation de lignées multiples à partir de cellules souches mésenchymateuses (MSC ) 1-7.
Dans cette étude, un nouveau système de combinaison de spheroid culture et transfection génique est utilisée pour servir de plate-forme pour une transplantation de cellules génétiquement modifiées. Pour la création de cellules sphéroïdes, un système de culture sphéroïde sur des plaques de culture microélectrodes est utilisé. Sur ces plaques, les zones d'adhésion cellulaire de 100 um de diamètre sont régulièrement disposées de manière bidimensionnelle et sont entourées par des zones non adhésives revêtues par une matrice 3 de PEG. Par ensemencement d'un nombre suffisant de cellules, des matrices de sphéroïdes 3D de 100 um de diamètre correspondant sont formés dans le lit de culture microélectrodes.
Les sphéroïdes sont récupérés sans perturber leur structure 3D en utilisant thermosensibles plaques de culture cellulaire, qui a été revêtu d'un polymère thermosensible, poly (iso-propylacrylamide) (PIPAAm) 10/08. L'architecture microélectrodes est construit sur les plaques thermosensibles (construit sur mesure). En abaissant simplement la température des plaques, les sphéroïdes sont détachés du lit de culture et se dispersentd en solution saline tamponnée au phosphate (PBS). Ainsi, un grand nombre de sphéroïdes d'une taille uniforme de 100 um peut être obtenue sous la forme d'une suspension injectable.

Figure 1. Représentation schématique du système de culture sur une plaque sphéroïde microélectrodes. La modification génétique est obtenue par transfection des gènes en utilisant le support de gène non viral initial, nanomicelle polyplex. Il est composé d'ADN plasmidique (ADNp) et de polyéthylène glycol (PEG) des copolymères séquencés de 11 -polycation. Celles-ci ont une structure noyau-enveloppe caractéristique qui consiste en une coquille PEG et un noyau interne de pDNA condensée, permettant l'introduction du gène sûr et efficace dans les cellules à des fins thérapeutiques 11. S'il vous plaît, cliquez ici pour voir une version plus grande de this figure.
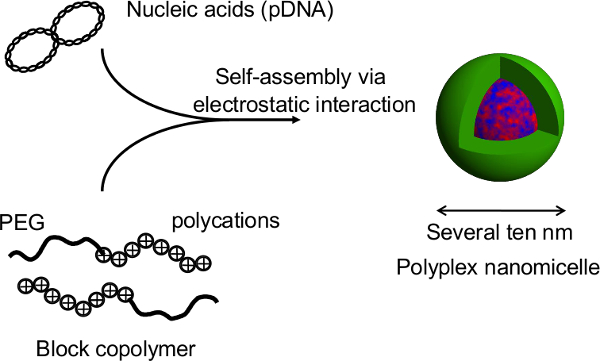
Figure 2. Structure de la nanomicelle polyplexe formé par le complexe d'acides nucléiques et des copolymères à blocs PEG-bloc-polycation. Dans cette étude, le principal avantage de cette technique est que la structure sphéroïde ne soit pas perturbé par transfection génique pendant les nanomicelles. Après les transfections à médiation par des nanomicelle de sphéroïdes d'hépatocytes de rat primaires, l'expression du transgène est obtenu prolongée pendant plus d'un mois avec continu sécrétion d'albumine à partir des hépatocytes à un niveau comparable à celui de sphéroïdes non transfectées 12. L'expression du transgène et de sécrétion d'albumine dans les sphéroïdes sont également maintenus après la récupération à partir des plaques thermosensibles. Il est évident que nanomicelles peuvent faciliter en toute sécurité l'introduction du gène sans altérer les fonctions innées de l'hépatiteatocytes. Ainsi, la combinaison de cellules cultivées sur des plaques sphéroïde micropatterned thermosensibles avec l'introduction du gène en utilisant nanomicelles est une plate-forme prometteuse pour la transplantation de cellules génétiquement modifiées. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les études sur les animaux ont été menées avec l'approbation du Comité soin et l'utilisation des animaux de l'Université de Tokyo, Tokyo, Japon.
1. Préparation des cellules
- Pour hépatocytes primaires, suivre le protocole pour l'isolement des hépatocytes de rat par un processus de digestion de collagénase en deux étapes modifiée 13,14.
- Anesthésier Sprague Dawley (SD) des rats (mâles, âgés de 5 semaines) sous anesthésie par inhalation avec de l'isoflurane. Placer un rat dans une chambre reliée à un appareil d'anesthésie à l'isoflurane pour fournir de la chambre. Sortez le rat après l'endormissement, et le mettre sur la table d'opération avec une ventilation en utilisant un masque. Contrôler l'isoflurane écouler approximativement à 0,4 à 0,7 L / min en vérifiant les conditions du rat. Perfuser le foie de Sprague Dawley (SD) des rats (mâles, âgées de 5 semaines) à partir de la veine porte hépatique avec une solution spéciale composée de 8 g / L de chlorure de sodium (NaCl), 400 mg / L de chlorure de potassium (KCl), 78 mg / Lle dihydrogénophosphate de sodium dihydrate (NaH 2 PO 4 · 2H 2 O), 151 mg / l phosphate disodique dodécahydraté (Na 2 HPO 4 · 12H 2 O), 2,38 g / L d'acide 2- [4- (2-hydroxyéthyl) -1 pipérazinyl] éthanesulfonique (HEPES), 190 mg / L d'acide éthylèneglycol tétraacétique (EGTA), 350 mg / L de carbonate acide de sodium (NaHCO 3), et 900 mg / L de glucose.
- Faire circuler une solution de collagénase à travers le foie.
REMARQUE: La solution est composé de 500 mg / L collagénase, 9,8 g / saline tamponnée de L Hank, 2,38 g / ml d'HEPES, 556 mg / ml de chlorure de calcium hydraté (CaCl 2 · H 2 O), 350 mg / L de NaHCO 3, et l'inhibiteur de trypsine / L de 50 mg, avec le pH ajusté à 7,2. - Retirer soigneusement le foie, et hacher le doucement sur un plat en utilisant une lame de scalpel, ajouter milieu de Eagle modifié par Dulbecco (DMEM) supplémenté avec 10% de sérum bovin fœtal (FBS), et filtrer la suspension de cellules à travers un 100 ummaille de nylon. Pour retirer les débris supplémentaires, centrifuger la suspension cellulaire à 20 g pendant 1 min. A ce stade, les hépatocytes sont dans le surnageant.
- Répétez l'étape de centrifugation deux fois (un total de trois centrifugations). Enfin, centrifuger les hépatocytes à 50 g pendant 3 min pour les récupérer sous la forme d'une pastille.
- Re-suspendre les hépatocytes à une concentration de 4 x 10 5 cellules / ml dans un milieu de culture spécial composé de DMEM supplémenté avec 10% de FBS, 1% de Pen-Strep-Glut (PSQ), 1% de diméthylsulfoxyde (DMSO), 0,1 umol / L dexaméthasone, 0,5 pg / ml d'insuline, 10 mmol / L nicotinamide, 0,2 mmol / L ascorbate phosphorylé (Asc-2P), et 10 ng / ml de facteur de croissance épidermique humain (hEGF) 15. Ce milieu spéciale est obligatoire pour la préservation de la fonction hépatique dans des conditions in vitro.
- Pour obtenir CSM de rats, euthanasier Sprague Dawley (SD) des rats (mâles, âgés de 5 semaines) par l'administration excessive de isoflurane. Réséquer les fémurs et tibias, et de recueillir les moelle osseuse en insérant une aiguille 22 G dans le corps de l'os de la nettoyer avec 10 ml de DMEM complété avec 10% de FBS. Recueillir les cellules par filtration à travers un tamis en nylon de 100 um.
- Ensemencer les cellules sur 10 boîtes de culture cm en utilisant du DMEM contenant 10% de FBS et 1% de pénicilline / streptomycine. Pour les expériences de sphéroïde, utiliser MSC dans les 5 passages.
2. Préparation de sphéroïdes cellulaires 3D
- Obtenir dans le commerce des plaques de culture microélectrodes, sur lequel les zones adhésives cellulaires sont régulièrement disposés à 100 um de diamètre de façon bidimensionnelle, entouré par des zones non adhésives revêtues par la matrice de PEG.
NOTE: Pour la transplantation de cellules, une couche supplémentaire avec le PIPAAm de polymère thermosensible est nécessaire pour permettre le détachement des cellules en refroidissant les plaques (voir étape 5.1). Les fluctuations de température peuvent induire des changements dans la chimie de ce polymère10.8. A 37 ° C, PIPAAm est légèrement hydrophobe, ce qui permet aux cellules d'être cultivées dans des conditions normales. Une diminution de la température en dessous de 32 ° C entraîne une hydratation rapide du polymère, conduisant au détachement spontané des cellules. - Ensemencer les cellules souches mésenchymateuses ou des hépatocytes sur des plaques à 12 puits à une densité de microélectrodes de 4 x 10 5 cellules / puits les andincubate à 37 ° C dans une atmosphère humidifiée contenant 5% de CO 2. Les cellules seront accumuler sur les zones d'adhérence microélectrodes et de former progressivement sphéroïdes rondes en 2 jours.
Remarque: Pour la préparation de cellules de contrôle dans une culture monocouche, en utilisant des plaques à 12 puits normales et ensemencer les cellules à une densité identique, suivant une procédure similaire à celle décrite ci-dessus.
3. Préparation de Polyplex nanomicelles
- Synthétiser un copolymère séquence de PEG-pAsp (DET) (poly [N '- [N - (2-aminoéthyl) -2-aminoéthyl] aspartamide]) (PEG Mw = 12,000, le degré de polymérisation (DP) du PASP (DET) Segment = 59), et un homopolymère qui est composé de seulement le segment cationique [PASP (DET)] (DP = 55), suivant les procédures décrites précédemment par les 11 auteurs, 16, 17.
- Préparer une solution mixte du copolymère séquencé (DET) PEG-pAsp et PASP (DET) homopolymère dans un rapport molaire égal de groupes amino résiduels dans 10 mM de tampon HEPES (pH 7,3) en ajustant la concentration en polymère de 33,3 ug / ml et 19,1 ug / ml, respectivement.
REMARQUE: Les concentrations de polymère décrits ci-dessus sont des valeurs représentatives pour la préparation nanomicelles avec un taux résiduel molaire des groupes acides totaux dans les deux polymères aux groupes phosphate dans le ADNp (N / P) de 10. Le rapport N / P peut varier selon le type de cellule et le but (pour plus de détails, voir Discussion). L'utilisation combinée de ces deux polymères peut atteindre à la fois un blindage efficace de PEG et le fonctionnement du PASP (DET) afin d'améliorer endosomiqueéchapper (pour plus de détails, voir discussion) 18. - Préparer la luciférase ADNp codant Gaussia, GL4 luciférase, ou érythropoïétine en clonant le segment exprimant les gènes respectifs dans le plasmide pCAG-GS (http://www.cdb.riken.jp/pcs/protocol/vector/map/m36.html ) pour obtenir une expression sous la CAG promoteur / amplificateur en utilisant un kit commercial selon le protocole du fabricant. Amplifier l'ADNp dans une souche d'Escherichia coli compétent et le purifier en utilisant un système de purification d'ADN plasmide exempt d'endotoxine. Déterminer la concentration d'ADNp à une absorbance de 260 nm pour obtenir une solution / ml 150 ug dans du tampon HEPES 10 mM (pH 7,3).
- Pour préparer les nanomicelles polyplexe, bien mélanger la solution d'ADNp (150 ug / ml dans du tampon HEPES 10 mM) et la solution de prémélange des deux polymères dans un rapport de 2: 1 (en volume).
4. Gene transfection dans Sphéroïdes
- Incuber les cellules (hépatocytesou MSC) pendant 72 heures après l'ensemencement sur des plaques microélectrodes pour permettre la formation de sphéroïdes matures. Pour la transfection de gènes, ajouter 100 ul de la solution de polyplex nanomicelle (contenant 10 pg d'ADNp) dans chaque puits après avoir remplacé le milieu de culture avec 1 ml de milieu frais. Poursuivre l'incubation avec la solution de nanomicelle pendant 24 heures.
- Pour un contrôle en utilisant un réactif de transfection à base de lipides, mélanger les solutions ADNp avec le réactif à un rapport en poids de réactif / de l'ADNp 3. Ajuster la dose finale d'ADNp à être égale à la fois pour le réactif à base de lipides et les méthodes de nanomicelle.
5. Récupération et la transplantation de Sphéroïdes cellulaires
- Remplacez le milieu de culture avec 200 pi de PBS froide et placer les plaques sur de la glace.
NOTE: En général, les sphéroïdes peuvent se détacher dans environ 15 min et peut être récupéré sous la forme d'une suspension pour la transplantation. - Aspirer délicatement les cellules dans le 200 pisuspension en utilisant une seringue avec une aiguille 23 G ou 27 G pour injections in vivo.
6. Évaluation de l'expression transgénique
- Pour l'évaluation in vitro de l'expression de la luciférase de Gaussia sécrétée dans le milieu de culture, de recueillir de 50 à 100 ul de milieu précisément 24 heures après le remplacement par du milieu frais. Estimer l'expression de la luciférase en utilisant un système de dosage de la luciférase de Renilla commercial et un luminomètre selon le protocole du fabricant.
NOTE: La luciférase Gaussia reste stable dans le milieu de culture pour plus d'une semaine. Ainsi, pour évaluer l'efficacité en temps réel de l'expression du transgène, remplacer le milieu avec une douce avant de recueillir le milieu de l'échantillon. Le calendrier de la changement de milieu peut être flexible. - Pour l'évaluation de l'expression du transgène dans des animaux hôtes in vivo après transplantation de cellules, anesthésier souris BALB / c nu (femelle; 7 semainesancienne) sous anesthésie par inhalation avec de l'isoflurane.
- Placer une souris dans une chambre reliée à un appareil d'anesthésie à l'isoflurane pour fournir de la chambre. Sortez la souris après l'endormissement, et le mettre sur la table d'opération avec une ventilation en utilisant un masque. Contrôler l'isoflurane écouler approximativement à 0,2 à 0,5 L / min en vérifiant les conditions de la souris.
- Injecter 200 ul de la suspension cellulaire contenant des sphéroïdes transfectées avec les ADNp exprimant la luciférase GL4 (comme décrit en 4.1) dans le tissu sous-cutané de la région abdominale.
- Immédiatement après l'injection de D-luciférine (150 mg / kg; voie intraveineuse), mesurer l'expression de la luciférase en utilisant le système d'imagerie IVIS selon le protocole du fabricant.
- Pour évaluer les effets thérapeutiques de la transplantation de cellules, injecter 200 ul de la suspension cellulaire contenant des sphéroïdes transfectées avec les ADNp codant pour l'érythropoïétine dans latissu sous-cutané de la région abdominale.
- Recueillir des échantillons de sang par des saignements sous-maxillaire pour obtenir environ 200 pi de sang 19. Mesurer le taux d'hémoglobine et l'hématocrite utilisant un échantillon de sang analyseur.
REMARQUE: Le nombre de cellules pour la transplantation est réglementée par le nombre ensemencées sur les plaques. Malheureusement, il est difficile de déterminer le nombre de cellules exacte parce que le nombre à l'intérieur sphéroïdes ne peut être mesurée.
- Recueillir des échantillons de sang par des saignements sous-maxillaire pour obtenir environ 200 pi de sang 19. Mesurer le taux d'hémoglobine et l'hématocrite utilisant un échantillon de sang analyseur.
- Après des expériences, placez la souris sur un coussin chauffant relié à un contrôleur de température jusqu'à ce que l'éveil de l'anesthésie.
Access restricted. Please log in or start a trial to view this content.
Résultats
Gene transfection de la luciférase de Gaussia exprimant ADNp a été effectuée dans les sphéroïdes formés par les hépatocytes ou les cellules souches mésenchymateuses à l'aide nanomicelles Polyplex ou le réactif de transfection à base de lipide de commande 12. Les nanomicelles induites pratiquement aucun changement dans la structure de sphéroïde par rapport à sphéroïdes non transfectées microélectrodes sur les plaques, tandis que le réactif de contrôle perturbé de manière significativ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans ce protocole, il est essentiel de maintenir la structure 3D de sphéroïdes lors des étapes d'introduction de gène et la récupération de sphéroïde. Il est essentiel de maintenir un micro-environnements favorables pour les cellules afin d'éviter la mort cellulaire ou la perte de l'activité cellulaire. Par exemple, la sécrétion d'albumine, une fonction innée représentant des hépatocytes, est bien conservés dans les sphéroïdes d'hépatocytes, tandis que les hépatocytes dans la cult...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
Nous sommes profondément reconnaissants à Dr. Takeshi Ikeya et le personnel technique dans Toyo Gosei, Tokyo, Japon pour fournir des plaques de culture microélectrodes thermosensibles ainsi que des conseils scientifiques. Nous remercions également Mme Ogura Satomi, Mme Sae Suzuki, Mme Asuka Miyoshi et Mme Katsue Morii d'assistance technique avec des expérimentations animales. Ce travail a été soutenu financièrement en partie par la JSPS KAKENHI Grant-in-Aid pour la recherche scientifique, le Centre du Programme d'innovation (COI) et le programme d'innovation de l'Agence S Japan Science and Technology (JST), et de la JSPS Core- à-Core Programme, A. Réseaux de recherche avancée.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| Collagenase | Wako Pure Chemical Industries | 639-00951 | |
| Trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| Blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
Références
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon