Method Article
Super-résolution de l'imagerie cellulaire Synapse immunologique Natural Killer sur un verre soutenu par Planar lipidique en deux couches
Dans cet article
Résumé
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
Résumé
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
Introduction
La synapse immunologique (IS) se trouve à un carrefour critique pour l'activation et la fonction une cellule. Ce est le moyen principal par lequel la présentation des antigènes et de l'immunité à médiation cellulaire sont réalisés. Les premières études microscopiques de la formation des synapses utilisés un système conjugué cellule-cellule 2. La principale limite de cette approche est que la plupart des conjugués sera consulté 'profil', pour ainsi dire, limitant ainsi le point de vue de l'observateur de la structure synaptique lui-même. En 1999, le laboratoire Dustin adressée cette limitation en utilisant la technique 3-verre soutenue bicouche lipidique (SLB), qui avait été un pionnier tôt par le laboratoire 4,5 McConnel. Cette approche disposé de cellules présentatrices d'antigène (CPA) en faveur d'une surface plane lipidique verre soutenue, dans lequel protéines pourraient être attachés et se déplacent librement dans deux dimensions. En utilisant cette méthode, Dustin et ses collègues ont pu pairs directement vers le haut dans til Synapse utilisant la microscopie à fluorescence haute résolution, et pour la première fois obtenir un look "face-à-face" à la structure de l'IS.
Avec l'utilisation du système SLB, le détail avec lequel la SI peut être visualisé a été limité seulement par les limites des techniques actuelles d'imagerie 8.6. En utilisant des techniques d'éclairage classiques, la résolution minimale (ce est à dire, la distance minimale entre deux objets distincts dans laquelle ils peuvent être distingués) a été <200 nm sur la base du critère de Rayleigh neuf. Cette limite empêche l'imagerie de structures très fines, à l'échelle moléculaire qui composent la synapse, et jusqu'à ce que le développement de techniques d'imagerie de super-résolution 12/10, la visualisation de ces structures se est limitée à l'imagerie de cellules fixées à l'aide de la microscopie électronique.
Avec l'avènement récent d'une variété de techniques de super-résolution, telles que la carte SIM (microscopie éclairage structuré), PALM (microscopie de localisation photoactivé), STORM (microscopie de reconstruction optique stochastique) et STED 10-12, les enquêteurs sont maintenant en mesure d'étudier ces structures synaptiques en détail sans précédent, qui a à son tour fourni une compréhension de plus clarifié de l'IS. Les avantages de la microscopie STED ont été décrits avant le 13. Nous décrivons ici super-résolution imagerie par microscopie STED équipé du laser 660 nm d'épuisement nouvellement développé. Par rapport à la 592 nm laser appauvrissement classique, le laser de 660 nm permet une sélection plus large de colorants fluorescents (voir http://nanobiophotonics.mpibpc.mpg.de/old/dyes/), en particulier ces fluorophores rouges.
Autres publications ont décrit l'imagerie STED des synapses des cellules NK sur des lames de verre recouvertes d'anticorps 13,14. Ici, le système est combiné avec SLB super-résolution microscopie STED pour étudier la cellule NK synapse. Cette technique présente l'avantage par rapport aux anticorps-des lames revêtues d'être une mosaïque de fluide, dans lequel les protéines de surface embarqués peuvent se déplacer librement dans une surface à deux dimensions à plat (plan xy). Cela imite plus fidèlement la surface organique et mobiles d'une cellule cible, et par conséquent mieux récapitule la formation d'une synapse immunologique physiologiquement pertinent.
L'objectif de ce protocole est de fournir à l'utilisateur final avec une description détaillée de la façon de l'image de la synapse immunologique des cellules NK en combinant le système SLB et de super-résolution STED microscopie. Il fournira à l'utilisateur final avec les mesures nécessaires pour: préparer les liposomes, construire bicouches protéines intégré, déterminer la densité de protéine sur les bicouches lipidiques, et acquérir des images de super-résolution utilisant la microscopie STED. Ces techniques ne sont pas limités au domaine de l'immunologie, et peuvent être largement utilisés dans divers domaines.
Protocole
1. Préparation de Liposomes
- Calculez le montant des solutions mères chloroforme suspension de 1,2-dioléoyl-sn-glycéro-3-phosphocholine (DOPC) et le 1,2-dioléoyl-sn-glycéro-3-phosphoéthanolamine-N-cap biotinyl (biotine-PE) de faire des stocks dilué à la concentration finale souhaitée. Pour des concentrations finales de 400 uM et 80 uM DOPC phospholipides biotine-PE à 10 ml chacune, commencer par placer 629 ul de 10 mg / ml et 88 ul DOPC 10 mg / ml biotine-PE dans des tubes de chromatographie en verre séparées.
REMARQUE: il est important de nettoyer verre seringues Hamilton et tubes de chromatographie en verre par une solution (1 L 95% d'éthanol à 120 ml d'eau contenant 60 g d'hydroxyde de potassium, KOH) nettoyage, tout en transférant solution stock de chloroforme en suspension de DOPC et biotine-PE. - Sécher le chloroforme avec un courant d'argon dans la hotte chimique. Scellez le tube de chromatographie par parafilm.
- Soumettre les liposomes nouveau séché à un vide poussé dans un lyophilizer O / N pour éliminer tout le chloroforme résiduel. Pour l'achèvement le même jour, sec pour 60-90 min.
- Alors que les pistes lyophilisateur, préparer quelques tampon de dilution. Pour ce protocole, préparer 25 ml consistant mM Tris, pH 8,0 25; NaCl 150 mM; et 2% (en poids) de n-octyl-β-D-glucopyranoside (OG) de détergent. Mélanger les deux premiers ingrédients, puis déplacer l'oxygène avec de l'argon avant d'ajouter la poudre de OG sec. Après la préparation, filtrer la solution OG avec membrane d'acétate de cellulose de 0,2 micron, et conserver à 4 ° C.
- En outre, préparer deux vis-top bouteilles de 1 L de tampon Tris-solution saline aux mêmes concentrations, mais sans OG. Placer une barre d'agitation magnétique nettoyé à l'eau distillée dans le fond de chaque. Préparez 6 litres supplémentaires du tampon Tris-solution saline. Éliminer l'oxygène de toutes les bouteilles avec de l'argon et de les placer à 4 ° C également.
- Après lyophilisation, on dissout les lipides séchés dans le tampon de OG Tris-solution saline pour fabriquer une solution 4 mM de chacun. A l'instarvolumes, ajouter 2 ml au tube de DOPC et de 0,2 ml dans le tube biotine-PE.
- Mélanger les lipides biotine-PE avec les lipides de DOPC. Cela permet d'améliorer la mobilité de la SLB, comme la biotine couplé peut nuire à la fluidité des groupes de tête phosphate. Pour une concentration finale de 80 uM biotine-PE, mélanger 0,2 ml de 4 mM biotine-PE et 1 ml de 4 mM DOPC. Puis ajouter 8,8 ml de tampon de Tris-solution saline OG.
- Pour une concentration finale de 400 uM DOPC, il suffit de 1 ml de 4 mM DOPC mélanger avec 9 ml d'OG Tris-solution saline.
- Remplissez le sonicateur avec de l'eau glacée. Placer le tube de verre contenant le phospholipide dilué dans le centre de l'appareil à ultrasons en utilisant une pince d'utilité. Soniquer le phospholipide diluée pendant 10 min jusqu'à ce que la solution devient limpide.
NOTE: Ajouter de la glace dans le bain d'eau sonicateur pour maintenir la température bas depuis ultrasons génère de la chaleur. - Remplir les tubes avec de l'argon pour déplacer l'oxygène de l'air au-dessus du liquide, et les sceller avec du parafilm.
2. Dialyse de liposomes
- Coupez deux sections de tube de dialyse à sec (poids moléculaire de coupure: 12-14,000, diamètre: 6,4 mm) de longueur appropriée (dans cet exemple, 40 cm), une pour chaque dilution de phospholipides, à partir du rouleau.
- Réhydrater les sections de tube en leur permettant de tremper dans un 200 ml d'eau distillée dans un bêcher en verre pendant 2 min.
- Micro-ondes ce pendant 5 min à une valeur élevée, ou au moins jusqu'à ce que l'eau arrive à ébullition.
- Faire un nœud à une extrémité de chaque tube et rincer l'intérieur avec quelques millilitres de tampon Tris-solution saline-OG. Par la suite, serrer méticuleusement autant de ce tampon de lavage que possible pour minimiser la quantité de tampon restant à l'intérieur.
- Dans une hotte à flux laminaire, à ajouter les phospholipides dilué dans chaque tube et serrer les extrémités ouvertes avec une petite fermeture du tube de dialyse de façon à exclure tout l'air. Exclusion d'air complète, il faudra le sacrifice d'un petit volume de l'échantillon par serrage en dessous du &# 8220; la ligne d'eau ".
- Plonger les échantillons dans les bouteilles préparées auparavant de tampon Tris-solution saline sans OG. Déplacer l'oxygène dans la bouteille avec de l'argon avant de re-étanchéité et le lieu de remuer O / N à 4 °.
- Transférer le tube dans une nouvelle bouteille de tampon Tris-solution saline sans OG toutes les 12 h pendant au moins trois fois.
- Peu de temps avant l'élimination des lipides dialyses, préparer un certain nombre de petits tubes à aliquoter dans laquelle les lipides en remplissant chacun avec de l'argon pour déplacer l'oxygène.
- Après 36 h, prendre les bouteilles de dialyse dans la hotte à flux laminaire et retirer les tubes de dialyse des bouteilles. Avoir une couche ou bécher banc sur place pour recueillir les eaux de ruissellement humide.
- Couper le tube de dialyse dessus du clip, puis retirer le clip et transférer soigneusement la solution lipidique dialyse via pipette en aliquots de 1 ml dans des tubes pré-préparés remplis avec du gaz argon sur de la glace.
- Aliquoter la solution aqueuse de liposomes, utiliser le flux d'argon pour déplacer l'oxygène nouveau in chaque tube.
- Conserver les liposomes à 4 °. Ne pas congeler.
3. Détermination de la densité d'anticorps sur la bicouche lipidique
- Préparer une série de dilutions de biotinylée, un anticorps marqué par fluorescence, 50 ul de volume de chaque dilution aux concentrations suivantes: 0 nM (témoin), 10 nM, 50 nM, 100 nM et 500 nM. (Ci-après dénommée "série d'échantillons").
- Ajouter 1 pi de billes de silice dans six puits d'une plaque à 96 puits à fond en V. Ne oubliez pas de secouer les perles bien avant pipetage, car ils ont tendance à se installer.
NOTE: Si avoir ordonné perles sèches plutôt que suspendue, suivez les instructions du fabricant pour diluer. - Pour ces billes, ajouter 2 ul de mélange DOPC: phospholipides biotinyle à un rapport de 1: 1. Pour ce faire, pour chaque puits.
- Pulse la plaque sur un vortex à force moyenne trois fois pendant 10 secondes chacun pour encourager l'interaction avec les perles et les phospholipides.
- Ajouter 150 pi de 5% CASein à chaque puits. Mélangez bien par aspiration et à trois reprises.
- Laissez la plaque incuber dans la solution de caséine pendant 10 min, puis lavez-le. Pour laver, remplir chaque puits pour un volume total de 250 pi avec une solution saline tamponnée HEPES (HBS) avec de l'albumine 1% de sérum humain (HSA). Centrifuger à 1000 g pendant 2 min. Introduire à la pipette et jetez les 200 meilleurs ul de surnageant, et répéter deux fois pour un total de trois cycles de lavage.
- Ajouter 50 pi de streptavidine à 333 ng / ml de concentration. Pulse nouveau la plaque 3x 10 sec, et laisser reposer sur un agitateur pendant 15 min. Laver 3x comme à l'étape 6 pour supprimer streptavidine non liée.
- Ajouter 50 ul de l'anticorps biotinylé marqué par fluorescence de la série de dilution préalablement préparé (voir l'étape 3.1) dans chaque puits, et remplacer la plaque sur l'agitateur pendant 20-30 min. Laver 3x comme à l'étape 6 pour éliminer l'anticorps non lié.
- Après le lavage final, remettre en suspension les billes dans 100 ul de HBS / 1% de HSA, puis transfert à un tube FACS. Répétez cette opération deux fois pourassurer l'élimination efficace de toutes les perles du puits, pour un total de 300 pi, et le faire pour chaque puits.
- Apportez les tubes résultant pour le cytomètre de flux. Il est temps de les lire.
- Ajouter une goutte de la bouteille marquée "B" à partir de l'étalonnage de l'intensité de fluorescence (FIC) Kit de talon (ci-après dénommé "série standard") dans un tube FACS, et diluer avec 300 ul de HBS / 1% de HSA.
- Lire ce tube, mais ne pas enregistrer tout de suite les données. Pour l'instant, tout simplement se assurer que les perles blanches sont correctement mis à zéro. Faire un histogramme montrant la fluorescence des perles mesurées dans le canal approprié, puis passer la tension du laser d'excitation jusqu'à ce que le pic est à l'extrême gauche de l'histogramme.
- Retirer le tube et ajouter une goutte de chacun des quatre autres tubes de la série (numérotés de 1 à 4) dans le même tube. Maintenant, placez le tube dans la machine, et d'enregistrer les données résultantes, qui doit apparaître comme cinq pics distincts.
- Lisez chaque tube individuel de la série d'échantillons.
- Grâce à un logiciel d'analyse FACS, dessiner une grille couvrant toute la largeur de chaque pic dans l'histogramme de la série standard au point demi-maximale. Ce est une porte pour chaque pic. Faites de même pour chaque échantillon. Remarque l'IMF (intensité de fluorescence moyenne) pour chaque porte.
- En utilisant une entrée de tableur les valeurs mesurées par les IFM à l'endroit approprié. Entrée aussi le MESF (molécules d'équivalent Soluble Fluorochrome) des valeurs (nombre moyen de molécules fluorescentes revêtement chaque bille) pour chaque bouteille dans la série standard. Cette information peut être trouvé en suivant les instructions sur le plastique se entrechoquaient les tubes sont venus.
- Utilisez la feuille de calcul va tracer l'IMF contre les valeurs de MESF, la création d'une corrélation linéaire entre le nombre de fluorophores et de l'intensité mesurée.
- Utiliser le module de «protéines» et des étiquettes dans le spectrophotomètre micro-volume pour déterminer le rapport de colorant à proprotéine dans l'anticorps marqué.
- Entrée de l'efficacité de marquage de la protéine de l'échantillon, le diamètre moyen des billes revêtues avec des lipides, et de la valeur MFI pour chaque entrée. La feuille de calcul utilise automatiquement la formule de la ligne graphique généré à l'étape 3.16 pour calculer les valeurs de Mesf pour chaque dilution de la protéine et de la densité d'ensemencement de la protéine de l'échantillon pour chaque concentration.
4. isolement et de culture de cellules NK humaines
- Aliquoter 15 ml de sang périphérique ou la couche leucocytaire dans un tube conique de 50 ml. Diluer ce sang avec du PBS contenant 1% de FBS à raison de 1: 1.
- Ajouter 13 ml de Ficoll doucement au fond du tube avec une pipette sérologique de 10 ml.
- Centrifugeuse ce tube pendant 20 min à 1200 xg avec l'accélérateur et la pause à pied ou à leurs réglages les plus bas.
- Après centrifugation, utiliser une pipette sérologique pour recueillir le trouble couche intermédiaire blanc flottant de cellules mononucléaires du sang périphérique (CMSP), wHICH devrait se asseoir et l'intersection entre une couche supérieure jaune clair et une couche inférieure couleur pâle plus trouble, qui tous deux se asseoir dessus d'une couche la plus basse de globules rouges (hématies). REMARQUE Ne pas pour recueillir des globules rouges dans la collecte des CMSP.
- Placez les PBMC recueillies dans une nouvelle 50 ml tube conique, et diluer à la capacité avec du PBS contenant 1% de FBS. Centrifuger de nouveau, cette fois avec le frein et accélérateur sur maximum pendant 5 minutes à 300 x g.
- Jeter le surnageant et remettre en suspension les cellules dans 10 ml de PBS contenant 1% de FBS.
- Compter les cellules tout en centrifugation une fois de plus avec les mêmes paramètres que dans l'étape 4.6.
- Jeter le surnageant une fois de plus, et remettre en suspension les cellules dans du milieu R10 à une densité de 10 millions de cellules / ml.
- Prendre 30 millions de cellules dans un tube de 5 ml de polystyrène, et d'isoler les cellules NK en utilisant un kit de séparation magnétique, en suivant les instructions du fabricant. Après isolement, compter les cellules une plus et remettre en suspension à une densité de 500,000 cellules / ml dans du milieu complet R10 (88% de RPMI, 10% de FBS, 1% de HEPES, du pyruvate de sodium à 1%) supplémenté avec de l'IL-2 (100 U / ml). Culture à 37 ° dans un incubateur CO 2, et remplacer moyenne 2-3 fois par semaine.
5. Montage du verre soutenu par Planar lipidique en deux couches
- Préparer la solution de piranha de 100 ml en mélangeant 30% de peroxyde d'hydrogène avec de l'acide sulfurique dans un rapport de 1: 3 dans un bêcher.
REMARQUE: Toujours effectuer le travail avec les agents nocifs comme l'acide sulfurique dans une hotte chimique bien désigné. - Dans cette solution, plongez deux rectangulaires # 1.5 lamelles dans une solution piranha pendant 20-30 min.
NOTE: Il est essentiel de nettoyer les lamelles par solution piranha. - Alors que les lamelles sont nettoyés, prendre 1 tube de 400 um préalablement préparé lipides DOPC et 1 tube de préalablement préparé 80 uM lipides biotine-PE. Les transporter sur de la glace dans le réservoir d'argon.
- Déplacer l'oxygène dans un nouveau tube avec de l'argon,puis ajouter ensemble la DOPC et biotine-PE à un ratio de 1: 1. Volume spécifique varie en fonction des besoins expérimentaux, mais doit être au minimum de 2 pi de chacun. Déplacer l'oxygène dans le tube de mélange une fois de plus avec du gaz argon, et les tubes à réactifs individuels et, avant de retourner ce dernier au réfrigérateur.
- Après qu'ils ont terminé le nettoyage, rincer les lamelles avec de l'eau distillée. Définissez les lamelles sur sécher à l'air pendant quelques minutes.
- Retirer 1,5 ul du mélange de liposomes préparée à l'étape 5.4 et aliquoter dans une seule goutte dans l'une des chambres de voie de la glissière de la chambre. L'utilisation de deux gouttes par voie est typique, mais pas nécessaire.
- Placer rapidement et efficacement la lamelle sec sur les gouttelettes. Se assurer que les gouttes sont suffisamment espacées afin qu'elles ne se confondent pas, une fois la lamelle est placée. De plus, assurez-vous que les gouttes restent circulaire et bien définie, sans toucher les bords des parois de la chambre. Appuyez fermemententre et autour chaque voie pour assurer l'étanchéité entre la lamelle et un toboggan.
- Marquez les positions des gouttes à l'aide d'un marqueur
- Passez 100 pi de solution aqueuse à 5% de caséine à travers la chambre pour bloquer la bicouche. Essayez de vous assurer qu'il n'y a pas de bulles dans la chambre d'écoulement.
- Injecter 100 ul de streptavidine à une concentration de 333 ng / ml dans chaque couloir. Incuber pendant 10-15 min à température ambiante. Par la suite, laver en exécutant 3 ml de HBS / 1% de HSA par chaque voie pour éliminer l'excès de streptavidine.
- Ajouter 100 pi de biotinylé marqué par fluorescence anti-CD16 tels que Alexa Fluor 568 à la concentration de protéines préalablement déterminée pour être plus efficace dans la section 3. Incuber dans l'obscurité pendant 20 à 30 min. Laver ensuite en exécutant 3 ml de HBS / 1% de HSA travers chaque voie.
- Débit 100 pi de D-biotine à une concentration de 25 nM à travers la chambre afin de lier tout excès de streptavidine et ainsi éliminer la possibilité d'une liaison non-spécifique de streptavidin aux cellules.
- Compter les cellules NK et les remettre en suspension à une concentration de 500 000 / ml dans du HBS / 1% de HSA.
- Tout en faisant tourner vers le bas des cellules, laver la D-biotine hors de la chambre avec un autre 3 ml de HBS / 1% de HSA par voie.
- Vérifiez la mobilité des ligands sur le SLB par la récupération de fluorescence après photoblanchiment (FRAP) sur une fluorescence totale interne de réflexion (FRBR) ou microscopie confocale avant d'ajouter les cellules NK.
- Une fois que les cellules ont fini de filage et ont été remises en suspension à la concentration désirée, ajouter 100 ul de chaque couloir.
- Placer la chambre dans un incubateur à CO2 à 37 ° de 5% pour 30 à 60 min.
- Après cette période d'incubation, fixer les cellules avec du paraformaldehyde à 4% à température ambiante pendant 10 à 20 min. Laver en exécutant 3 ml de PBS par chaque voie pour supprimer le paraformaldéhyde.
- Ajouter 400 ul de tampon de blocage (5% de sérum d'âne normal et de 0,2% Tritron X-100 dans du PBS). Incuber à température ambiante pendant 30 min.
- Stain F-actine et la perforine par l'annonceurDing 200 pi de dilution phalloïdine marquée par fluorescence (1 unité / ml phalloïdine marquée) et marqué par fluorescence anti-perforine mAb (500 ml mAb ng / anti-perforine). Incuber à température ambiante pendant 1 heure.
- Laver en exécutant 3 ml de PBS. La chambre est prête pour la formation d'image.
6. L'imagerie du NK Synapse sur les lipides bicouche utilisant STED
- Mettez tous les modules matériels nécessaires.
- Démarrez le logiciel d'analyse d'image. Activer la numérisation de résonance et modules STED. Après avoir effectué ces sélections, attendez environ 3-5 min pour le logiciel pour lancer.
- Cliquez sur l'onglet "Configuration" en haut de l'écran.
- Sélectionnez "Laser Config" puis allumez la lumière blanche et STED 592 lasers nm.
- Choisissez l'objectif 100x, et aligner le faisceau laser d'excitation avec le 592 nm laser d'épuisement.
- Sélectionnez le module "Laser Config", éteignez l'épuisement 592laser, et son tour sur le 660 nm laser d'épuisement.
- Placer la lame sur la scène, sur la lentille. Apportez les cellules liées sur la région de bicouche délimitée au point en utilisant la lampe de lumière blanche et les oculaires.
- Retournez à l'onglet "Acquisition", directement à la droite de l'onglet "Configuration".
- Cliquez sur l'onglet «Basculer vers Whitelight", puis tournez ce module sur et faites glisser la ligne de laser d'excitation à la longueur d'onde appropriée.
- Sélectionnez le détecteur souhaité dans la liste de ceux disponibles, puis réglez la plage de détection pour englober la gamme de longueurs d'onde appropriée.
NOTE: NE JAMAIS mettre la gamme de détection directement sous le faisceau d'excitation. - Cliquez sur le bouton "Seqential" dans la barre d'outils à gauche "Acquérir" pour faire apparaître le dialogue de numérisation séquentielle dans le bas de la barre d'outils de gauche. Cela permet à l'utilisateur d'ajouter des séquences multiples, chaqueavec un faisceau d'excitation différentes pour une couleur différente. Cliquez sur "Entre Frames", puis régler la fréquence d'excitation, détecteur, et la gamme de détection pour chaque couleur supplémentaire comme dans les étapes 6,9 et 6,10.
- Une fois que tous les paramètres sont optimisés, cliquez sur "Démarrer" pour commencer le processus d'acquisition.
- Appliquer le logiciel de déconvolution libre (Huygens) en utilisant un cadre conçu pour STED déconvolution, comme décrit précédemment 13.
Résultats
La figure 1 montre le résultat de la densité de l'anticorps sur la bicouche lipidique. Le principe est d'utiliser des billes standard pour rendre la courbe standard du MESF par rapport IMF par cytométrie de flux (A). Le MFI de la série d'échantillons a été converti en MESF en utilisant la courbe standard. La densité d'anticorps sur la bicouche lipidique est linéairement corrélée avec la concentration d'anticorps (B). Figure 2 montrent la couleur triple STED l'image de NK synapse sur verre-support plan bicouche lipidique. L'anticorps anti-CD16 sur la bicouche lipidique se accumule, provoquant la formation de F-actine et de la polarisation et de la pénétration à travers les mailles perforine F-actine à partir du panneau central de synapse immunologique des cellules NK. En utilisant cette approche combinée, on peut observer les microamas proprement marquées par fluorescence de anti-CD16 dans le SLB, qui reflète directement le regroupement de CD16 sur la cellule NK. Par rapport à l'image confocale classique, la structure du CD16 central cluster est plus facilement discerné dans l'image la STED en raison de la fluorescence ambiante appauvri. En outre, l'ultrastructure du cytosquelette d'actine est vu avec une résolution améliorée de manière significative. Conformément aux observations antérieures 16,17, les granules lytiques perforine positif sont considérés positionné au-dessus des régions de faible densité F-actine dans l'image la STED, un détail crucial qui est la plupart du temps perdu dans l'image confocale.
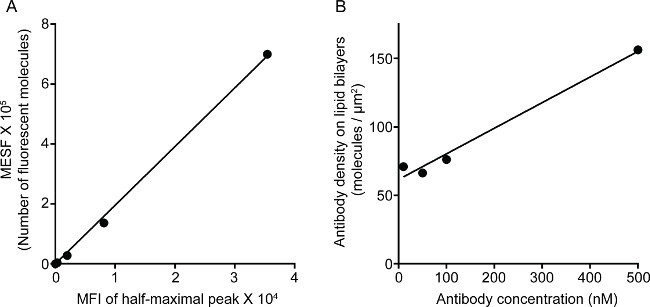
Figure 1. Densité d'anticorps 3G8 sur bicouche lipidique. (A) de corrélation linéaire entre MESF et IMF pour la série standard. (B) corrélation linéaire entre la densité des protéines et de la concentration pour la série protéine échantillon de dilution, indiquant le nombre de monomères marquées par fluorescence protéines par unité de surface en fonction de la concentration croissante de Si revêtus de lipidesperles de lica.
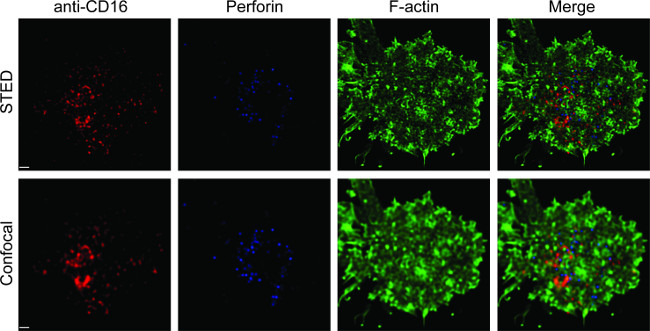
Figure 2. STED imagerie de NK synapse sur plan bicouche lipidique. Cellules NK primaire ont été stimulées sur le SLB contenant biotinylé marqué par fluorescence anti-CD16 (rouge), fixées, perméabilisées, puis colorées avec la phalloïdine (bleu) et anti-F-actine (vert). Une cellule individuelle a été imagé sous le paramètre confocal normale, puis le réglage STED. Images confocale et STED ont été déconvolution en utilisant un logiciel Huygens. Barre d'échelle, une um. Cliquez ici pour une version plus grande de cette figure.
Discussion
La nouveauté de l'étude est qu'il combine la technique SLB avec STED pour étudier synapses des cellules NK. Des études antérieures ont imager la bicouche lipidique avec TIRF pour étudier des cellules T 8 la formation des synapses et la traite molécule de signalisation sur la membrane plasmique 6. D'autres ont décrit STED imagerie des synapses des cellules NK en utilisant des lames de verre recouvertes d'anticorps 13,14. Procédé hybride décrit ici en outre se appuie sur ces efforts par imagerie de la synapse des cellules NK avec la pureté améliorée conférée par imagerie super-résolution sur la surface de la bicouche lipidique, qui meilleurs modèles dynamique de la surface d'une APC.
Bien que des membranes artificielles SLBS sont dépourvues de cytosquelette, les radeaux lipidiques et d'autres ligands que les cellules cibles réelles ou des APC possèdent, cette technique peut récapituler caractéristiques importantes telles que la mobilité et de l'orientation de ligands. Cela permet au système SLB pour servir une approche réductionniste à disséquer til contribution des récepteurs et des ligands individuels à la formation de l'IS et de la dynamique des IS. La caractéristique la plus importante de SLBS est que les chercheurs peuvent combiner cette technique avec des approches d'imagerie à haute résolution, comme la microscopie confocale et la FRBR. L'introduction de la microscopie STED augmente encore cet avantage, fournissant un aperçu sans précédent en est la recherche et de ses applications cliniques.
Une critique potentiel de ce système est que le SLB ne reproduit pas de manière adéquate la surface d'une APC complexe, donnant ainsi lieu à des caractéristiques anatomiques potentiellement non physiologiques dans les synapses qui en résultent. Se il est vrai que le répertoire limité de molécules de surface sur le SLB ne récapituler pas entièrement la surface hétérogène peuplé d'une APC, cette limite peut également être avantageuse en ce qu'elle permet aux chercheurs de déterminer l'influence des interactions des récepteurs et ligands individuels sur la formation des synapses .
Tvoici plusieurs étapes cruciales dans le processus. Parmi les plus critiques, ce est que l'oxydation des liposomes être empêchée par l'utilisation de l'argon constamment à déplacer l'oxygène dans le tube et une solution, par exemple dans les étapes 2,6, 1,10, et 2,11. L'oxydation des lipides se traduira par une diminution de la mobilité des lipides, ce qui empêche ainsi la capacité des protéines de surface de se déplacer librement et de participer à la structuration synaptique. De même, il est également crucial d'enlever tout le chloroforme dans le liposome par lyophilisation (étape 1.2). Dans la détermination de la densité de la protéine dans la bicouche lipidique, il est d'une importance de premier disperser les perles de silicium en une suspension homogène exempt de groupes. Si nécessaire, la sonication de billes peut être appliquée. Dans le montage de la SLB, les premières étapes (05.01 à 05.08), dans lequel les lamelles sont nettoyés, les gouttes sont placées, et lamelle est apposée sont vitales. Une erreur dans l'un de ces peut nécessiter de commencer l'expérience plus (depuis le début de l'article 5). Pour cette raison, il estbonnes pratiques pour nettoyer plus de lamelles sera nécessaire pour gagner du temps en cas d'accident.
Non-regroupement est la question la plus fréquente lorsque l'on travaille avec ce système. Si, lors de la visualisation des cellules dans l'étape finale, on ne parvient pas à trouver des synapses fluorescentes, il ya quelques étapes qui peuvent être prises. Une autre tache pour le récepteur de surface cellulaire apparenté peut être ajouté à la chambre afin de vérifier que la cellule n'a pas formé une synapse avec la bicouche, Alors que les cellules peuvent adhérer de manière non spécifique à la surface de la lamelle de verre ou bicouche, les protéines de surface synaptique-impliquées devraient apparaît comme grappes distinctes au niveau du plan de l'interface cellule-bicouche, tandis que les protéines de surface non engagés devraient apparaître comme coloration diffuse autour du périmètre de la cellule. Si cette méthode échoue, il faut vérifier leurs cellules par cytométrie de flux pour assurer que le marqueur particulier une espère étudier est exprimée en abondance suffisante sur la surface de la cellule. Certains prote de surfaceins sont connus pour être régulé à la baisse plus long terme dans la culture vivo.
Bien que ce protocole détails spécifiquement comment NK visualiser la formation des synapses des cellules, le système SLB peut être utilisée pour étudier la formation des synapses dans toute immunocytes imaginable simplement par la substitution du ligand dans l'étape primaire 5,11. Plusieurs ligands peuvent également être ajoutés simultanément. Un devez également pas utiliser un système streptavidine-biotine pour faire adhérer les protéines de surface dans la bicouche. Nickel-NTA: interactions histidine sont également viable. Toutefois, en raison de la résistance élevée et la spécificité de la streptavidine: interaction biotine, notre laboratoire préfère ce système. On peut également faire varier la concentration de cellules ajoutées sur la bicouche de la densité prédéterminée à l'étape 5.13, ainsi que la durée de la période d'incubation subséquente afin d'observer les synapses à différents stades de maturation. Cela peut même être fait en direct, bien que cela exclut évidemment la possibilité de visualiser str intracellulaireuctures (sauf se ils sont déjà étiquetés avec une étiquette fluorescente fusionnée; notre laboratoire utilise quelques telles lignées cellulaires modifiées). En raison du degré élevé de personnalisation possible dans ce protocole, on peut utiliser la technique SLB de base, ainsi que l'imagerie STED, pour répondre à un éventail incroyable diversité de questions en immunologie, la biologie cellulaire et la biochimie, y compris la dynamique de lipides de base 15, la formation des synapses 16, 17 signalisation intracellulaire, et la cellule tumorale 18 métastases.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
matériels
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
Références
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon