Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Système de Gel concentrique à étudier le rôle biophysique de Matrix microenvironnement sur 3D migration cellulaire
Dans cet article
Résumé
Les propriétés mécaniques et la microstructure de la matrice extracellulaire affectent fortement la migration de cellules 3D. Une méthode in vitro pour étudier le comportement de migration cellulaire spatio-temporelle dans des environnements biophysique variables, à des niveaux de cellules individuelles à la fois la population et, est décrit.
Résumé
La capacité des cellules à migrer est crucial dans une grande variété de fonctions cellulaires long de la vie de développement embryonnaire et la cicatrisation des plaies de la tumeur et les métastases du cancer. Malgré les efforts de recherche intenses, les principes biochimiques et biophysiques de base de la migration des cellules ne sont pas encore entièrement compris, en particulier dans les micro-environnements (3D) en trois dimensions physiologiquement pertinents. Ici, nous décrivons un essai in vitro destiné à permettre l'examen quantitatif de 3D comportements de migration cellulaire. Le procédé exploite la capacité et mechanosensing propension de la cellule à migrer dans la matrice extracellulaire précédemment inoccupé (ECM). Nous utilisons l'invasion des cellules cancéreuses du sein hautement invasives, MDA-MB-231, dans des gels de collagène en tant que système modèle. La propagation de la population de cellules et de la dynamique de migration des cellules individuelles pendant des semaines de la culture peuvent être surveillés en utilisant l'imagerie des cellules vivantes et analysées pour extraire des données spatio-temporellement résolues. En outre, La méthode est facilement adaptable pour diverses matrices extracellulaires, offrant ainsi un moyen simple mais puissant pour étudier le rôle de facteurs biophysiques dans le microenvironnement sur la migration cellulaire.
Introduction
Migration de cellules joue un rôle clé dans diverses réponses physiologiques tels que le développement embryonnaire, l'hémostase et la réponse immunitaire ainsi que dans les processus pathologiques tels que les maladies vasculaires, l'inflammation et le cancer 1. Disséquer les facteurs biochimiques et biophysiques sous-jacentes migration cellulaire est donc fondamentalement important non seulement de comprendre les principes de base des fonctions cellulaires, mais aussi pour faire avancer diverses applications biomédicales, comme dans l'ingénierie tissulaire, anti-métastases et le développement médicament anti-inflammatoire. Depuis l'observation in vivo est techniquement difficile, beaucoup d'efforts ont été concentrés sur la récapitulation in vitro de migration cellulaire.
Les méthodes in vitro pour étudier la migration cellulaire ont été largement conçu pour des essais sur deux (2D) des surfaces tridimensionnelles, notamment la rayure ou de cicatrisation dosage 2. Ces essais offrent dispositif expérimental simple, facile bétailimagerie cellulaire, et de fournir des indications utiles sur divers mécanismes biochimiques sous-jacents migration cellulaire. Cependant, ces essais ne représentent pas la matrice (ECM), l'architecture et le remodelage extracellulaire, qui sont des aspects critiques dans la compréhension de la migration in vivo. Récemment, il a été de plus en plus apprécié qu'un modèle de culture 3D, souvent dans des matrices à base de collagène 3, fournit une plate-forme qui ressemble davantage à la situation in vivo. En effet, les cellules présentent dynamiques migratoires qui sont distincts de ceux sur les surfaces 2D, en particulier en raison de la dimension différente de l'environnement 4. En outre, les propriétés biophysiques et mécaniques de la matrice de sensibilité affectent la migration des cellules 5, notamment dans le contexte de l'invasion des cellules tumorales 6.
Ici, nous présentons une méthode pour étudier 3D comportement de migration cellulaire dans ECM avec des propriétés biophysiques qui peuvent être facilement varié avec des conditions de préparation. Les cellules sontensemencées dans un "gel interne» et sont autorisés à se échapper dans et envahir le "gel externe" initialement acellulaire. La méthode repose sur la capacité de reconnaître la présence de, et la propension de la cellule à migrer dans, les régions exemptes de cellules dans le gel externe, qui est étroitement liée à la cellule mechanosensing 7. Dans cette étude, nous employons des réseaux de collagène que les ECM envahies par les cellules du cancer du sein très envahissante, MD-MBA-231. Les propriétés mécaniques et la microstructure à la fois des gels intérieure et extérieure peuvent être réglés 8 et 9 caractérisé pour obtenir des conditions physiologiquement pertinentes. La reconstruction et l'analyse des pistes cellulaires permettent Examen quantitative détaillée du comportement de migration spatio-temporelle, tant au niveau de la population et le niveau de la cellule individuelle. Fait important, le programme d'installation du système de gel concentrique vivo imite la topologie du tissu en face de la migration des cellules, en particulier d'invasion des cellules cancéreuses, offrant ainsi des informations importantes endes mécanismes physiques de la migration cellulaire et la métastase.
Protocole
1. Cellule récolte
- Obtenir MD-MBA-231 cellules provenant de la 37 ° C, 5% de CO 2 incubateur. Détacher les cellules de tissus plaque de culture à l'aide de 0,5% de solution de trypsine-EDTA. Utiliser 1 ml de solution de trypsine-EDTA pour la cellule en culture dans un flacon T25.
- cellules de granules dans un tube de 15 ml conique par centrifugation à 200 g pendant 4 min, aspirer le surnageant et remettre les cellules dans 5 ml de milieu de culture.
- Compter densité cellulaire, ρ, en utilisant un hémocytomètre.
Remarque: Pour préparer le gel interne cellule graines, la suspension cellulaire sera par la suite être dilué 10 fois pour atteindre la densité finale de l'ensemencement des cellules. Par conséquent, 10 × concentré suspension de cellules est nécessaire. - Calculer le volume de milieu nécessaire pour obtenir une concentration de 10 × portable:
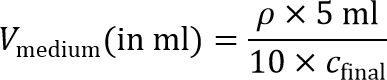
Remarque: Une densité finale de l'ensemencement des cellules, c finale, d'environ 215; 10 6 cellules / ml est recommandée pour les MD-MBA-231 cellules et sont utilisées dans ce protocole. Autres densités de semis peuvent également être explorées pour d'autres types de cellules. - Pellet cellules une plus de temps dans un tube de 15 ml conique par centrifugation à 200 g pendant 4 min, et aspirer le surnageant.
- Resuspendre les cellules dans la quantité requise (milieu de V calculées à l'étape 1.3) de milieu de culture cellulaire exempt de sérum soigneusement afin de minimiser l'agglutination des cellules.
Remarque: Le rouge de phénol est auto-fluorescent, et peut interférer avec l'imagerie de fluorescence / réflectance. Utilisation d'un milieu dépourvu de rouge de phénol peut être envisagée pour obtenir la meilleure qualité d'image.
2. Préparation des solutions de collagène
- Obtenir la solution mère de collagène, tampon de 10 × PBS, Milli-Q H 2 O, NaOH 0,1 M, et plusieurs microtubes. Conservez tous sur la glace pour empêcher la polymérisation prématurée de collagène, et de maintenir l'état stérile.
- Equilibrer une verrerie stérileplat de fond en chauffant dans la 37 ° C incubateur.
Remarque: Tous les volumes de ce protocole ont été optimisés pour un plat à fond de verre de 12 mm ainsi. Si un autre type de plat est utilisé, ajuster les volumes en conséquence. - Calculer le volume requis nécessaire pour préparer 50 pi de 2,4 mg / ml de solution de collagène pour le gel interne (solution I) en fonction de la concentration du collagène de stock.
Note: D'autres concentrations de collagène pour le gel interne peut également être utilisé. - Dans un environnement stérile (typiquement une hotte de biosécurité), ajouter lentement 5 ul de 10 x tampon PBS à la quantité nécessaire de solution de collagène de stock (calculée à l'étape 2.3) remuer doucement. Prenez soin d'éviter la formation de bulles d'air.
- Ajuster le pH du mélange à 7,4 en utilisant du NaOH 0,1 M à l'aide pH-mètre étalonné. A titre indicatif, environ 5 pi utiliser pour amener le pH proche de 7,4 (le montant varie en fonction de la concentration en stock et pH).
Remarque: Notez que les volumes impliqués dans ceétape est trop petite pour l'utilisation de pH-mètre standard. Utilisez l'une des astuces suivantes:- Préparer des solutions de collagène pour des échantillons multiples. Ajuster le pH en vrac utilisant pH-mètre standard et distribuer les solutions de collagène dans les échantillons.
- En variante, ajuster le pH d'une solution de collagène en grand volume (i. E., Volume qui permettent l'utilisation de pH-mètre standard). Notez la quantité de NaOH nécessaire pour amener le pH au pH final. Réduire les volumes et utiliser la quantité appropriée de NaOH pour l'expérience. Confirmer la valeur du pH en utilisant du papier tournesol.
- Sinon, utilisez un micro électrode de pH pour ajuster avec plus de précision le pH de petites quantités.
- Porter la solution à un volume de 45 ul en utilisant H 2 O. Effectuez toutes les étapes sur la glace pour empêcher la polymérisation prématurée de collagène.
3. Formation de Concentric Gel Culture
- Sortez le plat à fond de verre préchauffé (voir l'étape 2.2) à partir de ee incubateur.
- Ajouter 5 ul de la suspension cellulaire concentrée 10 x (préparé à l'étape 1.5) de solution I. Remettre en suspension soigneusement. Prenez soin d'éviter la formation de bulles d'air. Le mélange a maintenant un volume de 50 ul et contient la concentration finale de collagène (2,4 mg / ml) et la densité cellulaire (c finale = 2 × 10 6 cellules / ml).
- Ajouter 20 ul de la solution contenant les cellules I lentement vers le centre du puits, de manière à former une gouttelette en forme de dôme (figure 1A). Prenez soin d'éviter la formation de bulles à cette étape. Si une bulle se forme, avec soin, mais rapidement essayer de rompre soit ou sucer à l'aide d'une pipette. Placez délicatement le plat dans l'incubateur de laisser le gel interne polymériser pendant 45 min.
- Préparer la solution O (pour le gel de collagène extérieur, acellulaire) environ 15 min avant la fin de cette étape d'incubation.
Remarque: La condition de gel extérieure peut varier en termes de concentration de collagène et la polymérisation à pHobtenir des réseaux avec 10 différentes microstructures. Dans ce protocole, se concentrer sur un 1,5 - / gel de collagène ml 4,0 mg polymérisé à un pH de 7,4.- Basé sur la concentration de collagène boursier, calculer le volume requis nécessaire pour préparer 200 pi de collagène solution O à la concentration finale.
- Ajouter 20 ul de 10 x tampon PBS lentement à la quantité requise de solution de collagène de stock (calculée à l'étape 3.4) remuer doucement. Ajuster le pH du mélange à la pH final en utilisant du NaOH 0,1 M à l'utilisation de pH-mètre étalonné. Voir la note à l'étape 2.5 concernant l'ajustement du pH.
- Porter la solution à un volume final de 200 ul en utilisant H 2 O. Effectuez toutes les étapes sur la glace pour empêcher la polymérisation prématurée de collagène.
- Sortez le plat de l'incubateur après 45 min polymérisation du gel interne (voir l'étape 3.3). Ajouter doucement 180 ul de solution S sur le dessus du gel interne, de sorte que la solution couvre complètement la intérieuregélifier et remplit le puits (figure 1B).
- Effectuez attentivement cette étape sans agitation de la solution, qui peut conduire à des orientations de fibres non-uniformes dans le gel extérieure. Prenez soin d'éviter de toucher le gel intérieure avec une pointe de pipette, et d'éviter la formation de bulles ou de poches d'air. Si une bulle se forme, avec soin, mais rapidement essayer de rompre soit ou sucer à l'aide d'une pipette. Placez délicatement le plat dans l'incubateur de laisser le polymériser de gel extérieure.
- Sortez le plat de l'incubateur après 45 min de polymérisation. Le gel doit être déjà assez solidifié à ce point, mais il peut encore se détacher de la surface inférieure se il est manipulé environ.
- Verser doucement 2 ml de réchauffé milieu de culture de cellules à l'antenne (figure 1C). Assurez-vous que le gel est complètement immergé dans le milieu. Actualiser le milieu tous les 2-3 jours pendant la durée de la culture.
4. Imagerie des cellules vivantes
- Effectuer imagerie utilisant un microscope confocal inversé équipé capacité d'imagerie live-cellulaire à long terme. Inclure un haut-chambre d'incubation avec une température (37 ° C) et CO 2 (5%) de contrôle. Allumez le microscope et réchauffer la scène au moins une heure avant de commencer l'expérience.
Remarque: Utilisez objectif à longue distance de travail pour optimiser l'observation et la localisation des cellules dans les gels 3D. - Incuber le gel dans un milieu contenant 5 ul de colorant fluorescent d'analyse de cellule pendant 30 min pour permettre une localisation précise des cellules dans le système 3D. Par la suite, retirer le colorant non lié par lavage trois fois avec 1 × PBS. Ensuite, ajouter du milieu de culture de cellules à l'antenne.
- Sortez le plat de l'incubateur et le placer sur la platine du microscope (figure 1D).
Remarque: l'imagerie cellulaire Live peut commencer, en principe, juste après la polymérisation du gel extérieure. Toutefois, à ce stade, les cellules in Le gel internes ne ont pas encore se propager. Pour examiner la migration des premières cellules qui ont envahi le gel externe, l'imagerie des cellules vivantes peut commencer à 24 heures (en fonction du type de cellule) après le début de la culture. A titre indicatif, environ 12 à 14 jours de culture sont nécessaires pour la plupart des cellules dans le gel intérieur pour pénétrer dans le gel extérieure. - Sélectionner les volumes de vue (de VoV) dans les régions dans le gel externe entourant le gel interne. Après 24 heures d'incubation, la population de cellules se sont propagées, traversé l'interface entre les gels intérieures et extérieures, et a commencé à envahir le gel extérieure.
- Pour la VoV'S, inclure les régions de gel immédiatement à côté de l'interface de gel, les régions intermédiaires, et les régions à proximité de la périphérie extérieure du gel 7. Exclure des régions plus proches de 50 um à partir des surfaces inférieure et latérales, ainsi que par le haut du gel, pour éviter d'éventuels effets de bord. Chaque VoV mesure typiquement 647 × 647 × 100 um 3 (en x, y et z, respectivement), avec intervalle de 5 um dans le z -stack.
- Assurer modes d'imagerie, les canaux / filtres, temps d'exposition, et des résolutions d'images sont correctement sélectionnés. Pour l'imagerie sans étiquette du réseau de collagène, utiliser la microscopie confocale de réflectance simultanément pendant le time-lapse imagerie des cellules vivantes.
- Prenez des exemples d'images, tracer les histogrammes d'intensité, et ajuster les gains et les décalages pour observer un signal suffisamment et éviter la saturation en se assurant que l'histogramme se situe entre zéro et l'intensité maximale. Ne pas modifier ces paramètres plus pendant toute la durée de l'expérience.
- Prenez des photos de time-lapse de la VOV de sélectionnés, avec un intervalle de temps, Δ t, de 10 min pour 8 heures (ou plus si nécessaire).
5. Suivi cellulaire et l'analyse des données
- Effectuer l'image quantitative de post-traitement des images -stack z en utilisant appropriée.Boîte te logiciel de traitement d'image.
- Segmenter les images time-lapse pour sélectionner automatiquement les positions de cellules en 3D dans (x, y, z, t).
- Pour chaque image, vérifier manuellement la précision de la localisation et de supprimer des faux positifs dus à des débris cellulaires et des saillies cellulaires qui peuvent avoir été pris pour cellules. Éliminer les cellules prolifératives de l'analyse et des cellules qui se chevauchent ou connectés divisés en objets distincts.
- Générer des pistes en 3D de cellules laps de temps à partir des coordonnées de la cellule (x, y, z, t) obtenue à l'étape précédente en reliant l'emplacement de chaque cellule dans la séquence de temps.
- Éliminer le bruit aléatoire et le système en supprimant les pistes plus courtes que la longueur seuil de piste (généralement de 20 min).
- Corriger la dérive de l'échantillon en soustrayant les déplacements nets globaux des pistes si nécessaire.
- Calculer le déplacement de la cellule,iles / ftp_upload / 52735 / 52735eq2.jpg "width =" 80 "/>, et la distance de la migration cellulaire,
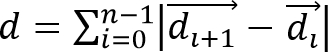 , À partir des trajectoires de cellules observées, où est un vecteur représentant la position 3D d'une cellule à une fois et est le nombre total de points dans le temps.
, À partir des trajectoires de cellules observées, où est un vecteur représentant la position 3D d'une cellule à une fois et est le nombre total de points dans le temps. - Calculer la vitesse de la cellule en tant que S = d / (n • Δ t), où Δ t est l'intervalle de temps entre les trames. Calculer la directionnalité de la migration cellulaire (ou la persistance) en utilisant P = Dd / j. Cette simple mesure de la persistance implique que pour P = 0, le déplacement net est nul et P = 1 la trajectoire est une ligne directionnelle droite.
Résultats
L'analyse sur gel concentrique présenté ici a été réalisée en utilisant des cellules de cancer du sein hautement invasives, MDA-MB-231, avec 2,4 mg / ml de gel de collagène interne et une densité d'ensemencement de cellules de = 2 × 10 6 cellules / ml, par exemple. Comme le montre la figure 2, généralement après quelques jours de culture, les cellules ont violé l'interface de gel interne-externe et ont commencé à envahir le gel extérieure. La population de cellules...
Discussion
In this protocol we describe an in vitro assay to study the 3D migrational behavior of cells in matrix environments that topologically resemble ECMs encountered in vivo. There are three main strengths of this assay as compared to other currently available methods. First, this assay allows one to simultaneously examine the cell migration mechanisms at both population level and individual cell level. This opens up possibilities of studying collective cell migration13, which has to date been lar...
Déclarations de divulgation
Les auteurs ne ont rien à divulguer.
Remerciements
Les auteurs remercient W. Sun et K. Jansen pour les discussions critiques, et reconnaissent le soutien du laboratoire de biomécanique Nano à l'Université nationale de Singapour. NAK reconnaît support par une bourse Marie Curie IIF.
matériels
| Name | Company | Catalog Number | Comments |
| Cell culture incubator | Fisher Scientific Pte Ltd | Model: 371, S/No 318854-6055 | |
| Confocal microscope | Nikon A1R | Inverted confocal laser scanning microscope equipped with incubator chamber | |
| Dulbecco's Modified Eagle's Medium (DMEM) | Life Technologies | 11965-092 | |
| Fetal Bovine Serum (FBS) | Life Technologies | 10082-147 | |
| Fluorescent CellTracker dye CMTMR | Life Technologies | C2927 | |
| Glass-bottom dish | IWAKI Cell Biology | 3931-035 | 35 mm diameter dish with 12 mm diameter glass-bottom well |
| Hemocytometer | iN CYTO | DHC-N01 (Neubauer Improved) | |
| Microprocessor pH meter | Hanna Instruments | pH 211 | |
| Nutragen Collagen | Advanced BioMatrix | #5010-D | Acid-solubilized bovine collagen type I (stock pH ~ 2) |
| Objective lens | Nikon | CFI Super Plan Fluor ELWD ADM 20XC, W.D. 8.2-6.9mm, NA 0.45. | |
| Penicillin-Streptomycin | Life Technologies | 15140-122 | |
| pH meter | Sartorius | S/No 29153352 | Basic pH Meter PB-11 |
| Trypsin-EDTA | Life Technologies | 15400-054 |
Références
- Horwitz, R., Webb, D. Cell migration. Curr Biol. 13 (19), R756-R759 (2003).
- Liang, C. C., Park, A. Y., Guan, J. L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nat. Protoc. 2 (2), 329-333 (2007).
- Provenzano, P. P., Eliceiri, K. W., Inman, D. R., Keely, P. J. Engineering three-dimensional collagen matrices to provide contact guidance during 3D cell migration. Curr. Prot. Cell Biol. 10, 10-17 (2010).
- Friedl, P., Sahai, E., Weiss, S., Yamada, K. M. New dimensions in cell migration. Nat. Rev. Mol. Cell Biol. 13 (11), 743-747 (2012).
- Grinnell, F., Petroll, W. M. Cell motility and mechanics in three-dimensional collagen matrices. Annu. Rev. Cell. Dev. Biol. 26, 335-361 (2010).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nat. Rev. Cancer. 11 (7), 512-522 (2011).
- Sun, W., Kurniawan, N. A., Kumar, A. P., Rajagopalan, R., Lim, C. T. Effects of migrating cell-induced matrix reorganization on 3D cancer cell migration. Cell. Mol. Bioeng. 7 (2), 205-217 (2014).
- Achilli, M., Mantovani, D. Tailoring mechanical properties of collagen-based scaffolds for vascular tissue engineering: the effects of pH, temperature and ionic strength on gelation. Polymers. 2 (4), 664-680 (2010).
- Kurniawan, N. A., Wong, L. H., Rajagopalan, R. Early stiffening and softening of collagen: interplay of deformation mechanisms in biopolymer networks. Biomacromolecules. 13 (3), 691-698 (2012).
- Sun, W., Lim, C. T., Kurniawan, N. A. Mechanistic adaptability of cancer cells strongly affects anti-migratory drug efficacy. J. R. Soc. Interface. 11 (99), 20140638 (2014).
- Guzman, A., Ziperstein, M. J., Kaufman, L. J. The effect of fibrillar matrix architecture on tumor cell invasion of physically challenging environments. Biomaterials. 35 (25), 6954-6963 (2014).
- Wolf, K., et al. Physical limits of cell migration: control by ECM space and nuclear deformation and tuning by proteolysis and traction force. J. Cell Biol. 201 (7), 1069-1084 (2013).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nat. Rev. Mol. Cell Biol. 10 (7), 445-457 (2009).
- Vedula, S. R. K., Ravasio, A., Lim, C. T., Ladoux, B. Collective cell migration: a mechanistic perspective. Physiology. 28 (6), 370-379 (2013).
- Petrie, R. J., Doyle, A. D., Yamada, K. M. Random versus directionally persistent cell migration. Nat. Rev. Mol. Cell Biol. 10 (8), 538-549 (2009).
- Miron-Mendoza, M., Seemann, J., Grinnell, F. The differential regulation of cell motile activity through matrix stiffness and porosity in three dimensional collagen matrices. Biomaterials. 31 (25), 6425-6435 (2010).
- Mouw, J. K., et al. Tissue mechanics modulate microRNA-dependent PTEN expression to regulate malignant progression. Nat. Med. 20 (4), 360-367 (2014).
- Wolf, K., et al. Collagen-based cell migration models in vitro and in vivo. Semin. Cell Dev. Biol. 20 (8), 931-941 (2009).
- Wong, L. H., Kurniawan, N. A., Too, H. -. P., Rajagopalan, R. Spatially resolved microrheology of heterogeneous biopolymer hydrogels using covalently bound microspheres. Biomech. Model. Mechanobiol. 13 (4), 839-849 (2014).
- Gupton, S. L., Waterman-Storer, C. M. Spatiotemporal feedback between actomyosin and focal-adhesion systems optimizes rapid cell migration. Cell. 125 (7), 1361-1374 (2006).
- Provenzano, P. P., Inman, D. R., Eliceiri, K. W., Trier, S. M., Keely, P. J. Contact guidance mediated three-dimensional cell migration is regulated by Rho/ROCK-dependent matrix reorganization. Biophys. J. 95 (11), 5374-5384 (2008).
- Wolf, K., et al. Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion. Nat. Cell Biol. 9 (8), 893-904 (2007).
- Jansen, K. A., Bacabac, R. G., Piechocka, I. K., Koenderink, G. H. Cells actively stiffen fibrin networks by generating contractile stress. Biophys. J. 105 (10), 2240-2251 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon