Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Microfluidique génipine dépôt Technique de la culture avancée de microélectrodes vasculaires musculaires Thin Films
Dans cet article
Résumé
We present a method for microfluidic deposition of patterned genipin and fibronectin on PDMS substrates, allowing extended viability of vascular smooth muscle cell-dense tissues. This tissue fabrication method is combined with previous vascular muscular thin film technology to measure vascular contractility over disease-relevant time courses.
Résumé
The chronic nature of vascular disease progression requires the development of experimental techniques that simulate physiologic and pathologic vascular behaviors on disease-relevant time scales. Previously, microcontact printing has been used to fabricate two-dimensional functional arterial mimics through patterning of extracellular matrix protein as guidance cues for tissue organization. Vascular muscular thin films utilized these mimics to assess functional contractility. However, the microcontact printing fabrication technique used typically incorporates hydrophobic PDMS substrates. As the tissue turns over the underlying extracellular matrix, new proteins must undergo a conformational change or denaturing in order to expose hydrophobic amino acid residues to the hydrophobic PDMS surfaces for attachment, resulting in altered matrix protein bioactivity, delamination, and death of the tissues.
Here, we present a microfluidic deposition technique for patterning of the crosslinker compound genipin. Genipin serves as an intermediary between patterned tissues and PDMS substrates, allowing cells to deposit newly-synthesized extracellular matrix protein onto a more hydrophilic surface and remain attached to the PDMS substrates. We also show that extracellular matrix proteins can be patterned directly onto deposited genipin, allowing dictation of engineered tissue structure. Tissues fabricated with this technique show high fidelity in both structural alignment and contractile function of vascular smooth muscle tissue in a vascular muscular thin film model. This technique can be extended using other cell types and provides the framework for future study of chronic tissue- and organ-level functionality.
Introduction
Les maladies vasculaires, tels que le vasospasme cérébral 1,2, 3 hypertension, l'athérosclérose et 4, se développent lentement, sont généralement de nature chronique, et impliquent dysfonctionnel génération de force par les cellules musculaires lisses vasculaires (CMLV). Nous visons à étudier ces dysfonctionnements vasculaires progresse lentement à l'aide de méthodes in vitro avec un contrôle plus fin des conditions expérimentales que les modèles in vivo. Films musculaires vasculaires Nous avons déjà développés minces (vMTFs) pour mesurer la contractilité fonctionnelle in vitro conçus tissus cardiovasculaires 5, mais cette méthode a été limitée à des études à relativement court terme. Ici, nous présentons une technique de modification du substrat qui élargit notre technique vMTF précédente pour les mesures à long terme.
Bien que l'endothélium est également critique en fonction globale vasculaire, lamelles artérielle conçue fournir un système de modèle utile pour évaluer les changements dans vasculairecontractilité pendant la progression de la maladie. Pour concevoir un modèle de tissu de maladie vasculaire fonctionnel, à la fois la structure et la fonction de la lamelle artériel, l'appareil contractile de base de la cuve, doit être récapitulé avec une grande fidélité. Arterial lamelles sont concentriques feuilles de CMLV contractiles séparées par des feuilles de 6 élastine, la circonférence-alignés. L'impression par microcontact de la matrice extracellulaire (MEC) protéines sur polydiméthylsiloxane (PDMS) substrats a déjà été utilisé pour fournir des signaux de guidage pour l'organisation des tissus pour imiter aligné tissu cardiovasculaire 5,7-10. Cependant, tissus à motifs en utilisant l'impression microcontact peuvent perdre leur intégrité après 3-4 jours de culture, limitant leur applicabilité dans les études chroniques. Ce protocole fournit une solution à ce problème en remplaçant les techniques d'impression par microcontact précédentes avec une nouvelle technique de dépôt microfluidique.
Genchi et al. PDMS substrats modifiés avec génipine et found viabilité des myocytes prolongée jusqu'à un mois dans la culture 11. Ici, nous utilisons une approche similaire pour étendre la culture de cellules motifs musculaires lisses vasculaires sur PDMS. Génipine, un dérivé hydrolytique naturelle du fruit de gardénia, est un candidat souhaitable pour la modification du substrat en raison de sa toxicité relativement faible par rapport aux agents de reticulation similaires et son utilisation croissante comme biomatériau dans les domaines de la réparation des tissus 12,13 et modification de l'ECM 14, 15. Dans ce protocole, la fibronectine est utilisée comme repère de guidage de la cellule, comme dans les méthodes d'impression par microcontact précédentes; Toutefois, génipine est déposé sur PDMS substrats antérieurs à la fibronectine structuration. Ainsi, comme les cellules dégradent la matrice à motifs, ECM nouvellement synthétisé à partir de CMLV attachés peut se lier au substrat de PDMS génipine revêtu.
Ce protocole utilise un dispositif de délivrance pour la génipine microfluidique en deux étapes et le dépôt ECM. La conception du dispositif microfluidique imite microcomotifs d'impression NTACT utilisés pour lamelles artérielle conçu dans les études précédentes 16. Ainsi, nous nous attendons à ce protocole pour obtenir imite artérielle de lamelles qui récapitulent avec succès le très-alignés dans la structure in vivo et de la fonction contractile du artérielle lamelles. On évalue également la contractilité du tissu afin de confirmer que la génipine est un composé de modification de substrat approprié pour le long terme dans des modèles de maladies vasculaires in vitro.
Access restricted. Please log in or start a trial to view this content.
Protocole
Remarque: L'objectif de ce protocole est de construire et d'utiliser un film vasculaire musculaire mince (vMTF) avec la structure représentée sur la figure 1 pour évaluer la contractilité pendant la culture prolongée de cellules musculaires lisses vasculaires (CMLV) sur PDMS substrats. Pour prolonger CMLV viabilité, nous utilisons l'génipine composé de réticulation. Les substrats de ces vMTFs sont conçus pour analyser la contractilité des tissus tels que développés par Grosberg et al. 8 Autres méthodes vMTF 5 mai également être utilisés, avec des changements subtils au protocole substrat de fabrication présenté.
1. Substrat Fabrication
- Nettoyage lamelle
- Placez 25 mm lamelles de verre de diamètre dans un rack lamelle de coloration. Placer la grille dans un grand bécher ou un récipient (par exemple, un 100 vide -. 1000 ul pipette pointe conteneur).
- Ajouter 70% d'éthanol au récipient pour immerger complètement les lamelles. Soniquer eux pendant au moins 30 min.
- Retirer le porte-lamelle à partir de la solution éthanolique. Autoriser les lamelles à l'air sec par pendaison le rack dans une hotte de culture stérile (pour éviter l'accumulation de particules sur des lamelles) pour 1- 2 heures.
Remarque: Les lamelles doivent être complètement sec avant les étapes suivantes.
- Le poly (N-iso-propylacrylamide) Isolation (PIPAAm) sur la bande de Coverslip
- Avec du ruban adhésif, ruban adhésif sur les côtés d'une lamelle nettoyé, laissant une bande exposée centrée sur la lamelle (figure 1A). Modifier la largeur de cette bande exposée sur la base de l'application et / ou de la conception microfluidique.
- Marquez les bords de bandes de ruban sur la lamelle en utilisant un marqueur de laboratoire pour référence ultérieure (figure 1A).
- Couper autour du périmètre de la lamelle de libérer de l'antenne (figure 1A, ligne rouge pointillée).
- Le poly (N-iso-propylacrylamide) (PIPAAm) Revêtement
- En utilisant une balance analytique, peser 1 g de PIPaam poudre. Ne pas utiliser non polymérisé N-iso-propylacrylamide, qui est une substance cancérigène.
- Transférer le PIPAAm à un tube de centrifugation de 50 ml. Ajouter 10 ml de 1-butanol dans une hotte chimique pour donner une solution à 10% p / v. ATTENTION: Le point de 1-butanol flash est de 37 o C. Conservez la solution résultante dans une armoire inflammable et éviter un échauffement.
- Laisser le PIPAAm de dissoudre pendant 10 min. Si la poudre est encore visible, mélanger la solution en utilisant un mélangeur-vortex jusqu'à ce que toutes poudre se dissout.
Remarque: Les étapes suivantes nécessitent l'utilisation d'une tournette. Pour chaque lamelle: - Placez la lamelle enregistrée sur le mandrin spin coucheuse avec une pince.
- Transférer 150 pl de solution PIPAAm sur la lamelle couvre-objet en plaçant des gouttelettes le long de la vitre exposée dans le centre de la lamelle couvre-objet. Assurer une couverture complète de la zone exposée.
- dépôt à la tournette PIPAAm en utilisant la recette suivante:
- Rampe 10 secondes à 3000 tours par minute. Habiter pendant 5 sec.
- Rampe à 10 s 6,000 min. Une temporisation de 60 sec.
- Rampe 10 secondes à 3000 tours par minute. Habiter pendant 5 sec.
- Placez la lamelle dans une boîte de Petri couverte avec le PIPAAm vers le haut. Laisser sécher à l'air pendant au moins 15 min.
- Retirez délicatement le ruban adhésif de tous les lamelles, laissant la lamelle pleine exposée avec une fine couche de revêtement PIPAAm dans une bande centrale.
- PDMS Revêtement
- Mélanger et dégazer 15 g de PDMS dans un ratio de 10: de réticulation: 1 base. Ajouter 7 - 8 gouttes de soniqués 0,2 um microbilles fluorescentes avant de les mélanger. Couvrir la tasse de PDMS avec une feuille d'aluminium lorsqu'il ne sert pas pour empêcher la poussière et d'autres particules de contaminer les PDMS.
Remarque: Les étapes suivantes nécessitent l'utilisation d'une tournette. Pour chaque lamelle: - Placez une lamelle PIPAAm enduit sur le mandrin spin coucheuse avec une pince.
- Transfert PDMS sur la lamelle, couvrant au moins un tiers de la zone de lamelle.
- manteau de Spin utilisant le recip suivantee:
- Rampe 5 secondes à 500 tours par minute. Dwell 5 sec.
- Rampe 5 sec à 1000 rpm. Dwell 5 sec.
- Rampe 10 secondes à 3000 tours par minute. Dwell 10 sec.
- Rampe 10 secondes à 4000 tours par minute. Dwell 60 sec.
- Rampe 10 secondes à 2000 tours par minute. Dwell 15 sec.
- Rampe 10 sec à 1000 rpm. Dwell 10 sec.
- Rampe 5 secondes à 500 tours par minute. Dwell 5 sec.
- Placez la lamelle dans une boîte de Petri couverte avec les PDMS vers le haut. Noter le temps quand la lamelle était spin-couché. Gardez une trace du temps associé à chaque lamelle toute l'expérience pour une utilisation ultérieure dans la détermination de l'épaisseur du substrat PDMS.
- Placer la boîte de Pétri contenant des lamelles couvre-objet dans un four à 90 ° C pendant au moins 1,5 heure afin d'assurer un durcissement correct de PDMS. Si un four ne sont pas disponibles, laisser les lamelles durcir pendant au moins 48 heures à température ambiante.
- Retirez les lamelles du four et de les stocker dans un tiroir sombre jusqu'au moment de servir.
- Mettez de côté chaque quatrième lamelle fou plus tard mesure de l'épaisseur du substrat, en fonction du temps de dépôt à la tournette, avec un profilomètre.
- Mélanger et dégazer 15 g de PDMS dans un ratio de 10: de réticulation: 1 base. Ajouter 7 - 8 gouttes de soniqués 0,2 um microbilles fluorescentes avant de les mélanger. Couvrir la tasse de PDMS avec une feuille d'aluminium lorsqu'il ne sert pas pour empêcher la poussière et d'autres particules de contaminer les PDMS.
2. Modélisation microfluidique pour les tissus d'ingénierie
- Fabrication de dispositifs microfluidiques
- Conception de tissus Photomask microfluidique
- Utilisez un programme de conception assistée par ordinateur approprié pour concevoir des modèles microfluidiques. Pour lamelles artérielle composé de cellules musculaires humaines d'artère ombilicale du cordon lisses vasculaires, utiliser un motif alterné de 10 um à 10 um canaux murs.
- Utilisez canal binaire ramification si possible 17, mais d'autres conceptions de ramification peuvent être utilisés. Diminuer la largeur et la longueur des canaux pour chaque itération de ramification jusqu'à ce que la réalisation du motif de tissu souhaité (murs et l'espacement des canaux, figure 1B).
- Concevoir le dispositif d'avoir une seule entrée pour le traitement de surface de placement de la solution et une seule sortie pour l'application d'un vide.
- Fabsant la photomasque contenant la conception (s) microfluidique, comme décrit précédemment 18.
- Photolithographique de fabrication de galettes
Remarque: Effectuez la photolithographie en salle blanche approprié ou une installation semblable. Pour faire des plaquettes de silicium avec des motifs pour la fabrication lithographique douce de dispositifs microfluidiques de tissus (~ 20-25 hauteur du canal de um) à l'aide de photolithographie:- Nettoyer une tranche de silicium dans de l'acétone, du methanol et de l'alcool isopropylique pendant 1 min chacun. Sécher la plaquette avec un pistolet à azote.
- Précuites la plaquette sur une plaque chauffante pendant 5 min à 115 ° C pour éliminer l'excès d'humidité.
- manteau de Spin la plaquette avec SU-8 3025 résine photosensible en utilisant la recette suivante pour obtenir dispose de 20 à 25 um de hauteur:
- Rampe 5 secondes à 500 tours par minute. Dwell 5 sec.
- Rampe 15 sec à 4000 tours par minute. Dwell 15 sec.
- Cuisson douce de la plaquette sur une plaque chaude à 95 ° C pendant 15 min.
- Charger un masque photographique, et d'exposer til plaquette pendant 16 secondes en utilisant un programme de contact sous vide sur un dispositif d'alignement de masque de contact.
- Disque cuire la galette sur une plaque chaude à 95 ° C pendant 4 min.
- Développer la plaquette pendant 6 min dans un révélateur. Ensuite, lavez la tranche deux fois pendant 2 secondes dans un révélateur frais et rincer la tranche avec de l'alcool isopropylique.
- Silanate la plaquette à motifs O / N en plaçant 2-3 gouttes de tridécafluoro-trichlorosilane dans un plat vide dans un dessiccateur à vide. Prop la plaquette en utilisant des boîtes de Pétri à la fois de telle sorte que la partie supérieure et inférieure de la plaquette sont exposées.
ATTENTION: Tridecafluro-trichlorosilane est un liquide inflammable et corrosif. Matériel de protection adéquat et échappement local est nécessaire pour l'utilisation.
- Tissue dispositif microfluidique Fabrication
- Placez une, plaquette fonctionnalité côté motif silaner dans une boîte de Petri.
- Mélanger et dégazer 100 g de PDMS avec un ratio de 10: de réticulation: 1 base. Verser les PDMS dans le plat, couvrir complètement et uniformément la plaquette.
- Placer la capsule dans un dessiccateur sous vide jusqu'à ce que toutes les bulles d'air sont éliminées de PDMS non durcies, environ 30 min. Guérir les PDMS dans le plat à 90 ° C pendant au moins 1,5 heure. Temps et la température peuvent être ajustés comme dictée par des lignes directrices de la production pour obtenir une guérison complète.
- Une fois que le PDMS a durci, couper les PDMS autour de la plaquette avec une lame de rasoir et libérer attentivement la plaquette de PDMS-couvertes dans le plat. Retirer PDMS excès sous plaquette et peler lentement PDMS de distance du sommet de la plaquette.
- Placez la fonctionnalité côté PDMS disque dans un plat propre et stocker la plaquette abri de la lumière après utilisation.
- Coupez l'excédent de PDMS autour des dessins en utilisant une lame de rasoir. dispositifs coupées dans des formes rectangulaires (figure 1C) pour faciliter l'épluchage du dispositif à partir de substrats dans les étapes ultérieures. Coupes précises ne sont pas nécessaires, tant que existe amplement d'espace pour l'entrée, la sortie, et zone de motif de tissu (figure 1C).
- Poinçonentrée et de sortie des trous (figure 1c) à l'aide d'une biopsie chirurgicale 1 mm poinçon.
- Conception de tissus Photomask microfluidique
- Microfluidique dépôt de périphériques
Remarque: Dans ce protocole, la livraison microfluidique est utilisé pour déposer la génipine à motifs, l'agent de réticulation clé pour la culture de tissu à long terme, ainsi que de la fibronectine. Étapes préalables à la pénicilline / streptomycine stérilisation (2.2.3) ne doivent pas avoir lieu dans des conditions stériles, mais en limitant la collecte de la contamination et de la poussière est encouragée tout au long du protocole. Toutes les étapes survenant après lamelle stérilisation avec de la pénicilline / streptomycine (2.2.3) devraient utiliser une technique stérile. Note: Cette partie du protocole doit être commencé un jour avant l'ensemencement des cellules.- Substrat et microfluidique Dispositif Préparation
- Soniquer les dispositifs microfluidiques à 70% d'éthanol pendant au moins 30 min.
- Sécher les dispositifs microfluidiques soniquées en utilisant de l'air comprimé ou de l'azote, et les placer dans une boîte de Pétri wiième canal dispose face vers le haut pour éviter l'usure inutile sur les fonctionnalités.
- Placez jusqu'à 10 vMTF lamelles de substrat dans un nettoyeur UVO (couvercle enlevé sur le plat afin que la surface est fonctionnalisée) pendant 8 min.
- Retirez les lamelles UVO-traités, et placer la fonctionnalité des dispositifs microfluidiques-côté vers le bas sur chaque feuillet un à la fois (orientation devrait être similaire à la figure 1C). Appuyez fermement sur les dispositifs pour assurer un joint étanche aux PDMS revêtus lamelles.
- Dépôt de génipine et fibronectine
- Préparer une / ml solution génipine 5 mg par addition de 1 ml de ddH 2 O stérile dans un récipient de 5 mg de génipine lyophilisée. Mélanger la solution en utilisant un mélangeur à tourbillon. Mettez de côté à température ambiante pendant au moins 30 min.
Remarque: La poudre est difficile à solubiliser à TA, le mélange de façon répétitive pendant au moins une minute est souvent nécessaire. - Rapidement, déposer une goutte d'éthanol à 70% à l'entrée de chaque dispositif pour l'amorçage de l'appareil. Remarque: Le ethanol devrait mèche à travers les dispositifs.
- Après 5 à 10 min, soigneusement aspirer l'excès d'éthanol à l'entrée, en le remplaçant immédiatement avec 1X tampon phosphate salin (PBS) à l'entrée. De ce point en avant, assurez-vous de ne pas permettre l'entrée de devenir complètement sec pour éviter l'introduction d'air à l'appareil.
- Placez un embout de l'aspirateur à vide à la sortie de chaque appareil. Dessinez PBS 1X à travers des dispositifs de rincer l'éthanol loin. Laissez une petite quantité de PBS 1X à l'entrée. Remarque: Si entrée apparaît presque à sec, ajouter plus de PBS 1X.
- Aspirer excès 1X PBS de sorte que seule une faible quantité reste à l'orifice d'entrée avant l'application de la solution génipine.
- Placer 60 ul de la solution génipine 5 mg / ml à chaque entrée (Figure 1D). Aspirer la solution de génipine à travers les dispositifs en plaçant un embout de l'aspirateur à vide à la sortie (figure 1D). Soyez sûr de ne pas attirer toute la solution à travers, laissant une petite quantité de solution à l'entrée.
- Lieu gouttes (environ sou-entreprises) de PBS 1X à la fois l'entrée et la sortie pour maintenir le mouillage pendant l'incubation. Déplacez le plat contenant des dispositifs à un four ou un incubateur humidifié (environnement stérile est pas nécessaire) fixés à 37 ° C, et incuber pendant 4 heures. Le plat n'a pas besoin d'être couverts.
- Pendant l'incubation, la fibronectine remettre en suspension à une concentration de 50 ug / ml dans 2 O stérile ddH sur de la glace pendant au moins 30 min avant l'application de dispositif microfluidique.
- Après l'incubation de génipine, aspirer tout le reste du PBS 1X à la sortie de l'appareil. Continuer à appliquer un aspirateur à vide à chaque sortie de l'appareil, tirant à travers le reste du PBS 1X à l'entrée.
- Placer 100 ul de 50 ug / ml de solution de fibronectine à chaque entrée, en ajoutant à une quantité minimale de 1X PBS restant à l'entrée (figure 1D).
- Aspirer la solution de fibronectine à travers les dispositifs en utilisant une canule d'aspiration sous vide à la sortie ( Figure 1D). Soyez sûr de ne pas en tirer toute la solution à travers. Remarque: baisse fibronectine sera différent que le PBS 1X et génipine raison des différences de tension de surface.
- Déplacez le plat découvert contenant les dispositifs à un four ou incubateur réglé à 37 ° C, et incuber pendant 24 heures. Remarque: L'étape de fibronectine ne nécessite pas de mouillage de l'entrée et la sortie avec du PBS 1X. La piscine reste de la fibronectine à l'entrée va sécher. Ceci est prévu.
- Préparer une / ml solution génipine 5 mg par addition de 1 ml de ddH 2 O stérile dans un récipient de 5 mg de génipine lyophilisée. Mélanger la solution en utilisant un mélangeur à tourbillon. Mettez de côté à température ambiante pendant au moins 30 min.
- Stérilisation et Préparation portable semis
- Préparer une solution de pénicilline / streptomycine pour la stérilisation des lamelles vMTF à motifs. Ajouter 5 ml de pénicilline / streptomycine (10 000 unités / ml; 10 000 ug / ml) à 500 ml de 1X PBS stérile.
- Placer le plat contenant les dispositifs dans une hotte de sécurité biologique stérile.
- Retirez délicatement les dispositifs des lamelles par pelage lentement l'appareil à un coin, tout en saisissant légèrement la lamelle dans la main opposée.Remarque: Cette étape nécessite la pratique pour réduire les dommages lamelle dans le processus de suppression. Une alternative est d'utiliser une seringue pour injecter du PBS 1X à l'entrée et / ou sortie pour faciliter la sortie de l'appareil.
- Placez les lamelles de boîtes à six puits stériles. Ajouter au moins 5 ml de solution de pénicilline / streptomycine dans chaque puits. Placer les capsules dans un incubateur stérile à 37 ° C pendant au moins 30 min.
- Après stérilisation, aspirer la solution de pénicilline / streptomycine, et épépiner les lamelles avec culture humaine artère ombilicale lisse vasculaire cells19 musculaire (figure 1D). La concentration d'ensemencement pour CMLV est ~ 80 000 cellules par cm 2. Pour réduire le nombre de cellules nécessaires pour chaque échantillon, en utilisant un réducteur pour réduire la zone d'ensemencement. Un exemple d'un réducteur est le sommet d'un tube conique de 15 ml fixée à la lamelle couvre-objet avec de la graisse à vide stérile avant l'ensemencement de coupe.
- Incuber les lamelles ensemencées dans un incubateur stérile à 37 ° C et 5% de CO 2 et laisser les cellules ensemencées pour fixer et forment alignés artérielles imite lamelles O / N (figure 2A-B).
- À long terme de la culture tissulaire vMTF
- Un jour après le semis, retirez le support de cellule et réducteurs. Rincer les tissus avec du PBS 1X. Ajouter 4 ml de milieu cellulaire sans sérum pour induire un phénotype contractile à la 20 CMLV.
- Répétez le rinçage du PBS 1X et addition de milieu sans sérum frais chaque autre jour comme souhaité pour la culture à long terme.
- Substrat et microfluidique Dispositif Préparation
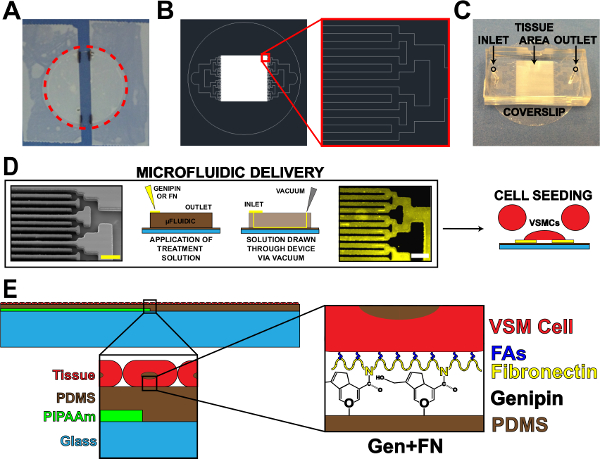
Figure 1. Dispositif microfluidique Protéines de livraison. (A) Taped hors lamelle pour le revêtement PIPAAm. Cercle rouge pointillé: la trajectoire de coupe pour libérer lamelle (B) le dessin représentant AutoCAD de motif de masque microfluidique de tissu.. En médaillon: Détail de branchement binaire à AlternAting 10 um x 10 um motif de tissu. (C) Mise en place de dispositif microfluidique sur un substrat de lamelle avec entrée et de sortie indiquée. (D) Schéma de la structuration de la protéine microfluidique et la livraison. Image de microscopie électronique à balayage de canaux microfluidiques (barre d'échelle: 50 um) de gauche à droite; Schématique détaillée du procédé pour le dépôt de protéines; Immunohistochimie fibronectine teinté (barre d'échelle: 50 um); Cellule ensemencement avec des cellules de muscles lisses vasculaires. (E) Schéma de tissu fabriqué. 1 er encart: Détail de construction en couches. 2 ème encart: Détail de la modification de la génipine du substrat PDMS après le dépôt microfluidique. © IOP Publishing. Reproduit et / ou modifié avec la permission. Tous droits réservés. 19 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
3. Analyse de tissus de fonction avec vMTF contractilité Assay
Remarque: Le test MTF de la contractilité présenté ici est calquée sur la technique développée dans Grosberg et al 8.
- vMTF contractilité Experiment
- Placer un échantillon de tissu dans une boîte de 100 mm. Ajouter les solution8 de Tyrode 1X stérile à pH 7,4 chauffé à 37 ° C afin de couvrir l'échantillon.
- Utilisez une lame de rasoir pour faire plusieurs coupes parallèles, perpendiculaires au bord PIPAAm. Faire des coupes d'une manière qui donne des coupes de tissus plus larges qui feront l'vMTFs (avec une largeur ~ 2 mm) alternant avec des bandes minces (figure 3A, les coupes latérales). Pour faire des coupes nettes, placez une lame de rasoir en contact avec l'échantillon et fermement glisser sur le côté.
- Tourner le plat 90 ° et faire deux coupes parallèles, droites au milieu du tissu, parallèlement à la bande de PIPAAm (figure 3A, coupures de fin). Retirer et jeter de la bande de tissu conjonctif lâche entre ces coupes et les bandes minces entre les deux vMTFs (coupe à l'étape précédente) pour empêcher films adjacents de la prise de contact.
- Laisser l'échantillon reposer à température ambiante pendant 10 min, ou jusqu'à ce que tout le PIPAAm soit dissous. Remarque: Si PIPAAm reste dans les étapes à venir, l'échantillon peut être retourné à l'antenne de coupe de dissoudre PIPAAm résiduelle. Un raclage doux de la face inférieure de vMTF peut aider à l'élimination PIPAAm, selon les besoins.
- Placez un petit point de la graisse à vide dans un endroit propre 35 mm boîte de Petri. Ajouter 5 ml de la solution de frais, stérile 1X Tyrode à 37 ° C. Transférer la lamelle avec des films de coupe de la boîte de 100 mm à l'antenne de 35 mm, et appuyez sur la graisse à vide pour empêcher le mouvement de la lamelle.
- Placez le plat dans une plate-forme à température contrôlée sur la scène stéréoscopique.
- Capture d'time-lapse transmis et images fluorescentes à intervalles souhaités (par ex., 30 sec) tout au long de dosage de traitement.
- Traiter série vMTFs avec 50 nM endothéline-1 pendant 20 min (la contraction induite) et 100 pM de HA-1077 pendant 30 min (relaxation des tissus). Ajouter des solutions concentrées de chaque traitement expérimental de la capsule contenant 5 ml de la solution de Tyrode 1X stérile à des points de temps spécifiés, ce qui donne la concentration désirée de traitement dans le volume de 5 ml. Faire des ajouts de traitement au cours de l'intervalle entre les prises de vue du temps de déchéance pour éviter de capturer des images en pipette.
- vMTF contractilité Analyse
- Utilisation de lamelles mis de côté dans 1.4.8, mesurer PDMS épaisseur de substrat avec une profilometer21. Créer une épaisseur rapport à la courbe de temps de rotation pour chaque ensemble de lamelles. Utiliser cette courbe pour estimer l'épaisseur de chaque lamelle vMTF utilisé dans une expérience de contractilité.
- Mesurer les longueurs de projection vMTF pour chaque point de temps au cours de l'expérience, et calculer les rayons de courbure associé (figure 3B) en utilisant des procédés rapportés précédemment 8.
- Calculer le stress vMTF à chaque po de tempsint en utilisant des procédés 5 vMTF précédentes.
Remarque: Utilisez l'épaisseur vMTF estimée calculée à partir de 3.2.1. Mesurer l'épaisseur de CMLV en utilisant des images confocale, comme indiqué précédemment 9. Obtenir le module de Young de PDMS fiches de données de l'entreprise.
Access restricted. Please log in or start a trial to view this content.
Résultats
L'objectif principal de ce travail était d'étendre la viabilité de CMLV microélectrodes sur PDMS substrats hydrophobes. Ceci a été accompli en incorporant un système de délivrance pour déposer microfluidique génipine à motifs et de la fibronectine sur PDMS (figure 1). Dépôt de protéines ECM en utilisant la livraison microfluidique a abouti à un transfert de haute fidélité du modèle de canal avec PDMS nus entre les lignes de génipine et de la fibronectine (figure 1D).
Access restricted. Please log in or start a trial to view this content.
Discussion
Ici, nous présentons un protocole qui repose sur la technologie vMTF précédemment développé, permettant des temps d'expérimentation prolongées plus typique des voies de maladies vasculaires chroniques 1,23,24. Pour ce faire, nous motif fin génipine, qui a été montré précédemment pour fournir fonctionnalisation à long terme des substrats PDMS 11, en utilisant une technique de dépôt microfluidique pour produire des lamelles artérielle d'ingénierie avec amélioration de...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We acknowledge financial support from the American Heart Association Scientist Development Grant, 13SDG14670062 (PWA) and the University of Minnesota Doctoral Dissertation Fellowship (ESH). We also acknowledge the microfabrication resources of the Minnesota Nano Center (MNC) and the image processing resources of the University Imaging Centers (UIC), both at the University of Minnesota. Parts of this work were carried out in the Characterization Facility, University of Minnesota, which receives partial support from NSF through the MRS program.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Coverslip staining rack | Electron Microscopy Sciences | www.emsdiasum.com/ | 72239-04 |
| Microscope cover glass - 25 mm | Fisher Scientific, Inc. | www.fishersci.com | 12-545-102 |
| Poly(N-iso-propylacrylamide) (PIPAAm) | Polysciences, Inc. | www.polysciences.com/ | #21458 |
| 1-butanol | Sigma-Aldrich | www.sigmaaldrich.com | 360465 |
| Spincoater | Specialty Coating Systems, Inc. | www.scscoatings.com | |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives (Dow Corning) | www.ellsworth.com | 184 SIL ELAST KIT 0.5KG |
| Fluorescent microbeads | Polysciences, Inc. | www.polysciences.com/ | 17151 |
| Silicon wafers | Wafer World, Inc. | www.waferworld.com | 2398 |
| Photoresist | MicroChem Corp. | www.microchem.com | |
| Contact mask aligner | Suss MicroTec | www.suss.com | |
| Developer | MicroChem Corp. | www.microchem.com | |
| Tridecafluro-trichlorosilane | UCT Specialties, Inc. | www.unitedchem.com | T2492 |
| Surgical biopsy punch | Integra LifeSciences Corp. | www.miltex.com | 33-31AA-P/25 |
| Genipin | Cayman Chemical | www.caymanchem.com | 10010622 |
| 1X phosphate buffered saline | Mediatech, Inc. | www.cellgro.com | 21-031-CV |
| Fibronectin | Corning, Inc. | www.corning.com | 356008 |
| Penicillin/streptomycin | Life Technologies, Inc. | www.lifetechnologies.com | 15140-122 |
| Umbillical artery smooth muscle cells | Lonza | www.lonza.com | CC-2579 |
| Tyrode's solution components | Sigma-Aldrich | www.sigmaaldrich.com | various |
| Stereomicroscope | Zeiss | www.zeiss.com | 4350020000000000 |
| Temperature-controlled platform | Warner Instruments | www.warneronline.com | 641659; 640352; 641922 |
| Endothelin-1 | Sigma-Aldrich | www.sigmaaldrich.com | E7764-50UG |
| HA-1077 | Sigma-Aldrich | www.sigmaaldrich.com | H139-10MG |
Références
- Humphrey, J. D., Baek, S., Niklason, L. E. Biochemomechanics of cerebral vasospasm and its resolution: I. A new hypothesis and theoretical framework. Ann. Biomed. Eng. 35, 1485-1497 (2007).
- Hald, E. S., Alford, P. W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm. Transl. Stroke Res. 5, 385-393 (2014).
- Olivetti, G., Anversa, P., Melissari, M., Loud, A. V. Morphometry of medial hypertrophy in the rat thoracic aorta. Lab. Invest. 42, 559-565 (1980).
- , Atherosclerosis. Nature. 407, 233-241 (2000).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Rhodin, J. A. G. Architecture of the vessel wall. Physiol. Rev. ed, B. erne,R. ., , American Physiology Society. (1979).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc. Natl. Acad. Sci. U. S. A. 108, 19943-19948 (2011).
- Grosberg, A., Alford, P. W., McCain, M. L., Parker, K. K. Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip. 11, 4165-4173 (2011).
- Alford, P. W., Nesmith, A. P., Seywerd, J. N., Grosberg, A., Parker, K. K. Vascular smooth muscle contractility depends on cell shape. Integr. Biol. (Camb). 3, 1063-1070 (2011).
- Win, Z., et al. Smooth muscle architecture within cell-dense vascular tissues influences functional contractility). Integr. Biol. (Camb). , (2014).
- Genchi, G. G., et al. Bio/non-bio interfaces: a straightforward method for obtaining long term PDMS/muscle cell biohybrid constructs). Colloid Surface B. 105, 144-151 (2013).
- Fessel, G., Cadby, J., Wunderli, S., van Weeren, R., Snedeker, J. G. Dose- and time-dependent effects of genipin crosslinking on cell viability and tissue mechanics - Toward clinical application for tendon repair. Acta Biomater. , (2013).
- Lima, E. G., et al. Genipin enhances the mechanical properties of tissue-engineered cartilage and protects against inflammatory degradation when used as a medium supplement. J. Biomed. Mater. Res. A. 91, 692-700 (2009).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. J. Biomed. Mater. Res. A. , (2011).
- Satyam, A., Subramanian, G. S., Raghunath, M., Pandit, A., Zeugolis, D. I. In vitro evaluation of Ficoll-enriched and genipin-stabilised collagen scaffolds. J. Tissue Eng. Regen. Med. , (2012).
- Alford, P. W., et al. Blast-induced phenotypic switching in cerebral vasospasm. Proc. Natl. Acad. Sci. U. S. A. 108, 12705-12710 (2011).
- Song, H., Tice, J. D., Ismagilov, R. F. A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl. 42, 768-772 (2003).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu. Rev. Biomed. Eng. 3, 335-373 (2001).
- Hald, E. S., Steucke, K. E., Reeves, J. A., Win, Z., Alford, P. W. Long-term vascular contractility assay using genipin-modified muscular thin films. Biofabrication. 6, 045005(2014).
- Han, M., Wen, J. K., Zheng, B., Cheng, Y., Zhang, C. Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells. Am. J. Physiol. Cell Physiol. 291, C50-C58 (2006).
- Feinberg, A. W., et al. Muscular thin films for building actuators and powering devices. Science. 317, 1366-1370 (2007).
- Volfson, D., Cookson, S., Hasty, J., Tsimring, L. S. Biomechanical ordering of dense cell populations. Proc. Natl. Acad. Sci. U. S. A. 105, 15346-15351 (2008).
- Intengan, H. D., Schiffrin, E. L. Vascular remodeling in hypertension: roles of apoptosis, inflammation, and fibrosis. Hypertension. 38, 581-587 (2001).
- Kayembe, K. N., Sasahara, M., Hazama, F. Cerebral aneurysms and variations in the circle of Willis. Stroke. 15, 846-850 (1984).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35, 5462-5471 (2014).
- Weir, B., Grace, M., Hansen, J., Rothberg, C. Time course of vasospasm in man. 48, 173-178 (1978).
- McCain, M. L., Sheehy, S. P., Grosberg, A., Goss, J. A., Parker, K. K. Recapitulating maladaptive, multiscale remodeling of failing myocardium on a chip. Proc. Natl. Acad. Sci. U. S. A. 110, 9770-9775 (2013).
- Agarwal, A., Goss, J. A., Cho, A., McCain, M. L., Parker, K. K. Microfluidic heart on a chip for higher throughput pharmacological studies. Lab. Chip. 13, 3599-3608 (2013).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab. Chip. 12, 2156-2164 (2012).
- Meer, A. D., van den Berg, A. Organs-on-chips: breaking the in vitro impasse. Integr. Biol. (Camb). 4, 461-470 (2012).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon