Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Orthotopique Implantation et périphérique des cellules immunitaires surveillance dans le modèle II-45 Syngénique Rat mésothéliome
Dans cet article
Résumé
La génération d'un modèle de rat orthotopique du mésothéliome pleural malin par implantation des II-45 cellules de mésothéliome dans la cavité pleurale de rats immunitaires compétentes est présentée. Un procédé de cytométrie de flux pour analyser les sept sous-ensembles de cellules immunitaires chez ces animaux à partir d'un échantillon de sang 25 ul est également décrit.
Résumé
L'énorme regain d'intérêt dans les traitements à base immunitaire contre le cancer tels que les vaccins et les inhibiteurs de point de contrôle immunitaire, et une meilleure compréhension du rôle du microenvironnement de la tumeur dans la réponse au traitement, pointez sur la nécessité pour les modèles orthotopiques immunitaire compétentes pour les essais pré-cliniques collectivement de ces nouvelles thérapies. Cet article montre comment établir un modèle de rat immunitaire compétent orthotopique du mésothéliome pleural malin. Suivi progression de la maladie dans des modèles orthotopiques se confond interne par l'emplacement des tumeurs. Pour surveiller longitudinalement progression de la maladie et ses effets sur cellules immunitaires circulantes dans ce domaine et d'autres modèles de rats de cancer, un seul tube cytométrie de flux dosage ne nécessitant que 25 ul de sang entier est décrite. Ceci permet d'obtenir une quantification précise de sept paramètres immunitaires: les lymphocytes totaux, monocytes et neutrophiles, ainsi que les sous-ensembles de cellules T CD4 et CD8, les cellules B et les cellules tueuses naturelles. Différents sous-marinsets de ces paramètres sont utiles dans des circonstances et des modèles différents, avec le rapport des neutrophiles à des lymphocytes ayant la plus grande utilité pour le suivi de progression de la maladie dans le modèle de mésothéliome. Analyser les taux circulants de cellules immunitaires en utilisant cette méthode de tube unique peut également aider à surveiller la réponse aux traitements à base immunitaire et de comprendre les mécanismes sous-jacents menant à la réussite ou l'échec du traitement.
Introduction
Le mésothéliome malin (MM) est une tumeur maligne agressive qui se pose à partir de cellules transformées dans la membrane (mésothélium) que les lignes les poumons et la cavité abdominale, le coeur et les organes génitaux internes, et est la tumeur primaire la plus fréquente de la cavité du poumon ou de la plèvre 1,2 . L'exposition aux fibres d'amiante représente 80% de tous les MM, et tandis que les interdictions sur utilisation de l'amiante ont été introduits il ya plusieurs décennies dans la plupart des pays occidentaux, son utilisation répandue dans la communauté a laissé un héritage mortel. L'Organisation mondiale de la santé a estimé que 107.000 personnes dans le monde meurent chaque année de maladies liées à l'amiante, avec des taux de mortalité continue d'augmenter. Une nouvelle vague d'incidence non professionnelle est également en train d'émerger et il ya peu de compréhension de quand, et à quel niveau ce sera à son maximum 3.
La majorité des gens atteints de MM sont diagnostiqués tardivement lorsque la chimiothérapie systémique représente une des seules options viables 4. Les plupart des effective chimiothérapie et de courant standard de soins "(pemetrexed association avec le cisplatine 5) a été identifié il ya plus de 10 ans. Cependant l'échec de ce traitement est inévitable et il n'y a pas des options de seconde ligne éprouvées, laissant les patients avec un pronostic sombre et la survie médiane de 12 mois seulement 2. Par conséquent, il ya un besoin non satisfait urgent de traitements plus efficaces. Malgré l'examen d'un certain nombre de nouvelles thérapies dans des essais cliniques aucune n'a abouti à des changements dans la pratique. Cela est dû en partie à la faible (5%) le transfert des résultats pré-cliniques, généralement effectuée dans des modèles de xénogreffe de souris, pour le réglage de la clinique 6-8. De tels modèles ne récapitulent pas fidèlement les aspects complexes du microenvironnement tumoral se produisant dans les zones non physiologiques, souvent en l'absence d'un système immunitaire fonctionnant 9.
Orthotopiques modèles syngéniques créent un environnement de la tumeur significativement plus réaliste que le commonly utilisé des modèles de xénogreffes sous-cutanées que les tumeurs se produisent dans l'emplacement physiologique correcte avec un système immunitaire 10,11 intacte. La grande taille du rat améliore son utilisation comme modèle de la maladie des rongeurs, en particulier dans les études sur les médicaments où le sang de série tire sont nécessaires pour évaluer la réponse au traitement et la toxicité 12. De plus, dans des modèles dans lesquels la surveillance de la maladie est la progression difficile en raison de l'emplacement des tumeurs (par exemple dans la cavité pleurale), la capacité de surveiller la progression de la maladie en utilisant des facteurs présents dans la circulation est extrêmement attrayant. La génération d'un modèle orthotopique syngénique de mésothéliome pleural en utilisant des rats immuno-compétentes est décrite. En outre, un procédé relativement simple et non invasif de surveillance de progression de la maladie en mesurant pleural cellules immunitaires circulantes est également décrite.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les procédures impliquant des animaux ont été effectuées en conformité avec les recommandations du Code australien de pratiques pour le soin et l'utilisation des animaux à des fins scientifiques. Le protocole de cette étude a été approuvée par le Comité de protection des animaux et de l'hôpital Royal North Shore éthique. Femme rats Fischer 344 (F344, 150-200 g) ont été maintenus à l'installation Kearns, Kolling Institut dans des conditions standard (12 h cycles lumière / obscurité et l'accès libre à la nourriture et de l'eau).
Remarque: Un organigramme pour toutes les procédures expérimentales est présentée dans la figure 1.
1. Préparation des cellules pour implantation
- Le mésothéliome de rat ligne de culture II-45 cellulaire (aussi connu comme l'IL-45; dérivée par l'introduction péritonéale de l'amiante crocidolite) dans du RPMI 1640 (RPMI) médias complété avec 10% de sérum fœtal bovin (FBS) et de grandir dans des conditions standard (37 ° C incubateur humidifié avec 5% de CO 2). Maintapar passage dans et sous-culture à environ 1:50 deux fois par semaine dans un flacon de 2 75 cm.
- Préparer les réactifs pour la culture cellulaire et des parties aliquotes chaud à 37 ° C. Réactifs nécessaires comprennent médias libres sériques RPMI (AFD), RPMI avec 10% de FBS, tampon phosphate salin (PBS) et 0,5% de trypsine-EDTA.
- Cellules de culture pour l'implantation à environ 70-80% de confluence. Ceci assure qu'ils sont dans la phase de croissance linéaire.
- Récolte des cellules en éliminant le support, lavage une fois avec 5 ml de PBS stérile, puis en ajoutant 3 ml de 0,5% de trypsine-EDTA.
- Flacons Retour à l'incubateur pendant environ 5 minutes jusqu'à ce que toutes les cellules deviennent non-adhérent.
- Une fois que les cellules sont non adhérente, ajouter 3 ml de RPMI avec 10% de FBS pour inactiver la trypsine. Recueillir et cellules de centrifugation à 300 g pendant 3 min.
- Laver le culot cellulaire dans 10 ml de GDF et centrifuger à 300 g pendant 3 min.
- Laver culot cellulaire à nouveau avec 10 ml de GDF et centrifuger comme ci-dessus.
- Reprendre les cellules dans 10 ml de GDF et d'effectuer un nombre de cellules en utilisant un hémocytomètre ou instruments similaires.
- Diluer les cellules de sorte que 100 ul contient la quantité de cellules à implanter.
Remarque: la croissance de la tumeur a été démontrée à une dose aussi faible que 100 cellules dans 100 pi, mais une dose standard est de 500.000 cellules dans 100 pi. - Préparer suffisamment de cellules dans un milieu pour le nombre de rats à être implanté (par exemple, 100 ul / rat), ainsi que d'au moins 0,5 ml supplémentaire pour compenser les pertes de l'amorçage et le volume mort de l'aiguille.
- Préparer suffisamment de GDF (sans cellules) pour être implanté dans des rats de contrôle (par exemple, 100 pl / rat), majoré d'au moins 0,5 ml supplémentaire.
Remarque: Les cellules et GDF sont maintenant prêts pour l'implantation. Ils doivent être maintenus à 37 o C et implantés dans les 2 heures de la récolte pour maintenir la viabilité.
2. In vivo implantation de cellules
- Placez le rat F344 (> 13 semaines d'âge) dans la chambre d'induction et anesthésier utilisant 1,4% inhalation isoflurane (ou la méthode en usage dans l'installation). Une fois que le rat semble être endormie mouvement à partir de la chambre à un cône de nez (avec 1,4% d'isoflurane qui coule), placez-le sur le dos, la poitrine vers le haut (vue ventrale). Ceci permet aux organes internes de régler l'écart de la cavité thoracique. Vérifiez réflexes selon les protocoles institutionnels pour assurer le rat est totalement anesthésié.
- Rasez la zone de droite regio costalis (poitrine) pour enlever la fourrure.
- Nettoyer la zone rasée avec 80% v / v d'éthanol.
- Identifier le site d'injection: sur le côté droit, trouver le 2ème glande crânienne départ. Le site d'injection est de 0,5 cm proximale à cela, entre la 3e et 4e côtes à partir de l'extrémité caudale de la cage thoracique. (Figure 2A).
- Mélanger délicatement les cellules II-45 pour remettre en suspension. Aspirez lentement la suspension de cellules (ou GDF pour les rats de contrôle) dans 1 ml &# 160; seringue sans aiguille attachée. Si une aiguille est fixée pour le dessin de cellules il y a le potentiel de se développer le long des cellules de la ligne d'injection à aiguille. Joindre une 23G x 1 ¼ needle. Premier l'aiguille et enlever les bulles d'air.
- Une fois la seringue et l'aiguille sont amorcées, placer à 20 mm de long et de 5 mm de diamètre entretoise sur l'arbre de l'aiguille. Ceci est utilisé pour empêcher l'aiguille de pénétrer trop profondément dans la cavité pleurale au cours de l'injection. Environ 5 mm-12 mm de l'aiguille exposée est suffisante pour la pénétration à travers les côtes sans endommager les organes.
- Insérer lentement l'aiguille entre les côtes, reculer sur la seringue pour assurer un vaisseau sanguin n'a pas été perforé (pas de sang devrait apparaître dans la seringue), puis injecter 100 cellules ul ou GDF. (Figure 2B).
- Retirez l'aiguille et rouler doucement le rat de gauche à droite pour répandre cellules dans la cavité thoracique.
- Placez le rat dans une cage et vérifier pour la récupération. The rat devrait être éveillé au sein de 1 min et de commencer à se déplacer.
- Répétez l'opération pour chaque rat en utilisant une nouvelle aiguille. Réutilisation de la même aiguille se traduira par la croissance des cellules le long de la conduite d'injection de l'aiguille.
- Surveiller le bien-être des animaux quotidienne.
- Euthanasier les animaux à extrémités éthique définis comme régi par le comité institutionnel de l'éthique animale. Les critères éthiques pour les rats dans ces expériences étaient perte de poids de plus de 10% ou la respiration difficile.
3. veine de la queue de prélèvement sanguin
- Si le sang doit être collecté immédiatement après l'implantation des cellules, gardez le rat anesthésié. Si l'échantillonnage de sang à un autre point de temps, anesthésier la rat en utilisant 1,4% inhalation isoflurane. Vérifiez réflexes selon les protocoles institutionnels pour assurer le rat est totalement anesthésié.
- Placez le rat sur le côté et localiser un veine de la queue latérale.
- Stériliser la queue avec 80% d'éthanol et étiqueter un 0,5 ml EDTA ctube de ollection.
- Pour recueillir le sang, toujours commencer à l'extrémité caudale de la queue (environ un tiers du chemin long). Ceci permet de nouvelles tentatives plus proche de l'extrémité crânienne de la queue dans le cas où la première tentative échoue. Jamais rééchantillonner caudale car cela peut causer un caillot de sang.
- Positionner un 23G x 1 ¼ needle parallèle à la veine latérale et faites-le glisser dans la veine à un angle faible de sorte qu'il pénètre d'environ 10 mm (figure 3A).
- Remarque: Si la veine a été percé avec succès le sang sera visible dans l'extrémité de fixation de l'aiguille (figure 3B).
- Une goutte de sang se forme sur la queue au niveau du site de la ponction de l'aiguille. Recueillir ce sang à l'aide d'une pipette et le transfert dans les étiquetées 0,5 ml (ou plus petit) tube de collecte de l'EDTA. Pour le dosage des cellules immunitaires 25 ul est suffisante. Appliquer de la gaze avec une pression à la perforation site jusqu'à ce que le saignement cesse.
- Flick le tube de sang de mélanger le sang et de l'EDTA à PRévénement de coagulation. Conserver le temps entre le prélèvement de sang et le mélange avec l'EDTA aussi court que possible pour empêcher la coagulation.
- Lors de la collecte du sang à partir de plusieurs rats magasins échantillons EDTA-sang dans un rack à température ambiante jusqu'à l'analyse. De traitement du sang dans les 2 heures de la collecte.
4. Préparation d'échantillons pour des cellules immunitaires profilage à l'aide de la méthode fondée sur la Perle
Note: Cette méthode de plate-forme unique repose sur l'utilisation des tubes de comptage absolu disponibles dans le commerce qui ont connu un certain nombre de billes pour chaque échantillon. Ces tubes contiennent des granulés lyophilisés qui se dissolvent lors de la préparation de l'échantillon, en libérant les perles. Les perles sont marquées par fluorescence et par gating sur la population de billes, les chiffres absolus peuvent être calculés.
- Vérifiez que le EDTA échantillon de sang entier est bien mélangé en le plaçant sur un mélangeur rotatif lente pendant plusieurs minutes. Etiqueter un tube de comptage absolu pour chaque échantillon. Un culot contenant les perles devrait être visible sous til support de bille de métal au fond du tube.
- Transférer 25 ul de sang entier dans un tube EDTA de comptage absolu marqué. Le culot de bille va se dissoudre lors de l'addition du sang.
- Pour chaque tube ajouter 20 ul d'anti-rat T / B / Natural Killer (NK) cellule cocktail, 10 pi d'anti-rat CD8a PE, 10 pi d'anti-rat CD4 (domaine 1) FITC et 10 pi d'anti-rat CD45 PE / Cy7 (figure 4A). Les fluorophores sont définis dans le Tableau 1.
- Centrifuger brièvement le tube (300 xg) pour assurer les anticorps et les cellules sont dans le fond du tube et non pas collées sur le côté du tube. Vortex pour mélanger et incuber pendant 15 min à température ambiante.
- Pour lyser les globules rouges d'ajouter 400 ul de Tris 10 mM, 0,15 M de tampon chlorure d'ammonium (pH 7,5) et vortex pour mélanger. Lyse est complète lorsque l'échantillon apparaît translucide et non trouble (figures 4B et C). Défaut de lyser l'échantillon complètement conduira à augmenterd arrière-plan et faussement élevés compte lors de l'analyse par cytométrie en flux.
5. cytométrie en flux traitement des échantillons
Remarque: Effectuez une couleur 4 cytomètre de flux.
- Ouvrez le logiciel en mode d'acquisition et un nouveau modèle avec 8 parcelles comme le montre la Figure 5.
- Réglez les paramètres de l'instrument à ceux énumérés dans le tableau 1 et mettre en place la porte R1 (FITC [FL-1] par rapport APC [FL-4]), Figure 5ai) pour compter les perles fluorescentes. Les autres portes ne sont pas aussi important à ce stade de l'acquisition, mais seront nécessaires pour l'analyse. Les perles de comptage absolu utilisé dans ce protocole contiennent des colorants fluorescents et peuvent être détectés dans un canal bien sont les plus faibles dans le canal bleu.
- En utilisant un échantillon de sang de commande préparée, vortex et ensuite charger sur le cytomètre et courir à une vitesse faible (12 pi / min) sur le mode de configuration afin portes d'acquisition de données peuvent être ajustés.
- Réglez l'acquisition derecueillir 10.000 événements dans la porte de perles R1.
- Mettre en place un dossier pour enregistrer les données et de définir le nombre de fichiers et l'étiquette exemple de fichier dans le menu d'acquisition.
- Charger l'échantillon à analyser sur le cytomètre et a fixé le taux à moyen (35 pi / min) Débit. Exécutez chaque échantillon au même débit. Le débit peut avoir besoin d'être modifiée à faible (12 pi / min) ou élevée (60 pi / min), mais moyen est généralement appropriée. A ce rythme, il faut environ 90 à 120 secondes à acquérir 10.000 événements billes pour chaque échantillon.
- Une fois que l'échantillon est chargé regarder les diagrammes de dispersion à faire en sorte que les événements apparaissent dans la grille de perles R1. Initialement il peut y avoir une certaine instabilité dans la pression de l'échantillon provoquant la dérive dans les diagrammes de dispersion. Attendre que ce se stabiliser.
- Une fois stabilisé, cliquez sur acquérir et permettre échantillon de fonctionner. Une fois que le cytomètre a terminé l'acquisition de 10.000 événements perles dans le cytomètre R1 va cesser d'acquérir et de sauvegarder toutes les données.
- Retirer l'échantillon et jetez écouler tuêtre. Le cytomètre est maintenant prêt pour l'échantillon suivant. Exécutez tous les échantillons et ensuite procéder au mode d'analyse.
6. immunitaire analyse cellulaire
Remarque: les stratégies de blocage et d'algèbre de Boole sont utilisés pour définir la population de chaque cellule. Algèbre booléenne est une méthode d'analyse logique sur la base qui permet plusieurs opérations sur un seul définition. Le logiciel d'analyse du cytomètre de flux (par exemple, BD CELLQuest) permet l'utilisation de l'algèbre de Boole. Les équations sont utilisés activement pour tenir compte de la réactivité négative importante qui aide dans la définition de la cellule pour identifier plus précisément chaque population de cellules. «Régions» sont utilisés pour définir une «porte». Les régions définissent un espace à 2 dimensions alors que les portes peuvent être constituées de nombreuses régions connectées par des opérateurs algébriques (+, *, -, défini dans le Tableau 2).
- Mettez le logiciel en mode d'analyse. Un modèle d'analyse doit être généré pour correspondre Figure 5 avec les parcelles et portails indiqués.
- Analyser chaque fichier individuel (ie, chaque échantillon individuel) séparément. Mettre en place des portes R1 à R9 et à ensuite mettre en place les algorithmes pour chaque type cellulaire tel que défini dans le tableau 2 (également représenté sur la figure 5).
- Utiliser les statistiques cellulaires compteur pour calculer populations de cellules individuelles définies par les portes et les algorithmes (tableau 2 et figure 5). Les algorithmes ajuster automatiquement le nombre de cellules dans les statistiques de la cellule contre.
- Calculer des sous-ensembles de cellules en utilisant l'équation suivante:
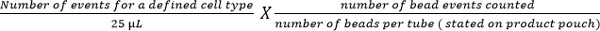
Note: Nombre d'événements cellulaires comptés (par exemple, les événements de cellules T CD4) est énumérée en utilisant l'équation ci-dessus pour donner le nombre de cellules par ml de sang. Des exemples sont montrés sur la figure 5.
Access restricted. Please log in or start a trial to view this content.
Résultats
La méthode utilisée dans ce document pour la génération d'un modèle orthotopique du mésothéliome pleural en utilisant des cellules II-45 a donné lieu à des animaux succombant à mésothéliome dans un délai reproductible et rapide, sans rats meurent en raison de la méthode d'implantation. Le titrage du nombre de cellules implantées déterminé que 1x 10 3 cellules a été le nombre minimum requis pour un modèle entièrement pénétrant (100% de la prise de greffe). Le nombre différent de...
Access restricted. Please log in or start a trial to view this content.
Discussion
Cet article détaille une méthode pour la génération d'un modèle orthotopique syngénique de rat de mésothéliome pleural et une méthode simple pour surveiller la progression de la maladie grâce à un échantillonnage de sang longitudinale.
Le modèle II-45 a été développé par l'exposition des rats Fischer 344 aux fibres d'amiante 13. Bien que cette exposition représente les vrais dynamique des interactions du système hôte-amiante-immune pour le mésothé...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The syngeneic rat mesothelioma II-45 cell line was a kind gift from A/Prof. Emanuela Felley-Bosco, Zurich University.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| EDTA Collection tube (0.5 ml) | Greiner Bio One GmbH | 450480 | |
| Rat T/B/NK Cell cocktail | BD Pharmingen | 558509 | anti-Rat CD3 APC (IgM clone 1F4), anti-Rat CD45RA Fitc (IgG1 clone OX-33), anti-Rat CD161a PE (IgG1 Clone 10/78) |
| anti-RAT CD8a PE | Biolegend | 200608 | (IgG1vClone G28) |
| anti-Rat CD4 FITC (Domain 1) | Biolegend | 203406 | (IgG1 Clone OX-38) |
| anti-Rat CD45 PE/Cy7 | Biolegend | 202214 | (IgG1 Clone OX-1) |
| TruCount Tubes | Becton Dickinson | 340334 | Box of 50 absolute counting tubes |
| RPMI 1640 media | Life Technologies | 11875-119 | |
| foetal bovine serum (FBS) | Scientifix | FBS500-S (lot# 010101-1) | |
| trypsin-EDTA | Life Technologies | 15400-054 | |
| PBS tablets | Medicago AB | 09-9400-100 | |
| 23Gx1¼ Needle | Becton Dickinson | 302008 | |
| 1 ml Syringe | Becton Dickinson | 302 100 | |
| Fischer 344 Rat | Animal Resources Centre, Perth Australia | F344 | |
| I.S.O (Isoflurane USP) | Veterinary Companys Australia (VCA) | B7058 | |
| II-45 Rat Mesothelioma line | Zurich University | Note: The cell line was given as a gift and is not commercially available at the ATCC | |
| FACSCalibur 4 color | Becton Dickinson | 342975 | |
| TRIS-HCL | SIGMA | T3253 | |
| Ammonium Chloride | SIGMA | 9718 | |
| Anaesthetic Machine (The stinger) | Advanced Anaesthesia specialists | #00449 |
Références
- Kao, S. C., et al. Malignant mesothelioma. Intern Med J. 40 (11), 742-7450 (2010).
- Zucali, P. A., et al. Advances in the biology of malignant pleural mesothelioma. Cancer Treat Rev. 37 (7), 543-558 (2011).
- Olsen, N. J., et al. Increasing incidence of malignant mesothelioma after exposure to asbestos during home maintenance and renovation. Med J Aust. 195 (5), 271-274 (2011).
- Zucali, P. A., et al. Thymidylate synthase and excision repair cross-complementing group-1 as predictors of responsiveness in mesothelioma patients treated with pemetrexed/carboplatin. Clin Cancer Res. 17 (8), 2581-2590 (2011).
- Vogelzang, N. J., et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol. 21 (14), 2636-2644 (2003).
- Lowenstein, P. R., Castro, M. G. Uncertainty in the translation of preclinical experiments to clinical trials. Why do most phase III clinical trials fail? Curr Gene Ther. 9 (5), 368-374 (2009).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Yakisich, J. S. An Algorithm for the Preclinical Screening of Anticancer Drugs Effective against Brain Tumors. ISRN Pharmacol. 2012, 513580(2012).
- Basu, D., Herlyn, M. Defining microenvironments within mouse models that enhance tumor aggressiveness. Cancer Biol Ther. 8 (4), 380-381 (2009).
- Abolhassani, M., et al. Screening of well-established drugs targeting cancer metabolism: reproducibility of the efficacy of a highly effective drug combination in mice. Invest New Drugs. 4 (4), 1331-1342 (2011).
- Hudson, A. L., et al. Establishing a panel of chemo-resistant mesothelioma models for investigating chemo-resistance and identifying new treatments for mesothelioma. Sci Rep. 4, 6152(2014).
- Iannaccone, P. M., Jacob, H. J. Rats! Dis Model Mech. 2 (5-6), 206-210 (2009).
- Craighead, J. E., et al. Characteristics of tumors and tumor cells cultured from experimental asbestos-induced mesotheliomas in rats. Am J Pathol. 129 (3), 448-462 (1987).
- Hunter, S. D., et al. Lymphocyte subset analysis by Boolean algebra: a phenotypic approach using a cocktail of 5 antibodies and 3 color immunofluorescence. Cytometry. 15 (3), 258-266 (1994).
- Brando, B., et al. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42 (6), 327-346 (2000).
- Schnizlein-Bick, C. T., et al. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Clin Diagn Lab Immunol. 7 (3), 336-343 (2000).
- Gajkowska, A., et al. Flow cytometric enumeration of CD34+ hematopoietic stem and progenitor cells in leukapheresis product and bone marrow for clinical transplantation: a comparison of three methods. Folia Histochem Cytobiol. 44 (1), 53-60 (2006).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Kao, S. C., et al. High blood neutrophil-to-lymphocyte ratio is an indicator of poor prognosis in malignant mesothelioma patients undergoing systemic therapy. Clin Cancer Res. 16 (23), 5805-5813 (2010).
- Kao, S. C., et al. Validation of prognostic factors in malignant pleural mesothelioma: a retrospective analysis of data from patients seeking compensation from the New South Wales dust diseases board. Clin Lung Cancer. 14 (1), 70-77 (2013).
- Burt, B. M., et al. Circulating and tumor-infiltrating myeloid cells predict survival in human pleural mesothelioma. Cancer. 117 (22), 5234-5244 (2011).
- Weir, C., et al. Streptavidin: a novel immunostimulant for the selection and delivery of autologous and syngeneic tumor vaccines. Cancer Immunol Res. 2 (5), 469-479 (2014).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon