Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une méthode d'évaluation des propriétés de renforcement de l'éthanol chez les rats sans eau Privation, saccharine fading ou formation d'accès étendu
Dans cet article
Résumé
Ce protocole décrit une nouvelle méthode et efficace pour initier rapidement operant répondre pour l'éthanol chez les rats que, contrairement aux méthodes classiques, ne nécessite pas la privation d'eau ou de la saccharine / saccharose fondu pour initier la réponse.
Résumé
méthodes opérants auto-administration par voie orale sont couramment utilisés pour étudier les propriétés de renforcement de l'éthanol chez les animaux. Cependant, les méthodes classiques nécessitent la saccharine / décoloration de saccharose, la privation d'eau et / ou d'une formation étendue pour initier operant répondre à des rats. Cet article décrit une nouvelle méthode et efficace pour initier rapidement operant répondre pour l'éthanol qui est pratique pour les expérimentateurs et ne nécessite pas la privation d'eau ou de la saccharine / décoloration de saccharose, éliminant ainsi le confondre potentiel de l'utilisation des édulcorants dans l'éthanol opérants des études d'auto-administration. Avec cette méthode, les rats Wistar acquièrent généralement et de maintenir l'auto-administration d'une solution d'éthanol à 20% en moins de deux semaines de formation. En outre, des concentrations et des récompenses d'éthanol sanguins sont positivement corrélés pour une séance d'auto-administration 30 min. En outre, la naltrexone, un médicament approuvé par la FDA pour la dépendance à l'alcool qui a été montré pour supprimer l'auto-administration de l'éthanolchez les rongeurs, dépendante de la dose diminue la consommation d'alcool et de la motivation à consommer de l'alcool chez les rats auto-administration de 20% d'éthanol, validant ainsi l'utilisation de cette nouvelle méthode pour étudier les propriétés de renforcement d'alcool chez les rats.
Introduction
Le développement de modèles animaux pour étudier les effets de renforcement de la drogue a prouvé un outil important pour étudier la toxicomanie humaine. Plus précisément, operant auto-administration est un modèle de comportement largement utilisé qui est l'un des moyens les plus efficaces pour évaluer les effets de renforcement positifs d'une solution d'éthanol consommée par voie orale. Une question précoce avec le développement d' un tel modèle était le goût aversif primaire des concentrations élevées d'éthanol pour la plupart des rongeurs, un phénomène qui est également partagé chez l' homme avec peu ou pas d' expérience avec de l' alcool 1. Un protocole standard pour surmonter cette barrière nécessite la privation d'eau et / ou de la saccharine ou le saccharose fondu pour l'acquisition et l'entretien de l'auto-administration. Cependant, ces deux approches ne sont pas avantageux. Ils nécessitent de longues périodes de formation pour initier simplement répondre pour l'éthanol et obtenir un taux de succès relatif de l'acquisition. L'utilisation d'édulcorants introduit également un biais potentiell'interprétation des données d'auto-administration. Ces limites ne sont pas applicables au protocole suivant.
En bref, Samson et ses collègues 2 ont montré que la dissolution de l' éthanol dans une solution douce de 20% de saccharose, puis estomper la douceur de plus de 4 semaines de formation est nécessaire pour initier la réponse pour 10% d' éthanol dans l' eau. En outre, la consommation d'éthanol fiable est habituellement obtenue en 6 à 8 semaines 1-3. Cette approche est très problématique. Premièrement, il faut de longues périodes de formation avant que les enquêteurs peuvent commencer à mesurer l'éthanol auto-administration. En revanche, auto-administration intraveineuse de cocaïne ou d' héroïne exige 0 - 1 jours de formation pré-drogue sur un levier alimentaire délivrant des animaux de nourriture restreinte, et stable pour répondre drogue est souvent réalisée en 10 - 12 jours 4,5. Une autre limitation de cette méthode réside dans le fait que la saccharine et le saccharose sont très valorisant pour les rats et provoquent motifs d'activation du cerveau similar aux drogues d'abus, introduisant ainsi le potentiel de l'éthanol confond l' auto-administration étudie 6-9. Enfin, les rats acquièrent l' auto-administration d'une solution d'éthanol à l' aide de cette méthode montrent la variabilité dans l' acquisition et le taux de réponse de 1,10, avec une proportion importante de rats systématiquement exclus des expériences en raison de l' acquisition infructueuse et / ou le taux de réponse insuffisante.
En revanche, avec ce protocole, nous présentons une méthode simple mais efficace pour l'acquisition et l'entretien des orale auto-administration d'un éthanol à 20% dans une solution d'eau qui ne nécessite pas la privation d'eau, le saccharose / saccharine fading ou de formation d'accès étendu. Une enquête récente a révélé que l'auto-administration pour l'éthanol par voie orale affiche une forme de U courbe de réponse de dose inversé avec la plus grande consommation d'éthanol pendant l'auto-administration à une concentration d'éthanol de 20%, offrant ainsi une logique de sélection de solution d'éthanol à 20% dans notre expérimental conception 11.
Protocole
Toutes les procédures sont menées en conformité avec le Guide du NIH pour les soins et l'utilisation des animaux de laboratoire.
1. Animal Care et de logement
- À l'arrivée dans la colonie, rats maison mâle Wistar pesant 200-225 g à l'arrivée par paires dans une température (21 ° C) et de l'environnement à humidité contrôlée avec un cycle de lumière-obscurité de 12 h inversée.
Remarque: Selon la logique des expériences, les rats peuvent être hébergés individuellement. - Laissez les rats s'acclimater au vivarium et le cycle de lumière pendant au moins une semaine avant de commencer une expérience et de gérer quotidiennement. Peser les animaux une fois par semaine.
- Donne rats libre accès aux chow et l' eau du robinet pour la durée de l'expérience (privation d'eau ne sont pas nécessaires pour initier la réponse 12). Effectuer tous les tests de comportement au cours de la phase d'obscurité du cycle lumière-obscurité dans une chambre d'essai sombre.
Note: Bien que nous utilisons régulièrement les jeunes adultes des rats mâles Wistar (jours postnataux 62 - 65), cette protocol peut théoriquement être approprié pour enquêter sur d'autres souches de rats, ainsi que les différences de sexe et / ou l'âge.
2. Formation Operant
- Effectuer toute la formation comportementale et d'essais dans des chambres opérantes identiques mesurant 30,5 × 29,2 × 24,1 cm et contenant des sols grillagés et des casseroles de déchets bordées de literie (changé entre les animaux pour réduire les odeurs indices), logés dans des cabines de insonorisants équipées de ventilateurs d'échappement pour la ventilation .
Note: Les rats sont formés par conditionnement opérant à partir du jour 1 de la formation (une réponse sur un levier est nécessaire pour obtenir un renforçateur) entre + 1 h et + 8 h du cycle sombre. Il n'y a pas de pré-exposition à l'alcool, ni la nourriture ou la mise en forme de liquide avant la formation de l'alcool. - Équiper chaque chambre operant avec des lumières de stimulation, pompes à seringues et deux leviers rétractables positionnées latéralement à une tasse réceptacle de liquide. chambres d'interface et de contrôle par un ordinateur en utilisant le logiciel approprié.
Remarque:La plupart des fournisseurs fourniront des paquets d'auto-administration contenant tous les composants nécessaires ainsi que les logiciels et les interfaces nécessaires pour contrôler les chambres. - Ecrire un programme opérante conditionné qui initie le calendrier rapport fixe (FR) de 20% d'éthanol renfort (un calendrier operant dans lequel une réponse est renforcée seulement après un certain nombre de réponses) selon les instructions du fabricant. Par exemple, dans un rapport fixe 1, les rats doivent produire une réponse pour obtenir un renforçateur (voir la section Fichiers de code supplémentaire pour un exemple d'un programme FR1). Exécutez les commandes suivantes.
- Prolonger deux leviers pour marquer le début de la session et signaler la disponibilité de l'alcool.
Remarque: Une simple pression de levier sur le levier associé à l'éthanol (actif) est récompensé par la fourniture d'un volume de 100 pi d'éthanol à 20% dans de l'eau dans le voisinage bien boire et initie une 5 s-période de temporisation d'élément signalé par le illumination ducue-lumière au-dessus du levier. La cue-lumière est introduit le jour 1 de la formation. - Au cours de la période de temporisation, dossier de réponse même si elle n'a pas de conséquences prévues. réponses sur l'autre levier (inactive), bien qu'ils ne jamais avoir des conséquences comportementales. Remarque: Le levier inactif sert de contrôle pour évaluer le comportement non-spécifique.
- Notez le nombre de réponses sur le levier actif (taux de réponse) et le nombre de 20% de récompenses d'éthanol gagnés.
- Au bout de 30 minutes se sont écoulées, les deux leviers se rétracter pour signaler la fin de la session, et pour signaler la fin de la disponibilité de l'alcool.
- Enregistrer et archiver toutes les données.
- Prolonger deux leviers pour marquer le début de la session et signaler la disponibilité de l'alcool.
- Avant de commencer la session de formation, vérifier le bon fonctionnement de tous les appareils dans chaque chambre opérante (leviers rétractables, distributeur de fluide).
- Préparer la solution d'éthanol v / v de 20% à partir de 190 Proof (95%) de l'éthanol dilué dans l'eau du robinet.
Remarque: une solution d'éthanol peut être conservé à température ambiante. En fonction, dépendemmentle fabricant, des solutions stocks d'éthanol peuvent être jusqu'à 99,98%. Notez également que, tandis que dans les manuscrits les plus publiés, des concentrations d'éthanol sont généralement présentées comme volume / volume, certains peuvent les présenter comme poids / volume. - Remplir la seringue avec la solution d'éthanol à 20% et assurez-vous qu'il n'y ait pas de fuites ou de bulles d'air dans les lignes de perfusion. Pousser manuellement un petit volume d'éthanol à travers les lignes de perfusion pour vous assurer que l'éthanol sera correctement livré dans le réceptacle de la première réponse renforcée. Sécher le récipient avec une serviette en papier et assurez-vous qu'il est vide avant de commencer la session.
- Chargez le logiciel qui contrôle le calendrier de FR de 20% le renforcement de l'éthanol
- operant- de train et les rats traités par un médicament selon un calendrier FR1 à l'auto-administrer 20% d'éthanol sans privation d'eau pendant 30 séances min.
- Transporter les rats du vivarium à la chambre d'essai en utilisant une cage de transport.
- Attribuez à chaque rat à une chambre.Prenez chaque rat individuel de la cage de transport et de le mettre dans la chambre d'auto-administration affectée.
- Essayez de garder les conditions de l'expérience cohérente chaque jour. Par conséquent, toujours tester les rats dans la même chambre d'auto-administration à peu près au même moment chaque jour.
- Démarrez le logiciel qui déclenche le calendrier FR1 de 20% le renforcement de l'éthanol.
- A la fin de la session, retirez les rats des chambres d'auto-administration et les retourner au vivarium.
- Afin de confirmer manuellement que la solution de l'alcool est consommé par les animaux, utilisez une serviette en papier et vérifier si le récipient est séché. En variante, utiliser une seringue de 1 ml ou 2, et collecter le fluide restant dans le récipient pour estimer le volume qui ne soit pas consommé.
Remarque: Pour une mesure plus précise (mais aussi plus cher), il est possible d'équiper chaque chambre avec un système de lickometer relié à la coupe réceptacle de liquide qui permet un comptage précis du licks produit par les rats au cours de la session d'auto-administration. - Nettoyez les parois et la grille plancher de chaque chambre avec un désinfectant de surface.
- Après utilisation, maintenir les lignes de perfusion en les nettoyant avec une solution d'éthanol à 70%. Lorsqu'ils ne sont pas en cours d'utilisation, insérez le bouchon pour éviter la moisissure et la poussière.
- Après chaque session, recueillir et analyser les données générées. Plus particulièrement, calculer le nombre moyen de presses à levier actifs, le nombre moyen de récompenses d'alcool obtenu ainsi que le nombre moyen de presses à levier inactifs.
Remarque: Dans la plupart des papiers, la consommation d'alcool est également présenté comme apport d'éthanol en g / kg (poids corporel). consommation d'éthanol peut être calculée en utilisant la formule suivante:
Avec un volume consommé (ml) - nombre de récompenses gagnées ± unitaire de volume / récompense et la densité de l'éthanol à la température ambiante - 0,789 g / mL.
Par exemple, si un rat pesant 400 g gagné 20 rewards de solution en volume / volume d'éthanol à 20%: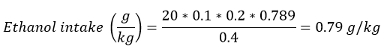
- Organiser des séances 5/6 jours par semaine jusqu'à ce que la stabilisation de la performance (défini comme un minimum de 15 sessions et aucun changement de plus de 15% du nombre total de récompenses gagnées au cours des 3 dernières séances).
Remarque: Une fois que les rats ont atteint une base stable sur FR1, le programme de conditionnement opérant peut être modifié selon les instructions du fabricant pour augmenter le nombre de réponses nécessaires pour obtenir une récompense d'alcool. Le rapport fixe peut par exemple être porté à FR2 FR3 ou pour réduire au minimum le renforcement accidentel. - Mesurer la concentration d'éthanol dans le sang:
- Pour confirmer que les récompenses obtenues dans une session d'auto-administration sont consommés par les rats, mesurer les concentrations d'éthanol de sang suivantes auto-administration. Une fois que les rats ont atteint un point de référence stable, recueillir le sang de la veine caudale latérale immédiatement aprèsla session. Insérer une aiguille de 23 G dans le vaisseau sanguin et recueillir des échantillons de sang de 50 ul en utilisant un tube capillaire.
- Transférer les échantillons de sang de 50 uL à 10 flacons Headspace ml et ajouter 50 pi de 1: 1000 de l'alcool d'isopropyle comme étalon interne. Préparer une courbe standard de 10 à 300 mg / dL par rapport aux normes de l'éthanol. Traitement des échantillons avec un échantillonneur Headspace avec une colonne de Chromatographie 13 en fonction des paramètres du fabricant.
- rapport progressif
- Utilisez horaires progressives rapport (PR) pour évaluer la motivation des animaux à consommer une récompense 14. PR est un calendrier operant dans lequel le nombre de réponses pour obtenir un renforçateur est augmentée progressivement (en d'autres termes, les rats doivent travailler plus fort pour chaque récompense successive).
Remarque: Contrairement à FR sessions, une séance de PR n'a pas expiré et ne sera terminée une fois 30 minutes est écoulé sans un rapport complété.- Placez rats dans leurs boîtes opérants assignées et permettrequ'ils répondent pour 20% d' éthanol dans un calendrier de PR de renfort: Conservez toutes les conditions expérimentales identiques à celles utilisées dans le calendrier de FR (voir étape 2.3), à l' exception d' augmenter l'exigence de réponse ou de coût au sein de la session ( à savoir, le nombre de presses à levier nécessaire sur le levier actif pour recevoir une seule récompense d'éthanol) selon la formule suivante: 1, 2, 3, 4, 6, 8, 10, 12, 16, 20, 24, 28, 32 ... Remarque: un exemple de programme de PR est fourni dans la section fichiers de code supplémentaire.
- Termine la session de PR une fois 30 minutes est écoulé sans une récompense.
Remarque: Le point d'arrêt est défini comme étant la dernière exigence de réponse complète au cours de la session de PR.
- Utilisez horaires progressives rapport (PR) pour évaluer la motivation des animaux à consommer une récompense 14. PR est un calendrier operant dans lequel le nombre de réponses pour obtenir un renforçateur est augmentée progressivement (en d'autres termes, les rats doivent travailler plus fort pour chaque récompense successive).
3. Test de la validité prédictive d'un modèle Operant d'alcool auto-administration
Note: Une fois que les rats ont acquis une base stable auto-administration (voir étape 2), il est possible d'évaluer la validité prédictive du modèle partester l'efficacité de la naltrexone, un médicament actuellement approuvé par la FDA pour la dépendance à l'alcool dans la réduction de 20% d'éthanol auto-administration. Nous vous recommandons de faire ce test sur le plus haut FR réalisés au cours de la formation (FR2), lorsque les réponses sont de manière fiable élevé. Une fois que la validité prédictive est établie, le modèle peut être utilisé pour évaluer les nouveaux médicaments candidats.
- Avant le jour du test, donner des rats injections de solution saline sous-cutanée 30 minutes avant les séances d'auto-administration pour les habituer à l'injection pendant un minimum de deux sessions d'auto-administration consécutives ou jusqu'à ce que la réponse de l'éthanol ne soit pas affectée par les injections de solution saline (définis comme aucun changement plus de 15% du nombre total de récompenses gagnées au cours des 2 dernières séances).
- Dissoudre naltrexone dans une solution saline et ajuster le pH pour atteindre la neutralité pour faciliter les injections aux animaux. Injecter le médicament à un volume de 1,0 ml / kg 30 min avant la session, en utilisant la voie sous-cutanée d'administration. Note: Les litreature fournit de bonnes preuves pour un choix de dose entre les gammes de 0,1 - 1 mg / kg, de sorte que 0,1, 0,3 et 1 mg / kg sont utilisées dans ce protocole.
Remarque: La recherche indique l' utilisation des deux voies sous - cutanée et intrapéritonéale de l' administration pour la naltrexone, bien que leur puissance peut varier avec l' injection sous - cutanée étant 30 fois plus puissant que les injections intra - péritonéales 15. Pour cette raison, nous vous recommandons d' utiliser la voie sous - cutanée que l'utilisation de cette voie pour l'injection de naltrexone a été validé et reproduit par divers laboratoires dans une gamme de concentration comprise entre 0,1 et 1 mg / kg 12,15,16. - Au cours de la journée de test, injecter des rats dans un ordre symétrique / aléatoire dans une conception inter-sujets dans l'un des quatre naltrexone dosage cycles (0, 0,1, 0,3 et 1 mg / kg) 30 minutes avant la séance d'auto-administration.
- Entre chaque cycle de dosage, permettent rats au lavage du médicament avec un minimum de deux sessions d'auto-administration consécutives ou jusqu'à ce que la réponse pouréthanol est de retour à l'état initial. Remarque: En conséquence, à la fin de l'essai, tous les rats ont été injectés avec chacune des quatre doses.
- Après cette phase, sélectionnez la dose la plus efficace (1 mg / kg) et de tester l'effet de la naltrexone sur la motivation des animaux à consommer de l'alcool en utilisant un schéma de rapport progressif (voir étape 2.12).
Résultats
La figure 1 montre le comportement d' auto-administration représentatif de rats Wistar operant- et de médicaments naïfs (huit cohortes différentes pour un montant total de 239 rats) formés sur un calendrier FR1 à l' auto-administration de 20% d' éthanol sans privation d'eau ou de la saccharine / saccharose fading lors de séances de 30 minutes. Avec ce protocole, les rats initient levier de pression pour obtenir une récompense de l' éthanol t...
Discussion
Avec ce protocole, nous présentons une nouvelle méthode pour acquérir et maintenir stable l'auto-administration par voie orale de 20% d'éthanol chez les rats que, contrairement aux modèles classiques d'éthanol auto-administration, ne nécessite pas l'utilisation de la privation d'eau, la formation d'accès étendu, ou la saccharine / saccharose fondu 12. En outre, la naltrexone, un médicament actuellement approuvé par la FDA pour la dépendance à l'alcool, diminue avec suc...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été soutenu par le Conseil suédois de la recherche.
matériels
| Name | Company | Catalog Number | Comments |
| Extra Tall MDF Sound Attenuating Cubicle, Interior: 22"W x 22"H x 16"D | Med Associates Inc. | ENV-018MD | |
| Extra Tall Modular Test Chamber with modified Top, Waste Pan and Photobeam | Med Associates Inc. | ENV-007CT-PH | |
| Stainless Steel Grid Floor for Rat or Small Primate | Med Associates Inc. | ENV-005 | |
| Retractable Lever | Med Associates Inc. | ENV-112CM | 2 by SA chambers |
| Stimulus Light, 1" White Lens, Mounted on Modular Panel | Med Associates Inc. | ENV-221M | 2 by SA chambers |
| Dual Cup Liquid Receptacle with 18 ga Stainless Steel Pipes | Med Associates Inc. | ENV-200R3AM | |
| Single Speed Syringe Pump, 3.33 rpm | Med Associates Inc. | PHM-100 | |
| Liquid Delivery Kit | Med Associates Inc. | PHM-122-18 | |
| SmartCtrl 8 Input / 16 Output Package | Med Associates Inc. | DIG-716P2 | |
| MED-PC software | Med Associates Inc. | SOF-735 | |
| http://www.mednr.com/ | Med Associates Inc. | A website that is open-source and has been created to offer researchers a place to exchange MEDState Notation code | |
| Kendall Monoject 20 cc Syringes, Regular Luer Tip | VWR International | MJ8881-520657 | |
| Ethanol, Pure, 190 Proof (95%), USP, KOPTEC | Decon Labs | 2801 | |
| 0.9% Sodium Chloride Injection, USP | Hospira | 0409-4888-50 | |
| Naltrexone hydrochloride | Sigma Aldrich | N3136-1G | |
| 23 G BD PrecisionGlide Needles | BD | 305145 | |
| Minivette POCT 50 µL, K3EDTA | Sarstedt | 17.2113.150 | For capillary blood collection |
Références
- Koob, G. F., et al. Animal models of motivation for drinking in rodents with a focus on opioid receptor neuropharmacology. Recent developments in alcoholism : an official publication. of the American Medical Society on Alcoholism, the Research Society on Alcoholism, and the National Council on Alcoholism. 16, 263-281 (2003).
- Samson, H. H. Initiation of ethanol reinforcement using a sucrose-substitution procedure in food- and water-sated rats. Alcoholism, clinical and experimental research. 10, 436-442 (1986).
- Weiss, F., Mitchiner, M., Bloom, F. E., Koob, G. F. Free-choice responding for ethanol versus water in alcohol preferring (P) and unselected Wistar rats is differentially modified by naloxone, bromocriptine, and methysergide. Psychopharmacology. , 178-186 (1990).
- Koya, E., et al. Role of ventral medial prefrontal cortex in incubation of cocaine craving. Neuropharmacology. 56, 177-185 (2009).
- Karlsson, R. M., Kircher, D. M., Shaham, Y., O'Donnell, P. Exaggerated cue-induced reinstatement of cocaine seeking but not incubation of cocaine craving in a developmental rat model of schizophrenia. Psychopharmacology. , 45-51 (2013).
- Augier, E., Vouillac, C., Ahmed, S. H. Diazepam promotes choice of abstinence in cocaine self-administering rats. Addiction biology. 17, 378-391 (2012).
- Cantin, L., et al. Cocaine is low on the value ladder of rats: possible evidence for resilience to addiction. PloS one. 5, (2010).
- Lenoir, M., Serre, F., Cantin, L., Ahmed, S. H. Intense sweetness surpasses cocaine reward. PloS one. 2, (2007).
- Spangler, R., et al. Opiate-like effects of sugar on gene expression in reward areas of the rat brain. Brain research. Molecular brain research. , 134-142 (2004).
- Rassnick, S., Pulvirenti, L., Koob, G. F. SDZ-205,152, a novel dopamine receptor agonist, reduces oral ethanol self-administration in rats. Alcohol. 10, 127-132 (1993).
- Carnicella, S., Yowell, Q. V., Ron, D. Regulation of operant oral ethanol self-administration: a dose-response curve study in rats. Alcoholism, clinical and experimental research. 35, 116-125 (2011).
- Augier, E., et al. Wistar rats acquire and maintain self-administration of 20 % ethanol without water deprivation, saccharin/sucrose fading, or extended access training. Psychopharmacology. , (2014).
- Macchia, T., et al. Ethanol in biological fluids: headspace GC measurement. Journal of analytical toxicology. 19, 241-246 (1995).
- Hodos, W. Progressive ratio as a measure of reward strength. Science. 134, 943-944 (1961).
- Williams, K. L., Broadbridge, C. L. Potency of naltrexone to reduce ethanol self-administration in rats is greater for subcutaneous versus intraperitoneal injection. Alcohol. 43, 119-126 (2009).
- Czachowski, C. L., Delory, M. J. Acamprosate and naltrexone treatment effects on ethanol and sucrose seeking and intake in ethanol-dependent and nondependent rats. Psychopharmacology. , 335-348 (2009).
- Stromberg, M. F., Volpicelli, J. R., O'Brien, C. P. Effects of naltrexone administered repeatedly across 30 or 60 days on ethanol consumption using a limited access procedure in the rat. Alcoholism, clinical and experimental research. 22, 2186-2191 (1998).
- Stromberg, M. F., Casale, M., Volpicelli, L., Volpicelli, J. R., O'Brien, C. P. A comparison of the effects of the opioid antagonists naltrexone, naltrindole, and beta-funaltrexamine on ethanol consumption in the rat. Alcohol. 15, 281-289 (1998).
- Gonzales, R. A., Weiss, F. Suppression of ethanol-reinforced behavior by naltrexone is associated with attenuation of the ethanol-induced increase in dialysate dopamine levels in the nucleus accumbens. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 10663-10671 (1998).
- Biggs, T. A., Myers, R. D. Naltrexone and amperozide modify chocolate and saccharin drinking in high alcohol-preferring P rats. Pharmacology, biochemistry, and behavior. 60, 407-413 (1998).
- Beczkowska, I. W., Bowen, W. D., Bodnar, R. J. Central opioid receptor subtype antagonists differentially alter sucrose and deprivation-induced water intake in rats. Brain research. 589, 291-301 (1992).
- Cooper, S. J. Effects of opiate agonists and antagonists on fluid intake and saccharin choice in the rat. Neuropharmacology. 22, 323-328 (1983).
- Samson, H. H., Pfeffer, A. O., Tolliver, G. A. Oral ethanol self-administration in rats: models of alcohol-seeking behavior. Alcoholism, clinical and experimental research. 12, 591-598 (1988).
- Koob, G. F., Weiss, F. Pharmacology of drug self-administration. Alcohol. 7, 193-197 (1990).
- Schank, J. R., et al. The Role of the Neurokinin-1 Receptor in Stress-Induced Reinstatement of Alcohol and Cocaine Seeking. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. , (2013).
- Avena, N. M., Bocarsly, M. E., Rada, P., Kim, A., Hoebel, B. G. After daily bingeing on a sucrose solution, food deprivation induces anxiety and accumbens dopamine/acetylcholine imbalance. Physiology. 94, 309-315 (2008).
- Avena, N. M. The study of food addiction using animal models of binge eating. Appetite. 55, 734-737 (2010).
- Morgan, D., Sizemore, G. M. Animal models of addiction: fat and sugar. Current pharmaceutical design. 17, 1168-1172 (2011).
- Lenoir, M., Cantin, L., Vanhille, N., Serre, F., Ahmed, S. H. Extended heroin access increases heroin choices over a potent nondrug alternative. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 38, 1209-1220 (2013).
- Augier, E., et al. The mGluR2 Positive Allosteric Modulator, AZD8529, and Cue-Induced Relapse to Alcohol Seeking in Rats. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 41, 2932-2940 (2016).
- Bice, P. J., Kiefer, S. W. Taste reactivity in alcohol preferring and nonpreferring rats. Alcoholism, clinical and experimental research. 14, 721-727 (1990).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon