Method Article
Isolement et compositionnelle Analyse des plantes cuticules lipidiques polyester monomères
Dans cet article
Résumé
Lipid polyesters constitute the structural components of two cell wall modifications, the plant cuticle and suberin-containing diffusion barriers. In this video, we describe a method to depolymerize cutin from whole delipidated leaves. The method can be applied to investigating mutants compromised in either cutin or suberin biosynthesis.
Résumé
Terrestrial plants produce extracellular aliphatic biopolyesters that modify cell walls of specific tissues. Epidermal cells synthesize cutin, a polyester of glycerol and modified fatty acids that constitutes the framework of the cuticle that covers aerial plant surfaces. Suberin is a related lipid polyester that is deposited on the cell walls of certain tissues, including the root endodermis and the periderm of tubers, tree bark and roots. These lipid polymers are highly variable in composition among plant species, and often differ among tissues within a single species. Here, we describe a detailed protocol to study the monomer composition of cutin in Arabidopsis thaliana leaves by sodium methoxide (NaOMe)-catalyzed depolymerisation, derivatization, and subsequent gas chromatography-mass spectrometry (GC/MS) analysis. This method can be used to investigate the monomers of insoluble polyesters isolated from whole delipidated plant tissues bearing either cutin or suberin. The method can by applied not only to characterize the composition of lipid polymers in species not previously analyzed, but also as an analytical tool in forward and reverse genetic approaches to assess candidate gene function.
Introduction
Les plantes vasculaires reposent sur des couches extracellulaires qui fonctionnent comme des barrières étanches entre les tissus végétaux et l'environnement externe. Ces structures de parois cellulaires associées à une infection pathogène lipophile limitent et régulent le transport passif de gaz, l'eau et les substances dissoutes dans et hors des tissus végétaux 1. Ces obstacles sont la cuticule de la plante, une structure unique de plantes synapomorphes 2, et les différentes barrières de diffusion contenant subérine. La cuticule est une couche oléophile synthétisé par les cellules épidermiques et lié à eux par l'intermédiaire d'une couche de pectine sur le côté extracellulaire de la paroi cellulaire 5.3. Il enveloppe les organes aériens primaires de plantes supérieures, fonctionnant comme une interface vitale entre les tissus végétaux et l'environnement.
Cutin, la matrice de structure de la cuticule, et subérine sont deux polyesters glycérolipides insolubles associés avec des cires solvant extractibles 2,4. Ces l polymèreipids sont constitués de dérivés saturés et insaturés et d'acides gras sont à la fois structurellement et fonctionnellement similaire. Toutefois, elles se distinguent par des différences dans les caractéristiques de composition et de dépôt des sites chimiques.
Subérine est un polyester aliphatique situé à l'intérieur des parois cellulaires de certains tissus externes et internes formant une paroi secondaire. Tissus subérisées comprennent péridermes de racines, de tubercules et de l'écorce d'arbre, endoderme profondes, couches de revêtement de semences, et les plaies guéries 2. Contrairement à la cutine, la subérine de polyester contient typiquement des alcools, des acides dicarboxyliques saturés et mono-insaturés, et une grande proportion de monomères à très longue chaîne (C≥20).
Cutin polyester lipidique est le plus abondant dans les plantes vasculaires 6, et est composé de glycérol et en C16-C18 dérivés d'acides gras interestérifié, tels que les acides gras hydroxy et hydroxy-4 époxy substitué. Bien que la composition de polymères cutinevarie selon les espèces de tracheophyte, les monomères principaux sont plus prédominants 10, 16-dihydroxy 16: 0, 18-hydroxy-9,10-époxy 18: 0, et 9,10,18-trihydroxy 18: 0 des acides gras. Fait intéressant, la feuille et la tige Arabidopsis cutine est composé principalement de 18: 2 acide dicarboxylique 7,8.
Cuticules végétales présentent aussi une grande variabilité dans l'épaisseur, allant de quelques nanomètres à plusieurs micromètres 9. Depuis l'isolement de la cuticule est une étape laborieuse et prend du temps, en particulier pour les très minces cuticules des feuilles tels que ceux d'Arabidopsis thaliana 8, méthodes qui contournent l'isolement de la cuticule ont été développés et validés 7,8. Ici, nous décrivons un protocole détaillé pour étudier la composition de monomères de cutine dans des feuilles d'Arabidopsis thaliana par le méthoxyde de sodium (NaOMe) et dépolymérisation catalysée par chromatographie en phase gazeuse subséquente / spectrométrie de masse (CG / SM) d'analyse. Ce protocole offre une méthode robuste pour le dosage de la composition de polyesters de lipides dans les tissus de la plante délipidés entiers, et a été adapté à partir de protocoles précédemment rapportés 7,10,11. Des échantillons de tissus entiers sont d'abord homogénéisé et exhaustive délipidé, enlever les lipides solvant extractible y compris la cuticule et les cires épicuticulaires, lipides membranaires, et triglycérides. Des résidus de parois cellulaires sont enrichis ensuite dépolymérisés en leurs monomères constitutifs ester méthylique par du méthylate de sodium méthanolyse catalysée. Gras esters méthyliques d'acide sont extraites lors de l'acidification et dérivés pour obtenir leurs dérivés triméthylsilyle ou acétyle correspondantes. Résidus dérivés sont très volatiles et peuvent être éluées d'une colonne de chromatographie en phase gazeuse à une température raisonnable sans modification de leur conformation structurelle lors de l'analyse GC / MS.
Protocole
Remarque: Ce protocole a été adapté à partir de Bonaventure et al. (2004), Molina et al. (2006), Li et al. (2013) 7,10,11. Les étapes 1-5 sont résumés dans la figure 1.
1. délipidation tissulaire
Remarque: Toujours rincer la verrerie et les bouchons avec du chloroforme, laissant à sec sous une hotte, avant de l'utiliser.
ATTENTION: Effectuer homogénéisation des tissus et toutes les étapes de transfert de solvant sous une hotte; toujours porter blouse de laboratoire, des gants et des lunettes de sécurité anti-éclaboussures pour éviter le contact direct avec des produits chimiques et de protéger les échantillons de la contamination.
- Préchauffer le bain d'eau et le bloc thermique à 85 ° C.
- Peser environ 0,5 g de chaque échantillon de feuille en mm x 125 tubes à essai en verre de 20 mm avec pré-pesé polytétrafluoroéthylène (PTFE) -faced bouchons à vis. Inclure quatre répétitions par échantillon.
- Placez 2-propanol dans un Erlenmeyer (environ 125 ml; 25 ml par g de sample). Ajouter 2,6-di-tert-butyl-4-méthylphénol (également connu comme l'hydroxytoluène butylé, le BHT) à une concentration finale de 0,01% (p / v).
Remarque: Ajouter BHT à partir d'un 5% (p / v) solution stock dans le méthanol (BHT aide minimiser l'oxydation des acides gras insaturés). - Préchauffer la solution de 2-propanol à 85 ° C dans un bain d'eau.
- Ajouter 12 ml chaude solvant 2-propanol à chaque tube de l'échantillon et de la chaleur pendant 15 min à 85 ° C dans le bloc thermique. Cette étape inactive lipases qui peuvent être émises à partir de cellules rompues.
- Laissez tubes de refroidir à la température ambiante et broient les tissus soigneusement avec homogénéisateur jusqu'à obtenir une suspension homogène.
- Placer les échantillons dans un agitateur orbital et agiter pendant 1-2 heures à 100 tours par minute et la température ambiante.
- Centrifuger pendant 10 min à 800 xg et éliminer le surnageant.
- Ajouter un volume égal de 2-propanol et agiter pendant 12 heures à température ambiante.
- Centrifuger pendant 10 min à 800 xg et éliminer le surnageant.
- Ajouter 12 ml CHCl 3: CH 3 OH (2: 1, v / v) au résidu (25 ml par g de l'échantillon) et agiter une nuit à 100 tours par minute et la température ambiante.
- Centrifuger pendant 10 min à 800 xg et éliminer le surnageant.
- Ajouter 12 ml CHCl 3: CH 3 OH (1: 2, v / v) au résidu et agiter une nuit à 100 tours par minute et la température ambiante.
- Centrifuger pendant 10 min à 800 xg et éliminer le solvant.
- Laissez sécher les échantillons sous une hotte pendant une nuit à température ambiante.
- Air-sécher le résidu, puis placer dans un dessiccateur à vide sur CaCl2 anhydre ou CaSO 4 jusqu'à poids constant (3-5 jours).
2. dépolymérisation: méthanolyse avec le méthylate de sodium (Figure 2)
ATTENTION: Effectuer les étapes 2.3 à 2.4, 2.7 à 2.8, 2.10 à 2.11, 2.13 à 2.15 et 2.17 à 2.18 sous une hotte; toujours porter blouse de laboratoire, des gants et des lunettes de protection contre les éclaboussures.
- Préchauffer le bloc de chauffage à 60 ° C.
- Peser tubes à essai contenant le résidu sec (important pour d'autres calculs).
- Ajouter normes internes à chaque tube: 25 ωL heptadécanoate de méthyle (1 mg / ml d'achat d'actions) et 25 ul ω-pentadécalactone (1 mg / ml d'achat d'actions).
- Ajouter 0,9 ml d'acétate de méthyle, 1,5 ml de méthylate de sodium et 3,6 ml de methanol à chaque tube et les coiffer. En variante, préparer un mélange de réaction de ces trois réactifs et ajouter des aliquotes de 6 ml de chaque échantillon.
- Des échantillons de la chaleur pendant 2 heures à 60 ° C et vortex périodiquement dans des intervalles de 15 min.
- Laissez refroidir les échantillons à la température ambiante.
- Ajouter 10 ml de dichlorure de méthylène (CH 2 Cl 2) et 1,5 ml d'acide acétique glacial pour extraire les esters méthyliques d'acides gras.
- Ajouter une solution saline (NaCl 0,5 M) pour remplir chaque tube et bouchon.
- Échantillons Vortex pendant 1 min et centrifuger pendant 10 min à 800 x g.
- Transférer la phase organique (inférieure) pour nettoyer les tubes de taille moyenne (16 x 125 tubes à essai en verre mm avec polytétrafluoroéthylène (PTFE) de bouchon à vis -faced).
- Ajouter une solution saline (NaCl 0,5 M) pour remplir chaque tube et bouchon.
- Échantillons Vortex pendant 1 min et centrifuger pendant 10 min à 800 x g.
- Retirer phase aqueuse (supérieure) et répétez les étapes 02.11 à 02.12.
- Retirez tout phase aqueuse (supérieure).
- Ajouter sulfate de sodium anhydre (Na 2 SO 4) pour le solvant, coiffer les tubes et les vortex pendant 1 min; échantillons peuvent maintenant être laissés jusqu'au lendemain. À ce point les échantillons peuvent être laissés toute la nuit sous la hotte.
- Centrifuger pendant 2 min à 800 x g pour compacter le Na 2 SO 4 dans le fond de sel.
- Transférer la phase organique dans un tube jetable petit verre (13 x 100 mm des tubes à essai en verre avec de polytétrafluoroéthylène (PTFE) de bouchon à vis -faced).
- Evaporer le solvant à siccité sous azote et passer à l'étape de dérivatisation. Si pas traités immédiatement, magasin évaporé échantillons à -20 ° C (échantillons peuvent être unlso stocké avant l'étape d'évaporation).
3. Préparation de dérivés pour chromatographie en phase gazeuse
ATTENTION: Effectuer les étapes 3.1.2 et 3.1.5 - 3.1.8 sous une hotte; toujours porter blouse de laboratoire, des gants et des lunettes de protection contre les éclaboussures.
- Dérivés triméthylsilyle
- Préchauffer le bloc de la chaleur à 100 ° C.
- Ajouter 100 ul de pyridine et 100 ul de BSTFA (N, O bis-triméthylsilyl-trifluoroacétamide) à chaque tube et les coiffer.
- Des échantillons de chaleur à 100 ° C pendant 10 min.
- Laissez refroidir les échantillons à la température ambiante.
- Évaporer échantillons sous azote à la température ambiante. Éviter l'application de chaleur à des échantillons, les monomères sont très volatiles à ce stade.
- Ajouter 500 ul de 1: 1 (v / v) d'heptane: toluène.
- Échantillons Vortex pendant 1 min et centrifuger 2 min à 800 x g.
- Ajouter échantillons dans des flacons de GC et de procéder à l'analyse GC / MS.
- Acétyldérivés
Remarque: Pour acétylation, modifier étapes 3.1.1-3.1.3 ci-dessus comme suit (non représenté sur la vidéo); 3.1.4-3.1.8 étapes sont les mêmes:- Préchauffer le bloc de chauffage à 60 ° C.
- Ajouter 100 ul de pyridine et 100 ul d'anhydride acétique (Ac 2 O) vers les tubes.
- Échantillons de chaleur de 1 heure à 60 ° C.
4. GC / MS Analysis
- Utilisez une colonne (30 mx 0,25 mm x 0,25 um d'épaisseur de film) ou équivalent (ie., 5% diphényle, 95% diméthylpolysiloxane) HP-5 capillaire. Programme GC avec le flux de gaz porteur d'hélium fixé à 1,5 ml / min et la température du four programmée de 150 à 300 ° C à 3 ° C / min.
- Utilisez injection split (rapport de division de 1:10) et définir spectromètre de masse en mode numériser sur 40-600 uma (ionisation par impact électronique).
- Créer une table de séquence y compris des solvants (vierge), WT et répétitions mutantes, chacun utilisant la méthode d'analyse cutine indiqué.
- Solvant de chargeet flacons d'échantillon sur le carrousel, ajoutent hexane dans des flacons de seringues-rinçage dans l'échantillonneur automatique si nécessaire, et de commencer la séquence. Après la séquence est terminée, le total des traces de chromatogramme d'ions sont disponibles pour tous les échantillons.
Analyse des données 5.
- Identifier les monomères de polyester lipidique en comparant le spectre de masse de chaque pic de spectres de masse publié ou en recherchant une bibliothèque commerciale si disponible.
- Pour chaque pic identifié dans le chromatogramme ionique total actuel, utiliser leurs temps de rétention respectifs de trouver les zones sur le tableau des résultats d'intégration à partir du logiciel GC / MS (Figure 1 supplémentaire).
- Pour chaque monomère (colonnes AB), ajoutez les valeurs de la zone trouvés dans le tableau de l'intégration (figure supplémentaire 1, colonne D) à la colonne correspondante pour chaque répliquer échantillon dans le tableau Excel de monomères (Fichier supplémentaire 2, colonnes FC), qui est une feuille de calcul pour quantifier Arabidopsisdérivés cutine TMSi. Utilisez la commande Fichier supplémentaire 3 si dérivés acétylés sont préparés à la place.
- Ajouter les domaines des normes internes (IS) à colonnes est (HK). Pour les monomères qui ne sont pas transformés en dérivés, les esters méthyliques savoir d'acides gras (EMAG), et esters de diméthyle d'acide dicarboxyliques (DCA PDEM), utiliser 17: 0 FAME (IS1) comme il est, pour la quantification (cellules violettes-ombragée dans le tableau de monomère; supplémentaire Fichiers 2/3). Pour les monomères hydroxylés, y compris les alcools primaires, l'acide férulique et des acides ω-hydroxy, utiliser 15: 0 FAME 15-hydroxy (IS2), tout comme de choix pour la quantification de composés (cellules vertes-parties ombragées dans le tableau de monomère; fichiers supplémentaires 2/3) .
- Ajouter du poids à sec de la feuille pour chaque répliquer aux colonnes AX-BA (Fichier supplémentaire 2) ou AQ-AT (Fichier supplémentaire 3); alternativement, balayer les feuilles pour calculer les zones de surface et ajouter des valeurs de la zone à la table de monomère pour exprimer des charges par unité de monomèressurface.
Résultats
Le protocole décrit dans ce manuscrit est mis en place pour déterminer lipides monomères de polyester, de minimiser les apports de lipides non-cutine 10 la figure 1 présente un aperçu de l'analyse, qui prend au total entre 8 (c.-à-cutine ou subérine.) -. 10 jours (à partir de prélèvement de tissu initial pour obtenir des données de GC), en fonction du temps des échantillons sont mis à sécher.
La méthanolyse catalysée par une base choisie (figure 2) Procédé pour dépolymériser des polyesters a été préalablement validé pour les graines d'Arabidopsis, qui contiennent à la fois la cutine et subérine. Les tissus sont d'abord homogénéisés et exhaustive délipidées à éliminer les lipides solvant-extractibles. Le rendement de résidu après extraction, en pourcentage du poids frais initial, est habituellement de 6% pour A. thaliana Col-0 feuilles. Des résidus de parois cellulaires enrichies sont séchés dans un dessiccateur sous vide et ensuite dépolymérisés en leurs monomères d'ester méthylique constitutifs parcatalysée par une base transmethylation. Incubation de deux heures a été choisi comme le temps critique nécessaire pour la dépolymérisation et la récupération des composants de polyester lipidiques appropriée. De plus longs temps d'incubation conduit à augmentation des acides 2-hydroxy; ceux-ci proviennent de sphingolipides potentiellement à membrane 10.
Un chromatogramme typique si Arabidopsis de type sauvage feuilles cutine est montré dans la figure 3, pour les dérivés O -TMSi éther (figure 3A) et dérivés de O-acétyl (figure 3B). Chaque pic a été identifié par comparaison de spectres de masse à partir de la littérature 7,8 et une base de données publique 12 .Our protocole vidéo montre comment préparer des dérivés TMSI, mais peut en variante être des échantillons acétylé pour dériver des groupes hydroxyle. Dérivés silylés sont bonnes pour des fins d'identification parce qu'ils donnent des spectres de masse de diagnostic. Cependant, les dérivés acétylés sont plus stables et une bonne alternative à Silylationmonomères fois ont été identifiés 10. Pour aider à mettre en œuvre ce protocole dans les laboratoires qui ont seulement GC couplé à ionisation de flamme détecteur (FID), GC / FID traces correspondant à des dérivés acétylés de WT monomères feuille de cutine et à une série homologue des normes d'esters méthyliques gras d'acide sont également représentées (figure supplémentaire 4).
Cette méthode est qualitative et détecte des différences quantitatives entre les échantillons, d'où sa valeur pour l'analyse mutant. Les quantités de monomères individuels sont déterminées en utilisant la méthode standard interne de quantification, permettant des comparaisons d'abondance de monomère entre les échantillons. Il convient de préciser, cependant, que la taille maximale (compteurs d'ions totaux) peut ne pas refléter les rapports molaires des monomères dans le polyester. Nous incluons des tableaux modifiables de monomères pour calculer les montants de monomères dans Arabidopsis feuille cutine que les esters d'acides gras de méthyle et les dérivés TMSi (Fichier supplémentaire 1), ou ACE dérivés tyl (Fichier supplémentaire 2) d'alcools. Peuvent avoir besoin d'être adapté si les échantillons sont extraites de différents organes ou d'espèces végétales Ces tableaux.
A titre d'exemple, nous avons analysé Arabidopsis Thalia na-Britannique (Col-0) de feuilles de type sauvage et deux allèles nuls mutant précédemment caractérisés du gène CYP86A2 / ATT1, att1-1 (m-1) et att1-2 (m-2 ) 13,14. Monooxygénases cytochrome P450 de la sous-famille de CYP86A codent oméga-oxydases putatifs et participent à la subérine et cutine biosynthèse de monomère. Les résultats (figure 4) montrent des réductions significatives de la charge de monomères trois principaux lipides dans les feuilles de mutants par rapport aux feuilles WT. En accord avec la fonction de l'enzyme prédite, 16: 0, 18: 2 et 18: 1 dicarboxylates ont été spécifiquement affectés à des mutants de att1.
"Src =" / files / ftp_upload / 53386 / 53386fig1.jpg "/>
Figure 1. Aperçu de l'analyse de polyester lipidique. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
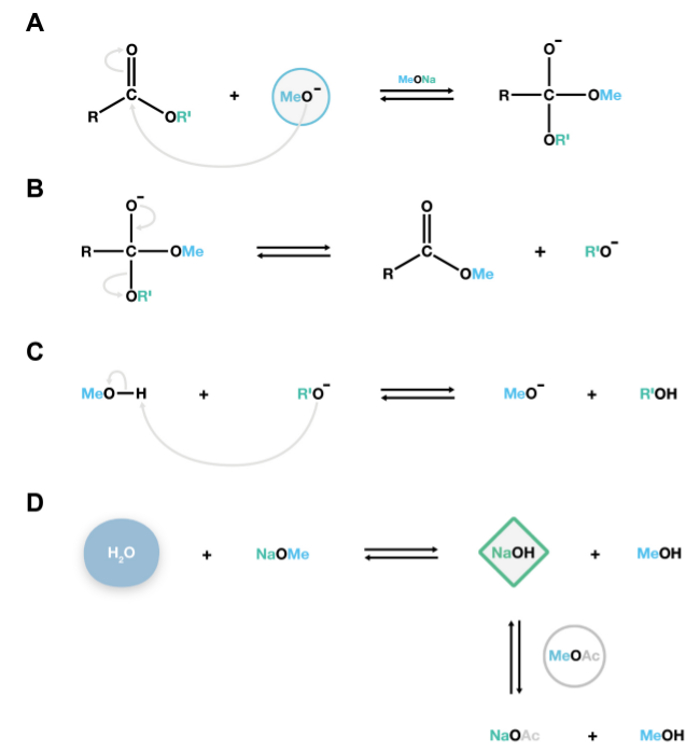
Figure 2. Mécanisme de la réaction de transméthylation NaOMe catalysée. Les anions méthoxyde nucléophile attaque le carbone cabonyl de polyesters de lipides pour former un instable intermédiaire tétraédrique (A), qui se dissocie facilement en esters méthyliques d'acides gras et les anions alcoolates (B). Ces alcoxydes sont des bases conjuguées, et de réagir avec le methanol, la régénération des anions méthoxyde catalytiquement actifs, soutenant ainsi les réactions de dépolymérisation supplémentaire (C). Si de l'eau est présent dans lesystème, il va réagir avec du méthylate de sodium pour former de l'hydroxyde de sodium, une base forte qui hydrolyse de manière irréversible pour produire des esters d'acides gras libres indésirables. L'acétate de méthyle est ajouté comme co-solvant 15 pour éliminer les petites quantités d'hydroxyde de sodium dans le système (D). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
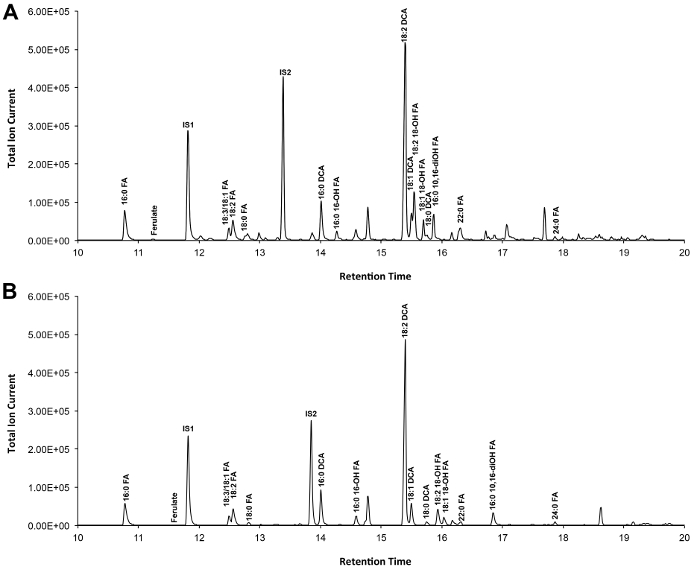
Figure 3. Représentant de chromatogramme ionique total de type sauvage monomères cutine Arabidopsis thaliana de feuilles. (A) O -trimethylsilyl (TMSi) éther et (B) des dérivés hydroxyles acétate. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
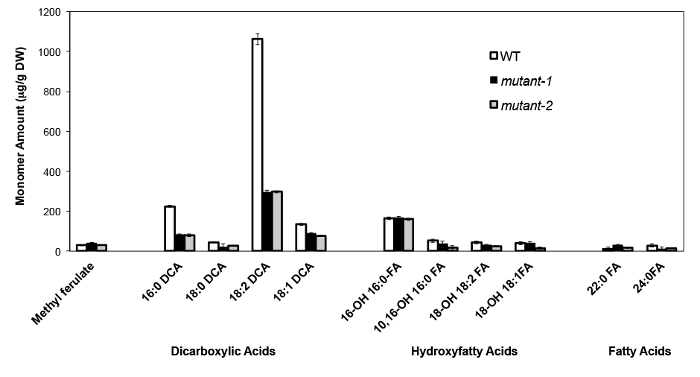
Figure 4. Composition de monomère Cutin d'Arabidopsis thaliana WT et deux alleles mutants nuls du gène CYP86A2. (Mutant att1-1-1 =; = 2-mutant att1-2) barres d'erreur représentent l'écart type de la moyenne (n = 4) . Adapté à partir du 13, avec la permission de © Blackwell Publishing (2007). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
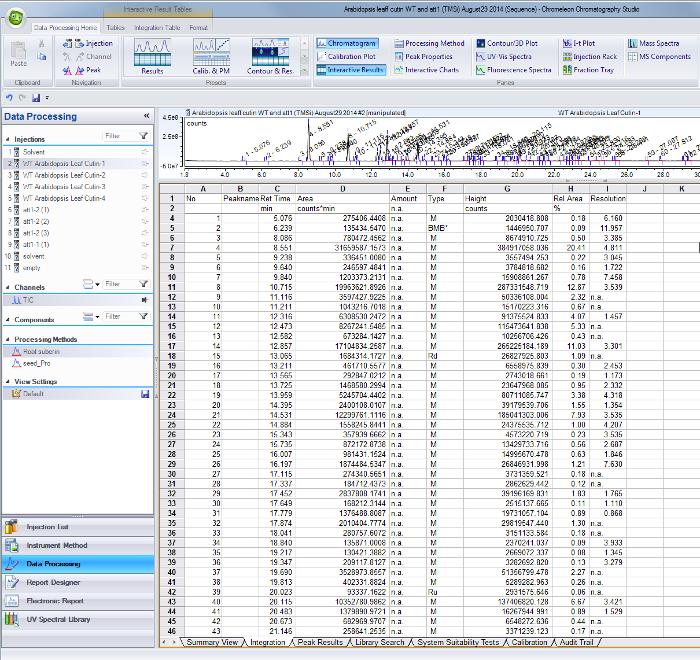
Figure supplémentaire 1. Pic résultats d'intégration table à partir du logiciel GC / MS. Pics correspondant aux monomères identifiés et des normes internes sont identifiés par leur retenti sur le temps (colonne C) et les valeurs de la région sont indiquées dans la colonne D. S'il vous plaît cliquez ici pour télécharger ce fichier.
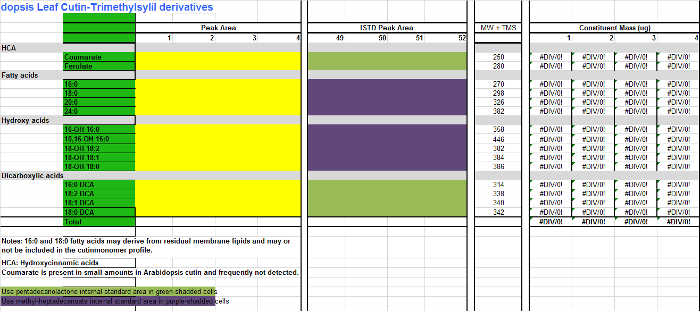
Fichier supplémentaire 2. Table des Arabidopsis monomères cutine (dérivés d'éthers de triméthylsilyle de hydroxy esters méthyliques d'acides gras). S'il vous plaît cliquer ici pour télécharger ce fichier.
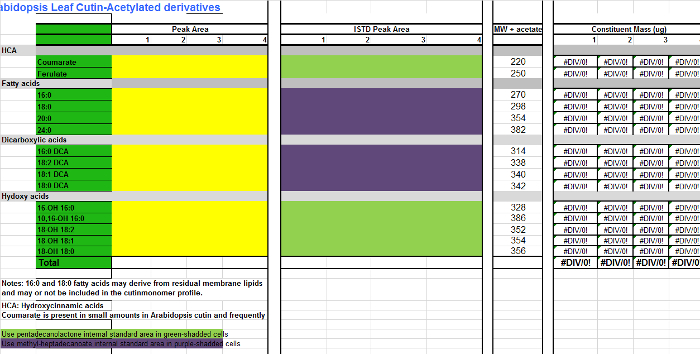
Tableau 3. Fichier supplémentaire de monomères Arabidopsis cutine (dérivés O-acétyl d'hydroxy esters méthyliques d'acide gras).com / files / ftp_upload / 53386 / Supplemental_File_3_Cutin_template_Acetylated_derivatives.xlsx "target =" _ blank "> S'il vous plaît cliquer ici pour télécharger ce fichier.
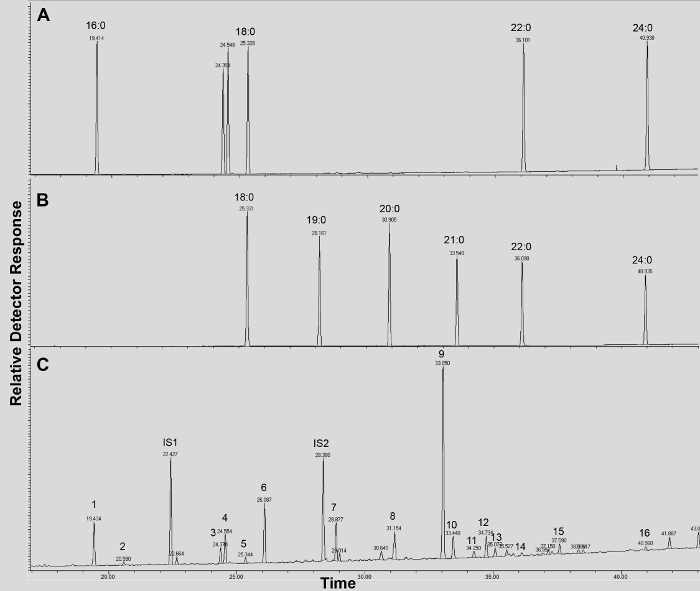
Supplement figure 4. GC / FID de traces (AB) ester gras méthylique de l'acide (FAME) des normes d'indice de rétention (pics sont marqués avec chaque FAME saturés de longueur de chaîne); et (C) acétyle A. thaliana WT feuilles monomères cutine. Numéros sur la visière correspondent à: 16: 0 FAME (1), férulate (2), 18: 3 FAME (3), 18: 1/18: 2 FAMEs (4), 18: 0 FAME (5), sinapate (6 ), 16: 0 DCA (7), 16-OH 16: 0 FAME (8), 18: 2 DCA (9), 18: 1 DAC (10) 18: 0 DCA (11), 18-OH 18: 2 FAME (12), 18-OH 18: 1 FAME (13), 20: 0 FAME (14), 10,16 diOH-16: 0 FAME (15), 24: 0 FAME (16). DCA: ester diméthylique de l'acide dicarboxylique; FAME: ester méthylique d'acide gras; IS1: standard interne 1, 17: 0 FAME; IS2: st interneAndard 2, 15-OH 15: 0 FAME. S'il vous plaît cliquer ici pour télécharger ce fichier.
Discussion
Contrairement à d'autres biopolymères tels que les protéines et l'ADN, des polyesters de lipides des plantes ne sont pas fabriquées à partir d'un modèle. Au lieu de cela, leurs compositions dépendent de la spécificité des enzymes présentes dans les tissus qui font de ces polymères extracellulaires. Comme de telles analyses, chimiques du constituant composants sont essentiels pour comprendre la composition de polyester lipidique.
Les méthodes chimiques pour couper des liaisons ester comprennent saponification, l'hydrogénolyse, transmethylation catalyse acide, et catalysée par une base transmethylation 2. Chacun d'eux a ses avantages et ses inconvénients. Saponification produit des acides gras hydroxyles libres qui peuvent subir des réactions secondaires. L'hydrogénolyse avec de l'hydrure de lithium-aluminium (LiAlH 4) 16 a été utilisé pour l'analyse de la cutine 7. Hydrogénolyse réduit carbones fonctionnalisés d'alcools et les structures originales doivent être inférée par deuteriolysis de lithium-aluminium deutérure (LiAlD 4). Lainconvénient de cette approche est l'exigence de haute résolution GC / MS de comparer le degré de deuteriation des polyols gras obtenus à effectuer des affectations de leurs structures. Transestérification à catalyse acide avec méthanolique de trifluorure de bore (BF3) a été fréquemment utilisé dans la cutine et subérine dépolymérisations 8,17,18, mais le réactif a une durée de vie limitée et peut introduire des artefacts dus à des réactions secondaires 15. L'acide sulfurique méthanolique donne aussi des esters méthyliques des monomères mais avec de plus grandes proportions d'acides gras 2-hydroxy, qui sont probablement pas de vrais composants de polyester de lipides, par rapport à 10 d'autres méthodes.
Le procédé de transestérification NaOMe catalysée décrit dans le présent protocole produit des esters méthyliques d'acides gras qui sont transformés en dérivés par silylation des groupes hydroxyle, en fournissant les spectres de masse caractéristique d'identification, ou par acétylation pour donner des dérivés plus stables de groupes hydroxyle for quantification. Un inconvénient de cette technique est que l'hydrolyse est en concurrence avec la transestérification en présence d'eau dans la réaction. L'eau réagit avec NaOMe (le catalyseur) et de NaOH produit, qui à son tour hydrolyse des esters gras méthyliques d'acide pour donner les acides libres (Figure 2D). Ceci est une réaction secondaire indésirable parce que deux pics sont présents pour chaque acide gras: un ester de méthyle et d'un dérivé d'ester TMSi, ce qui complique l'analyse. En utilisant des réactifs anhydres et en ajoutant de l'acétate de méthyle comme co-solvant de rivaliser avec saponification sont des étapes cruciales pour empêcher ainsi l'hydrolyse (figure 2D).
Cutine et subérine contiennent entre 1 et 26% de glycerol 4. Toutefois, ce monomère ne sera pas détecté par les conditions expérimentales décrites dans ce protocole. Le glycérol est hautement hydrophile et, à la différence des monomères d'ester de méthyle d'acide gras, seront éliminées au cours des étapes solvant aqueux de lavage. Cette limitation a égalementpplies à d'autres méthodes de dépolymérisation cutine, mais glycerol peuvent être déterminées dans la couche aqueuse obtenue après la transestérification en utilisant une méthode enzymatique. En variante, il peut être quantifiée en utilisant des conditions plus douces (par exemple., 0,05 M de NaOMe) sans autre extraction à l'eau afin de détecter tous les monomères, y compris le glycérol 19,20 .Bien utile à des fins de quantification glycérol, des conditions douces donnent généralement dépolymérisation incomplète de la cutine et subérine.
Si un GC couplée à un détecteur à ionisation de flamme (FID) est disponible, toutes les répétitions peuvent être analysés dans cet instrument à des fins quantitatives, après les pics d'un échantillon représentatif ont été identifiés par GC / MS. Alternativement, les monomères dans les GC / FID traces peuvent être identifiés si leurs indices de rétention sont connus. Le détecteur à ionisation de flamme a surtout une sensibilité élevée et une large gamme de proportionnalité, ce qui est essentiel pour la quantification des majeurs et mineurs composants de l'échantillondans les courses individuelles. En outre, il est robuste et facile à entretenir et exploiter 15.
Le protocole décrit permet l'isolement fiable et reproductible, l'identification et la quantification des lipides des plantes monomères de polyester, ce qui permet la caractérisation chimique des mutants qui diffèrent par la composition d'un ou plusieurs monomères de polyester lipidiques. La procédure est évolutif, il peut être facilement adapté pour traiter à la fois les petites et les grosses quantités de diverses matières végétales, y compris les racines, graines, feuilles, tiges et fleurs. Données spectrales de masse de lipides polyester monomères de nombreuses espèces ont été publiés par ex., 21-26 et constituent des ressources précieuses pour identifier les monomères inconnus lors de l'adaptation de ce protocole à d'autres tissus et / ou espèces. Cette méthode est applicable aux enquêtes de la biosynthèse, la réglementation, et la distribution de polyesters lipidiques chez les plantes supérieures.
Déclarations de divulgation
No conflicts of interest declared.
Remerciements
This work was supported by a Natural Sciences and Engineering Research (NSERC)-USRA grant to S.J., and by an NSERC-Discovery Grant to I.M. We thank Richard Bourgault, Meghan Rains, and Amanda Fluke for technical assistance. Seeds of att1-1 and att1-2 mutants were kindly provided by Dr. Jian-Min Zhou, Institute of Genetics and Developmental Biology, Beijing, China.
matériels
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-propanol | Fisher Scientific | BPA451-4 | Solvent for delipidation |
| Anhydrous sodium sulfate | Fisher Scientific | S421500 | |
| Acetic anhydride | Sigma Aldrich | 320102 | Derivatization agent |
| BSTFA (N,O-bis(trimethylsilyl)-trifluoroacetamide) | Sigma-Aldrich | 15222 | Derivatization agent |
| Butylated hydroxytoluene (BHT) | Sigma-Aldrich | 101162 | Antioxidant |
| Calcium chloride, anhydrous | Fisher Scientific | C614-3 | Desiccation agent |
| Calcium suflate, anhydrous (DRIERITE- 8 MESH with indicator) | Acros Organics | 219090020 | Desiccation agent |
| Chloroform (Trichloromethane) | Fisher Scientific | C6074 | Organic solvent |
| Glacial acetic acid | Fisher Scientific | BP2401212 | Acidification agent |
| Helium carrier gas, compressed | Air Liquide | ALPHAGAZ1-UN1046 | Carrier gas, GC/MS |
| Heptane | Fisher Scientific | H3501 | Organic solvent |
| Hexanes | Fisher Scientific | H3024 | Organic solvent |
| Methanol | Fisher Scientific | A4124 | Organic solvent, transmethylation reactive |
| Methyl acetate | Sigma-Aldrich | 296996 | Organic solvent |
| Methyl heptadecanoate | Sigma-Aldrich | H4515 | Internal standard (1mg/mL stock) |
| Methylene dichloride (Dichloromethane) | Fisher Scientific | D374 | Organic solvent |
| Nitrogen, compressed | Air Liquide | ALPHAGAZ1-UN1044 | Carrier gas, GC-FID |
| Pentadecanolactone | Fluka | 76530 | Internal standard (1 mg/ml stock) |
| Pyridine | Sigma-Aldrich | 270970 | Co-solvent for derivatization |
| Sodium chloride | Fisher Scientific | BP358212 | Saline solution |
| Sodium methoxide (25wt.%) | Sigma-Aldrich | 156256 | Nucleophile |
| Toluene | FIsher Scientific | T2904 | Organic solvent |
| Plant Growth Supplies | |||
| Pro-Mix PGX | Premier Tech Horticulture Ltd | Pro-Mix PGX is recommended to grow Arabidopsis plants (Eddy, R. and Hahn, D.T., 2012,http://docs.lib.purdue.edu/pmag/2) Purdue Methods for Arabidopsis Growth. | |
| PermaNest Humidity Dome | Grower's Solution, LLC, Cookeville, TN | GD2211-24 | |
| Perma-Nest Plant Trays (22x11in) | Grower's Solution, LLC, Cookeville, TN | N/A | |
| Square greenhouse pots, 3.5 inch | Grower's Solution, LLC, Cookeville, TN | P86 | |
| General Purpose Plant Fertilizer, Plant-Prod 20-20-20 | Premier Tech Home and Garden In., Brantford, ON | N/A | |
| Glassware | |||
| 13 x 100 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-13100 | |
| 16 x 125 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-16125 | |
| 20 x 125 mm glass test tubes with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-20125 | |
| GC vial caps | National Scientific | C400051A | |
| GC vial microinserts | National Scientific | C4011631 | |
| GC vials | National Scientific | C40001 | |
| Disposable pasteur pipets | Fisher Scientific | 1367820B | |
| Flasks | Fisher Scientific | ||
| Equipment | |||
| Allegra X15R centrifuge | Beckman Coulter | ||
| Analytic balance | Fisher Scientific | ||
| Belly dancer | A shaker can be used for this purpose if Belly Dancer not available | ||
| DB-5 Capillary GC column | J&W Scientific, CA, USA; | 30 m x 0.25 mm x 0.25 μm film thickness | |
| Desiccator | |||
| Isotemp 202 water bath | Fisher Scientific | ||
| ISQ LT single quadupole mass spectrometer | Thermo Scientific | ||
| Heat block | Fisher Scientific | ||
| Nitrogen evaporator | |||
| Polytron homogenizer | Birkmann | ||
| Trace 1300 gas chromatograph | Thermo Scientific | ||
| Two-stage regulator | Air Liquide | Q1-318B-580 | |
| Vacuum desiccator | Fisher Scientific | ||
| Vortex mixer | Fisher Scientific |
Références
- Kolattukudy, P. Biopolyester membranes of plants: cutin and suberin. Science. 208 (4447), 990-1000 (1980).
- Kolattukudy, P. E. Polyesters in higher plants. Adv. Biochem. Eng. Biot. 71, 1-49 (2001).
- Yeats, T. H., Rose, J. K. C. The formation and function of plant cuticles. Plant Physiol. 163 (1), 5-20 (2013).
- Pollard, M., Beisson, F., Li, Y., Ohlrogge, J. B. Building lipid barriers: biosynthesis of cutin and suberin. Trends Plant Sci. 13 (5), 236-246 (2008).
- Beisson, F., Li-Beisson, Y., Pollard, M. Solving the puzzles of cutin and suberin polymer biosynthesis. Curr. Opin. Plant Biol. 15 (3), 329-337 (2012).
- Heredia, A. Biophysical and biochemical characteristics of cutin, a plant barrier biopolymer. Biochim. Biophys. Acta. 1620 (1-3), 1-7 (2003).
- Bonaventure, G., Beisson, F., Ohlrogge, J., Pollard, M. Analysis of the aliphatic monomer composition of polyesters associated with Arabidopsis epidermis: occurrence of octadeca-cis-6, cis-9-diene-1, 18-dioate as the major component. Plant J. 40 (6), 920-930 (2004).
- Franke, R., et al. Apoplastic polyesters in Arabidopsis surface tissues - A typical suberin and a particular cutin. Phytochemistry. 66 (22), 2643-2658 (2005).
- Vogg, G., et al. Tomato fruit cuticular waxes and their effects on transpiration barrier properties: functional characterization of a mutant deficient in a very-long-chain fatty acid -ketoacyl-CoA synthase. J. Exp. Bot. 55 (401), 1401-1410 (2004).
- Molina, I., Bonaventure, G., Ohlrogge, J., Pollard, M. The lipid polyester composition of Arabidopsis thaliana and Brassica napus seeds. Phytochemistry. 67 (23), 2597-2610 (2006).
- Li-Beisson, Y., et al. Acyl-lipid metabolism. The Arabidopsis Book. 11, e0161 (2013).
- Molina, I., Ohlrogge, J. B., Pollard, M. Deposition and localization of lipid polyester in developing seeds of Brassica napus and Arabidopsis thaliana. Plant J. 53 (3), 437-449 (2008).
- Xiao, F., et al. Arabidopsis CYP86A2 represses Pseudomonas syringae type III genes and is required for cuticle development. EMBO J. 23 (14), 2903-2913 (2004).
- Christie, W. W., Han, X. . Lipid Analysis - Isolation, Separation, Identification and Lipidomic Analysis. , 446 (2010).
- Walton, T. J., Kolattukudy, P. E. Determination of the structures of cutin monomers by a novel depolymerization procedure and combined gas chromatography and mass spectrometry. Biochemistry. 11 (10), 1885-1896 (1972).
- Matzke, K., Riederer, M. A comparative study into the chemical constitution of cutins and suberins from Picea abies (L.) Karst., Quercus robur L., and Fagus sylvatica L. Planta. 185 (2), 233-245 (1991).
- Riederer, M., Schönherr, J. Quantitative gas chromatographic analysis of methyl esters of hydroxy fatty acids derived from plant cutin. J. Chromatogr. 360, 151-161 (1986).
- Moire, L., Schmutz, A., Buchala, A., Yan, B., Stark, R., Ryser, U. Glycerol Is a Suberin Monomer. New Experimental Evidence for an Old Hypothesis. Plant Physiol. 119 (3), 1137-1146 (1999).
- Graça, J., Schreiber, L., Rodrigues, J., Pereira, H. Glycerol and glyceryl esters of omega-hydroxyacids in cutins. Phytochemistry. 61 (2), 205-215 (2002).
- Eglinton, G., Hunneman, D. H. Gas chromatographic-mass spectrometric studies of long chain hydroxy acids-I: The constituent cutin acids of apple cuticle. Phytochemistry. 7 (2), 313-322 (1968).
- Espelie, K. E., Köller, W., Kolattukudy, P. E. 9,16-dihydroxy-10-oxo-hexadecanoic acid, a novel component in citrus cutin. Chem. Phys. Lipids. 32 (1), 13-26 (1983).
- Holloway, P. J. Intracuticular lipids of spinach leaves. Phytochemistry. 13 (10), 2201-2207 (1974).
- Holloway, P. J., Deas, A. H. B. Epoxyoctadecanoic acids in plant cutins and suberins. Phytochemistry. 12 (7), 1721-1735 (1973).
- Holloway, P. J., Cutler, D. F., Alvin, K. L., Price, C. E. . The chemical constitution of plant cutins. , 45-85 (1982).
- Croteau, R., Fagerson, I. S. The constituent cutin acids of cranberry cuticle. Phytochemistry. 11 (1), 353-363 (1972).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon