Method Article
Bioréacteurs à fibres creuses pour
Dans cet article
Résumé
Le comportement fonctionnel des cellules en culture peut être améliorée par la mise en culture plus in vivo -comme des milieux de culture de 16-21 3 dimensions. Ce manuscrit décrit la mise en place et le fonctionnement d'un système de bioréacteur à fibres creuses pour vivo -comme mammifère culture de tissus dans.
Résumé
Tissue culture has been used for over 100 years to study cells and responses ex vivo. The convention of this technique is the growth of anchorage dependent cells on the 2-dimensional surface of tissue culture plastic. More recently, there is a growing body of data demonstrating more in vivo-like behaviors of cells grown in 3-dimensional culture systems. This manuscript describes in detail the set-up and operation of a hollow fiber bioreactor system for the in vivo-like culture of mammalian cells. The hollow fiber bioreactor system delivers media to the cells in a manner akin to the delivery of blood through the capillary networks in vivo. The system is designed to fit onto the shelf of a standard CO2 incubator and is simple enough to be set-up by any competent cell biologist with a good understanding of aseptic technique. The systems utility is demonstrated by culturing the hepatocarcinoma cell line HepG2/C3A for 7 days. Further to this and in line with other published reports on the functionality of cells grown in 3-dimensional culture systems the cells are shown to possess increased albumin production (an important hepatic function) when compared to standard 2-dimensional tissue culture.
Introduction
La culture tissulaire est une technique bien établie pour la croissance et / ou le maintien des cellules qui ont été utilisés pour plus de 100 ans 1,2. La commodité des cellules qui étudient et réponses ex vivo a de vastes avantages permettant des expériences qui seraient autrement extrêmement difficile , sinon impossible, par exemple la génération de lignées cellulaires génétiquement modifiées et l'utilisation de cellules rapporteurs en haut débit des tests de criblage 3. Plus récemment , une culture tissulaire a donné naissance au domaine de l' ingénierie tissulaire, pour la génération de modèles in vitro et pour la médecine régénératrice. Avec ces applications, l'intérêt pour dynamiques en 3 dimensions (3D) des systèmes de culture a augmenté de manière significative.
Les méthodes de culture en 3D (définies ici comme substrat de culture 3D et / ou l'introduction de l' écoulement dynamique directionnelle) à mieux récapituler l'architecture de l'environnement cellulaire in vivo importante pour parvenir à unplus fonction physiologique semblable. La capacité d'extraire, de grandir, de se différencier et de cellules de transplantation dans le but de réparer des tissus malades et endommagés est un champ d'étude qui a un énorme potentiel pour le bénéfice des patients et opportunité commerciale. Par exemple l'utilisation de kératinocytes autologues pour traiter les brûlures (voir 4) et l'utilisation des thérapies à base de cellules pour le traitement des accidents vasculaires cérébraux (voir 5). De même, le marché des modèles in vitro couvre la découverte de médicaments pour des applications en médecine stratifiée. La convention dans la culture tissulaire est la croissance de types de cellules adhérentes ou dépendantes d'ancrage sur le (2D) de surface 2 dimensions d'un flacon de culture tissulaire. Alors actuellement acceptée comme la norme d'or dans un contexte de recherche, l' intérêt récent dans les applications d'ingénierie tissulaire a mis en évidence le fait que l' environnement actuel de la culture de tissus 2D est insuffisante pour la mise à l' échelle requise dans la production de cellules 6.
Pour les types de cellules adhérentes un de scaffold est nécessaire, ce qui varie en fonction de l'utilisation finale, en termes de composition chimique et les propriétés mécaniques. Certains systèmes utilisent des échafaudages comme inserts bien-plaques constituées d' une matrice hautement poreuse formée à partir interne élevée templating phase d'émulsion (voir 7) ou des fibres électrofilées (voir 8) nécessitant un minimum d' adaptation des techniques de culture 2D classiques. Les cellules peuvent être ensemencées sur des microsupports de compositions variées et cultivées dans des cuves agitées qui fournissent des nutriments et des molécules de signalisation, et emportent les déchets (transport de masse) dans un environnement bien mélangé dynamique 9. Toutefois, ces systèmes sont limités dans leur vivo -comme l' environnement et d' autres améliorations peuvent être apportées en ce qui concerne d'intensifier les coûts. Bioréacteurs à fibres creuses (HFBs) sont un système de culture en 3D qui se composent de fibres fixées dans un module avec des cellules typiquement ensemencées à l'extérieur des fibres poreuses et des supports fournis à travers la lumière de la fibre (revue dans 10) (figure 1). HFBs offrent une vivo -like environnement avec les fibres mimant les capillaires sanguins et de blindage des cellules à partir des contraintes de cisaillement associées à la fourniture de médias dynamique, tout en permettant à un cisaillement défini à appliquer aux cellules par l' intermédiaire d'un écoulement de fluide à travers les orifices latéraux si on le souhaite. Cela crée un système de culture polyvalent avec le transport de masse supérieure dans laquelle les densités cellulaires élevées peuvent être atteintes 11. Le système de HFB est bien adapté pour le maintien de types de cellules dépendantes de l' ancrage et a été utilisée pour la culture d' une variété de cellules , y compris le rat des îlots pancréatiques de Langerhans 12, β-TC-3 souris insulinome lignée cellulaire 12, les hépatocytes humains primaires 13, de l' os humain les cellules mononucléées de la moelle 14, les cellules Madin Darby canine rénaux (MDCK) 15 et cellules Caco-2 16 pour ne citer que quelques - uns.
En plus des avantages du système de transfert de masse et de mise à l'échelle, les cellules cultivées en 3D tissystèmes de culture Sue ont tendance à être plus in vivo -comme dans la morphologie et plus sensible aux signaux expérimentaux. Par exemple , chez le rat hépatocytes primaires présentent une morphologie plus cuboïde, la viabilité accrue, une plus grande induction d' une activité enzymatique cytochrome P450 et une sensibilité accrue à la toxicité du paracétamol lorsqu'il est cultivé dans un échafaudage de polystyrène disponibles dans le commerce comparées à des cellules cultivées en culture 2D 17. En utilisant le même échafaudage de la lignée cellulaire d'hépatocarcinome HepG2 a également été montré pour augmenter la production d'albumine 18 et montrent une plus in vivo -comme réponse au méthotrexate par rapport à 2D cellules cultivées 19. Hépatocytes humains primaires ont démontré dédifférenciation retardé, l' accroissement des activités cytochrome P450 et augmentation de la clairance pour 4/5 des composés testés dans un système de culture de perfusion 20. cellules souches neurales humaines neurones dérivés et glie en culture dans un polystyrène échafaudage disponibles dans le commerce présentent à la fois élevé (potentiel d'action) et à faible Frequency (potentiel de champ local) d'activité spontanée alors qu'aucune activité neuronale a été détectée dans les cellules cultivées en 2D 21. Les cellules Caco-2 ont montré une différenciation accrue dans un HFB par rapport à la culture 2D mesurée par l' augmentation de la phosphatase alcaline, γ-glutamyl transférase et l' activité P-glycoprotéine et une expression plus élevée de F-actine et de zona occludens-1 protéine 16. Malgré les avantages, la mise en culture de routine de cellules dans des systèmes autres que la surface du ballon de culture de tissus 2D est toujours pas pratiquée dans de nombreux laboratoires, bien que le nombre de publications citant la culture cellulaire 3D est en croissance (augmentation de 8 fois au cours des 10 dernières années. Source : PubMed 'Résultats par année' outil sondé avec la «culture 3D»).
Ce manuscrit décrit la mise en place et les conditions de fonctionnement d'un système HFB pour la culture de cellules de mammifères et démontre son utilité dans la culture de la lignée cellulaire d'hépatocarcinome HepG2 / C3A. Le but de cette méthode consiste à cultiver les cellules enun système de type vivo plus dans la culture qui conserve assez de simplicité pour la rendre prête à ceux qui sont nouveaux systèmes de culture 3D. La raison derrière l' utilisation de HFBs dans l'application décrit ici, ce qui est d'améliorer la prévisibilité des modèles de foie est qu'il est théoriquement possible d'imiter une sinusoïde hépatique dans l'environnement HFB 22. Cela ne veut pas actuellement réalisable avec d'autres systèmes de culture.
Protocole
1. fibres
- Fabrication des fibres par inversion de spin de phase de coulée (filature). Les détails de ce procédé peuvent être trouvés dans 23,24.
NOTE: Pour ce travail , les fibres sont fabriquées en interne en utilisant un polymère breveté non biodégradable, NMP comme solvant et H 2 O en tant que non-solvant. Détails des autres polymères appropriés peuvent être trouvés dans la discussion. Les fibres utilisées dans le système décrit ici sont 1.05mm diamètre extérieur avec un diamètre de lumière de 600 à 700 pm. Les fibres sont poreuses avec des diamètres de pores mesurant 2,28 um ± 1,5 um (moyenne ± écart type). Ceci est conçu pour séparer les cellules de l'alimentation du support dans la lumière de la fibre, reproduisant la sinusoïde du foie ou le système vasculaire d'autres tissus. Les fibres peuvent également être achetés auprès de fournisseurs tels que la membrane Pall.
2. Fabrication Module
REMARQUE: Les modules utilisés dans cette étude sont fabriqués à partir de 1 mm d'épaisseur en verre borosilicate avec 2 ports latéraux(Figure 2A). Les fibres dans le module décrit ici ont une aire de surface externe de 4,95 cm 2 qui est l'équivalent d'environ la moitié d'un puits d'une plaque à 6 puits.
- Les modules Siliconize avant leur première utilisation en revêtant la surface intérieure avec Sigmacote (tableau 1) et laisser sécher dans une hotte. Autoclave (121 ° C, 1 atm, 20 min) afin d'augmenter la durée du traitement.
- En utilisant un scalpel fibres coupées 75 mm de long et insérer trois fibres dans chaque module , laissant ~ 7 mm de longueur en excès à chaque extrémité (figure 3A).
- Placer ~ 0,5 ml de colle de silicone (tableau 1) dans une nacelle de pesée. Utiliser un embout de pipette P200 pour ramasser une petite quantité de silicone et de travailler la colle dans les extrémités du module autour des fibres pour former un bouchon de 3-5 mm (figure 3B). Laisser sécher pendant> 3 heures.
- En utilisant un scalpel coupé au ras de la silicone avec les extrémités des modules de verre (figure 3C).
- Enroulez unepetite quantité (~ 4 couches) de polytétrafluoroéthylène (PTFE) autour d'un orifice latéral.
3. Configuration du système et de stérilisation
REMARQUE: les tubes de la pompe et des modules avec des fibres ne sont pas autoclavables et sont stérilisés en utilisant 70% d'éthanol. Les auteurs recommandent de calibrer le tuyau de pompe avec la pompe à utiliser. La procédure suivante est effectuée dans une hotte à flux laminaire.
- Autoclave (comme la section 2.1) tous les composants autoclavables avant de mettre en place.
- Installer
- Placer 10 ml 70% d' éthanol dans la bouteille de réservoir et mettre en place le flacon réservoir, bouchon Q-série, tube d'alimentation, pompe et tuyau de pompe (tableau 1) comme dans la figure 4.
- Librement placer un bouchon sur l'orifice latéral PTFE-collé. Faites glisser les extrémités des connecteurs L modules / S16 sur les extrémités du module et du port de côté libre. Raccorder une section de 40 mm de L / S13 tube au connecteur du module le plus proche du port latéral capsulé (tableau 1) comme sur la figure 2B .
- Connecter le module à la tubulure de la pompe, assurant à orienter le module de sorte que le port latéral est couvert le plus proche de la pompe.
- Connectez la ligne de perméat et la ligne rétentat aux connecteurs du module et le L / S14 du connecteur en Y sur la bouteille de réservoir (tableau 1). Assurez -vous que la mise en place ressemble aux schémas de la figure 4.
- Stérilisation
- Pompe éthanol à travers le module à 800 pi / h (267 pl / h par fibre) pendant suffisamment de temps pour traiter les composants unautoclaved pour> 30 min (ajuster les temps si d' autres méthodes de stérilisation sont utilisées, voir 25).
- lavage
- Pour laver l'éthanol à partir du système, d'abord éteindre la pompe et vidanger la tuyauterie. Tout d'abord, détacher le tuyau de la pompe de la tubulure module adaptateur. Tenez le module en haut pour drainer l'éthanol à partir de la ligne de fibres et de rétentat, dans la bouteille de réservoir. Retirez le bouchon de l'orifice latéral du module pour drainer ee éthanol à partir du module lui-même, et la ligne de perméat. Replacez le bouchon de l'orifice latéral. Inverser le flux des médias sur la pompe pour vider le tuyau de la pompe et la conduite d'alimentation d'éthanol. Éteignez la pompe, et replacez le tuyau de la pompe à l'adaptateur de module.
- Dévisser la bouteille d'éthanol à partir du couvercle et la remplacer par une bouteille contenant 10 ml de milieu de croissance cellulaire (par exemple EMEM, GMEM, le DMEM ou RPMI) sans sérum. Pomper le milieu à travers le système à 800 pi / h jusqu'à ce que la ligne rétentat est plein de médias. Fixer la ligne de rétentat pour forcer perméation des médias à travers les fibres pour laver le module. Laver pendant ~ 2 h.
4. ensemencement
NOTE: Les médias et les suppléments utilisés dans ce protocole devraient être celles qui sont établies pour le type cellulaire souhaité. S'il vous plaît se référer à la littérature, la European Collection of Cell Cultures (ECACC) et American Type Culture Collection (ATCC) pour plus d'informations. Avant cette méthode cellules devraient être maintained selon des protocoles établis pour le type cellulaire souhaité. Pour ce travail, la lignée cellulaire d'hépatocarcinome HepG2 / C3A sous-clone ont été maintenus selon les recommandations des distributeurs (ATCC).
NOTE: Le protocole d'ensemencement présenté ci-dessous sert aussi à une pré-culture du module avec le milieu de culture cellulaire avant la croissance cellulaire. Au cas où un pré-culture plus poussée est nécessaire, cela doit être effectué avant le semis, le module en drainant le milieu de lavage à partir du système, en remplacement des milieux de croissance et imprégnant ce à travers le module pendant quelques heures. Voir la section 7.5.2.1 pour plus de détails sur le remplacement des médias dans le système.
- Préparer une suspension de cellules isolées par trypsinisation selon des protocoles établis pour le type cellulaire souhaité. Un protocole général pour une culture T75 est la suivante:
NOTE: Le nombre de cellules à utiliser dans l'étape d'ensemencement doit être déterminée de manière empirique pour votre type de cellule souhaitée. Les bioréacteurs décrites ici sont ensemencées à une cel 35 fois plus élevéela densité ls (cellules / cm2) que celle utilisée en 2D culture tissulaire en matière plastique pour une culture de 7 jours.- Laver les cellules en ajoutant 10 ml de tampon phosphate salin (PBS), aspirer, puis ajouter 3 ml de 0,05% d' acide éthylènediaminetétraacétique à la trypsine (EDTA) (suffisamment pour couvrir les cellules) et on incube à 37 ° C, 5% CO 2 pendant 5 min.
- Récolte des cellules dans 7 ml de milieu de croissance supplémenté avec 10% de sérum de fœtus bovin (FBS) pour neutraliser la trypsine. Bien mélanger, ajouter 10 pi à la chambre d'un hémocytomètre et compter les cellules.
- Centrifuger à 200 g pendant 5 minutes pour sédimenter les cellules.
- Aspirer le surnageant et remettre en suspension les cellules à 4x10 6 / ml dans un milieu de croissance supplémenté comme requis pour le type de cellule souhaité.
- Eteignez la pompe et vidanger le tube d'alimentation et le module comme dans 3.4.1.
- Détachez le module des connecteurs de module et fixer les embouts du module (tableau 1) pré-stérilisés dans 70% d' éthanol, de quitter le port d' un côté libre.
- Transfert ~ 500 pi de la suspension cellulaire (2x10 6 cellules) (4.1.4) au module à l' aide d' une seringue de 18 aiguilles G et 1 ml, en prenant soin d'éviter la formation de bulles et de ne pas endommager les fibres.
- Boucher l'orifice latéral à l'aide d'un capuchon d'extrémité. Incuber les cellules à 37 ° C, 5% de CO 2 pendant 2-4 heures avec rotation manuelle du module à 180 ° toutes les 5 min. En variante , les modules peuvent être fixés à un dispositif de rotation du tube avec un réglage de mélange intermittent (tableau 1).
- Après l' ensemencement, fixez un capuchon d'extrémité sur un orifice d'injection (tableau 1) pré-stérilisé dans 70% d' éthanol, et le joindre à l'orifice latéral PTFE-collé. Retirez l'autre embout d'orifice latéral et vidanger lentement les cellules en injectant de l'air dans l'orifice d'injection fixé à l'aide d'une seringue de 27 aiguilles G et 1 ml.
- Remplacer l'orifice d'injection avec un capuchon d'extrémité. Remplir lentement le module avec les médias en utilisant le port côté libre et une aiguille de 18 G avec une seringue de 1 ml. Remove les bouchons d'extrémité du module et fixer le module sur le tuyau à l'aide des connecteurs de module.
- Remplacez la bouteille de milieu de lavage avec un contenant 50 ml de milieu de croissance et les suppléments suivants la procédure détaillée dans 7.5.2.1. Pomper le milieu de croissance à travers le système à 800 pi / h.
5. prolifération
NOTE: Les fibres utilisées dans le système de recherche décrit ici sont mis à perméat à ~ 80 ul / h, avec un débit d'alimentation de 800 pi / h.
- Utilisez les fibres pour faire croître les cellules pendant des périodes allant jusqu'à 7 jours dans un incubateur humidifié réglé à 37 ° C, 5% de CO 2.
REMARQUE: La surveillance des substances nutritives et des métabolites pendant la phase de croissance peut fournir des informations utiles sur la prolifération, l'absorption métabolique et la sortie des cellules et des teneurs en éléments nutritifs et de métabolites dans les médias. Par exemple glucose utilisation et la production de lactate. Les kits sont disponibles auprès de divers fournisseurs qui peuvent quantifier ces facteurs à partir du support (voir Tableau 1 pour ceux qui sont utilisés dans cette étude). ports d'injection peuvent être ajoutés au perméat et rétentat tube et les médias échantillonnés par l'intermédiaire d'une aiguille et la seringue G 27, et les médias peuvent être échantillonnés à partir de la bouteille de réservoir de médias. Ceci donne des informations et du métabolisme des nutriments pour l'entrée et les deux courants de sortie. L'échantillonnage doit être effectué dans une hotte à flux laminaire. Stériliser ports d'injection avant le prélèvement en tenant un rouleau imbibé d'éthanol bleu sur le port pour> 30 sec.
6. excision
REMARQUE: Les fibres peuvent être excisées à partir du module à la fin d'une expérience d'analyse.
- Débrancher et vidanger le HFB.
- Insérez un scalpel / micro couteau (tableau 1) lame entre le verre et silicone. Tournez le module de manière à couper le silicone du verre. Répéter cette procédure au niveau des deux extrémités du module.
- Utilisation de la lame crochet le bouchon de silicone d'un bout et tirez doucement. Veiller à ce que les fibres viennent avec elle.
7. Analyse cellulaire
- Les nombres de cellules
NOTE: Pour les cellules C3A utilisées dans cette étude tous les points de temps dans la période de croissance de 7 jours sont appropriés pour une utilisation dans ce calcul que les taux de croissance ne changent pas sensiblement sur les densités cellulaires obtenus dans ce délai.- Après excision (Section 6) tremper les fibres dans PBS à laver et les couper en un tube de 1,5 ml contenant 0,5 ml de Tris EDTA (TE) tampon. Soumettre ce à deux cycles de gel-dégel dans un -80 ° C congélateur. Mesurer la teneur en ADN par Picogreen et déterminer le nombre de cellules en comparant cette valeur à une courbe étalon établie avec le type cellulaire souhaité 26.
- Les taux de prolifération cellulaire
- En utilisant les nombres de cellules calculées en deux points de temps différents calculer le taux de croissance spécifique μ (équation 1) où Ln (X1) est le logarithme naturel du nombre de cellules au niveau du premier point de temps et Ln (X2) est le logarithme naturel de la cellule numéro au deuxième point de temps.
μ = (Ln (X2) -ln (X1)) / heure (h) (1)
A partir de ce calcul des temps de doublement de la population (dT) (équation 2) où μ est le taux de croissance spécifique.
Ln2 = dT / μ (2)
- En utilisant les nombres de cellules calculées en deux points de temps différents calculer le taux de croissance spécifique μ (équation 1) où Ln (X1) est le logarithme naturel du nombre de cellules au niveau du premier point de temps et Ln (X2) est le logarithme naturel de la cellule numéro au deuxième point de temps.
- Viabilité cellulaire
- Après excision (Section 6) tremper les fibres dans PBS à laver et les couper en un tube de 1,5 ml contenant 500 ul d'acide éthylènediaminetétraacétique 0,05% de trypsine (EDTA). Incuber à 37 ° C pendant 10 min.
- Mélanger et ajouter 10 pi de suspension cellulaire à 10 pi de bleu trypan. Charge 10 pi sur un hémocytomètre et compter le nombre de morts (bleu) et cellules vivantes.
- Imaging
- Après excision tremper les fibres dans PBS à laver et utiliser des ciseaux pour les couper en petits longueurs dans une plaque de 24 puits. Ajouter 400 pi de paraformaldehyde à 4% (dans le PBS) et incuber à température ambiante pendant 20 min.
- Laver avec du PBS 400 pi par pipetage et hors tension. Répétez this étape avec du PBS frais.
- Ajouter 400 ul de 4 ', 6-diamidino-2-phénylindole (DAPI) dilué dans du PBS à env. 100 ng / ml et incuber à température ambiante pendant 20 min. Protéger de la lumière.
- Laver avec du PBS deux fois (comme 7.3.2) et une fois avec H 2 O. Ajouter un support de montage de fluorescence pour couvrir la fibre et de l'image immédiatement pour recueillir des données avant que les échantillons secs (DAPI ex / em; 359/461 nm).
- Prenez des images à différents plans focaux et utiliser le logiciel «focus stacking» (par exemple, la pile focuser plugin ImageJ, ci - dessous) pour faire une image composite montrant une profondeur considérablement élargi de champ. Ceci est nécessaire que les fibres ne sont pas planes.
- Télécharger ImageJ (http://imageJ.nih.gov/ij/) et le plugin "stack-focuser '(http://rsb.info.nih.gov/ij/plugins/stack-focuser.html).
- Dans ImageJ ouvrir les images pour être empilés. Ensuite, dans le menu 'Image' aller à 'Stacks' - 'Images à empiler. Dans le menu 'Plugins' aller 'Stack Focuser». Spécifiez un n pour le noyau de nxn. Essai et erreur avec 'n' peuvent être nécessaires afin de générer une image avec peu de «bruit». Les valeurs comprises entre 11 et 77 ont tendance à bien fonctionner.
- sécrétion albumine
NOTE: Ceci est un test de la fonction des cellules hépatocytes et non un test général de la fonction cellulaire.- Cellules de semences (HepG2 / C3A) sur 2D culture tissulaire en plastique à 10.667 / cm 2 et cultivées pendant 6 jours. HFBs de semences telles que décrites à la section 4 et grandir pendant 6 jours.
- Après cette période de prolifération changer le milieu de culture (milieu EMEM + 10% de FBS, 1 x glutamine et 1 x pénicilline / streptomycine) pour la matière plastique de culture de tissus et HFB à un libre E de Williams milieu de sérum supplémenté avec de la glutamine 1x et 1x pénicilline / streptomycine pendant 24 heures:
- Égoutter le module de tube et HFB suivant les étapes décrites dans 3.4.1. Dévissez la bouteille de réservoir et le remplacer par une bouteille contenant les médias Williams E. Cette pompe à travers le HFB à 800 pl / h.
- Après 24 h, prélever des échantillons de médias. Quantifier l' albumine sécrétée par ELISA selon les instructions du fabricant (tableau 1). Diluer les échantillons de milieux 1 à 10 pour 1 à 40 avant de l'utiliser afin d'amener la concentration en albumine dans la plage de la courbe standard.
Résultats
Cellule ensemencement est une étape critique. La capacité des cellules à adhérer à la fibre dans un 3D set-up est considérablement inférieure à celle observée pour la 2D culture de tissus en plastique. Cela est probablement dû au temps de contact réduite entre la cellule et le substrat. Dans le HFB les cellules tombent à travers le module pendant les phases statiques de l'ensemencement. Celles-ci sont beaucoup plus courte dans le temps par rapport à une phase statique en continu utilisé en 2D. Les cellules doivent établir des liens avec le substrat dans ce temps. En outre, en raison de la nature courbe des fibres il n'y a pas de surface plane pour les cellules pour se reposer et faire des liens comme il y a dans la culture 2D. Bien que cela peut être aggravé par la chimie de la fibre utilisée, nous savons que ce ne soit pas le cas pour le polymère utilisé dans cette étude (données non présentées). Augmenter le temps d'ensemencement et la densité d'ensemencement des cellules conduit à la formation d'agrégats de cellules qui tombent à travers le module pendant les phases statiques lors d'une rapide rate que des cellules simples et réduit encore le temps de contact entre les cellules et le substrat. L'augmentation du temps conduit aussi au jaunissement des médias comme il y a une forte densité de cellules et aucun échange de médias au cours de cette étape. En utilisant les conditions décrites dans les taux de ~ 15% Section 4 cellules d'ensemencement sont systématiquement réalisée avec les cellules HepG2 / C3A (Figure 5A). Bien que cela puisse être considéré comme une faible fraction il y a suffisamment de cellules pour générer des fibres bien peuplées en quelques jours (figures 5B et 6); après une période de prolifération de sept jours , la densité cellulaire atteint dans la HFB se rapproche de 3x10 5 / cm2. Ceci est une densité appropriée pour de nombreux essais en utilisant des hépatocytes et peuvent être considérés comme étant d'atteindre la confluence.
Les taux de prolifération obtenus dans la HFB sont plus lentes par rapport à celle obtenue dans la culture cellulaire 2D (figure 5C). Ceci est nonsusceptibles d'être dus à la perte de cellules dans le flux dynamique du système, comme le nombre de cellules dans les médias sont faibles (moyenne ± SEM: 20,343 cellules ± 3.674 cellules par 24 h à confluence, ce qui est de 4% des cellules totales) et ce ne pas augmenter lorsque la vitesse de perméation est tourné jusqu'à 400 ul / h (données non représentées). Il est également peu probable en raison d'une diminution de la viabilité et la perte subséquente de cellules (voir la figure 5D et ci - dessous). On peut expliquer, au moins en partie par le fait de cette lignée cellulaire a été clonale dérivée de HepG2 et sélectionné sur sa capacité à montrer le contact inhibition de la prolifération cellulaire. Les cellules dans le HFB sont ensemencées à la densité 6x des cellules 2D qui peuvent conduire à des vitesses de prolifération lente.
Viabilité reste élevée tout au long du HFB avec des cellules présentant> 90%. Bien qu'il existe une légère diminution de la viabilité à l'extrémité de sortie par rapport à l'entrée ceci n'a pas été jugée significative (t-test p = 0,22).
Surveillance de la consommation de glucose et de production d'acide lactique a été utilisé pour régler le débit et les médias d'alimentation volume média dans le système. En utilisant 800 ul / h et un volume total de support 50 ml du taux d'acide lactique et le glucose sont maintenus au-dessus et au-dessous (respectivement) celles observées en culture en plastique de culture de tissu standard.
la sécrétion d'albumine est une fonction hépatique clé effectuée par les hépatocytes. Il est sécrété dans le sérum, où il joue plusieurs rôles dans le transport et l'homéostasie. La sécrétion d' albumine par des cellules cultivées dans la HFB est 15 fois plus élevée que dans les cellules cultivées en 2D (figure 7). Ceci démontre que les cellules sont fonctionnelles dans la HFB et au moins dans le cas de la sécrétion de l'albumine, cette fonction est élevée dans la HFB.
jpg "/>
Figure 1. La vivo -like de l' environnement dans un HFB. Les cellules sont ensemencées sur l'extérieur des fibres poreuses. Le support est délivré à travers la lumière de la fibre, mimant un capillaire sanguin. (A) Coupe longitudinale d'une fibre (non à l' échelle). (B) de la section transversale d'un réacteur 3 de la fibre. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

La figure 2. Le module de HFB. (A) Les dimensions du module utilisé dans cette étude. Les dimensions ont été choisies pour être compatibles avec 3 fibres et répondre aux besoins du projet de recherche en cours. Différentes tailles peuvent être fabriqués et adaptés pour les systèmes et les fibres individuelles. (B) Une photographie de la mOdule avec capuchon d'extrémité et de modules connecteurs fixés. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
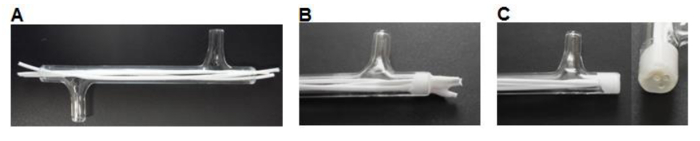
Figure 3. fabrication du module. (A) Les fibres sont coupées à dimension et introduite dans le module. (B) des fibres sont collées dans le module, on le laisse sécher. (C) Les extrémités sont coupées au ras du verre. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
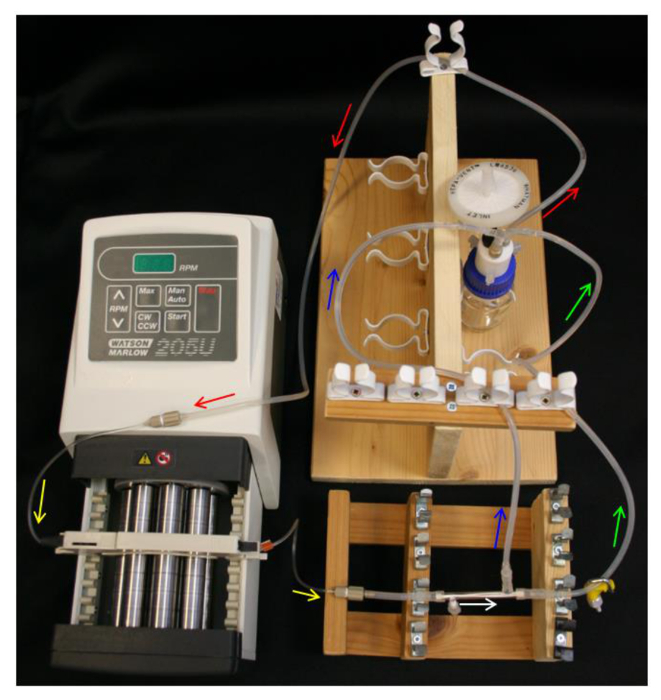
Figure 4. Système HFB set-up. Les flèches indiquent la direction des flux de médias. Rouge = tube d'alimentation. Jaune = pompe tuêtre. Blanc = module HFB. Vert = tube de rétentat avec pince de serrage. Bleu = perméat tube. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
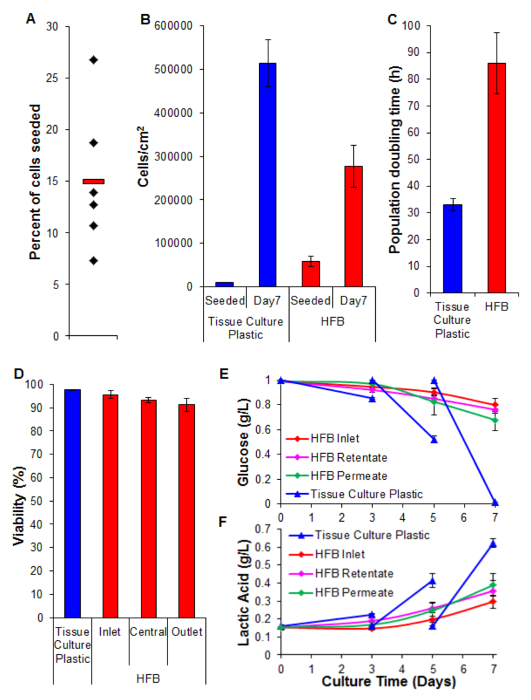
Figure 5. Ensemencement, la prolifération, la viabilité et l' analyse biochimique. (A) Pourcentage de cellules ensemencées. Les diamants noirs représentent HFBs individuels. La barre rouge est la moyenne. (B) Les cellules densités au semis et après une période de prolifération de 7 jours. le nombre de cellules 2D ont été déterminées par trypsinisation et le comptage en utilisant un hémocytomètre. Le nombre de cellules HFB ont été déterminées en utilisant le test PicoGreen et une courbe standard produite à partir de cellules C3A 26. n = 5-6. Bars = SEM. (C) Population doubler fois. n = 5-7. Bars = SEM. (D) Viabilité déterminée par trypune exclusion au bleu à la fin d'une prolifération de 7 jours. Inlet, centrale et de sortie représentent des régions au sein du HFB. n = 3-5. Bars = SEM. (E et F) , la consommation de glucose et la production d'acide lactique. On a surveillé les niveaux dans le flacon réservoir (entrée), ainsi que le rétentat et le perméat et sorties compered à la culture de routine sur une culture de tissu en plastique (médias a changé le jour 3 et 5). n = 3-5. Bars = SEM. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
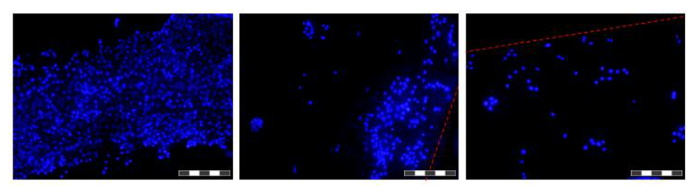
Figure 6. Les images des cellules cultivées sur des fibres dans un HFB. Les cellules ont été ensemencées et cultivées pendant 48 heures avant que les fibres ont été excisés, lavées dans du PBS, fixées dans 4% de paraformaldehyde, lavés dans du PBS et colorées avec du DAPI des noyaux. Chaque image est un composite de 12 'Focus empilés' imagements dans le but d'augmenter la profondeur de champ de l'image résultante. Domaines de densité cellulaire supérieure et inférieure se trouvent le long de la fibre à ce point de temps et sont présentés. Où limites actuelles de fibres sont désignées par une ligne en pointillé rouge. Les images ont été prises sur un microscope à fluorescence inversé. Image = 10X objectif. Bar = 200 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
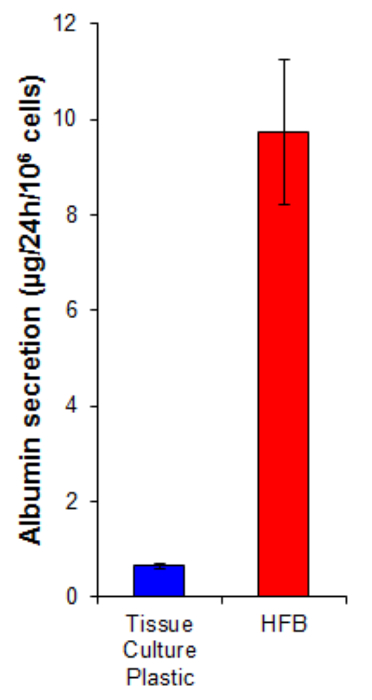
Figure 7. Albumine la sécrétion. Les cellules ont été ensemencées sur la culture tissulaire en plastique à 10.667 / cm 2 et dans le HFB comme décrit dans la section 4. Les cellules ont été proliféré pendant 6 jours. Après cette période de prolifération des médias en plastique de culture tissulaire et la culture a été changé HFB pour une connexion E de Williams milieu de sérum supplémenté avec de la glutamine et de la pénicilline / streptomycin pendant 24 heures. Échantillons des médias ont été prises et une albumine quantifiées par ELISA selon les instructions du fabricant (tableau 1). n = 5-6. Bars = SEM. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
| Section | Nom de l' équipement | Compagnie | Chat. Non. | Remarques | Images |
| 2 | Verre Module HFB | Soham Scientific | --- | Point personnalisé. | |
| 2.1 | Sigmacote® | Sigma-Aldrich | SL2 | ||
| 2.3 | Silicoset 151 | Intertronics | ACCSS151 | Silicune colle. | |
| 2.5 | ruban PTFE | Sigma-Aldrich | Z104388 | ||
| 3.2.1 | réservoir bouteille | Pêcheur | 11972619 | ||
| cap Q-series | Kinesis | 00932Q-3V | PTFE les filetages de vis des adaptateurs et écrou du raccord. Fixer le cap Q-series. Fixer une section de 8,5 cm du tube de PTFE fourni sous l'adaptateur de 1 mm et une section de 4 cm sous l'adaptateur 3 mm. |  | |
| Adaptateur, mâle, 1,0 mm ID | Kinesis | 008NB10-KD5L | |||
| Adaptateur, mâle, 3,0 mm ID | Kinesis | 008NB30-KD5L | |||
| écrou de fixation | Kinesis | U-350 | |||
| tube en néoprène | Pêcheur | 10366344 | Fixer le filtre Hepa à 6 cm de tube de néoprène et le joindre à l' 'écrou du raccord. Fixer un 2x 30 sections mm de L / tube S14 aux deux premiers barbillons du connecteur en Y et une section de 3 cm de L / tube S16 vers le bas. Le joindre à l'ardillon de l'adaptateur, ID 3 mm. (Section 3.2.1) |  | |
| HEPA-vent | Pêcheur | 11374634 | |||
| Y-connecteur, barbelé | Cole Parmer | OU-06295-10 | |||
| L / tube silicone S16 | Cole Parmer | OU-96410-16 | |||
| L / tube silicone S14 | Cole Parmer | WZ-96410-14 | |||
| L / tube silicone S13 | Cole Parmer | OU-96410-13 | 80 cm pour connecter l'adaptateur cannelé de 1,0 mm sur le bouchon Q-série à la cuve de pompe ing = tube d'alimentation. | ||
| pompe WM 205U / CA | Pêcheur | 1248-6300 | |||
| WM tuyau de pompe, PVC, bleu-orange, 0,25 mm d'alésage | Pêcheur | 12416310 | PTFE le filetage de l'adaptateur mâle et branchez l'adaptateur femelle. Travailler le tuyau de la pompe sur l'une des barbes. Répéter cette mise en place à l'autre extrémité du tube. (Section 3.2.1) |  | |
| Adaptateur, mâle, 1,0 mm ID | Kinesis | 008NB10-KD5L | |||
| Adaptateur, Femme, 1,0 mm ID | Kinesis | 008NB10-KD2L | |||
| 3.2.2 | Femme bouchon Luer | Cole Parmer | WZ-45508-64 | Côté embouts de port. | blefig4.jpg "/>  |
| L / tube silicone S13 | Cole Parmer | OU-96410-13 | section 40 mm pour connecter le tuyau de la pompe à un connecteur de module. | ||
| L / tube silicone S16 | Cole Parmer | OU-96410-16 | 3x 30 mm de L / S16 équipé 3x Réducteurs = connecteurs de module. (Section 3.2.2) | ||
| Réducteur Barbed 1/8 "x 1/16" | Cole Parmer | 30616-43 | |||
| 3.2.4 | L / tube silicone S13 | Cole Parmer | OU-96410-13 | 55 cm de section pour raccorder le rétentat à L / S14 du connecteur en Y sur le capuchon Q-série. |  |
| L / tube silicone S13 | Cole Parmer | OU-96410-13 | 45 cm de section pour raccorder le perméat à L / S14 du connecteur en Y sur le capuchon Q-série. | ||
| union barbelée droite | Cole Parmer | WZ-30612-43 | Attacher à l'extrémité de la L / S13 qui se connecte avec le rapport L / S14 du connecteur en Y. | ||
| 3.4.2 | Serrer | VWR | 229-0609 | ||
| 4.3 | Tuyau en silicone 4 mm | Pêcheur | FB68858 | Plier sur une section de 40 mm de tube et le fixer avec un module = capuchon d'extrémité d'attache de câble. (Section 4.3) |  |
| Attache de câble | Pêcheur | 12326377 | |||
| 4.4 | MACSmix Tube rotateurs | Miltenyi Biotech | 130-090-753 | Une adaptation peut être nécessaire pour attach les modules. | |
| 4.5 | L'orifice d'injection their | Thistle scientifique | IB-10820 | Fixez le capuchon d'extrémité au port d'injection. (Section 4.5) | |
| Femme bouchon Luer | Cole Parmer | WZ-45508-64 | |||
| 5 | kit d'acide L-lactique | Megazyme | K-TARD | ||
| 5 | kit D-glucose | Megazyme | K-GLUC | ||
| 6.2 | Scalpel / micro couteau | Interfocus | 10315-12 | ||
| 7.4.3 | albumine ELISA | Bethyl Labs | E80-129 |
Tableau 1. Composants du HFB set-up. La section de texte pertinent à chaque composant est donnée dans la colonne 1.
Discussion
Ce manuscrit décrit la mise en place et le fonctionnement d'un système creux bioréacteur de fibres (HFB) pour la culture de cellules de mammifères et de son utilité est démontrée dans la prolifération de la lignée cellulaire d'hépatocytes HepG2 / C3A. Le système est conçu pour tenir sur l'étagère d'un incubateur standard et sa mise en place est suffisante pour être effectuée par tout biologiste cellulaire compétent familier avec une technique aseptique simple.
Les fibres utilisées dans le système de recherche décrit ici sont fabriqués en interne par inversion de phase coulée centrifuge (spinning) en utilisant un polymère breveté non-biodégradable. Il est possible de fabriquer des fibres par filage à partir d'une variété de matériaux appropriés pour la culture cellulaire, à la fois biodégradables et non biodégradables, par exemple; polycaprolactone (PCL) 27, l' acide poly-L-lactide (PLLA) 28, le poly (acide lactique-co-glycolique) (PLGA) 29, de la polysulfone (PSU) et de 12 polyétheréthercétone (PEEK) 13. Chacun a des propriétés différentes d'une doit être choisi en fonction des besoins du système. Vérifier la compatibilité de la fibre utilisée avec l'éthanol utilisé dans l'étape de stérilisation. PLGA est connu pour plastifier avec de l' éthanol nécessitant un traitement alternatif, comme antibiotique / antimycosique solution 25.
Les dimensions des modules de verre utilisés ici ont été choisis en fonction des besoins de la recherche actuelle. Différentes tailles peuvent être faites par une entreprise de soufflage de verre de bonne réputation. Une considération de la taille du module est le nombre de cellules, qui est liée au nombre de fibres dans le module et de débits possibles. Les plus de cellules, il y a dans le module plus les débits devront être afin de maintenir des conditions de culture favorables à l'extrémité de sortie du bioréacteur. Cela va atteindre une limite un certain point et quelques essais et erreurs peuvent être nécessaires à la surveillance des conditions de médias dans le module perméat. La modélisation mathématique peut fournir quelques indications sur les dimen module requissions et des débits 22.
Les dimensions de l'appareil utilisé ici est conçu pour tenir sur une durée de l'incubateur. La longueur du tube est dictée par la longueur nécessaire pour atteindre entre les connecteurs tout en permettant un mouvement suffisant de composants pour permettre l'installation et le fonctionnement. Si l'échantillonnage au cours du temps est nécessaire, par exemple dans le suivi des conditions des médias dans le module perméat puis ports d'injection peuvent être ajoutés au rétentat et le perméat lignes pour faciliter cela.
Une condition préalable à tout système de culture cellulaire est de garder les cellules vivantes et dans la plupart des cas de plus en plus. À la lumière des études démontrant une plus in vivo -comme phénotype dans les cellules cultivées dans des systèmes de culture 3D , il semble également important de fournir un environnement qui imite étroitement l'environnement in vivo rencontré par les cellules. Ce dernier point est souvent négligé dans la culture cellulaire 2D en faveur de la commodité de ce système de culture offre. Til HFB mimétiques dans les réseaux capillaires in vivo en fournissant des nutriments aux cellules à travers la lumière des fibres. Les déchets sont éliminés du système par l'écoulement dynamique. Cela crée un système de type in vivo dans la culture cellulaire et qui imite étroitement l'environnement in vivo vu par les hépatocytes, ce qui rend ce système , un meilleur choix par rapport à 2D culture tissulaire en matière plastique pour la culture de ces cellules. Ceci est corroboré par le fait que les cellules sécrètent 15 fois la quantité d'albumine, une fonction hépatique importante, dans le système de culture HFB par rapport à ceux qui sont cultivés sur 2D culture de tissus en plastique.
Alors que le système HFB est adapté à la plupart des cas tous les types non d' ancrage de cellules dépendantes, l'exemple ici est pour hépatocytes parce qu'il ya un réel besoin d'être en mesure de la culture fonctionnelle, plus in vivo -comme hépatocytes pour une utilisation dans le développement de médicaments par l'industrie pharmaceutique et dans les dispositifs de foie bioartificiel pour le soutien extracorporelledes patients souffrant d'insuffisance hépatique. Le besoin de plus de cellules fonctionnelles va au-delà de ces exemples, en particulier le domaine de la médecine régénérative entre dans une phase de travail de traduction. Les avantages d'un environnement plus vivo -comme dans la culture ne doivent pas être négligés.
Déclarations de divulgation
MJE is a founder and director of Cellesce Ltd which aims to provide bioprocessing solutions for tissue engineering-based research and industry.
Remerciements
This work was funded by the National Centre for the Replacement, Refinement and Reduction of Animals in Research (NC3Rs) CRACK IT funding.
matériels
| Name | Company | Catalog Number | Comments |
| Glass HFB Module | Soham Scientific | --- | Custom Item. (Section 2) |
| Sigmacote | Sigma-Aldrich | SL2 | (Section 2.1) |
| Silicoset 151 | Intertronics | ACCSS151 | Silicone Glue. (Section 2.3) |
| PTFE tape | Sigma-Aldrich | Z104388 | (Section 2.5) |
| Reservoir bottle | Fisher | 11972619 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Q-series cap | Kinesis | 00932Q-3V | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 3.0 mm ID | Kinesis | 008NB30-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Fitting Nut | Kinesis | U-350 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Neoprene tubing | Fisher | 10366344 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| HEPA-vent | Fisher | 11374634 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| Y-connector, barbed | Cole Parmer | OU-06295-10 | Attach the Hepa filter to 6 cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S14 Silicone tubing | Cole Parmer | WZ-96410-14 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 80 cm to connect the 1.0 mm barbed adapter on the Q-series cap to the pump tubing = Feed tube. (Section 3.2.1) |
| WM 205U/CA pump | Fisher | 1248-6300 | (Section 3.2.1) |
| WM pump tubing, PVC, blue-orange, 0.25 mm bore | Fisher | 12416310 | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw thread of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Female, 1.0 mm ID | Kinesis | 008NB10-KD2L | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Side port end caps. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 40 mm section to connect the pump tubing to a module connector. (Section 3.2.2) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| Barbed reducer 1/8"x1/16" | Cole Parmer | 30616-43 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 55 cm section to connect the retentate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 45 cm section to connect the permeate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| Straight barbed union | Cole Parmer | WZ-30612-43 | Attach to the end of the L/S13 that will connect with the L/S14 of the Y-connector. (Section 3.2.4) |
| Clamp | VWR | 229-0609 | (Section 3.4.2) |
| 4 mm Silicone tubing | Fisher | FB68858 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| Cable tie | Fisher | 12326377 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| MACSmix tube rotator | Miltenyi Biotech | 130-090-753 | An adaptation may be required to attach the modules. (Section 4.4) |
| Leur Injection port | Thistle Scientific | IB-10820 | Attach the end cap to the injection port. (Section 4.5) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Attach the end cap to the injection port. (Section 4.5) |
| L-lactic acid kit | Megazyme | K-LATE | (Section 5) |
| D-glucose kit | Megazyme | K-GLUC | (Section 5) |
| Scalpel / micro knife | InterFocus | 10315-12 | (Section 6.2) |
| Albumin ELISA | Bethyl Labs | E80-129 | (Section 7.4.3) |
Références
- Lewis, W. H. Experimental evidence in support of the theory of outgrowth of the axis cylinder. American J Anat. 6 (1), 461-471 (1906).
- Harrison, R. G. The development of peripheral nerve fibers in altered surroundings. Wilhelm Roux Arch Entwickl Mech Org. 30 (2), 15-33 (1910).
- Ding, L., et al. A genome-scale RNAi screen for Oct4 modulators defines a role of the Paf1 complex for Embryonic Stem Cell identity. Cell Stem Cell. 4 (5), 403-415 (2009).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering -In vivo and in vitro applications. Adv Drug Deliv Rev. 63 (4), 352-366 (2011).
- Sinden, J. D., Vishnubhatla, I., Muir, K. W. Prospects for stem cell-derived therapy in stroke. Prog Brain Res. 201, 119-167 (2012).
- Ouyang, A., Yang, S. -. T. A two-stage perfusion fibrous bed bioreactor system for mass production of embryonic stem cells. Expert Opin Biol Ther. 8 (7), 895-909 (2008).
- Carnachan, R. J., Bokhari, M., Przyborski, S. A., Cameron, N. R. Taloring the morphology of emulsion-templated porous polymers. Soft Matter. 2 (7), 608-616 (2006).
- Deshpande, P., et al. Simplifying corneal surface regeneration using a biodegradable synthetic membrane and limbal tissue explants. Biomaterials. 34 (21), 5088-5106 (2013).
- Storm, M. P., Orchard, C. B., Bone, H. K., Chaudhuri, J. B., Welham, M. J. Three-dimensional culture systems for the expansion of pluripotent embryonic stem cells. Biotechnol Bioeng. 107 (4), 683-695 (2010).
- Wung, N., Acott, S. M., Tosh, D., Ellis, M. J. Hollow fibre membrane bioreactors for tissue engineering applications. Biotechnol Lett. 36 (12), 2357-2366 (2014).
- Ellis, M., Jarman-Smith, M., Chaudhuri, J. B., Chaudhuri, J., Al-Rubeai, Bioreactor systems for tissue engineering: A four-dimensional challenge. Bioreactors for tissue engineering; principles, design and operation. , 1-18 (2005).
- Silva, A. I., Mateus, M. Development of a polysulfone hollow fibre vascular bio-artificial pancreas device for in vitro studies. J Biotechnol. 139 (3), 236-249 (2009).
- De Bartolo, L., et al. Human hepatocyte functions in a crossed hollow fiber membrane bioreactor. Biomaterials. 30 (13), 2531-2543 (2009).
- Schmelzer, E., Finoli, A., Nettleship, I., Gerlach, J. C. Long-term three-dimensional perfusion culture of human adult bone marrow mononuclear cells in bioreactors. Biotechnol Bioeng. 112 (4), 801-810 (2015).
- Tapia, F., et al. Production of high-titer human influenza A virus with adherent and suspension MDKC cells cultured in a single-use hollow fiber bioreactor. Vaccine. 32 (8), 1003-1011 (2014).
- Deng, X., Zhang, G., Shen, C., Yin, J., Meng, Q. Hollow fiber culture accelerates differentiation of Caco-2 cells. Appl Microbiol Biotechnol. 97 (15), 6943-6955 (2013).
- Schutte, M., et al. Rat primary hepatocytes show enhanced performance and sensitivity to acetaminophen during three-dimensional culture on a polystyrene scaffold designed for routine use. Assay Drug Dev Technol. 9 (5), 475-486 (2011).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Novel cell culture device enabling three-dimensional cell growth and improved cell function. Biochem Biophys Res Commun. 354 (4), 1095-1100 (2007).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Culture of HepG2 liver cells on three dimensional polystyrene scaffolds enhances cell structure and function during toxicological challenge. J Anat. 211 (4), 567-576 (2007).
- Vivares, A., et al. Morphological behaviour and metabolic capacity of cryopreserved human primary hepatocytes cultivated in a perfused multiwell device. Xenobiotica. 45 (1), 29-44 (2015).
- Smith, I., et al. Human neural stem cell-derived cultures in three-dimensional substrates form spontaneously functional neuronal networks. J Tissue Eng Regen Med. , (2015).
- Davidson, A. J., Ellis, M. J., Chaudhuri, J. B. A theoretical approach to Zonation in a bioartificial liver. Biotechnol Bioeng. 109 (1), 234-243 (2012).
- Mulder, M. . The basic principles of membrane technology. 2nd ed. , (1996).
- Ellis, M. J., Chaudhuri, J. B. Poly(lactic-co-glycolic acid) hollow fibre membranes for use as a tissue engineering scaffold. Biotechnol Bioeng. 96 (1), 177-187 (2007).
- Shearer, H., Ellis, M. J., Perera, S. P., Chaudhuri, J. B. Effects of common sterilization methods on the structure and properties of poly(D,L lactic-co-glycolic acid) scaffolds. Tissue Eng. 12 (10), 2717-2727 (2006).
- Forsey, R. W., Chaudhuri, J. B. Validity of DNA analysis to determine cell numbers in tissue engineering scaffolds. Biotechnol Lett. 31 (6), 819-823 (2009).
- Williamson, M. R., Coombes, A. G. A. Gravity spinning of polycaprolactone fibres for applications in tissue engineering. Biomaterials. 25 (3), 459-465 (2004).
- El-Salmawy, A., et al. Preparation and properties of pronectin F-coated biodegradable hollow fibres. J Artif Organs. 8 (4), 245-251 (2005).
- Meneghello, G., et al. Fabrication and characterization of poly(lactic-co-glycolic acid)/polyvinyl alcohol blended hollow fibre membranes for tissue engineering applications. J Memb Sci. 344 (1-2), 55-61 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon