Method Article
Applications de la mono-sonde: Mass Spectrometry Imaging et simple Cellule d'analyse dans les conditions ambiantes
Dans cet article
Résumé
Here, we present protocols to perform both ambient mass spectrometry imaging (MSI) of tissues and in-situ live single cell MS (SCMS) analysis using the single-probe, which is a miniaturized multifunctional device for MS analysis.
Résumé
Mass spectrometry imaging (MSI) and in-situ single cell mass spectrometry (SCMS) analysis under ambient conditions are two emerging fields with great potential for the detailed mass spectrometry (MS) analysis of biomolecules from biological samples. The single-probe, a miniaturized device with integrated sampling and ionization capabilities, is capable of performing both ambient MSI and in-situ SCMS analysis. For ambient MSI, the single-probe uses surface micro-extraction to continually conduct MS analysis of the sample, and this technique allows the creation of MS images with high spatial resolution (8.5 µm) from biological samples such as mouse brain and kidney sections. Ambient MSI has the advantage that little to no sample preparation is needed before the analysis, which reduces the amount of potential artifacts present in data acquisition and allows a more representative analysis of the sample to be acquired. For in-situ SCMS, the single-probe tip can be directly inserted into live eukaryotic cells such as HeLa cells, due to the small sampling tip size (< 10 µm), and this technique is capable of detecting a wide range of metabolites inside individual cells at near real-time. SCMS enables a greater sensitivity and accuracy of chemical information to be acquired at the single cell level, which could improve our understanding of biological processes at a more fundamental level than previously possible. The single-probe device can be potentially coupled with a variety of mass spectrometers for broad ranges of MSI and SCMS studies.
Introduction
Mass spectrometry imaging (MSI) is a relatively new molecular imaging technique to provide the spatial distribution of the compounds of interest on surfaces. During the MSI analysis, mass spectrometry (MS) measurements are recorded across the surface on an individual pixel basis to create a 2D image of the species of interest 1. MSI techniques have the ability to provide a spatially resolved feature distribution for a large range of metabolites, allowing a much greater amount of information to be obtained from a sample than from using traditional molecular imaging techniques, and they have the potential to greatly improve the analysis of biological samples for biological and pharmacology studies 2. MSI can be broadly separated into non-ambient and ambient approaches. The non-ambient MSI analysis techniques, such as matrix assisted laser desorption ionization (MALDI) MS 3 and time of flight secondary ion MS (ToF SIMS) 4, are capable of high spatial resolution (around 5 µm and 100 nm, respectively) and high sensitivity. However, these methods require extensive sample preparation, such as the application of matrix molecules to the sample surface, and a vacuum sampling environment, which could introduce artifacts to the data obtained. Ambient techniques such as desorption electrospray ionization (DESI) MS 5, laser ablation electrospray ionization (LAESI) MS 6, and nano-DESI MS 7 are capable of MSI of samples with little to no prior preparation under the ambient environment, which is able to produce MS images that potentially reflect the sample in its most native state. However, most of these techniques generally lack the high spatial resolution and detection sensitivity compared with the non-ambient techniques, with experiments typically conducted at around 150 µm per pixel 8.
Single cell analysis (SCA) is a growing field that has the ability to characterize the chemical composition of biological samples at the cellular level. SCA enables the analysis of biological systems at a more fundamental level than traditional cell analysis techniques, which produce an averaged result of a population of cells, potentially providing insights that are previously intractable 9. MS techniques have recently been applied to SCA (termed single cell mass spectrometry or SCMS) using non-ambient techniques such as MALDI MS 10 and ToF SIMS 11 in which cells are pretreated before analysis, and with ambient techniques such as LAESI MS 12 and direct extraction methods, such as live single-cell video-MS 13, 14, to analyze a wide variety of cell types such as egg, plant, and cancer. Ambient techniques have the advantage of being applied to live cells, which again minimizes the artifacts, leading to a better representation of the metabolites in the live cells. The direct extraction based methods described above, however, perform the sample extraction and analysis process at two different steps, which result in a time gap during the analysis that could potentially alter the metabolites present within the sample.
The single-probe, a miniaturized multifunctional device that is capable of conducting high spatial resolution ambient MSI on biological tissue sections 15 and near real-time in-situ SCMS on live single cells 16. The single-probe has an integrated construction that is made up of a pulled dual-bore quartz capillary coupled with a solvent providing inlet and a nano-ESI emitter made from fused silica capillaries, enabling solvent delivery and analyte extraction to be performed from a single device. In the ambient MSI mode, the single-probe is placed over the sample tissue and surface micro-extraction occurs, allowing a rastered MS image to be made at high spatial resolution. Particularly, the tapered tip of the single-probe is small enough to be inserted into live eukaryotic cells for in-situ SCMS analysis, where the metabolite detection takes less than two seconds between probe insertion and MS detection, allowing chemical information to be taken in near real-time. Here are the protocols to fabricate the single-probe device and to conduct both the ambient MSI and SCMS modes using the single-probe MS techniques.
Protocole
l'utilisation et le bien-être des animaux devraient adhérer au NIH Guide pour le soin et l'utilisation des animaux de laboratoire suivant les protocoles examinés et approuvés par le Comité soin et l'utilisation institutionnelle des animaux (IACUC). des échantillons de tissus de souris ont été fournis par collaborateur Dr. Chuanbin Mao.
1. Souris Tissue Section Préparation
- Placez un organe de la souris entière d'intérêt (cerveau, les reins, le foie, etc.) dans le centre d'un petit plastique bien (par exemple, 12 puits plaque de culture cellulaire), et plonger dans le tissu composé enrobage jusqu'à environ 10 mm de hauteur. Assurez - vous qu'il n'y a pas de bulles formées dans la masse d' enrobage de tissus et que l'organe est placé dans l'orientation désirée (ie, sagittal, coronal, etc.).
- Placer immédiatement les tissus dans l'azote liquide pour la congélation instantanée. Pour le stockage à long terme, stocker les échantillons congelés dans un congélateur à -80 ° C.
- Prendre l'organe de souris congelées et décongélation à -15 ° C dans une tempérare cryomicrotome contrôlée.
- tissu sécurisé sur une base en acier avec environ 500 ul de tissu composé enrobage et placer sur un cryomicrotome sectionnant montage de telle sorte que l'orientation sectionnant souhaitée est présenté au couteau.
- Coupe du tissu à une épaisseur de 12 um. Placer des tranches de tissu sectionnés sur des lames de microscope en polycarbonate et laisser sécher pendant 30 minutes à température ambiante. Pour le stockage à long terme, stocker la diapositive congelé dans un congélateur à -80 ° C.
2. Culture cellulaire
Note: La culture cellulaire a été réalisée dans une enceinte de sécurité biologique (biosécurité de niveau II) dans des conditions stériles. lignée cellulaire HeLa a été utilisé en tant que système modèle, et les cellules ont été cultivées dans un milieu de culture complet avec les protocoles classiques suivants:
- Réactifs chauds (ie, la trypsine, tampon phosphate salin (PBS), et milieu de culture cellulaire) à 37 ° C.
Remarque: Le milieu de culture cellulaire contient sa inorganiqueLTS, des acides aminés, des vitamines et autres. Pour une liste complète des composants, reportez-vous à la formulation du fabricant. - Obtenir un échantillon cellulaire (par exemple, 1 ml de suspension de cellules HeLa) et l' ajouter dans 9 ml de milieu complet de culture cellulaire dans une plaque de 10 cm de culture cellulaire standard. Le nombre initial de cellules est d' environ 0,5 x 10 6 cellules / ml. Maintenir les cellules en culture à 37 ° C avec 5% de CO 2 pendant 2-3 jours jusqu'à ce que la surface de croissance est recouverte à 70-80% par rapport à la plaque de culture cellulaire. Numéro de passage de cellule pour chaque cycle successif.
- Effectuer des passages des cellules ( par exemple, la division cellulaire) dans la plaque de culture cellulaire.
- milieu de croissance Aspirer, et utiliser 5 ml de PBS 1x pour rincer les cellules. Retirer du PBS en utilisant une pointe d'aspiration stérile, et on incube les cellules avec 2,5 ml de trypsine (0,25%) pendant environ 5 min à 37 ° C pour détacher les cellules de la plaque de culture.
Remarque: Le temps de traitement à la trypsine réelle doivent être optimisés en fonction de la trypsine produ spécifiquect acheté auprès du fabricant. Temps de traitement inadéquat laisse les cellules fixées à la plaque, tandis que le traitement excessif conduit à la mort cellulaire. - Arrêter l'activité de la trypsine par addition de 7,5 ml de milieu complet de culture cellulaire, puis la remise en suspension de façon uniforme les cellules (volume total 10 ml). Utilisez la suspension cellulaire pour la culture (étape 2.2) ou de la préparation d'échantillons SCMS (étape 2.4).
- milieu de croissance Aspirer, et utiliser 5 ml de PBS 1x pour rincer les cellules. Retirer du PBS en utilisant une pointe d'aspiration stérile, et on incube les cellules avec 2,5 ml de trypsine (0,25%) pendant environ 5 min à 37 ° C pour détacher les cellules de la plaque de culture.
- Préparer les échantillons de cellules pour les expériences SCMS.
- Placez les diapositives individuelles micro de couverture dans une plaque de 12 puits et ajouter du milieu de culture de 1,8 ml de cellules et 0,2 ml de suspension de cellules dans le puits.
- Mélanger délicatement les cellules avec une légère agitation de la plaque, et incuber dans un environnement CO 2 de 5% à 37 ° C pendant environ 24 heures. Pour effectuer un traitement médicamenteux pour les cellules en culture, on ajoute une solution de composé de médicament (par exemple, dans du DMSO (diméthylsulfoxyde)) dans 12 puits une plaque de culture cellulaire.
Remarque: La concentration finale de médicament (par exemple, 10 nM, 100 nM, 1 pM et 10 pM) et ttemps raitement (par exemple, 4 h) sont modifiées en fonction de l'objectif spécifique d'études. Les cellules sont fixées sur les lames de couverture micro et prêt pour les expériences de CSMS (étape 6).
3. Single-sonde Fabrication
- Placez le tube de quartz à double alésage (diamètre interne (ID) 127 um, diamètre extérieur (OD) 500 um) dans un extracteur micropipette laser et tirer une aiguille à quartz double alésage. Utilisez les paramètres suivants comme points de départ: Heat = 400, Fil = 3, Vel = 80, Del = 150, et Pul = 250 (toutes les unités sont les unités du fabricant). Veiller à ce que l'aiguille à double alésage quartz tiré a une pointe conique pour des propriétés optimales de la sonde. Couper l'extrémité tirée de sorte qu'il ya ~ 5 mm de long du capillaire de quartz à double alésage unpulled gauche à l'autre extrémité.
Remarque: Les paramètres réels de l'extracteur de laser doivent être optimisés en fonction des conditions spécifiques de l'instrument. - Découper une section ~ 80 mm du capillaire en silice fondue (ID 40 um, OD. 105 um) comme solvant fournissant capillaire, et l'insérer dans un trou à l'extrémité plate de l'aiguille à quartz double alésage.
- Coupez une section ~ 40 mm de capillaire en silice fondue (ID 40 um, OD 105 um) et utiliser un rasoir pour se raser ~ 5 mm de la couche de polyimide à partir du point médian. Utilisez une flamme de propane pour chauffer et tirer le capillaire scellé dans un nano-ionisation par électronébulisation (ESI) émetteur d'une amende conique rapidement. Coupez un émetteur nano-ESI (~ 7-10 mm de long), et l'insérer dans l'autre alésage à l'extrémité plate de l'aiguille à quartz double alésage. Vous pouvez également utiliser l'extracteur de laser pour produire une amende conique.
- Appliquer une quantité minimale de (~ 1-2 pi) de résine de durcissement UV sur l'extrémité plate de l'aiguille à quartz double alésage, et solidifier la résine à l'aide d'une lampe UV à LED pour ~ 20 sec pour obtenir le solvant fournissant capillaire et le nano- émetteur ESI. Les procédures pour assembler les différentes pièces en une seule sonde sont présentés dans la figure 1a.
- Coupez un gl de microscope standardslide ass (1 "x 3") dans la moitié de la longueur. Placer la seule sonde sur une extrémité de la lame de verre de telle sorte que l'émetteur de nano-ESI est dirigé vers l'extérieur. Appliquer l'époxy régulière sur le corps de la sonde unique de sorte qu'il devient fixé sur la lame de verre (figure 1b). Laisser une nuit pour le durcissement. Couple la seule sonde fabriquée avec la configuration mono-sonde intégrée (figure 1c), qui est attaché à un spectromètre de masse , comme illustré sur la figure 1d.
4. Construire le MS Setup intégré unique sonde
- Modifier l'interface source d'ions bride du spectromètre de masse et de fabrication de la cage (avec position réglable et hauteur) du stéréoscope numérique (figures 1E et 1F).
- Percer une interface bride de source d'ions de deux trous permettant la fixation d'une carte optique en aluminium. Réaliser un dispositif de glissière de guidage et une tige de réglage de hauteur (fixée àune étape XY pour affiner la position de réglage), de telle sorte que le système de stéréoscope numérique peut être fixé à la carte optique en aluminium (figure 1E).
- Fixer le microscope modifié stéréo numérique, un microscope numérique USB, une XYZ étape manuelle miniature de traduction avec un support de fixation flexible, le système de platine de translation XYZ motorisé à la carte optique en aluminium, qui est monté sur l'interface source d'ions bride personnalisée du spectromètre de masse (figures 1c et 1f). Utilisez le support de fixation flexible pour fixer la lame de verre attaché avec une seule sonde.
- Fixer la configuration mono-sonde au spectromètre de masse (Figure 1f). Ajuster le support de serrage flexible et la platine XYZ miniature pour placer l'émetteur du seul capteur en face de l'entrée du spectromètre de masse. Utilisez le microscope numérique USB (avec angle de vue réglable) sur le côté de mono-sonde pour fournir une image zoomée du single-ppointe de robe ou de l'émetteur nano-ESI, et le stéréoscope numérique (réglable en hauteur) au-dessus de la seule sonde pour voir les cellules et la pointe de la sonde.
Remarque: L'utilisation de la bride de la source d'ions correspondante, ce système à une seule sonde intégrée peut être couplé à d'autres types de spectromètres de masse équipés de sources d'ionisation ambiante.
5. Ambient MSI
- Décongeler la section de l'échantillon à température ambiante et placez-le sur le système de platine de translation motorisé XYZ sous la seule sonde. Ajuster la position de l'échantillon en changeant les coordonnées dans le logiciel de contrôle.
- En utilisant la seringue pour pomper le solvant d'échantillonnage à un taux approprié (par exemple, 0,2 ul / min), et appliquer la tension d'ionisation (par exemple 5 kV). La sélection du solvant d'échantillonnage est flexible, et les plus communs comprennent MeOH: eau (9: 1) et l'acétonitrile. Le volume mort de l'émetteur nano-ESI a été estimé à ~ 3 nl, et le temps entre la sonde-surfacontact CE et de l' observation du signal d'ions est généralement inférieure à 1 sec 15.
Remarque: La bride d'interface de source d'ions sur mesure permet à la tension d'ionisation à livrer du spectromètre de masse à une union conductrice à travers une pince crocodile. La tension d'ionisation est alors transmise par l'intermédiaire d'une union conductrice au solvant à l'intérieur du capillaire et des canaux mono-sonde, et appliquée sur l'émetteur nano-ESI pour ioniser les analytes dans l'échantillon. Assurez-vous que la tension d'ionisation est désactivé lors de la connexion de la pince crocodile avec le syndicat conducteur. - Ajuster la hauteur de la sonde unique de sorte qu'il repose juste au-dessus de la surface de l'échantillon et capable d'effectuer la surface d'extraction de métabolites. Soulevez délicatement le Z-scène, et ensuite utiliser le microscope numérique USB (sur le côté de la seule sonde) pour surveiller le changement de distance entre la pointe unique sonde et la surface de tissu. Surveiller les changements dans le spectre de masse lors de ce réglage de la hauteur, et arrêter ascenseuring Z phases lors d'un changement du signal d'ions de fond solvant à des métabolites de tissu est observé.
- Répétez l'étape 5.3 trois fois pour régler trois points différents dans le programme de contrôle de la scène pour surface automatisé ajustement aplatissement. Placer la pointe de la sonde unique à trois points sur la surface de l'échantillon à une distance d'environ 10 mm les unes des autres. Effectuer le réglage en hauteur en appuyant sur le haut et le bas des icônes, et de verrouiller les trois points en position sous la «méthode de régime».
- Définissez les autres paramètres de tramage à travers la section d'intérêt au sein de l'échantillon à l'aide de ce programme. Pour les sections de rein de souris présentés ici, en utilisant un 10,0 um / s Vitesse de tramage et 20 um distance entre les lignes. Le système de platine motorisée a un incrément mouvement 0,1 um minimum. La distance entre la pointe unique sonde et le tissu est obtenu à partir de l'étape 5.3.
- Mettre en place une méthode pour l'acquisition automatique de spectres MS à partir du spectromètre de masse. for la résolution de masse élevée MSI sur un échantillon de rein de souris, utilisez les paramètres suivants: résolution de masse 60.000 (m / Δm), ~ mode positif de 5 kV, 1 microscan, temps d'injection 150 msec max, et AGC sur. Tous les spectres MS acquises représentant des lignes individuelles de l'image MS ont le même nombre de balayages avec un espacement de temps uniforme entre chaque balayage, ce qui indique que la taille des pixels pour les images produites sont réparties uniformément.
- Initier l'acquisition de données MSI. Initier la séquence d'acquisition MS pour le spectromètre de masse, puis lancer la séquence de tramage pour le programme de contrôle XYZ.
- Par exemple, dans le programme d'acquisition de données MS utilisé ici, allez dans "la configuration de séquence", sélectionnez "Nouvelle séquence", générer un ensemble de fichiers pour une nouvelle séquence numérotée de 01 à X, où X est le nombre de lignes utilisées pour la image MS désirée à prendre, puis appuyez sur "Exécuter séquence".
- Utilisez un dispositif électronique maison pour permettre au logiciel pour produire un contale signal de fermeture ct pour le spectromètre de masse pour collecter les données. Le schéma est représenté dans la figure supplémentaire (figure S1) comme référence.
- Construisez MS images à partir de fichiers MS brutes en utilisant le logiciel de visualisation MSI approprié. Par exemple, lorsque vous utilisez le logiciel développé par le groupe Laskin à PNNL 17, procédez comme suit.
- Cliquez sur "Sourcils fichier." Sélectionnez le premier fichier obtenu à partir de l'expérience MSI. Indiquez où le fichier commence et se termine sous la rubrique «Nombre de lignes». Sélectionnez une plage de valeurs m / z pour la gamme d'image MS sous "Entrée MZ Range".
- Appuyez sur le bouton "Démarrer" pour lancer le processus de création d'image. Une fois l'image MS est fait, cliquez sur "Enregistrer l'image" sous "Barre d'outils" pour stocker des images dans l'ordinateur.
6. In-situ en direct SCMS
- Configuration du système mono-sonde par instruireions pour MSI. Réglez le solvant (par exemple, MeOH / H 2 O ou acétonitrile) débit (par exemple, ~ 25 nl / min).
- Laver les cellules en culture, qui sont fixés sur les lames de verre de couverture micro, avec du PBS pour éliminer les médias culturels et des composants extracellulaires de drogue. Placez cellule contenant lame de verre sur le système de platine de translation motorisé XYZ pour l'expérience.
Remarque: Vous pouvez également utiliser le milieu de culture de cellules fraîches (sans contenant du sérum de veau foetal) pour rincer les cellules cultivées. suppression d'ions Moins a été observé. En outre, la cellule peut survivre plus longtemps au cours de l'expérience dans laquelle la température ambiante (~ 20 ° C) est nettement inférieure à la température de la culture (37 ° C). Le type de médicament, la concentration de la solution et la durée du traitement varient selon les études. - Concentrez le microscope stéréo numérique (au-dessus de l'échantillon) sur la pointe de la seule sonde pour contrôler la pénétration cellulaire lors de l'analyse. Utilisez le microscope numérique USB (sur le side de la seule sonde) pour surveiller les conditions de travail de l'émetteur nano-ESI sur la seule sonde.
- Utilisez le programme de commande de l'étage XYZ motorisé et d'un microscope stéréo numérique (au-dessus des cellules) pour localiser une cellule d'intérêt, et positionner avec précision la pointe unique sonde au-dessus de l'échantillon. Lancer l'acquisition de données MS avant la pointe seule sonde est insérée dans la cellule.
- Utilisez les paramètres suivants comme référence pour l'analyse MS en utilisant un spectromètre de masse à haute résolution: résolution de masse 100.000 (m / Δm), ~ mode 3 kV positif et négatif, 1 microscan, 150 msec max temps d'injection, le mode AGC. acquisition automatique des spectres MS se fait en cliquant sur "Démarrer" dans le programme d'acquisition de données MS.
- Soulevez le Z-platine motorisée en cliquant sur l'icône pour pénétrer la membrane cellulaire et de garder l'enregistrement du signal MS généré à partir de la cellule. Une temporisation de 1 à 2 secondes est généralement observée entre l'insertion de la sonde et la détection du signal SM. Que l'autre confirmation dela pénétration cellulaire, un changement dramatique des signaux MS peut être observée lors de la pénétration de la membrane cellulaire. Les signaux de composés intracellulaires MS peuvent généralement durer ~ 15-20 secondes avant une baisse significative.
- Plus bas dans la cellule contenant la plaque pour tirer la pointe unique sonde hors de la cellule. Cela prend habituellement <15 s pour les signaux d'ions des composés cellulaires pour approcher le niveau de bruit. Laissez le flux de solvant pour ~ 3 min pour vider complètement la seule sonde. Pendant ce temps, placez le système motorisé de stade XYZ pour localiser la cellule suivante à analyser. Chaque expérience cellulaire nécessite ~ 3 min à accomplir.
Résultats
La seule sonde a été utilisée avec succès pour l'analyse MSI ambiante de rein tissus de la souris en coupe 15. Le dispositif utilise le mécanisme de liquide de surface des micro-extraction (figure 1a), qui permet l' extraction d' un analyte très efficace à partir d' une petite surface, ce qui conduit à l' abondance des signaux d'intensités ioniques dans les résultats MSI. Par exemple, les intensités de signal de plus de 10 7 ont été obtenus pour certains métabolites abondants (figure 2a). Un grand nombre de métabolites ont été détectés de cette manière, y compris un certain nombre de sphingomyéline (SM) et de la phosphatidylcholine (PC) , des espèces telles que [SM (34: 1) + Na] + (725,5575 m / z), [PC (32: 0) + H] + (734,5700 m / z), [CP (34: 1) + Na] + (782,5696 m / z), et [PC (38: 5 + Na)] + (814,5726 m / z). Ces composés ont été identifiés avec une résolution de masse élevée et précision de la masse lorsqu'il est couplé toa haute résolution spectromètre de masse. Par exemple, l'identification a été effectuée avec moins de 4 ppm , m / z précision de masse ( à savoir, la différence entre les valeurs observées et théoriques) pour chaque métabolite (figure 2b) dans les résultats présentés ici. En outre, tandem MS analyse (c. -à- MS / MS) ont également été réalisées pour l' identification plus confiant des espèces d'intérêt 15.
En raison de la capacité d'effectuer efficacement des micro-extraction liquide sur une petite surface, le dispositif unique sonde peut être utilisée pour effectuer des expériences de résolution MSI élevés spatiales dans des conditions ambiantes 15. Par exemple, des images détaillées MS des sections de rein de souris ont été obtenus illustrant la répartition spatiale des métabolites sélectionnés (Figure 2c). La résolution spatiale de l'image MS a été déterminé à 8,5 um, suivant la métrique largement utilisé d'avoir le Transiti. sur le point d'une caractéristique forte déterminée au sein d' un changement d'intensité 20-80% du signal MS 18 Dans le cas de phospholipides [PC (38: 5 + Na)] + sur la section de rein de souris, la transition de fonction entre la moelle intérieure et la médullaire externe a lieu à travers un cycle de balayage dans le chronogramme, montrant un changement d'intensité supérieure à 20-80% de gamme. Sur la base de la vitesse échantillon mobile (10,0 um / sec) et MS taux d'acquisition de données (0,85 sec / spectre), l'échantillon se déplaçant distance en un MS scan du cycle (8,5 um), à savoir, la résolution spatiale MSI, peut être calculée (Figure 2d). Cette résolution spatiale est parmi les plus élevés encore atteint pour les techniques MSI ambiantes effectués sur des échantillons biologiques.
Pour SCMS la seule sonde a pu réaliser l'analyse des cellules HeLa vivantes individuelles 16. La taille de la seule sonde pointe est généralement inférieure à 10 pm (Figure 3a), qui est suffisamment petit pour être inséré directement dans de nombreux types de cellules eucaryotes, dont le diamètre est d' environ 10 um, pour l' extraction et l' analyse MS. Le processus d'insertion de la pointe unique sonde dans une cellule peut être contrôlée visuellement en utilisant un microscope stéréo numérique (Figure 3b), et la pénétration de la membrane cellulaire peut être confirmé par l'évolution rapide et significative des spectres de masse de PBS (ou culture de cellules fraîches moyen) à des composés intracellulaires (figures 3c et 3d). Les expériences peuvent être réalisées dans les deux modes d'ions positifs et négatifs pour détecter les types d'espèces moléculaires plus larges. Par exemple, les 18 espèces lipidiques différentes ont été identifiées dans le mode positif, notamment les sphingomyélines (SM) et les phosphatidylcholines (PC), tandis que les phosphates d' adénosine (AMP, ADP et ATP) ont été détectés dans le mode ions négatifs (figures 3c et d). Le délai entre la simple sonde insertion into une cellule et la détection du signal est typiquement inférieur à deux secondes, ce qui permet une détection en temps quasi réel de métabolites cellulaires. SCMS a également été appliqué à des expériences dans lesquelles les cellules ont été traitées avec des médicaments anti - cancéreux (par exemple, OSW-1, le paclitaxel et la doxorubicine) 19]. Les médicaments correspondants peuvent être détectés dans les cellules HeLa après un traitement de 4 heures à une série de concentrations ( par exemple, 10 nM, 100 nM, 1 uM et 10 uM) dans du DMSO (diméthylsulfoxyde), en utilisant les cellules non traitées (ajout du DMSO uniquement ) en tant que contrôles. Les signaux de médicaments MS ne sont pas présents au sein du PBS extracellulaire ou le témoin (figure 3e), mais ont été détectées dans les cellules individuelles en utilisant la technique MS mono-sonde (à 100 nM résultats du traitement sont présentés dans la figure 3f). Parce que les cellules ont été rincées avec du PBS (ou milieu de culture cellulaire frais) pour éliminer les composés extracellulaires et des contaminations, la détection de métabolites endogènes (par exemple, des lipides cellulaires und phosphates d' adénosine) et les composés exogènes (par exemple, les médicaments anticancéreux) indique que la technique MS unique sonde peut être utilisée pour analyser les composés intracellulaires.
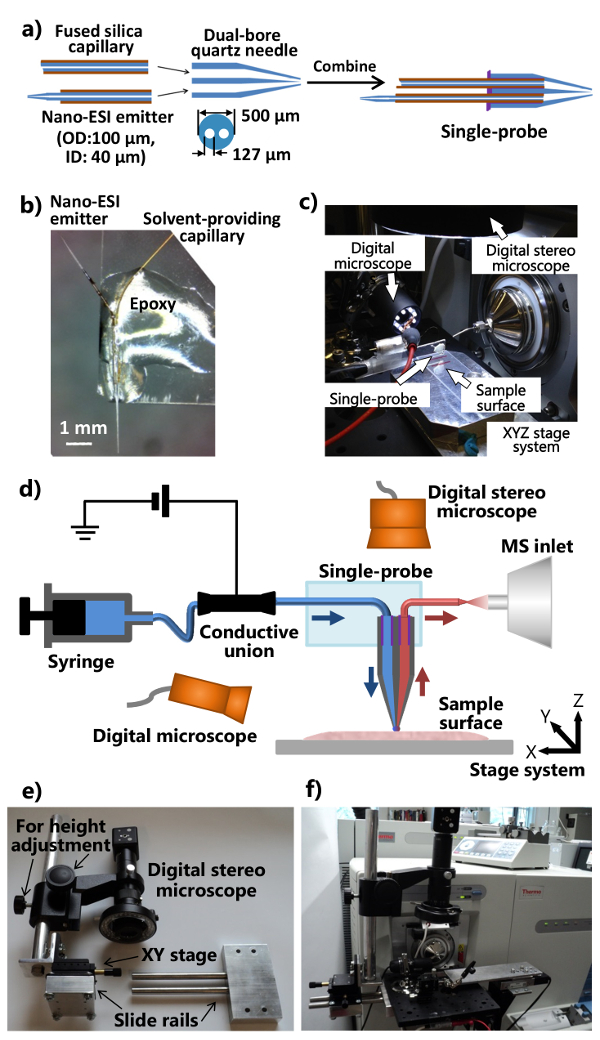
Figure 1. Fabrication et mise en place de la seule sonde pour MSI et SCMS analyse ambiante. A) les procédures de fabrication de la seule sonde. B) Photographie d'une seule sonde fabriquée attachée à une lame de verre. C) Photo du simple la configuration de la sonde fixée à un spectromètre de masse. d) Schéma de la configuration mono-sonde couplée à un spectromètre de masse. Lors d'une expérience, le solvant d'échantillonnage est fourni en continu à partir de la seringue, la tension d'ionisation est appliquée à l'union conducteur à partir du spectromètre de masse, deux microscopes numériques sont utilisés pour contrôler le placement de l'échantillon, la platine XYZ motorisésystème est utilisé pour contrôler le mouvement de l' échantillon, et un spectromètre de masse est utilisé pour l' analyse. e) Photo du système de stéréoscope numérique personnalisé. f) Photo montrant le stéréoscope numérique relié à l'interface source d'ions bride à travers une carte optique. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
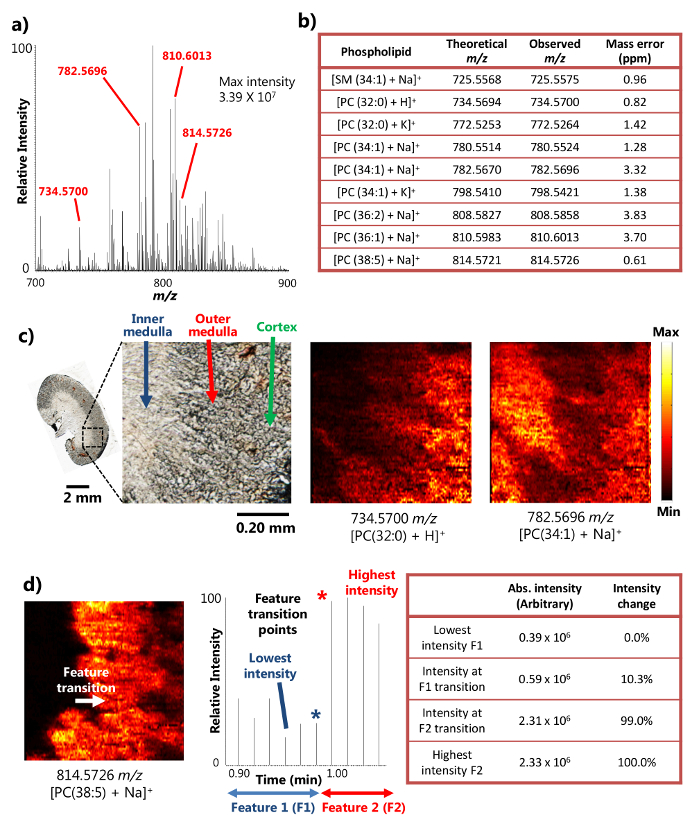
Figure 2. Les résultats d'une étude ambiante MSI d'une section de rein de souris avec une résolution spatiale et la masse élevée. A) Un spectre de masse représentant de la seule sonde MSI. L'intensité maximale des métabolites détectés peut atteindre 3,39 x 10 7 (unités arbitraires). B) Une sélection des métabolites détectés présenté avec leur précision de masse. C)Images MS de [PC (32: 0) + H] + et [PC (34: 1) + Na] + prélevés dans une section de rein de souris à 8,5 um résolution spatiale. PC: phosphatidylcholine. Barre d'échelle: 2 mm; 0,20 mm ( en médaillon) d) Détermination de la résolution spatiale de l'image MS pour. [PC (38: 5) + Na] + (adapté avec la permission de la référence 15). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3. Les résultats d'une analyse SCMS ambiante de drogue traitées cellules HeLa avec une résolution de masse élevée. A) zoomée photo de la pointe unique sonde montrant une taille typique de <10 um de diamètre. B) Photo prise au point de insertion unique sonde dans une cellule HeLa. Barre d'échelle: 50 um.c) Un spectre de masse positif typique du mode d'ions avec les identifications d'un certain nombre de PC (phosphatidylcholine) espèces. d) Une liste représentative des métabolites détectés par l' analyse SCMS des cellules HeLa à la fois dans les modes d'ions positifs et négatifs. ef) Les spectres de masse pour le contrôle et traité (100 nM OSW-1) cellules (adapté avec la permission de la référence 16). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
La figure S1. Schéma électrique du dispositif électronique utilisé pour produire un contact signal de fermeture pour un spectromètre de masse pour recueillir des données. S'il vous plaît cliquer ici pour voir ou télécharger ce chiffre.
Discussion
La seule sonde est un appareil multifonction qui peut être utilisé aussi bien pour les expériences MSI et SCMS. La configuration mono-sonde (y compris les systèmes en phase de traduction, des microscopes, source d'ions bride d'interface, etc.) est conçu comme un composant add-on qui peut être adapté de manière flexible au spectromètre de masse existant. Un échange rapide entre la configuration mono-sonde et la source d'ions ESI classique peut être effectuée en une minute. En principe, en utilisant l'interface source d'ions bride appropriée, la configuration unique sonde peut être adaptée à tout autre les spectromètres de masse. En outre, le solvant d'échantillonnage contenant une variété de réactifs peut être utilisé avec la configuration mono-sonde pour les expériences MSI et SCMS réactives, ce qui améliore considérablement la détection des gammes plus larges de biomolécules. En plus des tissus animaux et des lignées cellulaires, la seule sonde est aussi capable d'analyser d'autres systèmes biologiques comme les plantes. Par conséquent, avec la même configuration expérimentale etla formation d'utilisateur similaire, une variété d'études peut être réalisée à l'aide d'un seul instrument, et par les mêmes utilisateurs, ce qui permet des expériences efficace et polyvalent pour être accompli avec le temps de formation minimum et le coût de l'instrumentation.
L'élément clé de la technique MS seule sonde est la sonde elle-même. La qualité de la seule sonde a une influence significative sur sa performance, qui détermine en grande partie la qualité des deux expériences MSI et SCMS. Lors de la fabrication mono-sondes, assurez-vous que les capillaires à l'intérieur du tube à double alésage sont solidement collés pour éliminer le risque de fuite de solvant au cours des expériences. Il est essentiel d'utiliser une quantité minimale d'UV époxy durcissable, de telle sorte que les orifices et les capillaires ne sont pas obstrués lors de la fabrication de la sonde.
La seule sonde a été utilisée pour effectuer la résolution spatiale et la masse ambiante élevée MSI sur des échantillons biologiques 15. Le principal avantage de MSI ambiante surles méthodes non-ambiantes est que la préparation de l' échantillon est maintenu à un minimum sans avoir besoin d'un environnement d'échantillonnage sous vide, ce qui permet à l'échantillon à analyser dans un état proche natif 8. L' un des principaux obstacles pour la plupart des autres ambiante technique MSI a eu un manque de résolution spatiale 1. Par rapport à la désorption en fonction MSI techniques (tels que DESI et LAESI), la petite taille de la seule sonde pointe permet à un liquide de surface micro-extraction plus robuste et plus efficace à effectuer sur une petite surface, conduisant à une haute résolution spatiale 8,5 pm, qui est parmi les plus élevés obtenus en utilisant des techniques MSI ambiantes 15. En outre, le réglage des composants du solvant d'échantillonnage fournit une flexibilité supplémentaire pour effectuer des expériences. Par exemple, l' échantillonnage des solvants contenant des réactifs (par exemple, les composés dicationiques) ont été utilisées pour réaliser des expériences MSI réactives, permettant une augmentation significative du nombre de métabolites identifiés per 20 expérience. L'autre avantage de la seule sonde est la conception intégrée, qui assure la facilité d'utilisation pendant toute la durée du processus d'acquisition de données. Parce que la distance entre la pointe et la surface des tissus est très sensible pour l'intensité du signal d'ions et de la stabilité, l'obtention d'une coupe de tissu plat et surface conductrice aplatissement ajustement pour minimiser la variance de la distance est une clé pour des expériences MSI de haute qualité. Il en résulte que les techniques MSI mono-sonde ne sont pas appropriés pour obtenir des images MS spatiales élevées de surfaces inégales.
En plus de la fabrication d'une sonde de haute qualité, le réglage soigneusement l'instrument est essentiel pour une expérience réussie MSI. Parmi toutes les étapes de réglage, le réglage de la hauteur de la pointe unique sonde au-dessus de la surface de coupe de tissu est la plus critique. Lors du réglage de la hauteur de la sonde, la pompe du solvant d'échantillonnage et tourner sur la tension d'ionisation, de sorte que seuls les signaux d'ions de fond de solvants peuvent être observed. Puis suivre l'évolution du spectre de masse tout en réduisant soigneusement la distance sonde-surface en soulevant le Z-platine motorisée jusqu'à des signaux forts et stables ion de section de tissu peuvent être observés; cette hauteur de la sonde sera utilisée pour la collecte de données MSI pendant l'expérience. En outre, un débit de solvant optimisé est essentiel pour les expériences MSI. Réglez le débit à la hauteur de la sonde optimisée. Assurez -vous qu'il n'y a pas de propagation de solvant sur la surface du tissu (c. -à- débit est trop élevé) ou la formation de bulles à l' intérieur de l'émetteur nano-ESI (ie, le débit est trop faible).
La seule sonde est un dispositif multifonctionnel pour la bioanalyse. En plus des expériences MSI, il est capable de conduire en temps quasi réel in-situ SCMS pour élucider l' information chimique détaillée à partir de cellules eucaryotes vivantes 16, ce qui est un avantage majeur par rapport aux autres sous vide techniques SCMS base (tels que MALDI 10 et SIMS 21 ). La petite taille de la pointe de la sonde permet d'être inséré dans une cellule eucaryote en direct et pour extraire et ioniser les composés intracellulaires pour une analyse immédiate de MS. De même, les solvants d'échantillonnage contenant des réactifs (par exemple, les composés dicationiques) peuvent être utilisés dans les expériences SCMS, et une gamme plus large de constituants cellulaires peuvent être détectés dans une cellule vivante unique que jamais (recherche en cours, les données ne sont pas représentés). Bien que l'analyse en temps réel fournira les profils chimiques des cellules individuelles en direct, en raison de la pénétration cellulaire de la membrane et l'extraction du contenu cellulaire, la cellule sous enquête sera tué après l'expérience, ce qui implique que la technique SCMS seule sonde est encore une méthode destructive. En outre, la pointe de la sonde et de nano-ESI émetteur dans la seule sonde peut être facilement obstrués pour les utilisateurs inexpérimentés. Pour réduire le risque de colmatage de l'appareil, assurez-vous d'éviter de toucher le noyau lors de l'insertion de la pointe unique sonde dans un cell. En cas de bourrage, le dispositif peut être régénéré en chauffant la pointe de la sonde bouchée ou le nano-ESI émetteur utilisant une bobine de chauffage homebuilt 16. Une autre limitation de la technique SCMS seule sonde est que seules les cellules adhésives (c. -à- cellules sont fixées sur les surfaces) peuvent être analysées en utilisant la configuration actuelle. Cependant, en incorporant le système de manipulation des cellules dans l'appareil MS mono-sonde, des types plus larges de la cellule peuvent être étudiés à l'avenir.
Semblable à l'expérience MSI, l'obtention d'une sonde de haute qualité et un débit de solvant optimisé est essentiel pour les études SCMS. Lorsque le réglage du débit de solvant, la pointe unique sonde est placée au- dessus de l'échantillon (pas de contact avec le milieu de culture cellulaire ou), et veiller à ce qu'il n'y ait pas des gouttes de solvant à partir de la pointe de la sonde ou la formation de bulles à l' intérieur du nano-ESI émetteur.
Déclarations de divulgation
We have no conflict of interest to declare with the work presented here.
Remerciements
The authors would like to thank Dr. Laskin (the Pacific Northwest National Laboratory) for sharing the motorized stage control software and MSI visualization program. We also thank Dr. Mao (the University of Oklahoma) for providing mouse organ samples and Mr. Chad E. Cunningham (the University of Oklahoma) for the assistance in machining and electronics work. This research was supported by grants from the Research Council of the University of Oklahoma Norman Campus, the American Society for Mass Spectrometry Research Award (sponsored by Waters Corporation), Oklahoma Center for the Advancement of Science and Technology (Grant HR 14-152), and National Institutes of Health (R01GM116116).
matériels
| Name | Company | Catalog Number | Comments |
| Single-probe fabrication | |||
| Dual bore quartz tubing, 1.120’’ × 0.005” × 12” | Friedrich & Dimmock, Inc, Millville, NJ | MBT-005-020-2Q | |
| Micropipette laser puller | Sutter Instrument Co., Novato, CA | Model P-2000 | |
| Fused silica capillary, ID: 40 µm, OD: 110 µm | Molex, Lisle, IL | TSP040105 | |
| UV curing resin | Prime Dental, Prime-Dent, Chicago, IL, USA | Item No. 006.030 | |
| LED UV lamp | Foshan Liang Ya Dental Equipment, Guangdong, China | LY-C240 | |
| Epoxy resin | Devcon, Danvers, MA | Part No. 20945 | |
| Inline MicroFilter | IDEX Health & Science LLC, Lake Forest, IL | M-520 | |
| Microunion | IDEX Health & Science LLC, Lake Forest, IL | M-539 | |
| Microscope slide (glass) | C & A Scientific - Premiere, Manassas, VA | 9105 | |
| Syringe | Hamilton, Reno, NV | 1725LTN 250UL | |
| Mass spectrometer | |||
| LTQ Orbitrap Mass sprectrometer | Thermo Fisher Scientific, Inc., Waltham, MA | LTQ Orbitrap XL | |
| Xcalibur 2.1 Software | Thermo Fisher Scientific, Inc., Waltham, MA | XCALIBUR21 | |
| Fance Stage Control | Pacific Northwest National Laboratory, Richland, WA | ||
| MSI QuickView | Pacific Northwest National Laboratory, Richland, WA | ||
| Contact closure device | |||
| USB-6009 Multifunction DAQ | National Instruments, Austin, TX | 779026-01 | |
| DR-5V SDS Relay | Panasonic, Kadoma, Japan | DR-SDS-5 | |
| Logic Gates 50 Ohm Line Driver | Texas Instruments, Dallas, TX | SN74128N | |
| Single-probe setup | |||
| Motorized linear stage and controller (3 sets) | Newport, Irvine, CA | Conex-MFACC | |
| Miniature XYZ stage | Newport, Irvine, CA | MT-XYZ | |
| Translation XY stage | ThorLab, Newton, NJ | PT1 and PT102 | |
| Thermo LTQ XL ion source interface flange | New Objective, Woburn, MA | PV5500 | |
| Digital stereo microscope, 250X - 2,000X | Shenzhen D&F Co., Shenzhen, China | Supereyes T004 | |
| USB Digital Photography Microscope | DX.com, HongKong, China | S02 25~500X | |
| Syringe pump | Chemyx Inc., Stafford, TX | Nexus 3000 | |
| Solid Aluminum Optical Breadboard, 8" x 8" x 1/2" | Thorlabs, Newton, NJ | MB810 | |
| Flexible clamp holder | Siskiyou, Grants Pass, OR | MXB-3h | |
| Solvents | |||
| Methol | Sigma-Aldrich, St. Louis, MO | 34860 Chromasolv | |
| Water | Sigma-Aldrich, St. Louis, MO | W4502 | |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO | 34967 Chromasolv | |
| Cell culture | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Cellgro, Manasas, VA | 10-013-CV | |
| 10% heat-inactivated fetal bovine serum (FBS) | Gibco/Life Technologies, Long Island, NY | 10100-139 | |
| Penicillin/Streptomycin | Cellgro, Manasas, VA | 30-002-CI | |
| 10 mM HEPES (pH 7.4) | Cellgro, Manasas, VA | 25-060-CI | |
| Phosphate Buffered Saline (PBS) | Cellgro, Manasas, VA | 46-013-CM | |
| TrypLE Express | Thermo Fisher Scientific, Waltham, MA | 12604-013 | |
| 12-well plates | Corning Inc., Corning, NY | Falcon 351143 | |
| T25 flask | Corning Inc., Corning, NY | Falcon 3055 | |
| Micro Cover Glasses, Round, No. 1 | VWR International, Radnor, PA | 48380-046 | |
| DMSO (Dimethyl Sulfoxide) | VWR International, Radnor, PA | BDH1115-1LP | |
| Tissue imaging | |||
| Cyro-Cut Microtome | American Optical Coporation | ||
| Tissue-Tek, Optimum cutting temperature (OCT) | Sakura Finetek Inc., Torrance, CA | 4583 | |
| Microscope slide (polycarbonate) | Science Supply Solutions, Elk Grove Village, IL | P11011P | |
Références
- Vickerman, J. C. Molecular imaging and depth profiling by mass spectrometry-SIMS, MALDI or DESI?. Analyst. 136 (11), 2199-2217 (2011).
- Schwamborn, K. Imaging mass spectrometry in biomarker discovery and validation. J. Proteomics. 75 (16), 4990-4998 (2012).
- Schwamborn, K., Caprioli, R. M. MALDI Imaging Mass Spectrometry - Painting Molecular Pictures. Mol Oncol. 4 (6), 529-538 (2010).
- Kraft, M. L., Klitzing, H. A. Imaging lipids with secondary ion mass spectrometry. Biochim. Biophys. Acta. 1841 (8), 1108-1119 (2014).
- Wiseman, J. M., et al. Desorption electrospray ionization mass spectrometry: Imaging drugs and metabolites in tissues. Proc Natl Acad Sci U S A. 105 (47), 18120-18125 (2008).
- Nemes, P., Woods, A. S., Vertes, A. Simultaneous imaging of small metabolites and lipids in rat brain tissues at atmospheric pressure by laser ablation electrospray ionization mass spectrometry. Anal. Chem. 82 (3), 982-988 (2010).
- Laskin, J., Heath, B. S., Roach, P. J., Cazares, L., Semmes, O. J. Tissue Imaging Using Nanospray Desorption Electrospray Ionization Mass Spectrometry. Anal. Chem. 84 (1), 141-148 (2012).
- Wu, C., Dill, A. L., Eberlin, L. S., Cooks, R. G., Ifa, D. R. Mass spectrometry imaging under ambient conditions. Mass. Spectrom. Rev. 32 (3), 218-243 (2013).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: do differences make a difference?. Cell. 141 (4), 559-563 (2010).
- Amantonico, A., Urban, P. L., Fagerer, S. R., Balabin, R. M., Zenobi, R. Single-Cell MALDI-MS as an Analytical Tool for Studying Intrapopulation Metabolic Heterogeneity of Unicellular Organisms. Anal. Chem. 82 (17), 7394-7400 (2010).
- Passarelli, M. K., Ewing, A. G., Winograd, N. Single-cell lipidomics: characterizing and imaging lipids on the surface of individual Aplysia californica neurons with cluster secondary ion mass spectrometry. Anal. Chem. 85 (4), 2231-2238 (2013).
- Shrestha, B., et al. Subcellular metabolite and lipid analysis of Xenopus laevis eggs by LAESI mass spectrometry. PLoS One. 9 (12), e115173 (2014).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass. Spectrom. 43 (12), 1692-1700 (2008).
- Zhang, L., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Rao, W., Pan, N., Yang, Z. High Resolution Tissue Imaging Using the Single-probe Mass Spectrometry under Ambient Conditions. J. Am. Soc. Mass. Spectrom. 26 (6), 986-993 (2015).
- Pan, N., et al. The single-probe: a miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Thomas, M., et al. Visualization of High Resolution Spatial Mass Spectrometric Data during Acquisition. 2012 Annual International Conference of the Ieee Engineering in Medicine and Biology Society (Embc). , 5545-5548 (2012).
- Luxembourg, S. L., Mize, T. H., McDonnell, L. A., Heeren, R. M. High-spatial resolution mass spectrometric imaging of peptide and protein distributions on a surface. Anal. Chem. 76 (18), 5339-5344 (2004).
- Zhou, Y., et al. OSW-1: a natural compound with potent anticancer activity and a novel mechanism of action. J Natl Cancer Inst. 97 (23), 1781-1785 (2005).
- Rao, W., Pan, N., Tian, X., Yang, Z. High-Resolution Ambient MS Imaging of Negative Ions in Positive Ion Mode: Using Dicationic Reagents with the Single-Probe. J. Am. Soc. Mass. Spectrom. 27 (1), 124-134 (2016).
- Ostrowski, S. G., Kurczy, M. E., Roddy, T. P., Winograd, N., Ewing, A. G. Secondary ion MS imaging to relatively quantify cholesterol in the membranes of individual cells from differentially treated populations. Anal. Chem. 79 (10), 3554-3560 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon