Method Article
Haut Analyse de dépistage du contenu pour évaluer les effets toxicologiques des composants nocifs et potentiellement dangereux (HPHC)
Dans cet article
Résumé
The objective of the study was to assess the biological impact of 15 cigarette smoke constituents using a combination of an impedance-based real time cell analyzer and a high-content screening (HCS)-based platform for toxicological assessment in vitro. This study provides information on effective doses, toxicity and modes of action of the tested compounds.
Résumé
La fumée de cigarette (CS) est un facteur de risque majeur pour les maladies cardiovasculaires et pulmonaires. Parce que CS est un aérosol complexe contenant plus de 7000 produits chimiques 1 , il est difficile d'évaluer les contributions des différents constituants à sa toxicité globale. Profils toxicologiques des composants individuels ainsi que les mélanges peuvent cependant être établies in vitro, par application d'une haute traversante mettre des outils de dépistage, qui permettent le profilage des constituants nocifs et potentiellement dangereux (HPHCs) de la fumée de tabac, tel que défini par la US Food and Drug administration (FDA). 2
Pour une évaluation initiale, un instrument à base d'impédance a été utilisé pour un temps réel, l'évaluation sans étiquette de la toxicité du composé. L'affichage de l'appareil repose sur l'adhésion cellulaire, de la viabilité et de la morphologie qui fournissent ensemble une vue d'ensemble de l'état de la cellule. Un paramètre sans dimension, nommé index de cellule, est utilisée pour la quantification. Un ensemble de difprotocoles de coloration diffé- a été développé pour une enquête basée sur l'imagerie par fluorescence et une plate-forme de HCS a été utilisé pour gagner plus en profondeur des informations sur le type de cytotoxicité induite par chaque HPHC.
Sur les 15 constituants testés, seuls cinq ont été sélectionnés pour une analyse basée sur HCS comme ils ont enregistré une LD calculable 50 (<20 mM). Ceux-ci comprenaient 1-aminonaphtalène, Arsenic (V), le chrome (VI), crotonaldéhyde et Phénol. Sur la base de leurs effets dans le HCS, 1-aminonaphtalène et Phénol pourraient être identifiés pour induire un dysfonctionnement mitochondrial, et, conjointement avec le chrome (VI) comme génotoxique sur la base phosphorylation accrue de l'histone H2AX. Crotonaldéhyde a été identifié comme un inducteur de stress oxydatif et l'arsenic en tant que voie activateur stress kinase.
Cette étude démontre qu'une combinaison de technologies à base d' impédance et HCS fournit un outil robuste pour l' évaluation in vitro des constituants CS.
Introduction
l'évaluation des risques toxicologiques a toujours compté sur l'utilisation de modèles animaux qui, bien que fondamentale dans les sciences de la vie, sont aussi liés à des insuffisances telles que traductibilité incompatibles pour les humains et les coûts élevés. En outre, il y a eu un effort de plus en plus de trouver des alternatives à l' expérimentation animale dans l'esprit de «Les 3R» 2 (remplacement, réduction et raffinement). Cet effort a été accéléré au cours des dernières années, non seulement en raison des progrès récents, tels que les techniques à haut débit et approches de biologie systémique, mais aussi à cause de la législation limitant l'utilisation de tests sur les animaux, en particulier dans l'Union européenne.
La complexité des voies de signalisation cellulaires régulant la réponse aux agressions toxiques, il est évident que l'utilisation de paramètres toxicologiques simples ne sera pas suffisant pour décrire la base toxicologique de certains composés. Pour cela, le jeu des centaines d'interagir proteins contribuant à un réseau biologique devront également être pris en compte. Pour étudier l'effet des substances toxiques sur ces réseaux, une approche de la toxicologie du système combiné à moyen phénotypiques et des essais de criblage à haut débit est utile de déduire dynamisations et en même temps fournir plus d'informations sur le mécanisme d'action des toxiques individuels.
Dans cette étude, nous avons utilisé HCS comme un puissant outil de criblage qui se compose d'un microscope automatisé et d'une application logicielle biologique, qui peut acquérir, traiter et analyser des données d'images dérivées d'analyses cellulaires spécifiques basées sur la fluorescence. Cela permet des changements visuels dans une cellule à quantifier, à une seule cellule ou au niveau subcellulaire, et de nombreux paramètres à analyser simultanément. 3 Par exemple, l' ADN cassures double brin ont été évaluées à l' aide d' une identification à base d' anticorps de l' histone H2AX phosphorylation et espèces réactives de l'oxygène (ROS) ont été quantifiés en utilisant une cellule-permsuperoxyde Eable de colorant sensible.
Parce que les cellules épithéliales pulmonaires représentent la première barrière biologique contre les substances toxiques inhalés, y compris la fumée de cigarette, nous avons utilisé les cellules épithéliales bronchiques primaires comme un modèle in vitro pour profiler l'effet de HPHCs publiés par les États-Unis Food and Drug Administration. 4 Ce manuscrit est un suivi -up sur une étude précédente 5 , dans lequel nous avons évalué l'impact biologique d'un sous - ensemble différent de HPHCs.
Dans le cadre de notre flux de travail pour évaluer la cytotoxicité in vitro, nous avons d' abord évalué les potentialités d'une sélection de 15 HPHC de, en utilisant une analyse cellulaire en temps réel à base d' impédance système (RTCA) qui nous a permis d'établir la dose-gammes, appropriées pour HCS ultérieure analyse (figure 1). Une évaluation toxicologique HCS a ensuite été menée en utilisant neuf points d'extrémité multi-paramétriques de toxicité cellulaire, chaque suivi à deux points de temps (4 et 24 h). Les marqueurs utilisés sont une indication de la toxicité mitochondriale, des lésions de l' ADN, le stress kinase, les espèces réactives de l' oxygène (ROS), le glutathion (GSH) contenu caspase 3 - 7 activité, le cytochrome C libération et de la perméabilité de la membrane cellulaire, comme décrit dans le tableau 1.
Notre approche a permis l'identification et la caractérisation de l'effet des composants de la fumée de cigarette par échantillonnage de la dose et en fonction du temps. En fin de compte, cela a produit un profil toxicologique in vitro pour chaque HPHC. Les approches multi-omique peuvent également être utilisés pour compléter davantage l'analyse de HCS. Ce serait finalement aussi fournir une compréhension plus approfondie des effets sur la signalisation cellulaire et / ou niveau de la transcription.
Protocole
1. La récolte normale des cellules humaines épithéliales bronchiques (NHBEs)
- Préchauffer le milieu de culture cellulaire (milieu de milieu additionné de croissance des cellules épithéliales des bronches), le HEPES, la trypsine, la trypsine et la solution de neutralisation (TNS) dans le bain d'eau à 37 ° C.
- Récolter les cellules lorsque 80% de la confluence est atteinte.
Remarque: la culture de cellules NHBE suivant les conditions d'ensemencement peut être utilisé pour obtenir une convergence optimale dans des flacons T75 non enrobés avec 20 ml de milieu:- Ensemencer 1 x 10 6 cellules pour une culture de 3 jours, 0,5 x 10 6 cellules pour la culture de 4 jours et 0,25 x 10 6 cellules pour la culture de 5 jours. Changer le milieu tous les 2 jours lorsque les cellules sont en culture pour rafraîchir les éléments nutritifs. Les cellules de la culture à 37 ° C et 5% de CO 2.
- Retirer le surnageant du flacon (s) et ajouter de l' HEPES à laver les cellules (par ex., 3 : 2 ml pour une fiole de 75 cm). Tournez chaque flacon pour couvrir la monocouche cellulaire avec le sol HEPESution.
- On élimine la solution de HEPES et ajouter une solution de trypsine (par ex., 3 : 2 ml pour une fiole de 75 cm). Faire pivoter le flacon pour couvrir la monocouche cellulaire avec une solution de trypsine.
- Incuber la fiole pendant 5 minutes à 37 ± 2 ° C. Surveiller le détachement des cellules au microscope et, si nécessaire, incuber plus longtemps et appuyez sur le flacon pour libérer les cellules attachées restantes doucement.
- Ajouter TNS pour arrêter la réaction (par exemple., 3 ml pour un 2 flacon de 75 cm) et transférer la suspension cellulaire à un tube de 15 ml.
- Centrifuger la suspension cellulaire à 300 x g pendant 5 min.
- Jeter le surnageant et remettre en suspension le culot cellulaire dans 10 ml de milieu frais, en mélangeant doucement pour obtenir une suspension cellulaire homogène.
- Filtrer la suspension de cellules à travers un tamis cellulaire de 100 um pour éliminer les agrégats et compter les cellules. Remarque: Dans notre laboratoire, une multi-canal système de comptage de cellules par champ électrique a été utilisé pour évaluer de manière précise et cohérente la viablNombre de cellules e.
2. Temps réel cellulaire Analyzer (RTCA) à base Dose Range Finding (DRF)
NOTE: Un système de mesure à base d'impédance a été utilisé pour: 1) évaluer la toxicité du composé, 2) composés choisis pour être étudiés plus par HCS et 3) sélectionner les doses appropriées pour HCS. Les cellules NHBE dans les plaques RCTA sont dosés en ajoutant 25 pi d'essai dilutions de composé à 100 pi de milieu présent dans chaque puits. Par conséquent, toutes les solutions d'essai sont préparées à 5 fois (5x) la concentration finale désirée.
- Cellules NHBE Seeding
- Programmer l'instrument pour définir le nombre et la durée des mesures d'impédance. Dans cette étude, les données ont été enregistrées toutes les 15 minutes pendant 48 heures (à partir de 24 heures ± 2 heures avant et 24 heures après l'administration des cellules avec des agents de test).
- Mesurer l'arrière-plan de la plaque par pipetage 50 pi de milieu préchauffé dans chaque puits d'une plaque de 96 puits RTCA. Remarque: Cette étape représente une exigence techniquede l'instrument pour calculer la résistance électrique moyenne, qui est ensuite utilisé comme référence de base pour le calcul basé sur des cellules.
- Préparer une suspension cellulaire à une concentration de 144.000 cellules / ml (± 5%) et ajouter 50 ul de suspension cellulaire (7.200 cellules / puits) à chaque puits de la plaque RTCA dans lequel 50 pl / puits de milieu a déjà été ajouté pour instrument de fond la mesure.
- Que les cellules adhèrent pendant 30 min à température ambiante avant de les placer dans le berceau RTCA (pour améliorer la répartition homogène des cellules). Incuber les plaques RTCA dans le berceau RTCA dans l'incubateur (37 ° C et 5% de CO 2) et commencer à enregistrer les données pour le 24 ± 2 heures suivantes avant le dosage.
- Dilutions de HPHCs et contrôles positifs
- Contrôle positif Dilution
- Diluer la solution staurosporine de stock (10 mM) 1:10 dans du DMSO (voir tableau 3) et ajouter 5 pl du dilution à 195 ul de milieu pour obtenir une solution de travail 5x.
- HPHC dilution
- Dissoudre / diluer chaque HPHC dans le véhicule (tableau 2) pour générer une solution mère 1 M. Diluer chaque solution stock HPHC 1:10 dans un milieu pour produire une solution 100 mM.
- Générer la "plaque maître composé" en effectuant un cinq étapes dilution 1:10 de série en utilisant du milieu + 10% véhicule pour obtenir les solutions de travail 5x (Figure 2). Remarque: En fin de compte, les doses finales seront: 0,2 uM, 2 uM, 20 uM, 0,2 mM, 2 mM, 20 mM. Préparer également la dose 0, correspondant au seul véhicule, dans cette étape.
- dosage
- Pause l'instrument RTCA et ouvrez le berceau de retirer la plaque.
- Retirer la plaque et le placer dans l'outil de température de la plaque RTCA (conçu pour stabiliser la température de la plaque RTCA au cours des procédures expérimentales en dehors du RTCAla station) pour éviter le refroidissement des cellules, ce qui pourrait avoir un impact sur la mesure d'impédance.
- Ajouter 25 ul 5x solution de la "plaque composé de maître" aux cellules en triple exemplaire , en conservant le même ordre de dosage dans la plaque de maître composé (dose la plus élevée dans la rangée et de véhicules haut contrôle dans le numéro de la ligne 7) (figure 2). Ne pas retirer le (100 pi) milieu de culture cellulaire existant.
- Ajouter 25 ul 5x solution de contrôle positif pour les cellules de la ligne de fond (demi-droite) sans enlever le milieu de culture existant. Ajouter 25 milieu ul aux cellules dans la rangée inférieure (demi-gauche) sans enlever le milieu de culture cellulaire existant.
- Sceller la plaque avec plaque scellant. Placez la plaque arrière dans le berceau RTCA et le verrouiller. Données redémarrer l' enregistrement pour le temps d'exposition désiré (par exemple., 24 h). Note: L'utilisation de ce film d'étanchéité est recommandé d'éviter la contamination potentielle, y compris bien à bien la contamination croisée.
- Analyse des données RTCA et LD 50 Calcul
- données brutes à l'exportation en tant que texte (.txt) ou Excel (.xls). Remarque: Le fichier contiendra toutes les informations concernant le plan de plaque (composés, les doses et la position de puits). valeurs d'index de cellules brutes sont organisées dans un (la distribution de puits de la plaque miroir) format à 96 puits et sont prévus pour tous les points de temps au cours de laquelle l'enregistrement a eu lieu. La valeur à la position i dans la plaque de 96 puits à l' instant t est notée CI t (i).
- Identifier comme une normalisation la référence le dernier point de temps avant le dosage pour chaque position i dans la plaque de 96 puits (par exemple, l' indice cellulaire à 23 h 50 min 00 sec à la position i, CI t (i) = 23: 50: 00 = CI ref (i)). Note: Cette information doit être annotée lorsque le dosage est effectué.
- Divide, sur une base de bien, chaque fois que les valeurs de point par la référence de normalisation pour normaliser toutes les valeurs au moment de l'administration. La valeur normalisée au positioni dans la plaque de 96 puits à l' instant t est notée par le NCI t (i) et est ainsi définie par le NCI t (i) = CI t (i) / CI Ref (i) pour tout t.
- Calculer l'aire sous la courbe (AUC) à 24 h après l'administration pour chaque échantillon i (position i dans la plaque de 96 puits), y compris les postes de contrôle positif et le véhicule.
- Obtenir l'AUC à la position i est obtenue en additionnant les zones de chaque rectangle, chaque rectangle étant entre deux timepoints notée t k et t l (t k l); calculer chaque zone rectangulaire à l' aide x * y avec x = tl - t k étant la distance entre deux points dans le temps et y étant la moyenne de l'activité des deux points dans le temps (y = (les tk NIC (i) + NCI tl (i)) / 2).
Remarque: L'ASC à 24 h après l'administration de la position i est notée par l'ASC (i). Que toutes les conditions sont étalées dans des puits en triple à la médiane des trois valeurs est utilisée.
- Obtenir l'AUC à la position i est obtenue en additionnant les zones de chaque rectangle, chaque rectangle étant entre deux timepoints notée t k et t l (t k l); calculer chaque zone rectangulaire à l' aide x * y avec x = tl - t k étant la distance entre deux points dans le temps et y étant la moyenne de l'activité des deux points dans le temps (y = (les tk NIC (i) + NCI tl (i)) / 2).
- Normaliser les valeurs en utilisant l'équation suivante:
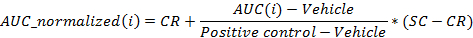
où i est la position de la plaque de 96 puits pour lesquels l' ASC a été calculée à 24 h après l'administration,
Le véhicule est la médiane des valeurs d' AUC pour les puits de véhicules sur une plaque à 24 heures après l'administration,
Le contrôle positif est la médiane des valeurs de l' ASC pour les puits de contrôle positif sur une plaque à 24 heures après l'administration,
CR est la valeur normalisée moyenne souhaitée pour le véhicule (0%), et
SC est la valeur normalisée moyenne souhaitée pour les témoins positifs (100%)
REMARQUE: A la fin de cette étape, une série de données est obtenue qui contient, pour chaque position i dans la plaque à 96 puits, un CI de concentration (en unités logarithmiques) qui est appliquée à l'échantillon contenu dans la position / puits i et son correspondant AUC normalisée à 24 h après l'administration AUC_normalized (i). - Terrain et monter le (c i, AUC_normalized (i)) -values en utilisant un 4-paramètres équation de Hill. Lorsque cela est possible, calculer également LD 50.
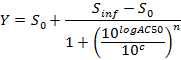
où Y = AUC_normalized,
Niveau 0 = Activité Activité Zéro à la concentration zéro du composé d'essai,
Niveau inf = Activité Infini Activité de S à une concentration infinie,
AC50 = Concentration à laquelle l' activité atteint 50% du niveau maximum,
Coefficient de Hill n = Mesure de la pente à AC50, et
c = concentration en unités logarithmiques correspondant aux valeurs sur l'axe des x du tracé de la courbe dose-réponse.
NOTE: AC50 correspond à LD 50 (tests de cytotoxicité). Il est une mesure de puissance où les valeurs faibles indiquent une puissance élevée.
- Contrôle positif Dilution
3. Mesurer les effets toxicologiques par HCS
NOTE: Un total de neuf marqueurs multi-paramétriques de toxicité, regroupées en six dosages différents, sont mesurés en utilisant la plate - forme de HCS (tableau 1). Basé sur le RTCA analyse de la viabilité des cellules (Section 2), la gamme de dose de chaque constituant est définie et une dose de référence 3R4F est également inclus. La dose de référence est équivalente à la quantité de HPHC présent dans la fumée d'un bâton de la 3R4F de cigarettes de référence.
- Cellules NHBE Seeding
- Préparer une suspension cellulaire à 120.000 cellules / ml (± 5%) et ajouter 100 ul de suspension cellulaire à chaque puits d'une plaque de HCS 96 puits (12.000 cellules / puits). Préparer assez d'assiettes pour l'évaluation de tous les essais (cytotoxicité, lésions de l'ADN, Stress kinase, ROS, contenu GSH et Apoptose) et timepoints (4 et 24 h).
- Laissez les plaques HCS à la température ambiante pendant 30 min pour permettre aux cellules de se fixer aux puits puis incuber à 37 ° C et 5% de CO 2 pendant 24 ± 2 heures avant le dosage.
- Dilution de HCHPs et contrôles positifs
NOTE: Les cellules NHBE dans les plaques HCS sera dosée en ajoutant 25 pi de solutions d'échantillon de test à 100 pi de milieu déjà présent dans chaque puits. Par conséquent, toutes les doses sont préparés à 5 fois la concentration finale souhaitée.- Contrôle positif Dilution (Positive Control Plate)
- Distribuer 40 pl de solution mère de chaque contrôle positif (voir le tableau 3) dans la colonne n ° 2 (figure 4a, puits ombragés en rouge). Distribuer 20 pi de véhicule dans les colonnes n ° 3 et n ° 5 (figure 4a, puits ombragés en bleu clair) et 40 pi de véhicule dans la colonne n ° 4 (figure 4a, puits ombragés en bleu clair).
- Retirer 12 ul des puits dans la colonne n ° 2, le distribuer aux puits dans la colonne n ° 3 et mélanger (figure 4b), Continuer jusqu'à une dilution en série finale avec 3 doses (d1, d2 et d3) et le véhicule (V) pour chaque composé témoin positif est obtenu (Figure 4c). Pour générer la plaque de contrôle positif, préparer une dilution 1:40 de composés dans les médias (Figure 4d).
- HPHC Dilution (composé de plaques de Master)
NOTE: Les gammes de doses choisies de HPHCs pour HCS sont énumérés dans le tableau 2.- Diluer chaque solution stock HPHC (1 M) 1:10 dans un milieu pour une concentration de 100 mM. Effectuer des dilutions en utilisant du milieu avec 10% de véhicule pour obtenir les doses 5x sélectionnées pour chaque HPHC.
- Contrôle positif Dilution (Positive Control Plate)
- dosage
- Ajouter 25 pi de solutions 5x de la plaque de maître composé aux cellules en triple exemplaire en conservant le même ordre de dosage dans la plaque de maître composé (dose la plus élevée dans la rangée et de véhicules haut contrôle dans le numéro de la ligne 7) (figure 5). Ne pas retirer le eEXISTANTS (100 ul) du milieu de culture cellulaire.
- Ajouter 25 pi de 5x solution de la plaque de contrôle positif pour les cellules dans la rangée du bas en maintenant le même ordre de dosage dans la plaque de contrôle positif (Figure 5). Ne pas retirer le (100 pi) milieu de culture cellulaire existant. Remarque: Chaque essai a un contrôle positif spécifique; voir le tableau 3. Incuber la plaque à 37 ° C et 5% de CO2 pendant la durée d'exposition désirée (4 ou 24 heures).
- tachant
- Préparation pour tous les dosages
- Préchauffer le tampon de lavage (PBS) solutions à 37 ° C.
- Préparer la solution de fixation (solution de formaldéhyde 4%) ajouter 10,81 ml de formaldehyde à 37% à 89,19 ml de tampon de lavage et préchauffer à 37 ° C.
- Préparer le tampon de perméabilisation en ajoutant 10 ml de 10x tampon de perméabilisation à 90 ml de tampon de lavage et préchauffer à 37 ° C.
- Préparer le Blotampon cking en ajoutant 10 ml de 10x tampon de blocage à 90 ml de tampon de lavage et préchauffer à 37 ° C.
- Préchauffer le milieu de culture cellulaire à 37 ° C.
- Retirez les plaques HCS de l'incubateur, une fois les temps 4 et 24 exposition h sont atteints et exécuter les protocoles spécifiques suivants pour chaque essai.
- Essai de cytotoxicité
- Préparer un volume suffisant (V) de la solution de cellules vivantes de coloration selon la formule suivante: Volume de moyenne (pi) V = 50 x W x 1.2 (W Nombre de puits)
- Diluer le colorant mitochondries dans la Solution Cell Coloration en direct selon les instructions du fournisseur. Diluer le colorant Membrane Perméabilité dans la Solution Cell Coloration en direct selon les instructions du fournisseur.
- Ajouter une solution de coloration de cellules vivantes de 50 pi à chaque puits de la plaque (s) désignée "cytotoxicité test". NE PAS éliminer le milieu de culture cellulaire et incuber pendant 30 min à 37 ° C, 5% CO 2.
- Aspirer doucement la solution à moyen et coloration et ajouter 100 pl / puits de solution de fixation à chaque puits, puis incuber plaque (s) pendant 20 min à température ambiante dans l'obscurité.
- Aspirer doucement la solution de fixation et laver une fois avec 100 pl / puits de tampon de lavage.
- Retirer le tampon de lavage et ajouter / tampon de perméabilisation et 1x 100 pi à chaque puits et incuber pendant 10 min à température ambiante dans l'obscurité.
- Aspirer tampon de perméabilisation et de la plaque de lavage deux fois avec 100 pl / puits de tampon de lavage.
- Aspirer le tampon de lavage et ajouter 100 pi de tampon de blocage 1x à chaque puits et incuber pendant 15 min à température ambiante dans l'obscurité.
- Préparer un volume suffisant (V) de la solution d'anticorps primaire selon la formule suivante: Volume de tampon de blocage (ul) 50 V = 1,2 x L x (W Nombre de puits). Diluer l'anticorps C anti-cytochrome (souris) 1: 250 dans la solution d'anticorps primaire.
- Aspirer un tampon de blocageD ajouter 50 pl / puits de solution d'anticorps primaire à chaque puits et incuber pendant 60 min à température ambiante dans l'obscurité.
- Préparer un volume suffisant (V) de l'anticorps secondaire et de la solution nucléaire selon la formule suivante: Volume de tampon de blocage (ul) 50 V = 1,2 x L x (W Nombre de puits). Diluer l'anticorps anti-souris 1: 500 dans un anticorps secondaire et de la solution nucléaire. Diluer le colorant nucléaire 1: 1000 en anticorps secondaire et la solution nucléaire.
- Aspirer Solution d'anticorps primaire et de la plaque de lavage à trois reprises avec 100 pl / puits de tampon de lavage en utilisant la rondelle de la plaque.
- Aspirer le tampon de lavage et ajouter 50 pl / puits d'anticorps secondaire et de la solution nucléaire à chaque puits de la plaque (s) et incuber pendant 60 min à température ambiante dans l'obscurité.
- Aspirer secondaire anticorps et Solution nucléaire et de la plaque de lavage à trois reprises avec 100 pl / puits de tampon de lavage en utilisant la rondelle de la plaque. Ajouter 100 pl / puits de tampon de lavage. Plate (s) est (sont) maintenantprêt à être évalué sur le lecteur HCS.
- DNA Damage Assay
- Aspirer doucement le milieu des plaques désignées «dommages à l'ADN".
- Effectuez les mêmes étapes que dans l'ordre: 3.4.2.4 - 3.4.2.8. Notez que dans ce cas, seul milieu est éliminé lors de l'étape 3.4.2.4.
- Préparer un volume suffisant (V) de la solution d'anticorps primaire selon la formule suivante: Volume du tampon de blocage (ul) 50 V = 1,2 x L x (W Nombre de puits)
- Diluer l'anticorps anti-phospho H2AX (souris) 1: 2000 dans la solution d'anticorps primaire.
- Effectuez la même étape que décrit dans 3.4.2.10.
- Préparer un volume suffisant (V) de l'anticorps secondaire et nucléaire Solution selon la formule suivante: Volume du tampon de blocage (ul) 50 V = 1,2 x L x (W Nombre de puits)
- Diluer l'anticorps anti-souris 1: 500 dans un anticorps secondaire et de la solution nucléaire.
- Diluer le Nuclear colorant 1: 1000 en anticorps secondaire et la solution nucléaire.
- Effectuez les mêmes étapes que celles décrites dans l'ordre: 3.4.2.12-3.4.2.14.
- Essai de stress Kinase
- Aspirer doucement le moyen de chacune des plaques désignées "Stress Kinase".
- Effectuez les mêmes étapes que dans l'ordre: 3.4.2.4 - 3.4.2.8. Notez que dans ce cas, seul milieu est éliminé lors de l'étape 3.4.2.4.
- Préparer un volume suffisant (V) de la solution d'anticorps primaire selon la formule suivante: Volume du tampon de blocage (ul) 50 V = 1,2 x L x (W Nombre de puits)
- Diluer l'anticorps anti-phospho cJun (lapin) 1: 200 dans la solution d'anticorps primaire.
- Effectuez la même étape que décrit dans 3.4.2.10.
- Préparer un volume suffisant (V) de l'anticorps secondaire et nucléaire Solution selon la formule suivante: Volume du tampon de blocage (ul) 50 V = 1,2 x L x (W Nombre de puits)
- Diluer l'anticorps anti-lapin 1: 500 dans un anticorps secondaire et de la solution nucléaire.
- Diluer le colorant nucléaire 1: 1000 en anticorps secondaire et la solution nucléaire.
- Effectuez les mêmes étapes que celles décrites dans l'ordre: 3.4.2.12-3.4.2.14.
- ROS Assay
- Préparer un volume suffisant (V) de Live Solution Cell Coloration selon la formule suivante: Volume de moyenne (pi) V = 50 x W x 1.2 (W Nombre de puits).
- Diluer le colorant ROS dans Live Cell Coloration Solution selon les instructions du fournisseur
- Diluer le colorant nucléaire 1: 1000 en Live Cell Coloration Solution.3.4.5.4) Ajouter 50 ul Live Cell Coloration Solution à chaque plaque de puits désignés "ROS"; NE PAS retirer les milieux de culture de cellules et incuber pendant 30 min à température ambiante dans l'obscurité.
- Aspirer doucement la solution à moyen et coloration et laver la plaque trois fois avec 100 pl / puits moyen.
- Aspirer le milieu, ajouter 100 _6; l / puits solution de fixation dans chaque puits et incuber la plaque pendant 20 min à température ambiante dans l'obscurité.
- Aspirer doucement la solution de fixation et laver la plaque trois fois avec 100 pl / puits de tampon de lavage.
- Ajouter 100 pl / puits de tampon de lavage. Plate (s) est (sont) maintenant prêt.
- Évaluer la plaque sur le lecteur HCS à 1 h.
- GSH Assay Content
- Préparer un volume suffisant (V) de cellules vivantes Coloration Solution nucléaire selon la formule suivante: Volume de moyenne (pi) V = 50 x W x 1.2 (W Nombre de puits).
- Diluer le colorant nucléaire (Extrême-Rouge) 1: 1000 en Live Cell Nuclear Coloration Solution.3.4.6.3). Ajouter 50 pi de cellules vivantes Coloration Solution nucléaire à chaque puits des plaques désignées "contenu GSH". NE PAS retirer les milieux de culture de cellules et incuber pendant 30 min à 37 ° C, 5% de CO 2.
- Préparer un volume suffisant (V) de cellules vivantes GSH Solution de coloration selon l'formule suivante: Volume de HBSS (pl) V = 50 x W x 1.2 (W Nombre de puits)
- Diluer le colorant GSH dans Live Cell GSH Coloration Solution selon les instructions du fournisseur.
- Aspirer doucement le milieu et la solution de coloration nucléaire et laver la plaque trois fois avec 100 pl / puits moyen.
- Aspirer le milieu et ajouter 100 pl / puits de cellules vivantes GSH Coloration Solution à chaque puits de la plaque (s).
- Incuber pendant 10 min à température ambiante dans l'obscurité. Plate (s) est (sont) maintenant prêt.
- Évaluer plaque (s) sur le Reader HCS à moins de 1 h.
- apoptose Assay
- Préparer un volume suffisant (V) de Live Solution Cell Coloration selon la formule suivante: Volume de moyenne (pi) V = 50 x W x 1.2 (W Nombre de puits).
- Diluer le colorant Caspase 1: 300 dans Live Cell Coloration Solution.
- Retirer milieux de culture cellulaire, ajouter 50 ul de cellules vivantes Coloration Solution à chaque puits de til plaque (s) désignée "Apoptose" et incuber pendant 30 min à 37 ° C, 5% de CO 2.
- Préparer un volume suffisant (V) de cellules vivantes Coloration Solution nucléaire selon la formule suivante: Volume de la solution Fix (pl) V = 50 x W x 1.2 (W Nombre de puits).
- Diluer le colorant nucléaire 1: 1000 en Live Cell Coloration Solution nucléaire.
- Retirer la solution en direct de coloration des cellules, ajouter 100 pl / puits de cellules vivantes Coloration Solution nucléaire à chaque puits de la plaque (s) et incuber pendant 30 min à température ambiante dans l'obscurité.
- Aspirer la solution de colorant fixateur / nucléaire et laver la plaque (s) trois fois avec 100 pl / puits de tampon de lavage.
- Ajouter 100 pl / puits de tampon de lavage. Plate (s) est (sont) maintenant prêt.
- Évaluer plaque (s) sur le lecteur HCS.
- Préparation pour tous les dosages
- Analyse des données HCS
- données brutes à l'exportation comme Excel (.xls). Remarque: Les valeurs de l'indice cellulaire Raw sont organisés sous une forme 96 puitsà (la distribution de puits de la plaque de mise en miroir) et sont prévus pour tous les points d'extrémité à un post-dosage de point de temps donné.
- Normaliser les valeurs en utilisant l'équation suivante:
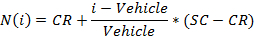
où i est la valeur de signal brut mesuré d'un puits,
Le véhicule est la médiane des valeurs de signal mesurées pour les puits de véhicule sur une plaque,
CR est la valeur normalisée moyenne souhaitée pour le véhicule (0%), et
SC est la valeur normalisée moyenne souhaitée pour les témoins positifs (100),
REMARQUE: A la fin de cette étape, une série de données est obtenue qui contient, pour chaque position i dans la plaque à 96 puits, une concentration C i (en unités logarithmiques) qui a été appliquée à l'échantillon contenu dans la position / puits i et son correspondant normalisé de signal N (i). - Terrain et monter le (c i, N (i)) - valeurs à l' aide d' un 4-paramètres équation de Hill.
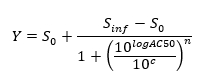
où le niveau 0 = Activité Activité Zéro à la concentration zéro du composé d'essai,
Niveau inf = Activité Infini Activité de S à une concentration infinie,
AC50 = Concentration à laquelle l' activité atteint 50% du niveau maximum,
Coefficient de Hill n = Mesure de la pente à AC50, et
c = concentration en unités logarithmiques correspondant aux valeurs sur l'axe des x du tracé de la courbe dose-réponse.
NOTE: AC50 est une mesure de puissance où les valeurs faibles indiquent une puissance élevée.
Résultats
RTCA
Du fait que les points d'extrémité HCS ne seront pas informatifs lorsque aucun effet toxique est détectée, ces composés ne présentant pas de diminution de la viabilité des cellules jusqu'à la concentration la plus élevée dans la RCTA ne sont pas testés par HCS (figure 3b, c, d, g, k, l, m , p). Les composés présentant une diminution de la viabilité cellulaire à la seule concentration la plus élevée (figure 3e, o) sont également désélectionné HCS. Enfin, seuls les constituants avec un LD calculable 50 (<20 mM) sont sélectionnés pour une analyse plus approfondie de HCS (Figure 3a, f, h, j, n). HPHCs répondant aux critères ci-dessus sont: 1-aminonaphtalène, Arsenic (V), le chrome (VI), crotonaldéhyde et Phénol.
HCS
Comme un contrôle de qualité (QC), les contrôles positifs sont fipremière analyse pour assurer que la procédure de coloration est correctement effectuée. Des images représentatives des cellules témoins positives traitées sont montrées sur la figure 6. Les valeurs données sont normalisées par rapport au véhicule tel que décrit précédemment. Aucune courbes dose-réponse sont tracées en seulement trois doses sont testées et ne sont pas tous les trois doses sont considérés comme à chaque point de temps. Les doses de témoin positives sont sélectionnées (sur la base des expériences antérieures, les données non présentées) de telle sorte que des réponses appropriées soient respectées pour chaque critère d'évaluation à la fois 4 h et 24 h. En doses particulières 1 et 2 sont utilisés pour évaluer l'effet à 4 h alors que des doses 2 et 3 sont utilisées pour évaluer l'effet à 24 h. Les plaques sont rejetées si aucune réponse est observée pour les doses de contrôle positif. A noter que pour tous les points d'extrémité, à l'exception du potentiel de membrane mitochondriale et la teneur en GSH, il est prévu une augmentation de l'intensité du signal.
Tous les composés, à l'exception de Phénol, induit une phéno nécrotique le type, basé sur l' augmentation de la perméabilité de la membrane cellulaire (figure 7a, f, h, i). 1-aminonaphtalène, chrome (VI), crotonaldéhyde et Phénol ont été identifiés comme étant génotoxiques basée sur l' augmentation de la phosphorylation de l'histone H2AX de (figure 7e, j, n, p). Phénol et 1-aminonaphtalène ont été trouvés pour induire une dysfonction mitochondriale sévère (figure 7b, o) qui, avec 1-aminonaphtalène, a conduit à une libération du cytochrome C a augmenté (Figure 7c). La détection d'une activité accrue de la caspase 3/7 a fourni des preuves de l'événement apoptotique lors de l'exposition au chrome. Le stress oxydatif induction (ROS ou GSH) a également été détecté lors d'un traitement avec le 1-aminonaphtalène, crotonaldéhyde et Phénol (Figure 7d, m, q). Enfin, l' arsenic induit un stress cellulaire tel que démontré par une augmentation de la phosphorylation du facteur de transcription cJun (figure 7g).
charge / 53987 / 53987fig1.jpg "/>
Figure 1. Composé Tox-Profiler Workflow. A) Schéma du flux de travail suivi dans cette étude. Tout d' abord, une constatation dose-gamme a été réalisée en utilisant la plate - forme RTCA pour sélectionner des doses appropriées pour HCS ultérieure pour caractériser les profils de toxicité spécifiques des composés. B) la conception expérimentale de l'étude. 24 heures après l' ensemencement, les cellules ont été dosés et les valeurs d'impédance surveillés en continu pendant 24 heures suivantes, alors que HCS paramètres ont été étudiés 4 et 24 heures après l' administration. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
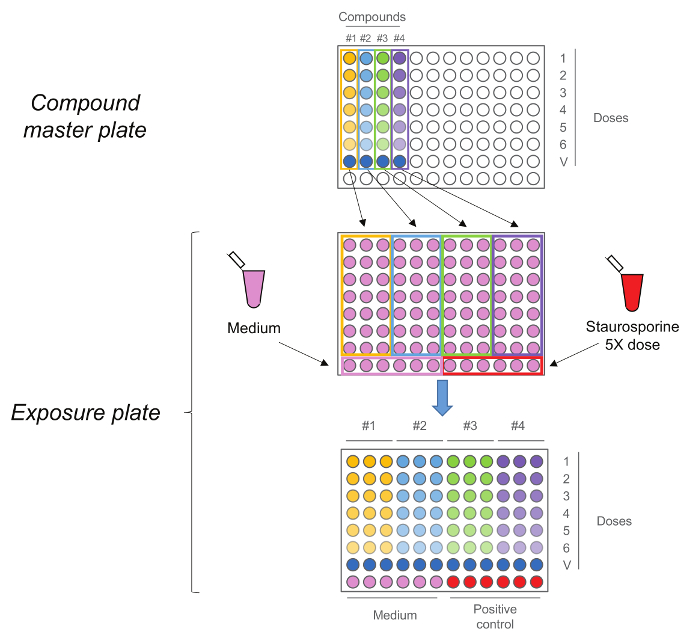
Figure 2. RTCA Exposition Plate. Plaque maîtresse composé est d' abord générée en effectuant une cinq étapes dilution 1:10 série. Chaque composé,y compris le contrôle du véhicule (dose 0) est ensuite ajouté en triple à la plaque d'exposition et en même temps avec un milieu staurosporine comme témoins. Notez que les doses séquence est maintenue au moment du transfert, doses les plus élevées sont dans la ligne numéro 1 tandis que les contrôles de véhicules sont en numéro de ligne 7. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
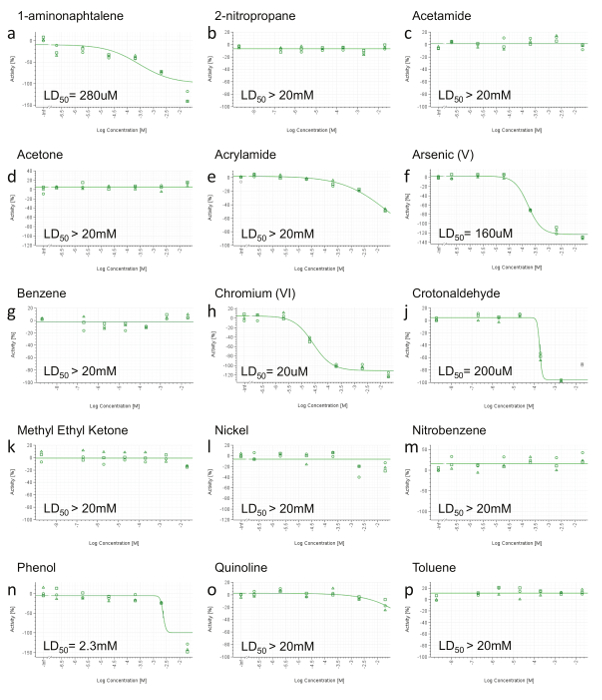
Figure 3 représentant RTCA Résultats Viabilité cellulaire. A) 1-aminonaphtalène, b) le 2-nitropropane, c) -acétamide, d) Acétone, e) acrylamide, f) , l' arsenic (V), g) benzène, h) et le chrome (VI) , j) crotonaldéhyde, k) méthyléthylcétone, l) Nickel (II), m) nitrobenzène, n) phénol, le o) -quinoléine, p) Toluène. À 24 h après l'administration, l'aire sous la courbe (AUC) a été calculée pour chaque dose (y compris le contrôle positif et le véhicule) et normalisé dans une plage de 0 à -100% d'activité (axe y), où 0 reflète l'activité de le véhicule et -100 du contrôle positif. Les valeurs ont ensuite été tracées et ajustés à l' aide d' un à quatre paramètres colline équation et, lorsque cela est possible, DL 50 a été calculé. Les concentrations sont exprimées sur une échelle logarithmique (axe x). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
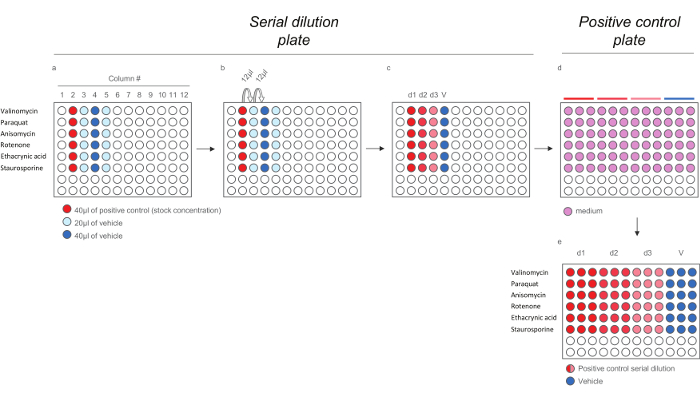
Figure 4. Schéma Dilution pour les composés contrôle positif pour HCS Assays. A) Ajout de contrôles positifs et cinqcule à la dilution de série plaque. b) de dilution en série des contrôles positifs. c) 200X contrôles positifs doses. de) Dilution des 200x positifs doses de contrôle dans le milieu (1:40) pour générer la plaque de contrôle positif contenant les doses 5x. Notez que chaque dose est diluée en triple afin de refléter la mise en page finale de la plaque d'exposition). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
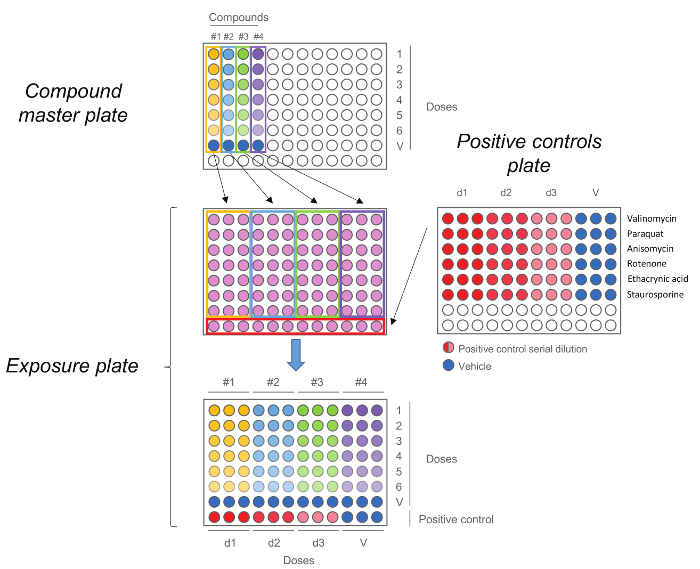
Figure 5. HCS Exposition Plate. Plaque maîtresse composé est d' abord générée en effectuant une dilution en cinq étapes. Chaque composé, y compris le contrôle du véhicule (dose 0) est ensuite ajouté en triple à la plaque d'exposition en même temps que les témoins positifs. Notez que l'ordre des doses est maintenue au moment du transfert,doses les plus élevées sont en ligne numéro 1 tandis que les contrôles de véhicules sont en numéro de ligne 7. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
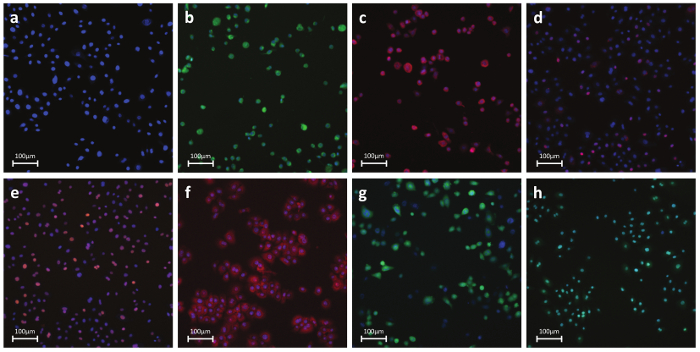
Figure 6. Représentant fluorescents Photos de anticorps- ou Dye-cellules colorées a) Paramètres nucléaires - tinctoriales nucléaire:. Un colorant perméable qui se lie à l' ADN dans les cellules vivantes ou fixes. Cette tache est utilisée pour identifier des cellules individuelles en matière d' étiquetage de la région nucléaire b) Nécrose - perméabilité de la membrane cellulaire colorant:. La détection de l' intégrité de la membrane cellulaire à base de colorant. Le réactif est intrinsèquement imperméable à la membrane cellulaire. Au cours de la nécrose, la membrane devient perméable et le colorant pénètre dans la cellule et se lie à l'ADN produisant une forte fluorescence de. ignal c) Apoptose - Cytochrome C: détection du cytochrome C libération, une caractéristique bien connue de l' apoptose précoce à base d'anticorps. Lors de l' induction de l' apoptose, le cytochrome c est libéré de la mitochondrie et diffuse dans le noyau d) l' ADN de dommages - de pH2AX:.. La détection de la phosphorylation de l' histone H2AX à base d'anticorps, une caractéristique bien connue des cassures double brin de l' ADN e) Stress Kinase - cJun:. la détection à base d'anticorps de la phosphorylation à Ser-73 de cJun, une caractéristique bien connue du stress cellulaire f) du stress oxydatif - DHE: détection de radicaux superoxydes Dye-based. Dihydroethidium se fluoresces bleu dans le cytoplasme tandis que la forme éthidium oxydée réagit en rouge sur l' ADN intercalation g) GSH - mBcl:. Détection de molécules libres GSH Dye-based. mBcl réagit avec GSH àgénérer un produit hautement fluorescent h) Apoptose - Caspase 3/7 activation:. détection de caspase 3/7 activité Dye-based. Le réactif est non fluorescent avec un peptide d'acides aminés quatre qui inhibe la liaison à l'ADN. Lors de l'activation de la caspase-3/7, le peptide est clivé permettre au colorant de se lier à l'ADN et de produire une réponse fluorogène lumineuse. Panneaux Bh montrent des cellules témoins traités positifs. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
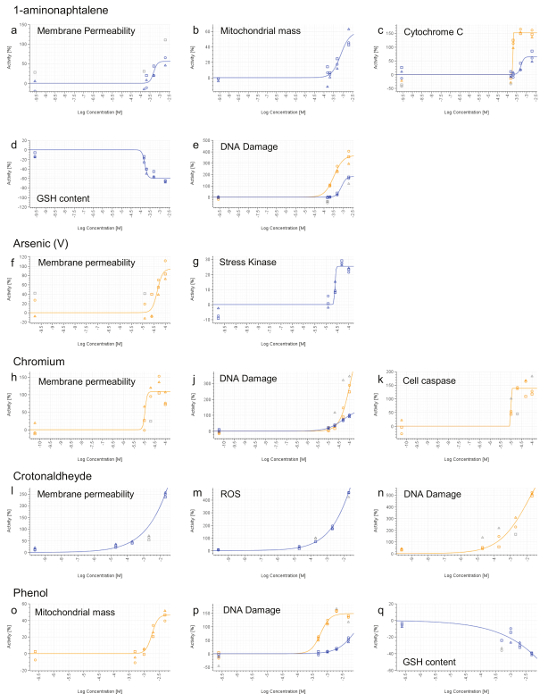
Figure 7. Résultats représentant HCS. 1-aminonaphtalène (ae), l' arsenic (V) (f et g), de chrome (VI) (hk), crotonaldéhyde (ln) et Phénol (OQ). 4 h (ligne bleue) etsignaux 24 h (ligne orange) ont été calculées pour chaque dose et normalisée à l'activité du véhicule (0%). Les valeurs qui ne sont pas inclus dans la courbe des calculs d'ajustement sont affichées en gris. Les concentrations sont exprimées sur une échelle logarithmique (axe x). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Essai | Endpoint # | critère biologique | compartiment cellulaire | fonction de sortie |
| cytotoxicité | 1 | Masse mitochondriale 6 | Cytoplasme | surface moyenne spot |
| 2 | Le potentiel de la membrane mitochondriale 6 | Cytoplasme | intensité moyenne spot | |
| 3 | Cytochrome C libération 7 | Noyau | intensité moyenne | |
| 4 | Membrane cellulaire perméabilité 8 | Noyau | intensité moyenne | |
| DNA Damage | 5 | phospho-H2AX 9 | Noyau | intensité moyenne |
| stress Kinase | 6 | 10 phospho-cJun | Noyau | intensité moyenne |
| ROS | 7 | ROS 11 | Noyau | intensité moyenne |
| GSH contenu | 8 | GSH 12 | Cytoplasme | intensité moyenne spot |
| apoptose | 9 | 13 caspase 3 | Cytoplasme | intensité moyenne spot |
Tableau 1. Liste des HCS assays et les terminaux.
| Véhicule | doses RTCA (uM) | LD 50 | doses HCS | |||||||||||
| La viabilité des cellules sélectionnées (uM) | 3R4F (nM) | |||||||||||||
| 1-aminonaphtalène | EtOH | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | 280 uM | 2000 | 500 | 200 | 150 | 0,27 | |
| 2-nitropropane | EtOH | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| acétamide | EtOH | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Acétone | Eau | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| acrylamide | Eau | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Arsenic (V) | Eau | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | 160 uM | 200 | 100 | 50 | 25 | 0,17 | |
| Benzène | EtOH | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Le chrome (VI) | Eau | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | 20 pm | 100 | 50 | 20 | dix | 0,06 | |
| crotonaldéhyde | Eau | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | 200 um | 20,000 | 2000 | 200 | 20 | 2000 | |
| Méthyle éthyle cétone | Eau | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | >20 mM, | ||||||
| Nickel | Eau | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| nitrobenzène | EtOH | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Phénol | EtOH | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | 2.300 uM | 5000 | 2000 | 1000 | 500 | 240 | |
| quinoléine | EtOH | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Toluène | Eau | 20,000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
Tableau 2. Liste des composés HPHC Testé avec LD Relative 50 à 24 h de traitement. Les composés sélectionnés pour l' analyse HCS sont surlignés en orange et les doses testées sont également donnés. La dose 3R4F est équivalente à la quantité de constituant présent dans la fumée d'un bâton de la 3R4F de cigarettes de référence.
| Essai | Composé | Stock Solution | Solvant | Dose (s) (M) | ||
| Viabilité cellulaire | staurosporine | 10 mM, | DMSO | 50 | ||
| cytotoxicité | valinomycine | 10 mM, | DMSO | 50 | 20 | 5 |
| DNA Damage | paraquat | 100 mM | DMSO | 500 | 200 | 50 |
| stress Kinase | anisomycine | 2 mM | DMSO | dix | 4 | 1 |
| ROS | roténone | 200 mM | DMSO | 1000 | 400 | 100 |
| GSH contenu | l'acide éthacrynique | 200 mM | DMSO | 1000 | 400 | 100 |
| apoptose | staurosporine | 40 mM, | DMSO | 200 | 50 | 20 |
Tableau 3. Liste des contrôles positifs et concentrations utilisées pour chaque essai.
Discussion
Les besoins des alternatives à l'expérimentation animale et de nouvelles approches de test à haut débit ont été largement discutés au cours des dernières années. Cela a conduit les scientifiques et les autorités réglementaires pour étudier des méthodes alternatives pour les tests de toxicité standard, en utilisant des dosages cellulaires qui imitent étroitement la physiologie des tissus cibles. Dans cette étude, nous avons démontré l'applicabilité de la combinaison d'un analyseur de cellules en temps réel (RTCA) avec une projection haute teneur (HCS) plate-forme pour évaluer l'impact de l'exposition aux constituants CS simples sur les cellules épithéliales pulmonaires humaines. Cette configuration pourrait être appliquée de façon analogue pour évaluer la cytotoxicité induite par divers autres polluants atmosphériques, les particules en suspension, et des nanoparticules. En outre, les résultats obtenus peuvent être jumelés à ceux de transcriptomique du génome entier et les méthodes de calcul basé sur les réseaux biologiques causales. Comme indiqué précédemment, cette approche nous a permis de corroborer les données sur voie moléculaireperturbation sur CS exposition 5 avec les terminaux HCS, face à ces perturbations de la voie aussi phénotypique.
Comme un essai d'organigramme, l' analyse des cellules en temps réel fournit des informations sur la viabilité des cellules dans une résolution de la dose et dépendante du temps, ce qui permet une meilleure prise de décision qui dose et l' exposition point de temps peuvent être favorables pour l' analyse en aval 14. Le principe de l'analyseur de repose sur des variations de l'impédance électrique produite par les cellules où ils se fixent et se propager sur une surface de culture de puits recouvert d'un micro-électrodes en or. L'impédance est convertie en un paramètre sans dimension appelé cellule d'indice, qui peut être utilisé pour contrôler l'adhérence cellulaire, la propagation, la morphologie et la viabilité des cellules en fin de compte. Bien que cette technique ne fournit pas d'informations sur les mécanismes cytotoxiques, sa sensibilité permet de détecter des changements cellulaires morphologiques, même à des doses très faibles au cours de laquelle le HCS est pas informative (données non présentées). Sur la base de précéexpériences UO, nous avons constaté que la méthodologie RTCA est capable de détecter les changements morphologiques à des doses plus faibles par rapport aux points de terminaison HCS.
Après la sélection initiale avec la cellule d'analyse en temps réel, une plate-forme de HCS a été utilisé pour gagner plus en profondeur des informations sur le type de cytotoxicité induite par chaque HPHC. Le panneau d'essai HCS permis au profil HPHCs vers leur impact potentiel sur les compartiments cellulaires / organelles, ainsi que pour identifier les personnes suscitant génotoxicité ou stress oxydatif. L'analyse a révélé des profils distincts de sorte que les HPHCs sélectionnés induisent une cytotoxicité dans les cellules NHBE. D'une manière générale, tous les composés, à l'exception Phénol, se sont avérés induire une nécrose aux doses maximales testées. Conformément à un rôle potentiel dans le développement du cancer 1-aminonaphtalène phosphorylation induite de H2AX comme marqueur pour la génotoxicité, mais le panneau de HCS également de l'activité découverte de cette HPHC dans la toxicité mitochondriale lecture (masse accrue et cytochrome C releasoi) et le stress oxydatif (GSH d'épuisement). De même, comme décrit précédemment, le phénol a été identifié pour provoquer un dysfonctionnement mitochondrial, et causer des dommages de l'ADN, ainsi que l'épuisement en GSH. Le chrome (VI), l'un des composés classés comme cancérogènes de groupe I, et crotonaldéhyde ont également été identifiés comme étant à la fois génotoxique, en particulier, le chrome (VI) l'apoptose induite également (activation en cascade de caspase) et crotonaldéhyde provoqué une augmentation de la génération de ROS. Enfin, l'arsenic (V) a été trouvée pour induire la phosphorylation cJun qui est un marqueur d'activation de la voie de la kinase de stress.
Dans cette étude, nous avons utilisé des cellules NHBE comme un modèle pour les cellules épithéliales pulmonaires in vitro. L'utilisation de ces cellules dans un cadre de HCS est sans précédent et a permis à l'enquête sur une plus large gamme de terminaux, y compris les marqueurs de génotoxicité et le stress oxydatif. Les deux cellules vivantes et des approches fixes de coloration des cellules ont été décrits au sein de nos protocoles, ce qui démontre la flexibilité de la technique dans son ensemble. En floi, les mêmes protocoles peut être appliquée à un plus large éventail de cibles, qui peut être traitée par l'utilisation d'un colorant ou d'un anticorps fluorescent. Pour la bonne exécution des protocoles de coloration en direct, il est important de respecter le temps d'incubation, comme certains des colorants ont une demi-vie limitée et le signal de fluorescence peut diminuer avant l'acquisition d'image est terminée. Il est également important de considérer que, si un type de cellule différent est utilisé, toutes les conditions de coloration doivent être réévalués, comme la concentration optimale de colorant et le temps d'incubation peuvent être différentes.
Dans le présent document, nous avons décrit un scénario où seulement cinq composés où criblées avec la méthodologie de HCS. Compte tenu de la disposition de la plaque décrite précédemment, ils ont reçu une dose de plus de deux différents ensembles de plaques pour un total de 24 plaques (6 essais et 2 points temporels) .Le nombre de plaques pourrait également être augmentée, permettant ainsi la projection simultanée de plusieurs composés ou les investigation de plusieurs noeuds finaux. Avant de le faire, cependant, il faut prendre en considération que certains effets (GSH et ROS) nécessitent l'acquisition immédiate, et en conséquence, le dosage des plaques doit être réalisée de manière décalée pour permettre l'acquisition de la plaque précédente. D'autre part, en utilisant un protocole de coloration cellulaire fixe représente un avantage car les plaques peuvent être empilées, en interrompant le protocole à une étape quelconque après la fixation, pour l'achèvement de la procédure de coloration à un stade ultérieur. Cette approche, par exemple, permettrait à l'opérateur le temps de remplir toutes les plaques de coloration des cellules vivantes sans compromettre la qualité des données.
Afin d'optimiser davantage le flux de production en réduisant le nombre de plaques, il serait également possible de multiplexer plusieurs noeuds finaux ensemble. Par exemple dans ce dommages de l'ADN de contexte et le stress Kinase pourraient être étudiés ensemble simplement en utilisant deux anticorps secondaire avec des fluorochromes émettant dans différentes channels. Le développement continu de la plate-forme de HCS, y compris l'ensemencement automatisé des cellules, la dilution composé, le dosage et la coloration, ainsi que l'ajout de nouveaux paramètres vont encore étendre la capacité de la plate-forme de HCS comme un outil de profilage puissant pour HPHCs sur épithéliale et d'autres types de cellules .
Déclarations de divulgation
Tous les auteurs sont des employés de Philip Morris International. Philip Morris International est la seule source de financement et parrain de ce projet.
Remerciements
Les auteurs tiennent à remercier Karsta Luettich et Grégory Vuillaume pour leur examen du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Cellomics ArrayScan VTI HCS Reader | Thermo | N01-0002B | |
| xCelligence RTCA MP | ACEA | 05331625001 | |
| Screener (HCS) | Genedata | NA | |
| CASY counter TTC | Roche | 05 651 719 001 | |
| e-Plates VIEW 96 | ACEA | 06 472 451 001 | |
| RTCA Frame 96 | ACEA | 05232392001 | |
| RTCA Cardio Temperature Tool | ACEA | 2801171 | |
| Plate sealer breathseal | Greiner bio-one | 676051 | |
| Normal Human Bronchial Epithelial cells (NHBE) | Lonza | CC-2540 | non-smoking 60-year-old Caucasian male donor |
| BEGM BulletKit | Lonza | CC-3170 | Warm at 37 °C before use |
| ReagentPack Subculture Reagents kit | Lonza | CC-5034 | Warm at 37 °C before use |
| Penicillin/Streptomycin (100x) | Corning | 30-002-CI | |
| Easy Flask filter cap 75 cm2 | Thermo Scientific | 12-565-349 | |
| 96 well assay plate black | Corning | 3603 | |
| Hoechst 33342 | Fisher Scientific | PI-62249 | |
| Draq5 (For Far Red Nuclear Staining) | Biostatus | DR50200 | |
| Mitochondrial Dye: MitoTracker Red CMXRos | Life technologies | M-7512 | |
| Mitochondrial Dye: MitoTracker Red CM-H2XRos | Life technologies | M-7513 | |
| ROS Dye: Dihydroethidium | Sigma | D7008 | |
| ROS Dye: CellROX | Life technologies | C10422 | |
| ROS Dye: MitoSOX | Life technologies | M36008 | |
| GSH Dye: Monochlorobimane | Sigma | 69899 | Toxic |
| GSH Dye: Monobromobimane | Life technologies | M-1378 | Toxic |
| Membrane permeability Dye: YO-PRO-1 | Life technologies | Y3603 | Irritating |
| Membrane permeability Dye: TO-PRO-1 | Life technologies | T3602 | Irritating |
| Membrane permeability Dye: TOTO-1 | Life technologies | T3600 | Irritating |
| Caspase Dye: Cellevent Caspase 3/7 green | Life technologies | C10423 | Irritating |
| Anti-Cytochrome C antibody (Mouse) | Thermo | MA5-11823 | |
| Anti-phospho-c-Jun antibody (Mouse) | Thermo | MA5-15889 | |
| Anti-phospho-H2AX antibody (Mouse) | Thermo | MA1-2022 | |
| Goat anti-Mouse IgG DyLight 650 | Abcam | ab96878 | |
| 10x permeabilization buffer | Fisher | 8408400 | |
| 4% Formaldehyde solution | Sigma | F1635 | Toxic |
| 10x blocking buffer | Fisher | 8408500 | |
| Dulbecco’s Phosphate Buffered Saline | Sigma | D8537 | |
| Hanks' Balanced Salt solution | Sigma | H8264 | |
| Staurosporine | Sigma | S4400 | Toxic |
| Valinomycin | Sigma | V0627 | Toxic |
| Paraquat | Sigma | 36541 | Toxic |
| Anisomycin | Sigma | A9789 | Toxic |
| Ethacrynic acid | Sigma | E4754 | Toxic |
| 1-Aminonaphthalene | Sigma | 34390 | Toxic |
| 2-Nitropropane | Sigma | 130265 | Toxic |
| Acetamide | Sigma | 695122 | Toxic |
| Acetone | Sigma | 650501 | Toxic |
| Acrylamide | Sigma | A9099 | Toxic |
| Arsenic (V) | Sigma | A6756 | Toxic |
| Benzene | Sigma | 12540 | Toxic |
| Chromium (VI) | Sigma | 216623 | Toxic |
| Crotonaldehyde | Sigma | 262668 | Toxic |
| Methyl ethyl ketone | Sigma | 34861 | Toxic |
| Nickel | Sigma | 203866 | Toxic |
| Nitrobenzene | Sigma | 48547 | Toxic |
| Phenol | Sigma | P5566 | Toxic |
| Quinoline | Sigma | 241571 | Toxic |
| Toluene | Sigma | 34866 | Toxic |
Références
- Rodgman, A., Perfetti, T. A. The chemical components of tobacco and tobacco smoke. , CRC Press. Boca Raton, FL. (2013).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. , Methuen, London. (1959).
- Zock, J. M. Applications of high content screening in life science research combinatorial chemistry & high throughput screening. Comb. Chem. High. Throughput. Screen. 132 (9), 870-876 (2009).
- US Food and Drug Administration. Harmful and potentially harmful constituents in tobacco products and tobacco smoke; established list, federal register. , 20034-20037 (2012).
- Gonzalez-Suarez, I. Systems Biology Approach for Evaluating the Biological Impact of Environmental Toxicants in Vitro. Chem. Res. Toxicol. 27 (3), 367-376 (2014).
- Camilleri-Broet, S., Vanderwerff, H., Caldwell, E., Hockenbery, D. Distinct alterations in mitochondrial mass and function characterize different models of apoptosis. Exp. Cell. Res. 239 (2), 277-292 (1998).
- Li, P., et al. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates and apoptotic protease cascade. Cell. 91 (4), 479-489 (1997).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. Double strand breaks induce histone H2AX phosphorylation on serine 139. J. Biol. Chem. 273 (10), 5858-5868 (1998).
- Westwick, J. K., Weitzel, C., Minden, A., Karin, M., Brenner, D. A. Tumor necrosis factor α stimulates AP-1 activity through prolonged activation of the c-jun kinase. J. Biol. Chem. 269 (42), 26396-26401 (1994).
- Bindokas, V. P., Jordán, J., Lee, C. C., Miller, R. J. Superoxide production in rat hippocampal neurons: selective imaging with hydroethidine. J. Neurosci. 16 (4), 1324-1336 (1996).
- Barhoumi, R., Bailey, R. H., Burghardt, R. C. Kinetic analysis of glutathione in anchored cells with monochlorobimane. J. Cytometry. 19 (3), 226-234 (1994).
- Huang, T. C., Lee, J. F., Chen, J. Y. Pardaxin an antimicrobial peptide, triggers caspase-dependent and ROS-mediated apoptosis in HT-1080 Cells. Mar. Drugs. 9 (10), 1995-2009 (2011).
- Bao, S., Knoell, D. L. Zinc modulates cytokine-induced lung epithelial cell barrier permeability. Am. J. Physiol. Lung Cell Mol. Physiol. 291 (6), L1132-L1141 (2006).
- Xia, M., et al. Compound Cytotoxicity Profiling Using Quantitative High-Throughput Screening. Environ Health Perspect. 116 (3), 284-291 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon