Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Three-Dimensional Culture Assay pour explorer des cellules cancéreuses invasives et Tumor Satellite Formation
Dans cet article
Résumé
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Résumé
culture de cellules animales dans des monocouches est largement utilisé pour étudier divers processus physiologiques et moléculaires. Cependant, cette approche pour étudier les cellules en croissance génère souvent des artefacts indésirables. Par conséquent, la culture de cellules dans un (3D) de l' environnement en trois dimensions, souvent en utilisant des composants de la matrice extracellulaire, est apparue comme une alternative intéressante en raison de sa similitude avec le natif dans un tissu ou un organe in vivo. Nous avons développé un système de culture cellulaire 3D à l' aide de deux compartiments, à savoir : (i) un compartiment central contenant des cellules cancéreuses noyées dans une faisant office de gel de collagène comme une tumeur macrospherical pseudo-primaire et (ii) un compartiment acellulaire périphérique constituée d'un gel de fibrine, soit un composant de la matrice extracellulaire différent de celui utilisé dans le centre, dans lequel les cellules cancéreuses peuvent migrer (invasion avant) et / ou de former des tumeurs microsphériques qui représentent les tumeurs secondaires ou satellites. La formation de tumeurs par satellite dans le compartiment périphérique estremarquablement en corrélation avec l'agressivité connue ou d'origine métastatique des cellules tumorales d'origine, ce qui rend ce système de culture 3D unique. Cette méthode de culture des cellules peut être considérée pour évaluer le cancer invasif et de la motilité des cellules, les interactions cellule-matrice extracellulaire et une méthode pour évaluer les propriétés des médicaments anti-cancéreux.
Introduction
L' étude des caractéristiques fondamentales et biomédicales de l' invasion des cellules cancéreuses / migration et l' établissement de métastases ultérieures est l'objet d'un 1,2 de recherche intense. Métastase est le stade ultime du cancer et de sa prise en charge clinique reste insaisissable. Une meilleure compréhension des métastases aux niveaux cellulaires et moléculaires permettra le développement de thérapies plus efficaces 3.
Plusieurs propriétés des cellules métastatiques peuvent être explorées 4 in vitro , y compris leur stemness et le potentiel d'acquérir un état de transition (par exemple, la transition épithélio-mésenchymateuse) à migrer et à envahir et à l'intérieur de la tumeur primaire 5. Toutefois, l'évaluation in vitro de processus / de métastases d'invasion a été un défi , car il exclut pratiquement la contribution du sang / circulation lymphatique. cultures organotypiques qui intègrent des fragments de tumeur dans des gels de collagène ont Previously été utilisé pour surveiller l'agressivité du cancer. Bien que la complexité des tumeurs est conservée (par exemple, la présence de cellules non cancéreuses), des fragments de tumeur sont exposées à une diffusion moyenne limitée à une variation d'échantillonnage et à une prolifération de cellules stromales 6. Une méthode alternative consiste dans les cellules cancéreuses en croissance au sein des composants de la matrice extracellulaire (ECM), qui imite la (3D) de l'environnement de la cellule à trois dimensions. La prolifération des lignées de cellules de cancer du sein dans un gel de collagène et / ou une matrice de membrane basale dérivé est parmi les exemples les mieux caractérisés de la culture de cellules 3D. En utilisant des milieux de culture cellulaire 3D spécifiques, l'ensemble désorganisé observée pour les cellules cancéreuses du sein cultivées dans des conditions standard peut être inversé pour la formation spontanée d'acini mammaires et des structures tubulaires 7-10. En outre, la formation de sphéroïdes de tumeur multicellulaires dérivées de cellules cancéreuses d'adénocarcinome rassemblés en utilisant différentes techniques (par exemple, la pendaison gouttes, sphéroïdes flottante, agar embedment) constitue désormais la cellule 3D culture test le plus couramment utilisé 11-13. Cependant, cet essai est limité par l'ensemble limité de lignées cellulaires cancéreuses qui peuvent former des sphéroïdes et par la courte période disponible pour étudier les cellules dans ces conditions.
Dans cette technique visualisée, nous ici introduire un dosage de culture cellulaire 3D sophistiqué où les cellules cancéreuses d'intérêt sont incorporés dans un gel de collagène pour permettre la formation in vitro d'une tumeur pseudo-primaire qui peut être alternativement revêtue d'une membrane - matrice dérivée de sous - sol. Une fois formée, la tumeur pseudo-primaire est alors prise en sandwich dans une matrice acellulaire (gel de fibrine dans le cas présent), ce qui permet aux cellules cancéreuses de traverser l'interface entre les deux compartiments de la matrice (voir figure 1). Fait intéressant, des structures ressemblant à des tumeurs secondaires issues de la tumeur pseudo-primaire ainsi que des cellules cancéreuses agressives apparaissent dans leun gel de fibrine. Un tel système de culture 3D offre la flexibilité nécessaire pour enquêter sur , par exemple, les médicaments anticancéreux, expression génique et cellule-cellule et / ou les interactions cellule-ECM 14-16.
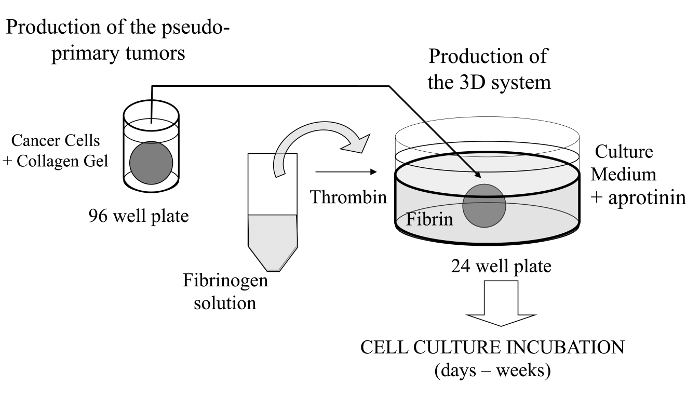
Figure 1:.. Vue d' ensemble de la méthode résumé schématique de la méthode pour générer le système de culture cellulaire 3D comme un modèle pour les études sur le cancer S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Protocole
NOTE: Aucune éthique considération car les cellules animales et les cancers humains ont été achetés ou aimablement fournis pour nous.
1. Faire de collagène Plugs (pseudo-tumeur primaire)
- Préparer une dispersion de collagène. Collagène de type I de tendons de queue de rat (RTT) peuvent être soit extraits et stérilisés comme indiqué précédemment 17, ou achetés. Disperser lyophilisé RTT collagène (3,25 à 3,50 mg / ml dans 0,02 N d'acide acétique) en utilisant un mélangeur (réglage haute vitesse; cinq 2 min pistes) pour un mélange uniforme.
- Harvest (trypsine-EDTA, généralement) et utiliser l'exclusion du bleu trypan pour compter les cellules viables en utilisant un hémocytomètre. Ajuster la densité cellulaire désirée (5 x 10 4 cellules par alvéole).
- Préparer toutes les solutions (NaOH, sérum fœtal bovin, DMEM 5x, NaHCO 3) séparément (Tableau 1) dans des conditions stériles et de garder sur la glace réfrigérée. Remarque: L'ordre d'addition des différentes solutions est important pour éviter les chocs osmotiques ou acides dans les cellules.
- Effectuer une dispersion cellulaire (1,25 x 10 6 cellules) dans la solution finale en collagène (5 ml) aussi rapidement que possible. Mélangez bien (par pipetage de haut en bas), tout en évitant les bulles d'air, puis de distribuer rapidement 200 ul de la solution prête à l'emploi dans chaque puits d'une plaque de 96 puits. frapper doucement la plaque multi-puits sur la surface de la zone de travail de la hotte de culture cellulaire pour éliminer les bulles d'air et de répandre la solution uniformément à l'intérieur des puits.
- Après avoir rempli tous les puits (cette étape prend environ 15-20 minutes par plaque de 96 puits), le stocker dans l'incubateur.
- Incuber la plaque à 37 ° C de 2 heures pour la nuit. Collagène gélification (ie, fibrillogenèse) se produit dans les 30 minutes. Ajouter au milieu de culture (100 ul / puits) à la culture pour effectuer une incubation d'une nuit.
2. Première couche de fibrine Gel
- Préparation de la solution de fibrinogène.
NOTE: Le même lot de gel de fibrine devrait idéalement être utilisé pour resul plus reproductiblets, la formation d'un gel de fibrine comme peut varier entre les différents lots de fibrinogène lyophilisé commercial.- Toujours utiliser une solution de fibrinogène fraîchement préparé. Amener le fibrinogène lyophilisé à température ambiante avant d'ouvrir le flacon afin d'éviter la formation de cristaux d'hydrates.
- Progressivement dissoudre le fibrinogène dans préchauffé (37 ° C) une solution saline équilibrée de Hank (HBSS) avec Ca 2+ / Mg 2+ à une concentration de travail de 3 mg / ml (envisager de préparer un excès de 15% du volume final minimum requis : par exemple, 17,25 mg dans 5,75 ml d'une solution 5 ml).
- Ajouter goutte à goutte HBSS préchauffé dans un premier temps pour solubiliser fragments de fibrinogène. Décomposer des fragments plus grands avec une spatule dans le bécher. Agiter le bêcher de temps à autre pour faciliter le mélange. Ne pas utiliser une plaque d'agitateur pendant la procédure. Dissoudre la poudre restante de la suspension par pipetage vers le haut et vers le bas.
- Gardez la solution de fibrinogène tiède tandis steriLIZING la solution en la faisant passer à travers un filtre de 0,22 um. Remarque: Si le HBSS est pas assez chaud ou le fibrinogène pas entièrement dissous, la solution peut obstruer le filtre. Le cas échéant, remplacer le filtre une ou deux fois, ce qui peut diminuer la concentration de fibrinogène, et la rigidité ainsi caillot de fibrine.
- Suspendre les cellules d'intérêt (par exemple, les cellules endothéliales) en solution prête à l' utilisation du fibrinogène tout en ajustant son volume final, comme une procédure alternative.
- Préparation des Solutions thrombine.
- Préparer une solution mère dans ddH 2 O (50 NIH unités / ml), puis le stériliser en utilisant un filtre de 0,22 um.
- Utiliser un rapport / de la thrombine du fibrinogène ≥1: 0,0075 (v / v) afin de générer le gel de fibrine.
- Génération du gel de fibrine.
- Gardez le fibrinogène et la thrombine stérile des solutions mères sur la glace au cours de toutes les étapes suivantes. Les gels de fibrine peuvent se former dans des plaques à 24 puits.
- e Promptement overlaye surface de chaque puits avec la solution de fibrinogène (200 pl / puits), tout en évitant la formation de bulles d'air. Processus 6 puits à la fois.
- Une fois la solution de fibrinogène recouvre complètement la surface des puits, incliner la plaque à un angle de 45 ° et ajouter 1,5 pi de solution de thrombine dans le premier puits en laissant tomber la thrombine dans le centre du puits, puis agiter doucement la plaque horizontalement pour 1-2 sec.
- Laisser la plaque dans une position stable sous la hotte à flux laminaire (5-10 min) jusqu'à ce que le processus de gélification / coagulation est terminée (NB: le procédé de polymérisation ne doit pas être perturbée, par exemple, en transportant la plaque dans l'incubateur).
- Une fois les six premiers puits ont polymérisé, répéter la même séquence (ie les 3 étapes précédentes) pour les six puits à venir jusqu'à ce que tous les puits ont été traités.
3. Deuxième couche de fibrine Gel et intercalée Collagène plug
- OptionA: (Utilisation du plug Collagène immédiatement).
- Assurez-vous que la première couche de gel de fibrine a polymérisé dans tous les puits en inclinant délicatement la plaque. Placer la plaque à 96 puits contenant du côté des fiches de gel de collagène par côté avec la plaque de 24 puits (contenant les gels de fibrine) pour faciliter le transfert des bouchons de collagène.
- Ajouter une goutte de HBSS dans chaque puits de la plaque contenant les bouchons de collagène.
- Retirez chaque bouchon de collagène du puits avec une aiguille fine montée sur une seringue (utilisé comme une poignée) ou en utilisant un micro-cuillère (voir la vidéo). Transférer chaque bouchon de collagène sur la première couche de gel de fibrine en utilisant un ou deux micro-cuillères, tout en veillant à ce que le bouchon de collagène est bien centré dans le puits et que la stérilité est bien entretenu.
- Recouvrir le gel de fibrine formé au préalable avec la seconde couche de solution de fibrinogène (300 ul / puits) et introduire la thrombine comme décrit au point 2.3, en gardant un minimum. 1: rapport de 0,0075 et une séquence de six puits à une époque
- Option B (revêtement Plug collagène avec une couche mince de facteur de croissance réduit la membrane basale (GFRBM)).
- Toutes les solutions et les instruments préparés Refroidir au préalable et de les garder à 4 ° C ou sur de la glace (par exemple, des pipettes, des conseils, des tubes à essai) lors de la manipulation depuis aliquotes congelées de GFRBM sont très sensibles aux taux d'échauffement excessif lors de la décongélation (suivre les instructions du fabricant) .
- Après le retrait des puits de la plaque, faire tremper chaque bouchon de collagène pendant 2 min dans un tube de centrifugeuse de 1,5 ml sur de la glace contenant 100 pi d'une solution de GRFBM pur.
- Transférer chaque bouchon enduit sur la première couche de fibrine, tout en assurant qu'il est bien centré, comme décrit précédemment. Incuber les plaques contenant enfichables à 37 ° C pendant 5 minutes pour permettre à la GRFBM pour former un gel. Ajouter la deuxième couche de fibrine comme dans l'étape 3.1.4.
4. Conditions de culture cellulaire moyen
- Remplir chaque puits avec du milieu de culture (400 ul). Les milieux de culture et les suppléments seront choisis en fonction de la lignée cellulaire et les conditions expérimentales.
- Ajouter l'aprotinine, un antifibrinolytique, un milieu de culture à une concentration finale de 100 unités inhibitrices de la kallikréine (KIU) / ml.
NOTE: Conserver les plaques dans un incubateur de culture cellulaire dans les conditions utilisées pour la lignée cellulaire testée. - Reconstituer cultures avec un milieu frais tous les jours ou selon le programme expérimental, et ajoutez aprotinine. Avant d'ajouter du milieu frais, inclinez légèrement la plaque (à un angle de 30-35 °) et incliner la pipette contre le côté du puits tout en aspirant soigneusement le milieu conditionné sous observation constante.
Résultats
Comme mentionné précédemment, une caractéristique intéressante de ce test de culture de cellules 3D est que les cellules cancéreuses ne peuvent pas migrer uniquement du bouchon de collagène dans le gel de fibrine adjacente, mais aussi d' établir des tumeurs secondaires (structures , par exemple, le satellite tumeurs similaires). Ceci peut être observé directement avec un microscope à contraste de phase inversée à des grossissements faibles et élevées à traver...
Discussion
Comme une note technique important, il est essentiel qu'aucun écart est présent à l'interface entre la centrale et les gels périphériques. Dans le cas contraire, il pourrait réduire la capacité des cellules à migrer / envahissent le gel de fibrine. Un espace entre le collagène et les gels de fibrine peuvent se former pendant les 24 premières heures de la culture si la thrombine n'a pas été dilué de manière appropriée. Il est également possible que la lignée cellulaire testée pourrait entra?...
Déclarations de divulgation
The authors have no disclosure.
Remerciements
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
matériels
| Name | Company | Catalog Number | Comments |
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65 - 85% protein with ≥ 75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5 - 10T IU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
Références
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon