Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Synthèse des polymères cycliques et caractérisation de leur mouvement Diffusive dans l'État Melt à la molécule unique Level
Dans cet article
Résumé
Un protocole pour la synthèse et la caractérisation du mouvement diffusif de polymères cycliques au niveau molécule unique est présenté.
Résumé
We demonstrate a method for the synthesis of cyclic polymers and a protocol for characterizing their diffusive motion in a melt state at the single molecule level. An electrostatic self-assembly and covalent fixation (ESA-CF) process is used for the synthesis of the cyclic poly(tetrahydrofuran) (poly(THF)). The diffusive motion of individual cyclic polymer chains in a melt state is visualized using single molecule fluorescence imaging by incorporating a fluorophore unit in the cyclic chains. The diffusive motion of the chains is quantitatively characterized by means of a combination of mean-squared displacement (MSD) analysis and a cumulative distribution function (CDF) analysis. The cyclic polymer exhibits multiple-mode diffusion which is distinct from its linear counterpart. The results demonstrate that the diffusional heterogeneity of polymers that is often hidden behind ensemble averaging can be revealed by the efficient synthesis of the cyclic polymers using the ESA-CF process and the quantitative analysis of the diffusive motion at the single molecule level using the MSD and CDF analyses.
Introduction
Cyclic polymers are unique in that they do not have chain ends. They often exhibit unusual behaviors which is distinct from their linear counterpart, including increased thermal stability of polymer micelles by a linear-to-cyclic conversion,1,2 and spatial organization of DNA in bacterial cells by a loop formation.3 Topological interactions between the cyclic chains are believed to be the critical factor for such unusual behaviors.4,5 Therefore, characterizing the motion and relaxation of cyclic polymers under entangled conditions has been an important research topic in polymer science for decades.6
Cyclic polymer dynamics has been investigated using both synthetic and naturally occurring molecules by means of ensemble averaged experimental methods such as nuclear magnetic resonance (NMR), light scattering, and viscosity measurements.7-9 However, these studies often suffer from impurity molecules in the samples.10 Furthermore, spatiotemporal heterogeneities of the motion of individual molecules caused by inherent structural heterogeneity of entangled polymers are often hidden behind the ensemble averaging in these studies. In order to characterize molecular level dynamics of cyclic polymers, a synthesis method that provides high purity cyclic polymers and an experimental and analysis methods that allow for quantitative characterization of molecular motion at the single molecule level have to be developed. Here, we will show a method to synthesize high-purity cyclic and dicyclic poly(THF)s that incorporate a fluorophore unit using an electrostatic self-assembly and covalent fixation (ESA-CF) process11-13 and a method to analyze the motion of the individual fluorophore-incorporated polymer chains using a combination of mean-squared displacement (MSD) and cumulative distribution function (CDF) analyses.
A proper data processing has been shown to be essential for the accurate characterization of the diffusive motion. With an adequate MSD and CDF analyses, a multiple-mode diffusion of the cyclic and dicyclic polymers in the melt and semi-dilute solution of the linear polymer chains has been revealed,14-16 suggesting the significant effects of the topological states of the polymers on the diffusive motion of the chains under entangled conditions.17 While the experimental and analytical approaches to characterize the motion of the cyclic polymers are described in this protocol, the same method can be used to quantitatively characterize the diffusive motion in many other heterogeneous systems. The approach would be especially suitable when multiple diffusion components existing in the samples are to be analyzed.
Protocole
1. Synthèse des mono- et bifonctionnels Poly (THF)
- Poly monofonctionnel (THF)
- Flamme sécher un ballon à fond rond à 2 cols de 100 ml. Aspirer et remplir le flacon avec de l'azote (3 cycles).
- Ajouter du tétrahydrofuranne distillé (THF) (50 ml) dans le ballon. Placer le ballon dans un bain d'eau à 20 ° C et à équilibrer la température.
- Ajouter le triflate de méthyle (0,5 mmol) dans le flacon par une seringue. Agiter le mélange pendant 5-10 min à 20 ° C.
- Ajouter N -phényl pyrrolidine (4-6 équiv.) Dans le flacon par une seringue. Agiter le mélange pendant 30-60 min.
- Complètement éliminer le solvant sous pression réduite (environ 100 Torr). On dissout le résidu dans 3-5 ml d'acétone. Ajouter la solution d'acétone dans 300-500 ml de n - hexane. Filtrer le précipité et le sécher sous pression réduite.
- Poly Bifonctionnel (THF)
- Flamme sécher un ballon à fond rond à 2 cols de 100 ml. Virginiecuum et remplir le flacon avec de l'azote (3 cycles).
- Ajouter du THF distillé (50 ml) dans le ballon. Placer le ballon dans un bain d'eau à 20 ° C et à équilibrer la température.
- Ajouter de l'anhydride triflique (0,3 mmol) dans le flacon par une seringue. Agiter le mélange pendant 5-10 min à 20 ° C.
- Ajouter N -phényl pyrrolidine (4-6 équiv.) Dans le flacon par une seringue. Agiter le mélange pendant 30-60 min.
- Complètement éliminer le solvant sous pression réduite (environ 100 Torr). On dissout le résidu dans 3-5 ml d'acétone. Ajouter la solution d'acétone à 300-500 ml de n - hexane. Filtrer le précipité et le sécher sous pression réduite.
En forme de 8 2. Synthèse de pérylène diimide incorporé Étoiles 4-armé et dicyclique Poly (THF)
- Armed poly étoiles (THF)
- Échange d'ion
- Dissoudre le sel pérylène diimide tétracarboxylate de sodium dans de l'eau (10 mg / ml, 150 ml). Dissoudrepoly monofonctionnel (THF) dans l'acétone (160 mg / ml, 4 ml). Ajouter goutte à goutte une solution d'acétone dans la solution aqueuse sous agitation vigoureuse. Recueillir le précipité formé par filtration.
- Répétez la procédure ci-dessus avec le précipité récupéré (2.1.1.1) quatre fois.
- covalent fixation
- On dissout le précipité obtenu dans le toluène (5 mg / ml). Faire refluer la solution pendant 4 heures.
- Complètement éliminer le solvant sous pression réduite (environ 100 Torr). Filtrer le résidu à travers un bouchon de gel de silice avec un mélange n - hexane / acétone (01/02 vol / vol). Ajouter la solution dans de l'eau glacée (300-500 ml) pour précipiter le produit. Recueillir le précipité par filtration.
- Échange d'ion
- Poly-forme 8 dicyclique (THF)
- Échange d'ion
- Dissoudre le sel pérylène diimide tétracarboxylate de sodium dans l'eau (6 mg / ml, 50 ml). Dissoudre du poly bifonctionnel (THF) (0,5 g) Dans 30-50 ml d'acétone. Ajouter goutte à goutte une solution d'acétone dans la solution aqueuse sous agitation vigoureuse à 0 ° C. Recueillir le précipité formé par filtration.
- Répétez la procédure ci-dessus avec le précipité récupéré (2.2.1.1).
- covalent fixation
- On dissout le précipité obtenu dans le toluène (0,05 g / L). Faire refluer la solution pendant 4 heures.
- Complètement éliminer le solvant sous pression réduite (environ 100 Torr). Ajouter le toluène pour dissoudre partiellement le résidu. Re-précipiter dans 300-500 ml de n - hexane.
- Filtrer le précipité formé à travers un bouchon de gel de silice avec un mélange n - hexane / acétone (01/02 vol / vol). Re-précipiter dans 300-500 ml d'eau.
- On purifie le précipité formé par Chromatographie sur colonne 18 en utilisant un gel de polystyrène. Purifier davantage le produit brut par chromatographie sur gel preparative (GPC) , 19 avec un éluant CHCl 3 à remsous-produits ove en surveillant l'indice de réfraction (RI) et des détecteurs UV.
- Échange d'ion
3. Single-molécule Fluorescence Imaging Experiment
- La préparation des échantillons
- Nettoyage de couverture glisse de microscope
- Lieu n ° 1,5 24 x 24 mm couverture de microscope glisse dans un bocal de coloration.
- Ajouter la solution de l'hydrure de potassium 1 M (100 ml) dans le récipient et de traitement par ultrasons pendant 15 min. Décanter la solution d'hydroxyde de potassium par décantation et rincer les lamelles avec de l'eau ultra-pure à plusieurs reprises. Ajouter l'éthanol de qualité spectroscopique (100 ml) dans le bocal et sonication pendant 15 min.
- Verser de l'éthanol par décantation et rincer les lamelles avec de l'eau ultra-pure à plusieurs reprises. Après avoir versé de l'eau ultra-pure par décantation, répéter l'étape 3.1.1.2.
- Ajouter de l'eau ultra-pure à la jarre et sonication pendant 15 min. Rincer les lamelles avec de l'eau ultra-pure à plusieurs reprises. Sortez les lamelles de la jarre par des brucelles en plastique et les sécher soit par l'air sec ou de l'azote sec.
- Préparation des échantillons de polymère fondu 14,15
- Ajouter 100 ul de non marqué linéaire poly (THF) dans un flacon en verre et chauffer à une température supérieure au point de fusion (environ 25 ° C) à l'aide d'un sèche-cheveux.
- Dissoudre le polymère fluorophore incorporé (linéaire, étoile 4 bras, cyclique ou bicyclique en forme de 8 synthétisé en 2.1 et 2.2) dans le chloroforme (1 ml, 10 -6 M). Ajouter 1 pi de la solution à 100 ul de la masse fondue du poly linéaire non marqué (THF).
- Après avoir mélangé à fond l'échantillon avec une pointe de pipette, évaporer le chloroforme en chauffant l'échantillon à l'aide d'un sèche-linge.
REMARQUE: Ceci permet d' obtenir une masse fondue du poly linéaire non marqué (THF) contenant 10 -8 M des polymères fluorophore incorporé. - Prélever 10 pi de l'échantillon à l'aide d'une micro-pipette et dRop sur une lamelle nettoyée. Mettez une autre lamelle nettoyée sur l'échantillon et l'échantillon en sandwich entre les deux lamelles.
- Appuyez sur l'échantillon doucement à l'aide des brucelles en plastique.
- Nettoyage de couverture glisse de microscope
- Grand champ configuration d'imagerie par fluorescence 15
- Introduction d'un laser d'excitation (488 nm) dans l'orifice arrière du microscope inversé
- Insérer un filtre passe-bande d'excitation et le polariseur dans le trajet du faisceau.
- Étendre le faisceau à environ 1 cm de diamètre par un élargisseur de faisceau.
- Insérez une plaque quart d'onde dans le trajet du faisceau. Régler l'axe optique de la plaque d'onde à 45 degrés par rapport à celui du polariseur. Vous pouvez également insérer un compensateur Berek et régler le retard optique à X / 4.
- Insérer un diaphragme dans le trajet du faisceau d'excitation pour régler la taille du faisceau.
- Avant d'introduire le faisceau laser dans le port arrière du microsco optique inversépe, insérer une lentille de focalisation (lentille plan-convexe, longueur focale ≈ 300 mm) à une position où le faisceau laser sur l'objectif est collimaté.
- Après la réflexion du faisceau laser à l' aide d' un miroir dichroïque monté sur un cube de filtre, d' introduire le faisceau laser sur l'échantillon à travers une grande ouverture numérique (NA) objectif (par exemple, NA 1.3, 100X, immersion dans l'huile).
- Fixer un chauffe objectif à l'objectif et régler la température à 30 ° C.
- Monter l'échantillon sur la platine du microscope inversé
- Déposer une goutte d'huile à immersion sur la lentille d'objectif et monter l'échantillon sur l'état du microscope.
- Faire en sorte que l'épaisseur d'environ 10 um d'échantillon est obtenue en contrôlant la position axiale de la surface supérieure et inférieure de l'échantillon.
- Ajuster la mise au point du microscope à quelques micromètres au-dessus de la surface inférieure de l'échantillon.
- Obtenir la lumière d'excitation polarisée circulairement dans l'objectif
- Insérez un polariseur dans le faisceau laser collimaté sur l'objectif.
- Enregistrer l'intensité du laser transmise à travers le polariseur en insérant un dispositif de mesure de puissance après le polariseur. Enregistrer la puissance du laser émis à des angles différents de polarisation en faisant tourner le polariseur.
- Si la puissance du laser transmis est pas constant à tous les angles de polarisation, tourner légèrement la plaque quart d'onde ou Berek compensator inséré dans le trajet du faisceau d'excitation.
- Répétez l'étape 3.2.5.2 et 3.2.5.3 jusqu'à ce que la puissance constante laser transmise est obtenue à tous les angles de polarisation. Faire en sorte que la lumière polarisée circulairement est obtenue à l'échantillon.
- Configuration EM (de multiplication d'électrons) -charge dispositif couplé (CCD)
- Fixez la caméra EM-CCD au port côté du microscope et le connecter à til logiciel d'acquisition d'images.
- Si nécessaire, synchroniser l'exposition de la caméra à un obturateur mécanique ou un filtre accordable acousto-optique inséré dans le trajet du faisceau d'excitation en envoyant le transistor à transistor logique (TTL) des signaux générés par la caméra CCD EM aux appareils. En variante, synchroniser l'exposition de la caméra à la sortie du laser en envoyant les signaux TTL générés par la caméra EM-CCD au laser.
NOTE: La dernière option est applicable seulement quand un laser à l'état solide dont la puissance peut être modulée par une entrée logique transistor-transistor signaux (TTL) est utilisé pour l'expérience. - Appliquer un gain EM (typiquement environ 300) à la caméra CCD en utilisant un logiciel contrôlant l'appareil afin d'obtenir une image de fluorescence de haute qualité du fluorophore unique.
- Définir une région d'intérêt (ROI) (typiquement 128 x 128 pixels au centre du champ de vision) en utilisant le logiciel de contrôle de l'appareil photo.
NOTE: Cela permet l'imagiexpériences ng aux taux de trames 100 - 200 Hz dans le mode de transfert de trame, qui est nécessaire pour visualiser le mouvement des chaînes de polymère fluorophore incorporé dans l'échantillon à l'état fondu.
- Introduction d'un laser d'excitation (488 nm) dans l'orifice arrière du microscope inversé
- Exécution de l'expérience
- L' optimisation des conditions expérimentales
- Ajuster la zone d'illumination de l'échantillon à environ 20 um de diamètre à l'aide du diaphragme inséré dans le trajet du faisceau d'excitation.
- Régler la puissance du laser d'excitation à l'échantillon à 4 - 8 MW en sélectionnant manuellement une densité neutre (ND), un filtre approprié inséré dans la trajectoire du faisceau d'excitation.
REMARQUE: Ceci permet d' obtenir la puissance laser moyenne de 1 - 2 cm -2 kW à l'échantillon. - images de fluorescence d'enregistrement de l'échantillon aux taux de 100 cadres - 200 Hz. Si l'intensité de fluorescence obtenue à partir des polymères de fluorophores incorporés individuels est trop faible, augmenter progressivement la puissance d'excitation utilisant ee filtre ND jusqu'à atteindre environ 100 mW à l'échantillon.
- Si la qualité de l'image de fluorescence de molécule unique est toujours pas satisfaisante, vérifier les impuretés de fluorescence dans l'échantillon en enregistrant des images de fluorescence d'une masse fondue pure du poly non marqué (THF). Dans le cas où un fond de fluorescence élevée est observée, utiliser différents poly non marqué (THF).
- Si la densité de la tache de fluorescence obtenue à partir des polymères de fluorophores incorporés dans la masse fondue est trop élevée pour isoler spatialement eux (ce qui provoque des erreurs dans l'analyse du mouvement diffusif), diminuer la concentration des polymères de fluorophores incorporés dans l'échantillon jusqu'à spatialement endroits isolés sont observés.
- Si la densité de la tache de fluorescence obtenues à partir des polymères d'un fluorophore incorporé dans la masse fondue est trop faible (ce qui provoque un faible débit de l'expérience d'imagerie), d'augmenter la concentration des polymères fluorophore incorporé dans l'échantillon jusqu'à une approprdensité iate de la tache de fluorescence est atteint.
- Si les images de fluorescence obtenues à partir des polymères de fluorophores incorporés dans la masse fondue sont floues, augmenter les taux de l'acquisition d'imagerie de cadre.
NOTE: Cela nécessite souvent un retour sur investissement plus faible, typiquement 64 x 64 pixels.
- L' optimisation des conditions expérimentales
- Acquisition d'image
- Une fois que les conditions expérimentales sont optimisés, laisser l'échantillon monté sur la platine du microscope pendant une heure afin que l'échantillon atteint des conditions d'équilibre.
- Enregistrer 500 - 1000 images de fluorescence des séquences des polymères de fluorophores incorporés dans l'état de fusion à 100 - 200 taux de trame Hz. Si le format de fichier par défaut est pas TIFF, convertir toutes les séquences d'images au format TIFF.
4. Analyse de la Diffusive Mouvement
- Déplacement quadratique moyenne (MSD) Analyse
- Rogner les séquences d'images de fluorescence de telle sorteque chaque séquence d'image contient un polymère en utilisant la diffusion de logiciels de traitement unique et bien ciblé fluorophore incorporé image, par exemple ImageJ.
- Lorsque les séquences d'image rognée contiennent plus de 10 trames, diviser les séquences d'images en séquences multiples de telle sorte que chaque séquence est constituée de 10 trames.
- Déterminer les positions des molécules dans chacune des séquences d'images avec précision par ajustement gaussienne à deux dimensions des images.
- Déterminer le coefficient de diffusion (D) de molécules individuelles par déplacement (TMS) analyse quadratique moyenne des trajectoires de diffusion ( par exemple, des positions dépendant du temps de la molécule) , en utilisant une équation 20
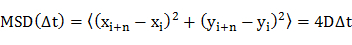
où x i et y i sont les positions de la molécule dans le cadre de l' image i, et n désigne le numéro de l' image avec le laps de temps At de trame i. - Tracer les coefficients de diffusion dansun histogramme de fréquence.
NOTE: En règle générale, l'histogramme est construit à partir de plus de 100 molécules.
- Fonction de distribution cumulative (CDF) Analyse
NOTE: Un CDF, P (r 2, i Δ t) correspond à la probabilité cumulative de trouver les molécules diffusant dans un rayon r de l'origine après un certain laps de temps i ô t.- Calculer le déplacement carré se produisant pendant le temps des décalages 1Δt, 2Δt, ····, iΔt pour toutes les trajectoires de diffusion obtenues en 4.1.3.
NOTE: Ces calculs donnent total m i au carré-déplacements pour les décalages de iΔt. - Calculer le nombre des-déplacements au carré (l i) dans le total ensemble de données m i qui sont plus petites que r 2 à différents r 2 valeurs (0 i vs r 2 parcelles correspondent à la CDF, P (r 2, iΔt).
- Calculer le déplacement carré se produisant pendant le temps des décalages 1Δt, 2Δt, ····, iΔt pour toutes les trajectoires de diffusion obtenues en 4.1.3.
- Analyse des CDFs avec des modèles de diffusion distincts
Remarque: Les CDFs obtenus sont montés par des modèles de diffusion distincts; l' homogénéité du modèle de diffusion, plusieurs modes de diffusion dans laquelle la distribution D est décrite par une gaussienne (Gaussian modèle simple), et de multiples modes de diffusion dans laquelle la distribution D est décrite par plusieurs gaussiennes (modèle gaussien multiple).- Dans le modèle de diffusion homogène, déterminer une dimension moyenne en ajustant la CDF en utilisant une équation 21
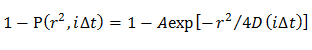
NOTE: Tout écart par rapport à l'équation suggère la diffusion hétérogène de la molécule. - Dans le modèle gaussien unique, de déterminer la distribution de probabilité de D décrite par une gaussienne (f (D)) en ajustant la FCD à l' aide 15
on3 "src =" / files / ftp_upload / 54503 / 54503equation3.jpg "/>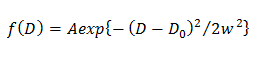
où A, W, D et 0 sont l'amplitude, la largeur et le centre de la gaussienne. - Dans le modèle de Gauss double, de déterminer la distribution de probabilité du j - ième composante du D décrite par une gaussienne (f (D)) en ajustant la CDF en utilisant 14
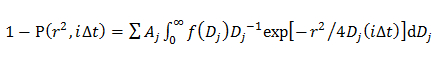

où A j est la fraction de chaque composante de diffusion et α j, W j et D j 0 sont l'amplitude, la largeur et le centre de la j - ième composante du gaussienne.
- Dans le modèle de diffusion homogène, déterminer une dimension moyenne en ajustant la CDF en utilisant une équation 21
- Calcul de la probabilité théorique distrition du coefficient de diffusion
NOTE: Les distributions de probabilité de D se produisant en raison des erreurs statistiques (p (D) d D) sont calculés pour les différents modèles de diffusion; l' homogénéité du modèle de diffusion, plusieurs modes de diffusion dans laquelle la distribution D est décrite par une gaussienne (Gaussian modèle simple), et de multiples modes de diffusion dans laquelle la distribution D est décrite par plusieurs gaussiennes (modèle gaussien multiple).- Dans le modèle de diffusion homogène, calculer la distribution de probabilité statistique de D en utilisant une équation 22
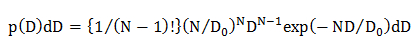
où N est le nombre de points de données dans une trajectoire de diffusion (N = 10, voir 4.1.2), D 0 est le coefficient de diffusion moyen (déterminé par l'analyse CDF, voir 4.2.3.1), et D est le obtenue expérimentalement coefficient de diffusion pour une trajectoire individuelle. - dans leseul modèle de diffusion gaussienne, on calcule la répartition de la probabilité statistique de D en utilisant une équation 15

où f (D) désigne la distribution de probabilité de D déterminée par l'analyse CDF (voir 4.2.3.2), et D 0 est le coefficient de diffusion moyen (déterminé par l'analyse CDF, voir 4.2.3.2). - Dans la double modèle de diffusion gaussien, calculer la distribution de probabilité statistique de D en utilisant une équation 14

où f (D j) désigne la distribution de probabilité du j - ième composante D (D j) déterminée par l'analyse CDF (voir 4.2.3.3), D 0j est le coefficient de diffusion moyenne de la j - ième composante (déterminée par la CDF analyse, voir 4.2.3.3).
- Dans le modèle de diffusion homogène, calculer la distribution de probabilité statistique de D en utilisant une équation 22
Résultats
Le pérylène diimide-incorporé étoiles 4-armé et poly bicyclique en forme de 8 (THF) s ont été synthétisés en utilisant l'auto-assemblage électrostatique et fixation covalente (ESA-CF) processus (Figure 1, Figure 2). Une seule molécule des images de fluorescence Time-lapse ont été mesurées pour le 4-armé (Figure 3a) et en forme de 8 (Figure 3b) des polymères. Les images de fluorescence temps-lapse
Discussion
Les polymères armés 4 et 8 en forme ont été préparés par le protocole ESA-CF (figure 1), ce qui constitue une étape critique pour la synthèse. 12,24 monofonctionnel et bifonctionnel poly linéaire (THF) s avec des groupes N - terminaux sont -phenylpiperidinium synthétisé selon la procédure précédente. 11 l'échange d'ions a été effectuée par reprécipitation d'une solution d'acétone d'un précurseur de polymère avec des contre - anions...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by a Grant-in-Aid for Scientific Research No. 22750122 (S.H.), No. 26288099 (T.Y.), and No. 23350050 (Y.T.) of the Japan Society for the Promotion of Science. S.H. is grateful for The Kurata Memorial Hitachi Science and Technology Foundation. The research reported in this publication was supported by the King Abdullah University of Science and Technology (S.H.).
matériels
| Name | Company | Catalog Number | Comments |
| Materials | |||
| THF | Godo | ||
| Wakosil C-300 | Wako Pure Chemical Industries | ||
| Acetone | Godo | ||
| Toluene | Godo | ||
| n-Hexane | Godo | ||
| CHCl3 | Kanto Chemical | ||
| Bio-Beads S-X1 | Bio-Rad | ||
| Methyl triflate | Nacalai Tesque | ||
| Triflic anhydride | Nacalai Tesque | ||
| Potassium Hydroxide | Wako Pure Chemical Industries | ||
| Ethanol | Wako Pure Chemical Industries | ||
| Poly(tetrahydrofuran) | Aldrich | ||
| Chloroform | Wako Pure Chemical Industries | ||
| Immersion oil | Cargille | Type 37 / Type A | |
| Equipment | |||
| 2-Neck 100-ml round-bottom flask | |||
| Flask | |||
| Beaker | |||
| Funnel | |||
| Filter paper | Whatman | ||
| Reflux condenser | |||
| Syringe | |||
| Water bath | |||
| Magnetic stirrer | |||
| Rotary evaporator | |||
| Microscope cover slips (24 x 24 mm, No. 1) | Matsunami Glass | CO22241 | |
| Staining jar | AS ONE Corporation | 1-7934-01 | |
| Ultrasonic cleaner | VWR International | 142-0047 | |
| Inverted microscope | Olympus | IX71 | |
| Ar-Kr ion laser | Coherent | Innova 70C | |
| Berek compensator | Newport | 5540 | |
| Excitation filter | Semrock | LL01-488-12.5 | |
| Dichloric mirror | Omega optical | 500DRLP | |
| Emission filter | Semrock | BLP01-488R-25 | |
| Lens and mirror | Thorlabs | ||
| EM-CCD camera | Andor Technology | iXon | |
| Objective lens (100X, N.A. = 1.3) | Olympus | UPLFLN 100XOP | |
| Objective heater | Bioptechs | ||
| Preparative GPC | Japan Analytical Industry | LC-908 |
Références
- Honda, S., Yamamoto, T., Tezuka, Y. Topology-Directed Control on Thermal Stability: Micelles Formed from Linear and Cyclized Amphiphilic Block Copolymers. J. Am. Chem. Soc. 132 (30), 10251-10253 (2010).
- Honda, S., Yamamoto, T., Tezuka, Y. Tuneable enhancement of the salt and thermal stability of polymeric micelles by cyclized amphiphiles. Nat. Commun. 4, (2013).
- Jun, S., Mulder, B. Entropy-driven spatial organization of highly confined polymers: Lessons for the bacterial chromosome. Proc. Natl. Acad. Sci. U. S. A. 103 (33), 12388-12393 (2006).
- McLeish, T. Polymers without beginning or end. Science. 297 (5589), 2005-2006 (2002).
- McLeish, T. Polymer dynamics: Floored by the rings. Nat. Mater. 7 (12), 933-935 (2008).
- Roovers, J., Tezuka, Y. . Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. , 137-156 (2013).
- Klein, J. Evidence for reptation in an entangled polymer melt. Nature. 271 (5641), 143-145 (1978).
- Leger, L., Hervet, H., Rondelez, F. Reptation in entangled polymer-solutions by forced rayleigh light-scattering. Macromolecules. 14 (6), 1732-1738 (1981).
- von Meerwall, E. D., Amis, E. J., Ferry, J. D. Self-diffusion in solutions of polystyrene in tetrahydrofuran - comparison of concentration dependences of the diffusion-coefficients of polymers, and a ternary probe component. Macromolecules. 18 (2), 260-266 (1985).
- Kapnistos, M., et al. Unexpected power-law stress relaxation of entangled ring polymers. Nat. Mater. 7 (12), 997-1002 (2008).
- Adachi, K., Takasugi, H., Tezuka, Y. Telechelics having unstrained cyclic ammonium salt groups for electrostatic polymer self-assembly and ring-emitting covalent fixation. Macromolecules. 39 (17), 5585-5588 (2006).
- Oike, H., Imaizumi, H., Mouri, T., Yoshioka, Y., Uchibori, A., Tezuka, Y. Designing unusual polymer topologies by electrostatic self-assembly and covalent fixation. J. Am. Chem. Soc. 122 (40), 9592-9599 (2000).
- Yamamoto, T., Tezuka, Y. Topological polymer chemistry: a cyclic approach toward novel polymer properties and functions. Polym. Chem. 2 (9), 1930-1941 (2011).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Tezuka, Y. Single-molecule imaging reveals topological isomer-dependent diffusion by 4-armed star and dicyclic 8-shaped polymers. Polym. Chem. 6 (22), 4109-4115 (2015).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Vacha, M., Tezuka, Y. Single-Molecule Study on Polymer Diffusion in a Melt State: Effect of Chain Topology. Anal. Chem. 85 (15), 7369-7376 (2013).
- Habuchi, S., Satoh, N., Yamamoto, T., Tezuka, Y., Vacha, M. Multimode Diffusion of Ring Polymer Molecules Revealed by a Single-Molecule Study. Angew. Chem. Int. Ed. 49 (8), 1418-1421 (2010).
- Habuchi, S., Tezuka, Y. . Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. , 265-290 (2013).
- Fernandez, P., Bayona, J. M. Use of off-line gel-remeation chromatography normal-phase liquid-chromatography fro the determination of polycyclic aromatic-compounds in environmental-samples and standard reference materials (air particulate matter and marine sediment). J. Chromatogr. 625 (2), 141-149 (1992).
- Biesenberger, J. A., Tan, M., Duvdevan, I., Maurer, T. Recycle gel permeation chromatography. 1. recycle principle and design. J. Polym. Sci. Pol. Lett. 9 (5), 353 (1971).
- Kusumi, A., Sako, Y., Yamamoto, M. Confined lateral diffusion of membrane-receptors as studied by single-particle tracking (nanovid microscopy) - effects of calcium-induced differentiation in cultured epithelial-cells. Biophys. J. 65 (5), 2021-2040 (1993).
- Schutz, G. J., Schindler, H., Schmidt, T. Single-molecule microscopy on model membranes reveals anomalous diffusion. Biophys. J. 73 (2), 1073-1080 (1997).
- Vrljic, M., Nishimura, S. Y., Brasselet, S., Moerner, W. E., McConnell, H. M. Translational diffusion of individual class II MHC membrane proteins in cells. Biophys. J. 83 (5), 2681-2692 (2002).
- Margineanu, A., et al. Photophysics of a water-soluble rylene dye: Comparison with other fluorescent molecules for biological applications. J. Phys. Chem. B. 108 (32), 12242-12251 (2004).
- Tezuka, Y., Oike, H. Self-assembly and covalent fixation for topological polymer chemistry. Macromol. Rapid Commun. 22 (13), 1017-1029 (2001).
- Deres, A., et al. The Origin of Heterogeneity of Polymer Dynamics near the Glass Temperature As Probed by Defocused Imaging. Macromolecules. 44 (24), 9703-9709 (2011).
- Flier, B. M. I., et al. Heterogeneous Diffusion in Thin Polymer Films As Observed by High-Temperature Single-Molecule Fluorescence Microscopy. J. Am. Chem. Soc. 134 (1), 480-488 (2012).
- Habuchi, S., Oba, T., Vacha, M. Multi-beam single-molecule defocused fluorescence imaging reveals local anisotropic nature of polymer thin films. Phys. Chem. Chem. Phys. 13 (15), 6970-6976 (2011).
- Zettl, U., et al. Self-Diffusion and Cooperative Diffusion in Semidilute Polymer Solutions As Measured by Fluorescence Correlation Spectroscopy. Macromolecules. 42 (24), 9537-9547 (2009).
- Kirstein, J., Platschek, B., Jung, C., Brown, R., Bein, T., Brauchle, C. Exploration of nanostructured channel systems with single-molecule probes. Nat. Mater. 6 (4), 303-310 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon