Method Article
Induction de l’athérosclérose accélérée chez les souris : le modèle « Wire-Injury »
Dans cet article
Résumé
Cette étude décrit une procédure invasive pour l’induction de l’athérosclérose accélérée chez les souris. En comparaison avec d’autres méthodes utilisant des dommages électriques ou cryo-induits, les dommages mécaniques-induits imitent la condition humaine de la restenose après thérapies de revascularisation et est idéale pour l’étude des mécanismes moléculaires impliqués.
Résumé
L’athérosclérose est une maladie fibro-inflammatoire proliférative qui se développe dans la paroi artérielle, induisant un flux sanguin déficient ou un manque de flux sanguin. En outre, par rupture de la paroi vasculaire défectueuse, l’athérosclérose induit la formation de thrombus occlusif, qui représente la cause principale de l’infarctus du myocarde ou de l’AVC et la cause la plus fréquente de décès. Malgré les progrès dans le domaine cardiovasculaire, de nombreuses questions restent sans réponse, et la recherche fondamentale supplémentaire est essentielle pour améliorer notre compréhension des mécanismes moléculaires pendant l’athérosclérose et ses effets. En raison d’études cliniques limitées, il est nécessaire de présenter des modèles animaux représentatifs recréant des affections athérosclérotiques telles que la formation de néointima après l’implantation de stent, l’angioplastie des ballons ou l’endartectomie. Puisque la souris présente de nombreux avantages et est le modèle le plus fréquemment utilisé pour étudier les processus moléculaires, l’étude actuelle propose une procédure invasive de dénudation endothéliale, également connu sous le nom de modèle de lésions filaires, qui est représentatif de la condition humaine de la formation de néointima dans les artères après les procédures de revascularisation.
Introduction
L’athérosclérose est la pathologie principale sous-jacente aux événements cardiovasculaires tels que l’infarctus du myocarde ou l’AVC. Les principaux mécanismes déclenchant des syndromes cardio-vasculaires aigus sont la rupture de plaque, l’érosion superficielle, et la formation de thrombus. Il existe de multiples situations cliniques liées au développement de la plaque : plaque athérosclérotique indigène, resténose après endartectomie, et resténose après angioplastie de ballon avec/sans implantation de stent1. Après une lésion artérielle, la suppression des processus inflammatoires2,3 et la récupération du compartiment endothélial sont essentiels pour prévenir d’autres complications1. La recherche clinique est limitée aux échantillons de tissus et de sang en raison de considérations éthiques, des coûts et d’un manque de connaissances dans les mécanismes de base. Pour ces raisons, il est nécessaire d’étudier les mécanismes moléculaires dans les modèles animaux4-6, qui peuvent recréer les conditions cliniques. Notre modèle de formation accélérée de néointima dans le contexte de l’athérosclérose est le résultat de nombreuses années d’expérience dans la mise en œuvre de ces modèles chez les petits animaux7-11. Le modèle de souris est le modèle le plus attrayant pour la recherche, en raison de sa facilité de manipulation, la capacité d’avoir de grands groupes d’animaux en raison de faibles coûts liés à l’achat et les soins des animaux, et la disponibilité de diverses souches transgéniques et knock-out.
Le principal inconvénient du modèle de souris est la petite taille des artères principales soumises à la maladie athérosclérotique (l’artère carotide, l’aorte, et l’artère fémorale), qui exige une expertise chirurgicale qualifiée et des compétences pour manipuler les vaisseaux et d’induire invasivement une plaque athérosclérotique. Par conséquent, le modèle de formation accélérée de néointima, dans le contexte de la restenosectomie après l’implantation d’endartectomie ou de stent, proposé dans ce document est présenté avec une ligne directrice étape par étape et des suggestions pour faciliter l’introduction pour le personnel intéressé. Un autre inconvénient est que la dénudation est faite sur la paroi artérielle normale, et donc, la formation néo-ittima sera modérée par rapport à la situation clinique. Le niveau élevé de cholestérol plasmatique atteint chez les souris apolipoprotéines E knockout (Apoe-/-) nourris avec un régime riche en matières grasses crée un environnement pro-inflammatoire approprié nécessaire à la formation néo-intima.
La chirurgie est effectuée sous un stéréomicroscope. L’artère carotide est exposée par une incision médiane dans la région cervicale ventrale. Les structures anatomiques au-dessus et entourant l’artère carotide sont minimalement manipulées pour réduire l’inflammation post-chirurgicale. La bifurcation de l’artère carotide est exposée. Pour induire la formation accélérée de neointima, les artères carotides internes et externes sont préparées pour l’arrêt de flux sanguin et la dénudation commune suivante d’artère carotide. En conclusion, la méthode peut être apprise par le personnel ayant une expérience minimale dans les chirurgies animales.
Protocole
Les expériences présentées dans cet article sont réalisées conformément à la loi allemande et aux directives européennes en matière de soins aux animaux. Les animaux sont élevés dans l’établissement animalier de l’Institute for Laboratory Animal Science, University Hospital Aachen, Allemagne, sous la supervision du Professeur R. Tolba et du Dr A. Teubner (agent du bien-être animal).
1. Soins aux animaux
- Gardez les souris dans une unité de soins spécialisée, assurant un accès approprié à la nourriture et un contrôle et un traitement vétérinaires spécialisés. Si les animaux sont déplacés ou achetés auprès de tiers, veuillez vous assurer une période d’hébergement d’une semaine avant de subir la procédure.
2. Incitation à l’hyperlipidémie
- Nourrir 6 à 8 semaines, 18 à 20 g, femelle (facultatif) ApoE-/- souris avec un régime athérogène (21% de matières grasses, 0,15% de cholestérol, 19,5% de caséine, wt/wt) une semaine avant la procédure chirurgicale et continuer le régime jusqu’à ce que l’analyse de la plaque athérosclérotique soit effectuée.
3. Préparation chirurgicale
- Anesthétiser les souris à l’aide d’une injection intrapéritonéale de 100 mg/kg de kétamine par poids corporel et de 10 mg/kg de xylazine par poids corporel. Confirmer l’anesthésiation appropriée avant la chirurgie par le manque de réflexes et le mouvement de moustache. Placez une petite quantité d’onguent stérile dans l’œil pour minimiser le séchage.
- Assurer le maintien des conditions stériles pour éviter les infections pendant la chirurgie en utilisant des matériaux et des instruments stériles.
- Raser les souris dans la région ventrale du cou. Désinfecter la peau avec de la bétadine avant l’incision. Faire une incision cutanée de 1 cm dans la région médiane de la région du cou, au-dessus de la trachée.
- Séparez les deux corps gras pour assurer une bonne vue sur la région trachéale. Utilisez des rétractateurs pour maintenir la couche musculaire et exposer l’artère carotide. Si elle est présente, effectuer la dissection émoussée de la couche musculaire mince couvrant l’artère carotide.
- Utilisez des forceps incurvés pointus pour séparer l’artère carotide du nerf vague et de la veine jugulaire. Ainsi, la zone de bifurcation avec l’artère carotide interne et externe devrait être visible. Utilisez 0,9% de NaCl afin d’éviter la sécheresse des tissus pendant l’intervention chirurgicale.
4. Blessure par fil
- Placez une suture de soie de 7 cm de long 0/5 sous l’artère carotide, proximale à l’arc aortique. Faites une boucle ouverte, prête à être fermée à tout moment.
- Placez deux sutures de soie de 0/7 (chacune de 1,5 cm de long) autour de l’artère carotide externe : une boucle près du point de bifurcation et une boucle aussi distale que possible. Préparez-les en boucle ouverte, prêtes à être fermées à tout moment.
- Placer une suture de soie de 0/7 (1,5 cm de long) sous l’artère carotide interne. Préparez-le en boucle ouverte, prêt à être fermé à tout moment.
- Placez la table de souris avec la tête de la souris vers l’opérateur afin d’assurer un positionnement approprié pour l’insertion du fil de guidage pendant la dénudation (figure 1A).
- Sous la vue microscopique, arrêter le flux sanguin à travers l’artère carotide commune en tenant et tirant les extrémités de la suture de soie 0/5 avec des forceps hémostat.
- Immédiatement après la ligature commune de l’artère carotide, fermez les boucles de suture placées sur l’artère carotide interne et la suture distale sur l’artère carotide externe étroitement (figure 1B).
- Effectuer une petite incision (artériotomie, la moitié du diamètre du navire) distale à l’artère carotide externe, entre les deux boucles, à l’aide de petits ciseaux (Figure 1C). Si l’incision est trop grande, veuillez suivre les instructions de dépannage (voir la discussion).
- Utilisez des fils de guidage polis commercialement ou utilisez du personnel spécialisé interne pour polir les fils de guidage. Désinfectez le fil de guidage flexible poli de 14 pouces avec de l’alcool et humidifiez-le dans une gouttelette de 0,9 % de NaCl pour assurer une glissade appropriée dans le navire.
- Insérez le fil de guidage dans l’artère carotide commune par l’intermédiaire de l’artériotomie transversale de l’artère carotide externe (Figure 1D). Obtenez la dénude endothéliale en passant le fil de guidage le long du navire pendant la rotation. Répétez cette procédure trois fois. Maintenir la même amplitude du mouvement de rotation dans chaque souris pour augmenter la reproductibilité.
- Fermez fermement la boucle proximale de l’artère carotide externe. Restaurer le flux sanguin dans l’artère carotide en coupant la suture autour de l’artère commune et la suture autour de l’artère carotide interne.
5. Suture et récupération
- Retirez les rétractateurs et retournez la couche musculaire et les deux corps gras à la position physiologique.
- Fermez la peau avec trois sutures séparées 0/6, si des mesures échocardiographiques sont nécessaires. Si aucune imagerie n’est nécessaire, utilisez des clips métalliques pour fermer la peau.
- Posez la souris sur son côté gauche sous la lumière infrarouge jusqu’à ce qu’elle se réveille. Ne laissez pas un animal sans surveillance ni en compagnie d’autres animaux jusqu’à ce qu’il soit entièrement récupéré.
- Pour l’identification future, marquez la souris à l’aide du système local. Demandez à l’agent de protection des animaux de l’institution locale.
6. Analyse de la plaque athérosclérotique
- Anesthétiser les souris au point de fin d’heure à l’aide d’une injection intrapéritonéale de 100 mg/kg de kétamine par poids corporel et de 10 mg/kg de xylazine par poids corporel. Confirmer l’anesthésiation appropriée par le manque de réflexes et le mouvement de moustache.
- Effectuer l’exsanguination par ponction rétro-orbitale ou cardiaque et recueillir le sang pour une analyse plus approfondie2.
- Désinfecter la peau avec de la bétadine. Ouvrez la cavité thoracique et retirez l’auriculum droit du cœur. Perfuse phosphate tamponné solution par ventricule gauche pour enlever le sang restant du vaisseau, puis perfuse 4% PFA pour fixer le tissu.
- Si aucune fixation n’est requise, explanter l’artère carotide immédiatement après le lavage2,4,11. Effectuer des protocoles standards avec des analyses d’intérêt : incorporation de paraffine, cryosection, analyse de l’ARNm ou des protéines, etc.
- Pour les mesures morphométriques, explanter soigneusement l’artère carotide, y compris la bifurcation, avec une manipulation minimale, comme proximal à l’arc aortique à l’aide de forceps incurvés et de petits ciseaux.
- Incorporer l’artère carotide dans le bloc de paraffine à l’aide de protocoles d’intégration standard. Pour effectuer des sectionnements transversaux, placez l’artère carotide verticale sur la bifurcation. Couper 5 sections de série d’épaisseur de 5 μm à partir de la bifurcation et les recueillir toutes sur des lames histologiques enduites (figure 2A).
- Tacher toutes les10 e section en utilisant la coloration Movat pour mettre en évidence les laminas2,4,11. Après avoir recueilli des photos microscopiques de tous les vaisseaux (en utilisant un objectif 10X), mesurer le lumen, ainsi que la lamina interne et externe pour chaque section, à l’aide d’un logiciel spécial conçu2,4,11, comme le montre la figure 2B. Calculer la croissance intimale et les supports des navires.
- Analyser les cellules musculaires lisses et la teneur en macrophage, ou la récupération endothéliale dans les sections en série, en utilisant la coloration immunohistologique habituelle2 (Figure 2C).
Résultats
La procédure d’induction de plaque athérosclérotique prend 15 - 20 min et montre un taux de mortalité minimal, principalement dû au saignement se produisant pendant la procédure. Après la chirurgie, les souris récupèrent de l’anesthésie dans les 20 - 25 min. Aucune altération physique, telle que la paralysie, ou la perturbation d’alimentation n’a été observée après la chirurgie.
La blessure de fil induit une désadothelialization, imitant des lésions vasculaires après la dénudation de ballon ou l’implantation de stent. Immédiatement après la blessure, la paroi vasculaire dénudée sera recouverte d’une couche de thrombocytes, qui médiateur et favorise l’adhérence des monocytes12. Les cellules musculaires lisses activées des médias prolifèrent et migreront dans les espaces intimaux, formant le neointima. D’autres progéniteurs pour les cellules musculaires lisses migreront du sang (estimé à 40%) et contribuer à la croissance neointima. La formation de plaque se terminera après la re-endothélialisation complète, habituellement 4 semaines après la blessure de fil.
La formation de neointima peut être évaluée à l’aide de la coloration Movat. La taille de la plaque est calculée pour chaque diapositive à l’aide d’un logiciel tel qu’illustré à la figure 2B. La taille totale de la plaque (artère carotide gauche) peut varier entre 70 000 et 100 000 μm², tandis que la taille du vaisseau témoin (artère carotide droite) peut varier entre 7 000 et 8 000 μm². Ces valeurs dépendent en grande partie du chirurgien. Par conséquent, nous recommandons fortement d’utiliser le même chirurgien pendant les expériences pour la même étude.
La plaque développée ressemble à la resténose de stent, qui se compose principalement des cellules musculaires lisses proliférées et migrées des médias. La composition cellulaire déterminée par les procédures immunologiques de coloration montre que la teneur lisse des cellules musculaires est d’environ 30 à 40%, tandis que les macrophages se trouvent dans 15 - 25% de la neointima du vaisseau blessé. La ré-endothélialisation peut être mesurée après coloration pour un marqueur endothélial, et calculée comme le pourcentage de circonférence tachée sur toute la circonférence du lumen. Habituellement, la re-endothélialisation atteint 80 - 90% après 3 semaines, et devrait presque être terminée après 4 semaines (Figure 2C). Pour suivre la croissance de la plaque au cours de son développement, la même analyse peut être répétée pour chaque point de temps après le fil-blessure, en fonction de l’intérêt et du sujet étudié (voir le tableau 1).
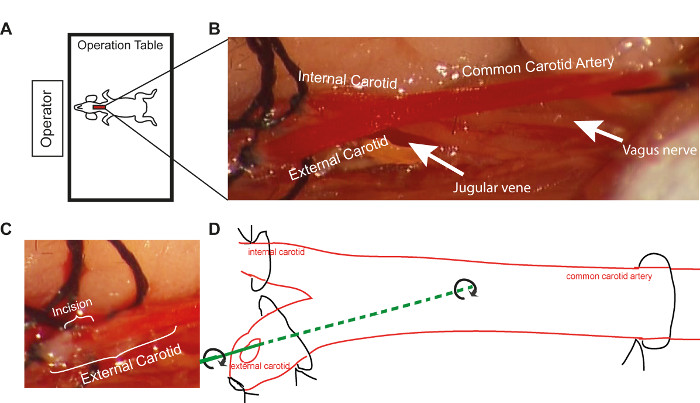
Figure 1. Représentation schématique de la procédure opératoire. (A) Le positionnement de la table d’opération vers l’opérateur pendant la procédure de lésion du fil(B) Vue élargie de l’artère carotide commune et de ses branches, telle qu’elle apparaît au microscope au grossissement 10X(C) La taille de l’incision dans l’artère carotide externe sous le microscope à grossification 10X(D) représentation schématique de la procédure de lésion filaire à l’aide du fil de 14 pouces. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
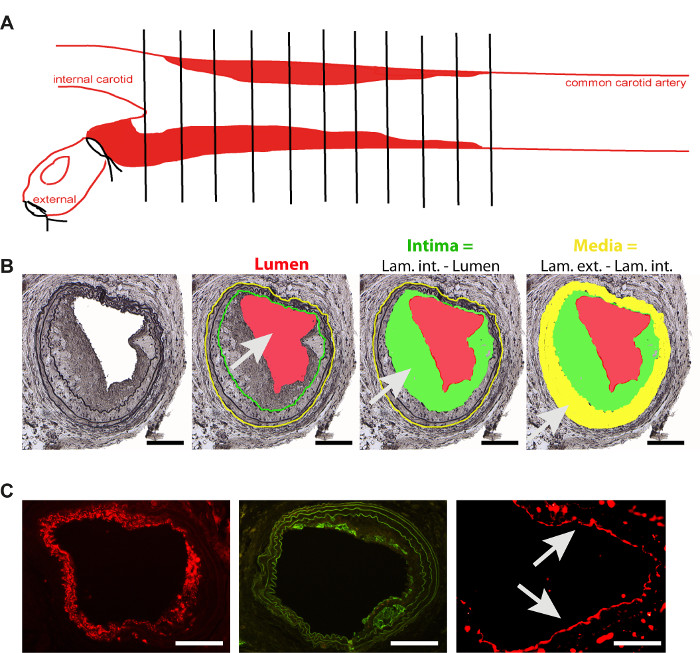
Figure 2. Analyse de la plaque de restenose. (A) Représentation schématique de l’analyse de la plaque dans l’artère carotide commune, 4 semaines après l’induction de lésion filaire(B) formation de Neointima 4 semaines après la lésion du fil et la représentation schématique des paramètres principaux utilisés pour l’analyse. Intima (zone verte) est la différence entre le lumen (rouge) et la lamina interna (ligne verte). Le média (zone jaune) est la différence entre la lamina externe (ligne jaune) et l’interna (ligne verte). Barre d’échelle 100 μm (C) Images représentatives de la coloration des principaux types de cellules impliqués dans la formation de néointima. Cellules musculaires lisses (actionnus musculaire lisse -rouge, barre d’échelle 100 μm), macrophages (Mac 2- vert, barre d’échelle 100 μm) et cellules endothéliales (CD31- rouge, flèches, barre d’échelle 50 μm). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Heure | Trombus | Plaque (μm²) |
Macrophages (% de Plaque) |
Cellules musculaires lisses (% de Plaque) |
Re-endothélialisation (% tour de lune) |
| 1 jour | Présent | 0 | 0 | 0 | 0 |
| 1 semaine | - | 30 000 | > 10 | < 50 | < 50 |
| 2 semaines | - | < 50 000 | > 10 | < 50 | > 50 |
| 3 semaines | - | 70 000 | 15-25 | 30-40 | 80-90 |
| 4 semaines | - | 70 000 – 100 000 | 15-25 | 30-40 | Complet |
Tableau 1. Développement de plaque dépendante du temps.
| Modèle | Animaux | Avantages | Désanvantages |
| Athérosclérose indigène induite par l’alimentation | Petit |
|
|
| Grand |
|
| |
| Dilatation de ballon | Petit |
|
|
| Grand |
|
| |
| Blessure de fil | Petit |
|
|
| Implantation de stent | Petit |
|
|
| Grand |
|
|
Tableau 2. Avantages et inconvénients des modèles existants de lésions artérielles.
Discussion
Dans cet article, nous fournissons des conseils utiles pour effectuer la procédure de blessure de fil, même par le personnel avec une expérience minimale dans les chirurgies animales. Il y a deux étapes critiques dans l’exécution de cette procédure : l’incision de l’artère carotide externe et l’insertion du fil. L’incision dans l’artère carotide externe doit être effectuée dans la mesure du possible de la bifurcation, afin d’assurer suffisamment de matériaux restants (Figure 1C). L’incision ne doit pas être trop grande, en raison du risque de coupe de l’ensemble du navire. La deuxième étape critique est le risque élevé de saignement pendant l’artériotomie et l’insertion du fil de guidage si le flux sanguin n’est pas efficacement interrompu. De plus, la dénuderation endothéliale pourrait ne pas avoir lieu ou une rupture artérielle est possible si le fil de guidage n’est pas correctement introduit dans le récipient de lumen. Pour éviter cela, la surface du fil de guidage doit être soigneusement polie avant l’opération.
Pour optimiser le protocole, la position de la table d’opération avec la tête de souris vers le chirurgien assure une meilleure vue, l’accessibilité et le contrôle pour la manipulation appropriée de fil de guidage. En outre, pour augmenter la reproductibilité, utilisez le même fil de guidage dans toutes les études. Comme la taille du fil ne change pas, il est important d’examiner et d’éliminer toutes les différences possibles entre les souris en utilisant le même sexe, l’âge et le même poids pour toutes les souris incluses dans une étude. Par la suite, la coloration Evans-Blue aidera le chirurgien à déterminer l’efficacité de la dénudation. L’existence d’équipements appropriés est une condition préalable au succès de la procédure. Un stéréomicroscope 10X est essentiel pour effectuer cette procédure. La bonne préparation du fil de guidage (par exemple le polir) est cruciale. Par conséquent, nous recommandons fortement que la préparation du fil de guidage soit effectuée par du personnel technique spécialisé, le cas échéant.
Il existe de nombreuses étapes de dépannage dans ce protocole. Si incising l’artère carotide externe près de la bifurcation, lier soigneusement l’externa, près de la bifurcation, de sorte qu’aucun saignement ne se produit. Pendant la coupe, l’artère carotide externe ne peut pas être vu. Par conséquent, considérez la bifurcation au niveau de la suture de soie. Recueillir les sections lorsque la suture de soie disparaît. Si l’incision dans l’artère carotide externe est trop grande et que le vaisseau est rompu, assurez-vous que le flux sanguin dans la communauté carotide et l’artère carotide interne est effectivement interrompu et essayez de trouver l’ouverture du vaisseau à l’aide de forceps. Après avoir introduit le fil de guidage et effectué la dénature, lier le navire près de la bifurcation. Pendant la coupe, commencer à recueillir lorsque la soie de la suture commence à disparaître. Si la rupture artérielle se produit pendant la dénudation avec le fil de guidage, vérifiez sous le microscope si le fil de guidage est correctement poli.
Malgré la similitude du modèle de lésions filaires avec les situations cliniques, de nombreux groupes se concentrent sur l’athérosclérose indigène chez les souris, ou ils choisissent des inductions invasives d’athérosclérose, telles que l’angioplastie de ballon chez les rats ou les lapins, en raison du manque de personnel formé qui peut effectuer de petites chirurgies animales. Malgré les avantages de l’utilisation de lapins/rats, par exemple pas besoin d’équipement miniaturisé, ni les modèles de rat ni les modèles de lapin n’offrent une variété de souches knock-out différentes, en termes d’étude des mécanismes moléculaires impliqués dans la croissance du néointima et la thrombose en stent.
Les modèles existants pour étudier la restenose en stent chez la souris sont difficiles, nécessitent des compétences chirurgicales élevées, et ont des risques élevés de complications telles que des saignements ou une paralysie. Par exemple, la blessure mécanique ou l’implantation de stent dans l’aorte thoracique par l’artère fémorale est accompagnée d’un taux de mortalité élevé (35%) en raison d’une paralysie de la jambe arrière ou d’un saignement13-15. Nous décrivons également l’implantation de stent dans l’artère carotide d’une souris16. La procédure est similaire; toutefois, le traitement des tissus pour analyse est compliqué et n’est pas disponible pour tous les laboratoires16. L’artère carotide est directement accessible, non seulement pour les procédures d’opération, mais aussi pour les méthodes d’imagerie existantes telles que l’imagerie par ultrasons. D’autres inductions de blessures dans les artères carotides chez les souris peuvent être faites à l’aide de dispositifs électriques17. Cette méthode est facile à exécuter et assure une reproductibilité élevée. Cependant, il provoque des blessures dans toutes les couches du navire, ce qui n’est pas identique à une blessure mécanique. Les applications de ballon ont des avantages, par exemple l’ajustement au diamètre du navire en conformité avec la pratique clinique et a une forte influence sur les résultats pathologiques. Même si les ballons de souris sont disponibles, ils sont très chers et donc, pas largement utilisé. Au lieu de cela, le fil-blessure est la méthode établie, imitant la sténose en stent.
La dénudation est exécutée sur la paroi artérielle normale, bien qu’avec un fond athérosclérotique. Par conséquent, la formation de neointima sera modérée par rapport à la situation clinique. Le nombre élevé de modèles précliniques démontre qu’aucun des modèles ne répond à tous les critères nécessaires pour découvrir l’ensemble des mécanismes cellulaires et moléculaires menant à la pathophysiologie chez l’homme (voir tableau 2).
Après avoir effectué la procédure de lésion filaire, d’autres analyses biologiques et moléculaires peuvent être effectuées pour identifier les cellules, les protéines, les ARNm, les microARN, les gènes ou d’autres biomarqueurs, qui peuvent être utilisés comme cibles thérapeutiques pour développer de nouvelles stratégies de traitement de l’athérosclérose, et en particulier pour la formation de néointimas après une lésion vasculaire. Si disponible, la croissance de la plaque peut être surveillée à l’aide d’ultrasons à haute fréquence ou d’autres techniques d’imagerie haute résolution. De plus, la maîtrise de cette technique donnerait à l’opérateur la possibilité d’adapter le protocole à d’autres modèles invasifs d’incitation à l’athérosclérose, tels que le placement du collier, la ligature partielle ou même l’implantation de stent.
Déclarations de divulgation
Il n’y a pas de divulgations par les auteurs.
Remerciements
Ce travail a été soutenu par le Centre interdisciplinaire de recherche clinique IZKF Aix-la-Chapelle (groupe de recherche junior à E.A.L.) au sein de la faculté de médecine de l’Université RWTH d’Aix-la-Chapelle. Nous remercions également Mme Roya Soltan pour son aide pour la coloration de l’immunohistorique.
matériels
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Olympus | SZ/X9 | - |
| Forceps | FST, Germany | 91197-00 | standard tip curved 0,17 mm |
| Hemostat forceps | FST, Germany | 13007-12 | curved |
| Scissors | FST, Germany | 91460-11 | Straight |
| Vannas scissor | Aesculap, Germany | OC 498 R | - |
| Retractors | FST, Germany | 18200-10 | 2.5 mm wide |
| Retractors | FST, Germany | 18200-11 | 5 mm wide |
| Ketamine 10% | CEVA, Germany | - | - |
| Xylazine 2% | Medistar, Germany | - | - |
| Bepanthene eye and nose cream | Bayer, Germany | - | - |
| Silicon tube | IFK Isofluor, Germany | custom-made product | diameter 500 µm, |
| section thickness 100 µm, | |||
| polytetrafluorethylene catheter | |||
| PROLENE Suture 6/0 | ETHICON | 8707H | polypropylene monofilament suture, unresorbable, needle CC-1, 13 mm, 3/8 Circle |
| 7/0 Silk | Seraflex | IC 1005171Z | - |
| Michel Suture Clips | FST, Germany | 12040-01 | - |
| Clip Applying Forcep | FST, Germany | 12018-12 | - |
| 14”Wire for Catheter | Abbot | 1000462H | Use 10 cm from stiff part and equalize the ends |
| Mice | Charles River | Apolipoprotein E -/- mice with C57/Bl6 background | - |
Références
- Simsekyilmaz, S., Liehn, E. A., Militaru, C., Vogt, F. Progress in interventional cardiology: challenges for the future. Thromb Haemost. 113 (3), 464-472 (2015).
- Kubo, N., McCurdy, S., Boisvert, W. A. Defective Fas Expression on Bone Marrow Derived Cells Alters Atherosclerotic Plaque Morphology in Hyperlipidemic Mice. Discoveries. 3 (1), e37 (2015).
- Saffarzadeh, M., et al. Characterization of rapid neutrophil extracellular trap formation and its cooperation with phagocytosis in human neutrophils. Discoveries. 2 (2), e19 (2014).
- Lindner, V., Fingerle, J., Reidy, M. A. Mouse model of arterial injury. Circ Res. 73 (5), 792-796 (1993).
- Schwartz, R. S., et al. Preclinical evaluation of drug-eluting stents for peripheral applications: recommendations from an expert consensus group. Circulation. 110 (16), 2498-2505 (2004).
- Schwartz, R. S., et al. Restenosis and the proportional neointimal response to coronary artery injury: results in a porcine model. J Am Coll Cardiol. 19 (2), 267-274 (1992).
- Curaj, A., et al. Noninvasive molecular ultrasound monitoring of vessel healing after intravascular surgical procedures in a preclinical setup. Arterioscler Thromb Vasc Biol. 35 (6), 1366-1373 (2015).
- Liehn, E. A., Schober, A., Weber, C. Blockade of keratinocyte-derived chemokine inhibits endothelial recovery and enhances plaque formation after arterial injury in ApoE-deficient mice. Arterioscler Thromb Vasc Biol. 24 (10), 1891-1896 (2004).
- Liehn, E. A., Zernecke, A., Postea, O., Weber, C. Chemokines: inflammatory mediators of atherosclerosis. Arch Physiol Biochem. 112 (4-5), 229-238 (2006).
- Simsekyilmaz, S., et al. Role of extracellular RNA in atherosclerotic plaque formation in mice. Circulation. 129 (5), 598-606 (2014).
- Wu, Z., et al. Rhodamine-loaded intercellular adhesion molecule-1-targeted microbubbles for dual-modality imaging under controlled shear stresses. Circ Cardiovasc Imaging. 6 (6), 974-981 (2013).
- Schober, A., et al. Crucial role of the CCL2/CCR2 axis in neointimal hyperplasia after arterial injury in hyperlipidemic mice involves early monocyte recruitment and CCL2 presentation on platelets. Circ Res. 95 (11), 1125-1133 (2004).
- Ali, Z. A., et al. Increased in-stent stenosis in ApoE knockout mice: insights from a novel mouse model of balloon angioplasty and stenting. Arterioscler Thromb Vasc Biol. 27 (4), 833-840 (2007).
- Chamberlain, J., et al. A novel mouse model of in situ stenting. Cardiovasc Res. 85, 38-44 (2010).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Simsekyilmaz, S., et al. A murine model of stent implantation in the carotid artery for the study of restenosis. J Vis Exp. , e50233 (2013).
- Schroder, K., et al. NADPH oxidase Nox2 is required for hypoxia-induced mobilization of endothelial progenitor cells. Circ Res. 105 (6), 537-544 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon