Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
High Throughput, en temps réel, à double lecture Test de intracellulaires activité antimicrobienne et eucaryotes cytotoxicité cellulaire
Dans cet article
Résumé
A high throughput, real-time assay was developed to simultaneously identify (1) eukaryotic cell-penetrant antimicrobials targeting an intracellular bacterial pathogen, and (2) assess eukaryotic cell cytotoxicity. A variation on the same technology was thereafter combined with digital dispensing technology to enable facile, high-resolution, dose-response, and two- and three-dimensional synergy studies.
Résumé
Les mesures traditionnelles d'activité antimicrobienne intracellulaire et la cytotoxicité des cellules eucaryotes reposent sur des tests finaux. De tels tests finaux nécessitent plusieurs étapes expérimentales supplémentaires avant une lecture, telles que la lyse cellulaire, la formation de colonies de détermination de l'unité, ou l'addition de réactifs. Lorsque vous effectuez des milliers de tests, par exemple, au cours de criblage à haut-débit, l'effort aval requis pour ces types d'essais est considérable. Par conséquent, pour faciliter la découverte antimicrobienne à haut débit, nous avons développé un essai en temps réel pour identifier simultanément des inhibiteurs de la croissance bactérienne intracellulaire et d'évaluer la cytotoxicité des cellules eucaryotes. Plus précisément, la détection de la croissance bactérienne intracellulaire en temps réel a été activé par le marquage des souches bactériennes de criblage soit d' un opéron bactérien lux (1 essai de génération st) ou reporters de protéines fluorescentes (2 ème génération, le dosage orthogonales). Une membrane cellulaire imperméant, un colorant de liaison aux acides non toxiques, Nucleica également été ajouté au cours de l'infection initiale des macrophages. Ces colorants sont exclues des cellules viables. Cependant, les cellules hôtes non viables perdent l'intégrité de la membrane permettant l'entrée et le marquage fluorescent de l'ADN nucléaire (acide désoxyribonucléique). Notamment, la liaison d'ADN est associée à une forte augmentation du rendement quantique de fluorescence qui fournit une lecture à base de solution de la mort de la cellule hôte. Nous avons utilisé ce dosage combiné pour réaliser un écran à haut rendement en format microplaque, et pour évaluer la croissance intracellulaire et la cytotoxicité par microscopie. En particulier, les antimicrobiens peuvent présenter une synergie dans laquelle l'effet combiné de deux ou plusieurs agents antimicrobiens, lorsqu'il est appliqué en même temps est supérieur lorsqu'ils sont appliqués séparément. Test de synergie in vitro contre les pathogènes intracellulaires est normalement une tâche prodigieuse permutations combinatoires d'antibiotiques à différentes concentrations doivent être évaluées. Cependant, nous avons trouvé que notre analyse en temps réel combinée avec automatisé, distribution numérique technologie permitted tests de synergie facile. L' utilisation de ces approches, nous avons pu étudier systématiquement l' action d'un grand nombre des seuls antimicrobiens et en combinaison contre le pathogène intracellulaire, Legionella pneumophila.
Introduction
Pathogens qui poussent ou résident temporairement dans des compartiments intracellulaires sont difficiles à éradiquer thérapeutique. OBLIGER ou relativement obliger les agents pathogènes intracellulaires tels que Legionella pneumophila, Coxiella burnetii, Brucella spp. , Francisella tularensis, et Mycobacterium spp. nécessitent souvent des cours de thérapie antimicrobienne prolongée pour la guérison qui peut aller de quelques mois à voire des années. En outre, les agents pathogènes extracellulaires peuvent transitoirement occuper des niches intracellulaires et de cette façon échapper à un dégagement de cours normales de traitement antimicrobien et de sortir plus tard pour commencer de nouveaux cycles d'infection virulente. Staphylococcus aureus 1 et uropathogènes entérobactéries 2,3 infections sont deux exemples de plus en plus reconnus. Par conséquent, un objectif fondamental de découverte de médicament consiste à identifier de nouveaux agents antimicrobiens qui pénètrent dans les compartiments intracellulaires. Le traitement optimal pour éradiquer rapidementorganismes intracellulaires et de prévenir le développement de la résistance aux antimicrobiens par l'exposition sous-inhibitrice est particulièrement souhaitable.
À cette fin, nous avons développé une technologie de criblage à haut débit pour identifier les antimicrobiens intracellulaires-ressuage ciblant la croissance intracellulaire de l'agent pathogène du modèle, Legionella pneumophila. 4 observations cliniques antérieures indiquent que les tests de sensibilité aux antimicrobiens norme n'a pas prédire avec précision in vivo l' efficacité thérapeutique contre cet organisme. 5 Plus précisément, ce fut parce que les principales catégories d'antimicrobiens tels que les ß-lactamines et aminosides, bien que très efficace contre axéniquement cultivé Legionella, ne pénètrent pas suffisamment dans les compartiments intracellulaires où Legionella réside. 5,6 preuves plus tard suggéré que les essais de croissance intracellulaire techniquement plus complexes de manière efficace prédit l' efficacité clinique. 7 Malheureusement, ces essais ont été extrêmement laborieux points d'extrémité des essais, ce qui nécessite des macrophages infectés, traités avec des antimicrobiens, être lysées à différents moments de points pour former des colonies unité dénombrement. De tels essais ne sont pas pratiques à faire sur une grande échelle et ne conviennent pas à haut débit de découverte de médicaments.
Par conséquent, nous avons développé la technologie pour la détermination en temps réel de la croissance bactérienne intracellulaire. 6 Cela a été réalisé par l' utilisation d'une souche bactérienne modifiée par l' intégration soit une luciférase bactérienne opéron 8 (dosage de première génération a été décrite précédemment) , 4 ou protéine fluorescente 9 reporters (deuxième génération, le dosage orthogonaux, décrit ici) dans le chromosome bactérien. De cette façon, luminescent ou signal fluorescent fournit un substitut, la lecture en temps réel du nombre de bactéries.
Cependant, ces attributs ne traitent pas un facteur de confusion majeure dans infectio intracellulairen essais, les effets hors-cible sur les cellules hôtes. En particulier, la mort de la cellule hôte limite intrinsèquement la croissance intracellulaire et conduit à l'identification de faux positifs de l'effet antimicrobien. Comme de nombreux composés dans les bibliothèques de criblage sont cellules eucaryotes toxiques, ces faux positifs submergent vrais antimicrobiens, ce qui nécessite un grand nombre de suivi, des tests de cytotoxicité point final pour la résolution.
Ainsi, il était d'un grand intérêt pour être en mesure d'évaluer la viabilité des cellules eucaryotes et la croissance intracellulaire simultanément. En particulier, une caractéristique des cellules eucaryotes non viables est la perte d'intégrité de la membrane cellulaire. Les sondes qui testent la perméabilité de la membrane cellulaire peuvent donc être utilisés pour évaluer la viabilité cellulaire. Nous avons précédemment caractérisé l'aptitude d'une série de cellules putativement membrane, imperméants, des colorants de liaison à l'ADN fluorescent d'accès et de souiller l'ADN nucléaire des cellules mortes. 4 sur la liaison de l' ADN nucléaire, ces colorants présentent une forte augmentation Quantum rendement de fluorescence entraînant une augmentation de signal sur la fluorescence de la solution de fond. Par conséquent, ces colorants ont fourni une lecture quantitative de la mort cellulaire eucaryote. 4 Notamment, nous avons constaté que plusieurs étaient non toxiques eux - mêmes pendant la co-incubation prolongée avec les macrophages J774. Lorsqu'il est ajouté au cours de l'infection initiale, ils ont fourni en temps réel, la lecture de fluorescence de la mort cellulaire eucaryote qui peut être mesurée par un fluorimètre à microplaques ou observée au microscope.
Par conséquent, en combinant l'utilisation d'un journaliste bactérienne et non toxique, membrane-impermeant, colorants de liaison d'ADN, nous avons pu mettre au point un non-destructif, simple essai, en temps réel pour mesurer à la fois la charge bactérienne et eucaryote cytotoxicité cellulaire simultanément. Ce test nous a permis d'écran dans 384 puits format de plaque ~ 10.000 bioactifs connus, y compris ~ 250 antimicrobiens et> 240.000 petites molécules ayant une activité fonctionnellement non caractérisée par la capacité à inhiber la croissance intracellulaire deLegionella pneumophila, tandis que dans le même temps , la génération de données de cytotoxicité des cellules eucaryotes pour chaque composé. 6 Notre analyse des antimicrobiens connus contre la croissance intracellulaire de Legionella était l'exploration la plus complète de ce type à ce jour. 6
Sur la base de l'efficacité de notre format d'essai, nous avons également exploré ensuite les effets synergiques potentiels des antimicrobiens connus lorsqu'ils sont utilisés en combinaison. L'un des essais de synergie les plus courants, le dosage que l'on appelle damiers, est réalisée en évaluant la manière standard les effets combinatoires des dilutions en série de deux en deux de deux ou plusieurs agents antimicrobiens. 10 Dans ces essais, la synergie est définie par l'observation d' un effet plus important lorsque deux ou plusieurs agents antimicrobiens sont appliqués en même temps que la somme des effets de chacun appliqués séparément. Il convient de noter, jusqu'à présent, uniquement axé et les tests de synergie sélective a été réalisée contre intracellulaire Legionella pneumophila à cause du grand effort impliqué dans les essais finaux traditionnels multiplié par les permutations combinatoires nécessaires.
Pour faciliter les tests de synergie, nous avons fait usage de notre temps réel la croissance intracellulaire / test de cytotoxicité eucaryote en combinaison avec la technologie de distribution numérique automatisé 6. Cette automatisation nous a permis de distribuer des dilutions en série des composés dissous dans du DMSO ou de la solution aqueuse seuls ou en combinaison dans un format à 384 puits. 11 En outre, cette technologie de traitement des liquides robuste nous a permis d'effectuer facilement une résolution plus élevée, la racine carrée de deux enfants (plutôt que la norme, une résolution inférieure, doublant) combinaisons de dilution pour atteindre des niveaux plus élevés de spécificité dans nos deux dimensions, checkerboard synergie une analyse. Cette résolution a été particulièrement précieuse pour répondre aux préoccupations en matière de synergie sur les reproductibilité lors de l' utilisation double série de dilutions 12. Enfin, notre analyse était quantitative et aussi thervant gradations d'inhibition mesurée. En conséquence, l'essai a capturé la totalité de l'information d'inhibition, exprimables dans isocontour isobologrammes dans lequel isocontours relier les concentrations combinatoires avec des niveaux similaires d'inhibition de la croissance. 6 Cette stratégie a permis la visualisation de tracé des courbes dose-réponse combinatoires. Pour illustrer notre méthodologie, nous décrivons notre protocole pour effectuer ces tests et montrer des résultats représentatifs.
Protocole
1. Temps réel intracellulaires croissance et cellules eucaryotes Essai de cytotoxicité
- Préparation de cellules hôtes (Cellules J774A.1)
- Les cellules de type macrophage Culture J774A.1 Mus en suspension dans RPMI 1640 avec 9% de sérum de veau fer complété. Un premier passage dans des flacons de culture tissulaire. Après que les cellules sont devenues confluentes dans 75 cm 2 flacon de culture tissulaire dans 15 ml de milieu, divisé par grattage et de dilution à 65 ml avec le même type de support, dont 15 ml retourne dans le flacon de culture tissulaire et 50 ml est transféré à un 250 ml bactérienne flacon shaker.
- Pour la mise à l'échelle, la culture en suspension dans 250 ml et / ou 1000 flacons bactériens ml remplie à un cinquième du volume avec un milieu de culture tissulaire. Aérer en réglant la vitesse de rotation à environ 120 tours par minute. Pour une croissance constante, incuber à% exactement 5 CO 2 et 37 ° C.
- Récolte des cellules quand ils atteignent une densité dans la gamme de 2,5 x 10 6 cellules/ ml à 5 x 10 6 cellules / ml. Assurer le pourcentage de cellules mortes (le plus facilement dosée par coloration au bleu trypan) ne dépasse pas 25%, comme les cellules mortes vont augmenter le bruit de fond dans les tests de cytotoxicité.
- Plaque en blanc, culture de tissus traitée, 384 puits des microplaques à 5 x 10 4 cellules J774A.1 dans 30 ul de milieu de culture tissulaire par puits. Incuber microplaques pendant une nuit pour atteindre 90% de confluence le jour de l'expérience.
- Préparation luminescent ou fluorescent Legionella pneumophila
- Passage L. pneumophila (LP02 :: flaA :: lux 8) bactéries sur un milieu approprié, à savoir, tamponnée extrait du charbon de levure (BCYE) moyenne. Si vous utilisez une souche auxotrophe de thymidine, compléter le milieu avec 100 pg / ml de thymidine. Préparer des taches de bactéries pour des expériences par des organismes d'étalement en couche épaisse sur une nouvelle plaque de BCYE et l'incubation d'une journée (si d'un passage de la plaque précédente) ou deux à trois jours (si du stock congelé) pour obtenir confluentescroissance.
- Préparer des plaques de BCYE en dissolvant 10 g d' extrait de levure, 10 g de N - (2-acétamido) -2-aminoéthanesulfonique, 0,35 g de K 2 HPO 4 et 1 g de potassium monobasique α-cétoglutarate dans 950 ml d' eau déminéralisée. Ajuster le pH à 6,9 avec de l'hydroxyde de potassium (≥ 2,5 ml d'une solution de 11,9 molaires).
- Ajouter 15 g d'agar et 2 g de charbon activé; et porter à 1 L volume final. Ajouter une barre d'agitation magnétique et autoclave. milieu frais à 55 ° C et ajouter des solutions stérilisées par filtration contenant 0,4 g de L-cystéine et 0,42 g d'ammonium fer (III), le citrate dissous dans de l'eau déminéralisée. Utilisez l'aimant plaque d'agitation pour mélanger avant de verser des boîtes de Pétri.
- Pour les essais de L. pneumophila dans la croissance du milieu de croissance axénique, préparer un bouillon d'extrait ACES-levure (AYE) en combinant tous les réactifs chimiques utilisés pour BCYE sauf pour le charbon de bois et d' agar. Filtre stériliser et utiliser immédiatement ou congeler pour des expériences ultérieures.
- Remettre en suspension dans les organismes SAMe milieu de culture de tissu utilisé pour les cellules J774A.1 avec 100 pg / ml de thymidine complémentation selon le cas.
- Passage L. pneumophila (LP02 :: flaA :: lux 8) bactéries sur un milieu approprié, à savoir, tamponnée extrait du charbon de levure (BCYE) moyenne. Si vous utilisez une souche auxotrophe de thymidine, compléter le milieu avec 100 pg / ml de thymidine. Préparer des taches de bactéries pour des expériences par des organismes d'étalement en couche épaisse sur une nouvelle plaque de BCYE et l'incubation d'une journée (si d'un passage de la plaque précédente) ou deux à trois jours (si du stock congelé) pour obtenir confluentescroissance.
- infection Macrophage
- Ajouter des composés d'essai d'intérêt (criblage de composés, ainsi que des contrôles positifs et négatifs pour l'inhibition de la croissance bactérienne et la lyse des cellules eucaryotes). De préférence, on dissout les solutions mères à ≥500x dans du DMSO (diméthylsulfoxyde) ou une solution aqueuse pour permettre une dilution suffisante du véhicule.
- Bien que les solutions d'achat d'actions peuvent être conservés congelés, éviter les cycles de gel-dégel pour les composés labiles et antimicrobien.
- Diluer les bactéries luminescentes à une cible de 2,5 x 10 6 UFC (unité formant colonie) / m et des bactéries marqué par un rapporteur fluorescent à 1,0 x 10 7 UFC / ml dans un milieu de culture tissulaire et ajouter non toxique, membrane imperméant aux acides nucléiques appropriés un colorant de liaison à 2,5x concentration analytique finale.
- Ajouter 20 pi de mélange pour chaque culture J774A.1 bien, le volume d'essai final50 ul, la concentration bactérienne finale 1 x 10 6 UFC / ml (lux opéron reporter) ou 4 x 10 10 6 UFC / ml (fluorescent reporter de la protéine).
- Incuber à 37 ° C pendant 1-3 jours dans 5% de CO2 à 100% d' humidité relative pour éviter les effets de bord par évaporation.
- Ajouter des composés d'essai d'intérêt (criblage de composés, ainsi que des contrôles positifs et négatifs pour l'inhibition de la croissance bactérienne et la lyse des cellules eucaryotes). De préférence, on dissout les solutions mères à ≥500x dans du DMSO (diméthylsulfoxyde) ou une solution aqueuse pour permettre une dilution suffisante du véhicule.
- Assay Readout
- Lire la croissance bactérienne et la toxicité des cellules eucaryotes sur un luminomètre de microplaques et fluorimètre selon le cas pour les journalistes utilisé.
- Pour éviter les effets de bord associé à la température, thermiquement équilibrer microplaques avant luminescence lecture par le placement dans une seule couche sur un banc de laboratoire avec des couvercles entrebâillée pendant environ 20 min (ou dans une enceinte de sécurité biologique avec des couvercles off pendant environ 10 min).
- Retour microplaques à incubateur si la lecture en temps réel à des points de temps plus tard, est souhaitée.
- Lire la croissance bactérienne et la toxicité des cellules eucaryotes sur un luminomètre de microplaques et fluorimètre selon le cas pour les journalistes utilisé.
Analyse 2. Données
- Normaliser les données à con positive et négativecommandes pour calculer pour cent ou pliez-inhibition de la croissance bactérienne intracellulaire et la cytotoxicité pour cent pour les cellules eucaryotes.
- Pour évaluer dosage robustesse, calculer la séparation statistique entre les contrôles positifs et négatifs à la fois pour l' inhibition de la croissance bactérienne et la cytotoxicité à l' aide du facteur Z (Z ') l' analyse dans laquelle Z' = 1 - 3 (σ p + σ n) / | u p + u n |. Dans cette équation, σ σ p et n sont les écarts - types pour les puits témoins positifs et négatifs, respectivement; μ p et u n sont les valeurs moyennes des puits témoins positifs et négatifs, respectivement.
- Pour les essais de criblage à haut débit, calculer z-scores standard (ou autre alternative, des mesures statistiques quantitatives) pour évaluer les effets des composés d'essai d'intérêt. Vous pouvez également calculer un pli-simple réduction ou log-fold réduction comme potentiellement physiologiquement plus pertinent mesure de l'effet grandeur pour les bactéries répliquant géométriquement.
3. Simple et multi-dimensionnelle (c. -à- Synergy) dose-réponse Test et données Interprétation
- Préparer les macrophages et les bactéries comme décrit dans la section 1 du protocole.
- Juste avant l'infection ou l' incubation axénique, ajouter des antimicrobiens d'intérêt expérimental dans une série, doublant la série de dilution, dans le but de spanning sur le haut de gamme une concentration qui élimine complètement la croissance (ie, la concentration ou MIC minimale inhibitrice) et sur le bas mettre fin à une concentration qui ne montre aucune activité évidente.
- Utilisez un système de manipulation de liquide automatisé pour faciliter seule dose-réponse et la configuration de test de synergie combinatoire à travers, plus direct automatisé de dilutions antimicrobiennes selon le protocole du fabricant.
- Envisager l'utilisation de dilutions sous-doublement, par exemple,841 / 54841eq1.jpg "/> - pliez série de dilution, et le dosage réplique pour augmenter la précision et la reproductibilité des données.
- Pour l' infection des macrophages, diluer les bactéries luminescentes pour cibler de 2,5 x 10 6 CFU (colonie unité formant) / ml dans un milieu de culture de tissus. Ajouter 20 pi de mélange à chaque culture de J774A.1 bien, volume final d'essai de 50 pi, la concentration bactérienne finale 1 x 10 6 UFC / ml; et incuber à 37 ° C dans 5% de CO2 à 100% d' humidité relative.
- Pour les essais de croissance axénique, on dilue les bactéries luminescentes à une concentration finale de 1 x 10 6 UFC / ml dans un milieu AYE, ajouter 50 ul à chaque puits d'une plaque à 384 puits et incuber à 37 ° C dans 5% de CO 2 à 100% d'humidité relative.
- Calculer l'indice de concentration d'inhibiteur fractionnaire pour des combinaisons antimicrobiennes qui inhibent la croissance des bactéries. Pour chaque médicament dans la combinaison (a, b,.. N), qui se traduit par une inhibition totale ou> 99% des bactéries groissance, calculer la concentration inhibitrice fractionnelle individuelle (FIC a, b, n...) de la manière suivante: FIC A = la concentration du composé "a" divisée par la concentration inhibitrice minimale de "a" par lui - même. . En utilisant la même formule, calculer FIC b, etc. Ensuite , calculer l'indice FIC combinatoire ou
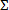 FIC = FIC a + b + FIC. . .FIC N pour chaque combinaison inhibitrice.
FIC = FIC a + b + FIC. . .FIC N pour chaque combinaison inhibitrice. - Utilisez l'index combinatoire qui dévie le plus éloigné de 1,0 pour évaluer la synergie. Considérons une coupure de ≤0.5 comme une indication prudente d'un effet synergique et ≥4, un effet antagoniste. 12
- Terrain isobologrammes, isocontour isobologrammes, et / ou isosurface isobologrammes 6 représentations graphiques comme alternatives d'effets combinatoires.
Résultats
essai de croissance intracellulaire microplaque
Figure 1 schématise les étapes d'essai. Les étapes automatisées indiquées peuvent être effectuées manuellement. Cependant, le débit est grandement facilité l'utilisation de systèmes de manipulation de liquides.
La figure 2 montre des résultats représentatifs d'u...
Discussion
Nous décrivons des tests en temps réel pour la détection simultanée de la croissance bactérienne intracellulaire et la cytotoxicité des cellules hôtes. Il y a plusieurs étapes critiques dans le protocole. D'abord, pour les performances du test robuste, il doit y avoir une séparation spectrale suffisante entre les lectures bactériennes et cytotoxicité. Une telle séparation est intrinsèque des combinaisons de reporters opéron luciférase et des colorants de liaison à l'ADN fluorescents. Cependant, s...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
La recherche rapportée dans ce manuscrit a été soutenu par l'Institut national des allergies et des maladies infectieuses des Instituts nationaux de la santé sous le numéro d'attribution R01AI099122 à JEK Le contenu est uniquement la responsabilité des auteurs et ne représentent pas nécessairement les vues officielles des National Institutes of Santé. Nous tenons à remercier Jennifer Smith, David Wrobel, Su Chiang, Doug Flood, Sean Johnston, Jennifer Nale, Stewart Rudnicki, Paul Yan, Richard Siu, et Rachel Warden de la Facilité de dépistage BICE-Longwood et / ou le Laboratoire national de dépistage pour les nouveaux centres régionaux d'excellence en Angleterre biodéfense et les maladies infectieuses émergentes (pris en charge par U54AI057159) pour leur aide dans le développement et la performance des essais de criblage à haut débit. Nous tenons également à remercier Kenneth P. Smith pour leurs commentaires utiles sur le manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| J774A.1 cells | American Type Culture Collection | TIB-67 | Host cell |
| ACES | Sigma-Aldrich | A9758 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Yeast extract, ultrafiltered | Becton-Dickinson/Difco | 210929 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; lower grades may cause impaired growth and/or alter sensitivity of Legionella to growth inhibitors |
| Alpha-ketoglutaric acid, monopotassium salt | Sigma-Aldrich | K2000 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Sodium pyruvate | Sigma-Aldrich | P5280 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Potassium phosphate, dibasic | Thermo Fisher Scientific | P288-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| L-cysteine | Sigma-Aldrich | C-7755 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Ammonium iron(III) citrate | Sigma-Aldrich | F5879 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; ferric pyrophosphate may be used instead but is more difficult to weigh accurately |
| Potassium hydroxide solution, concentrated | Thermo Fisher Scientific | SP236-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Deonized water | N/A | N/A | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Thymidine (tissue culture grade) | Sigma-Aldrich | T1895 | For supplementing both RPMI 1640 and buffered yeast extract agar/medium — lower grade thymidine may be used for the latter, but may cause impaired cell growth and/or cell death in RPMI 1640 |
| RPMI 1640, standard formulation | Corning via Thermo Fisher Scientific | 10-040-CV | For growing J774A.1 cells prior to plating; includes 2 mM L-glutamine |
| RPMI 1640 lacking phenol red | Corning via Thermo Fisher Scientific | 17-105-CV | For plating J774A.1 cells in 384 well dishes (not suitable for growth prior to plating); also lacks L-glutamine — supplement to 2 mM before use |
| L-glutamine, 200 mM in 0.85% NaCl (tissue culture grade) | HyClone via Thermo Fisher Scientific | SH30034.02 | For supplementing RPMI 1640 lacking L-glutamine, to 2 mM final concentration |
| Iron-supplemented calf serum | Gemini Bioproducts | 100-510 | For supplementing RPMI 1640, to 9.1% final concentration |
| Trypan Blue solution | Sigma-Aldrich | T8154 | For staining for J774A.1 cell death determination while counting cell density |
| SYTOX Green, 5 mM solution in DMSO | Thermo Fisher Scientific | S7020 | For staining for J774A.1 cell death determination by fluorescence reading or epifluorescence microscopy (in conjunction with orange-red or far red fluorescent bacteria). Use at 125 nM final concentration. |
| Cell culture incubator | Thermo Fisher Scientific | 13-255-26 | For incubation of J774A.1 cells (both before and after infection); can also be used for incubation of bacteria, or a standard atmosphere incubator can be used instead) |
| Orbital shaker | BellCo Glass | 7744-01010 | For shaking incubation of J774A.1 cells before infection; fits inside cell culture incubator; includes shaker base 7744-01000 and tray 7740-01010 (these are also available separately) |
| Shaker flasks (250 ml) | ChemGlass Life Sciences | CLS-2038-04 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (250 ml) | BellCo Glass | 7744-16250 | For shaking incubation of J774A.1 cells before infection |
| Shaker flasks (1,000 ml) | ChemGlass Life Sciences | CLS-2038-07 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (1,000 ml) | BellCo Glass | 7744-16100 | For shaking incubation of J774A.1 cells before infection |
| Sponge foam caps for flasks (250 ml-1,000 ml) | ChemGlass Life Sciences | CLS-1490-038 | For shaking incubation of J774A.1 cells before infection; reduces risk of contamination relative to standard metal caps |
| MultiDrop Combi programmable multichannel peristaltic pump | Thermo Fisher Scientific | 5840300 | For dispensing J774A.1 cells, medium, and bacterial suspension containing fluorophores to large numbers of 384 well dishes |
| Combi standard bore manifold | Thermo Fisher Scientific | 24072670 | Default predispense volume of 20 μl is insufficient to compensate for settling — increase to 80 μl |
| White 384 well dishes treated for tissue culture | Corning | 3570 | For reading luminescence and fluorescence; Greiner catalog # 781080 also tested successfully |
| DMSO (tissue culture grade, in sealed ampoules) | Sigma-Aldrich | D2650 | For dissolving positive control and test compounds |
| Azithromycin | Sigma-Aldrich | PHR1088 | Antibiotic positive control |
| Saponin (from Quillaja bark) | Sigma-Aldrich | S-4521 | Cytoxicity positive control |
| Multichannel pipettor | Thermo Fisher Scientific | Finnpipette | For transfer of fixed amounts of positive control compounds; pipettor must have digital dispensing with detents to enable repetitive fixed volume dispensing |
| Epson pin transfer robot | Epson/ICCB-L | (Custom equipment) | For transfer of fixed amounts of test compounds from library arrays |
| D300 digital dispensing system | Hewlett-Packard via Tecan | D300 | For transfer of variable amounts of test compounds ranging from 11 picoliters to 10 µl |
| T8+ cartridges for D300 digital dispensing system | Hewlett-Packard via Tecan | T8+ | For dispensing test compounds |
| Epifluorescence microscope with computer-connected digital camera | Nikon | Ti | For live cell imaging; any standard fluorescent microscope can substitute, with phase contrast or DIC optics, capable of imaging green (fluorescein), orange-red to red (Texas Red), and far-red (Cy5) fluorescence, with 100X oil objective for highest resolution |
| Glass-bottom tissue culture dishes | MatTek Corporation | P35G-1.5-20-C | For live cell imaging. Dishes such as the MatTek allow microscopic visualization at 600X or 1,000X magnification through use of an inverted epifluorescent or confocal microscope. These specific dishes are 3.5 cm nominal diameter, 3.3 cm inside diameter, with 20 mm diameter #1.5 thickness cover slips inserted into the bottoms. |
| Photoshop CS6 | Adobe | Adobe photoshop or similar programs can be used to pseudocolor and merge light microscopic and fluorescent images. | |
| Mathematica 10 | Wolfam | For generation of two-dimensioonal isocontour isobolograms and three-dimensional surface isobolograms. |
Références
- Garzoni, C., Kelley, W. L. Staphylococcus aureus: new evidence for intracellular persistence. Trends Microbiol. 17 (2), 59-65 (2009).
- Rosen, D. A., et al. Utilization of an intracellular bacterial community pathway in Klebsiella pneumoniae urinary tract infection and the effects of FimK on type 1 pilus expression. Infect Immun. 76 (7), 3337-3345 (2008).
- Blango, M. G., Mulvey, M. A. Persistence of uropathogenic Escherichia coli in the face of multiple antibiotics. Antimicrob Agents Chemother. 54 (5), 1855-1863 (2010).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay Drug Dev Technol. 12 (4), 219-228 (2014).
- Edelstein, P. H. Antimicrobial chemotherapy for legionnaires' disease: a review. Clin Infect Dis. 21 Suppl 3, S265-S276 (1995).
- Chiaraviglio, L., Kirby, J. E. High-Throughput Intracellular Antimicrobial Susceptibility Testing of Legionella pneumophila. Antimicrob Agents Chemother. 59 (12), 7517-7529 (2015).
- Pedro-Botet, L., Yu, V. L. Legionella: macrolides or quinolones?. Clin Microbiol Infect. 12 Suppl 3, 25-30 (2006).
- Coers, J., Vance, R. E., Fontana, M. F., Dietrich, W. F. Restriction of Legionella pneumophila growth in macrophages requires the concerted action of cytokine and Naip5/Ipaf signalling pathways. Cell Microbiol. 9 (10), 2344-2357 (2007).
- Chu, J., et al. Non-invasive intravital imaging of cellular differentiation with a bright red-excitable fluorescent protein. Nat Methods. 11 (5), 572-578 (2014).
- Eliopoulos, G. M., Moellering, R. C., Lorian, V. Ch. 9. Antimicrobial combinations. In: Antibiotics in Laboratory Medicin. , 330-396 (1996).
- Jones, R. E., Zheng, W., McKew, J. C., Chen, C. Z. An alternative direct compound dispensing method using the HP D300 digital dispenser. J Lab Autom. 18 (5), 367-374 (2013).
- Odds, F. C. Synergy, antagonism, and what the chequerboard puts between them. J Antimicrob Chemother. 52 (1), (2003).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9 (10), 1005-1012 (2012).
- Berger, K. H., Merriam, J. J., Isberg, R. R. Altered intracellular targeting properties associated with mutations in the Legionella pneumophila dotA gene. Mol Microbiol. 14 (4), 809-822 (1994).
- Berger, K. H., Isberg, R. R. Two distinct defects in intracellular growth complemented by a single genetic locus in Legionella pneumophila. Mol Microbiol. 7 (1), 7-19 (1993).
- Vogel, J. P., Isberg, R. R. Cell biology of Legionella pneumophila. Curr Opin Microbiol. 2 (1), 30-34 (1999).
- Kirby, J. E., Isberg, R. R. Legionnaires' disease: the pore macrophage and the legion of terror within. Trends Microbiol. 6 (7), 256-258 (1998).
- Kirby, J. E., Vogel, J. P., Andrews, H. L., Isberg, R. R. Evidence for pore-forming ability by Legionella pneumophila. Mol Microbiol. 27 (2), 323-336 (1998).
- Vogel, J. P., Andrews, H. L., Wong, S. K., Isberg, R. R. Conjugative transfer by the virulence system of Legionella pneumophila. Science. 279 (5352), 873-876 (1998).
- Song, H., Fares, M., Maguire, K. R., Sidén, A., Potácová, Z. Cytotoxic Effects of Tetracycline Analogues (Doxycycline, Minocycline and COL-3) in Acute Myeloid Leukemia HL-60 Cells. PLoS ONE. 9 (12), e114457 (2014).
- Isberg, R. R., Falkow, S. A single genetic locus encoded by Yersinia pseudotuberculosis permits invasion of cultured animal cells by Escherichia coli K-12. Nature. 317 (6034), 262-264 (1985).
- Niles, A. L., Moravec, R. A., Riss, T. L. Update on in vitro cytotoxicity assays for drug development. Expert Opin Drug Discov. 3 (6), 655-669 (2008).
- Niles, A. L., Moravec, R. A., Riss, T. L. In vitro viability and cytotoxicity testing and same-well multi-parametric combinations for high throughput screening. Curr Chem Genomics. 3, 33-41 (2009).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Curr Opin Pharmacol. 9 (5), 580-588 (2009).
- Dunlap, P., Thouand, G., Marks, R. Biochemistry and genetics of bacterial bioluminescence. Bioluminescence: Fundamentals and Applications in Biotechnology - Volume 1. 1, 37-64 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon