Method Article
Déclenchement Stress cellulaire et la mort Utilisation conventionnelle UV Laser Microscopie confocale
Dans cet article
Résumé
Targeted manipulations to cause directed stress or death in individual cells have been relatively difficult to accomplish. Here, a single-cell-resolution ablation approach to selectively stress and kill individual cells in cell culture and living animals is described based on a standard confocal UV laser.
Résumé
Using a standard confocal setup, a UV ablation method can be utilized to selectively induce cellular injury and to visualize single-cell responses and cell-cell interactions in the CNS in real-time. Previously, studying these cell-specific responses after injury often required complicated setups or the transfer of cells or animals into different, non-physiological environments, confounding immediate and short-term analysis. For example, drug-mediated ablation approaches often lack the specificity that is required to study single-cell responses and immediate cell-cell interactions. Similarly, while high-power pulsed laser ablation approaches provide very good control and tissue penetration, they require specialized equipment that can complicate real-time visualization of cellular responses. The refined UV laser ablation approach described here allows researchers to stress or kill an individual cell in a dose- and time-dependent manner using a conventional confocal microscope equipped with a 405-nm laser. The method was applied to selectively ablate a single neuron within a dense network of surrounding cells in the zebrafish spinal cord. This approach revealed a dose-dependent response of the ablated neurons, causing the fragmentation of cellular bodies and anterograde degeneration along the axon within minutes to hours. This method allows researchers to study the fate of an individual dying cell and, importantly, the instant response of cells-such as microglia and astrocytes-surrounding the ablation site.
Introduction
La microscopie à fluorescence a longtemps été utilisé pour étudier les effets des transgènes dans le SNC zebrafish, en particulier leurs effets sur le développement 1. Haute résolution microscopie a permis une cartographie détaillée des processus cellulaires impliqués dans le développement du cerveau, la génération de muscle, et bien d' autres événements de développement 2. L'étude de la mort d'une cellule individuelle a été plus difficile, principalement en raison des difficultés techniques d'induction de la mort cellulaire sélective au cours des procédures d'imagerie standard. Cependant, la combinaison de la résolution imagerie mono-cellulaire et les techniques d'ablation très ciblées permet l'étude des réponses cellulaires immédiates au stress et des blessures, ainsi que des interactions entre les cellules qui en découlent. La compréhension de ces processus est critique, en particulier pour les maladies neurodégénératives telles que la maladie du motoneurone (DMN), où ont été représentés les interactions neurones-glie pour contribuer à la progressionde la maladie 3.
MND, ou la sclérose latérale amyotrophique (SLA) est une maladie neurodégénérative dévastatrice qui affecte les neurones moteurs dans le tronc cérébral, le cortex moteur, et la moelle épinière. La perte de ces neurones conduit à la perte de masse musculaire, et les patients meurent dans les 3 - 5 4 ans après le diagnostic. Les neurones moteurs dans le lien de la moelle épinière aux fibres musculaires et jouent un rôle essentiel dans la facilitation de la contraction musculaire. L'échec de cette communication ou de la mort de ces neurones affaiblit progressivement les muscles et affecte la capacité du patient à avaler, marcher, parler et respirer. Visualiser la mort d'un neurone moteur et les conséquences à court terme sur un animal vivant constitue une excellente occasion de mieux comprendre les processus dynamiques impliqués dans l'homéostasie cellulaire normale et la maladie.
Zebrafish ont émergé comme un système modèle attractif pour étudier les maladies neurodégénératives 1. Ceest due aux avantages offerts par cet organisme modèle, comme la fécondation externe, peu de temps de développement, l'accès optique au système nerveux, et la facilité de la transgénèse. En outre, la capacité de générer facilement le poisson-zèbre transgénique composé permet de multiples stratégies de marquage des différents types de cellules. Ablation génétique se rapproche de tuer des types cellulaires spécifiques permettent assez large perturbation, mais manquent de contrôle fin de ciblage des cellules individuelles 5. techniques assistée par laser, d'autre part, fournissent un contrôle temporelle et spatiale fine et ont été utilisées pour les différents modèles animaux. Alors que la plupart des approches utilisent des équipements spécialisés, tels que les lasers 6, 7, 8, 9, 10, 11, 12 ou deux photons set-up 13 pulsé, autregroupes de recherche ont récemment profité d'un laser UV dans les microscopes confocaux conventionnels 14.
La technique décrite ici combine la microscopie confocale à haute résolution avec une approche laser médiée par UV pour causer un stress cellulaire ou la mort d'une manière dose-dépendante dans les neurones moteurs sélectionnés. Elle repose sur l'utilisation du laser de 405 nm couramment installé, a été testé avec succès dans la culture cellulaire et chez des animaux vivants, et permet la caractérisation détaillée des interactions cellulaires, tels que la clairance de la microglie après la mort neuronale.
Protocole
NOTE: Conception, conduite, et les rapports de l' expérimentation animale doivent tenir compte des lignes directrices actuelles 15. Ce travail doit être approuvée au préalable par l'autorité de protection des animaux local (dans notre cas, le Comité d'éthique animale de l'Université Macquarie).
1. Préparer le Zebrafish pour le montage et UV Cellule Ablation
- Générer zebrafish (Danio rerio) exprimant des protéines fluorescentes.
- Pour exprimer des protéines fluorescentes d'intérêt chez le poisson zèbre, effectuer des injections de plasmide dans le stade d' une cellule de l'œuf de poisson zèbre (comme décrit ailleurs 16) ou utiliser des lignées transgéniques fluorescents. Pour marquer plusieurs types de cellules, de créer des lignes de poisson zèbre transgénique composé en croisant lignées transgéniques établies pertinentes à la question de l'intérêt. Placez un mâle et une femelle zebrafish de chaque côté d'une paire réservoir d'accouplement faux-fond dans la soirée et retirez le diviseur avec l'apparition de la lumièrele lendemain matin (comme détaillé ailleurs 17). Gardez le poisson zèbre à 28 ° C et les traiter selon les protocoles établis 17, 18.
- Recueillir les embryons après la ponte réussie en filtrant l'eau du réservoir contenant les embryons à travers une passoire à thé en plastique. Rincer les oeufs avec l'eau du système et de les transférer dans l'eau d'œuf dans une boîte de Pétri.
- Examinez-les sous un microscope optique pour déterminer la fertilisation. Magasin d' œufs fécondés dans une boîte de Pétri et les placer dans un incubateur à 28 ° C 18.
- Facultatif: Effectuez une microinjection pour étiqueter des populations de cellules spécifiques.
NOTE: Ceci est une méthode alternative qui permet l'expression et la visualisation des protéines, sans la nécessité d'élever des lignées transgéniques stables. Ce procédé est également avantageux que la protéine d'intérêt est toxique et interdit la génération d'un trans stablelignes géniques.- Injecter les constructions plasmidiques dans le stade d' une cellule d'embryons de poisson zèbre, comme décrit ailleurs 19, 20, 21.
NOTE: Cette méthode se traduit par l'expression mosaïque de la protéine d'intérêt. La protéine d'intérêt est entraîné par un promoteur de choix (par exemple, islet1 22, -3mnx1 23, 24, a rencontré 25 ou MPEG1 26) flanqué de Tol2 répétitions inversées 20.
- Injecter les constructions plasmidiques dans le stade d' une cellule d'embryons de poisson zèbre, comme décrit ailleurs 19, 20, 21.
- Âge du poisson à la taille désirée.
- Soulever le poisson à 3 - 5 jours après la fécondation (dpf) et les placer sous un microscope composé fluorescent. Tamiser les animaux pour l'expression de fluorophore approprié et sélectionnez le poisson brillamment marqué. Séparer les larves approprié dans un autre plat avec de l'eau d'œuf pour l'enrobage finr sur (stocker dans un 28 ° C incubateur).
Facultatif: Les embryons peuvent être placés dans un 1-phényl-2-thioures solution 0,2 mM (PTU) Ringers à 24 h après la fécondation (HPF) pour inhiber la formation de la pigmentation. Des précautions doivent être prises avec PTU, car il est toxique et peut avoir physiologique indésirable, génétiques ou des effets morphologiques. - Pour les études à un stade de développement précoce (<2 dpf), dechorionate les embryons manuellement à l'aide des pinces coupantes. Dechorionate grand nombre d'embryons par voie enzymatique par addition de pronase (2 mg / ml) dans l'eau de l'oeuf et en les incubant pendant 10 min à 28 ° C.
- Passez les embryons périodiquement à travers une pipette Pasteur en plastique pour faciliter dechorionation. Termine le processus lorsque la majorité des embryons ont émergé de leurs chorions en les lavant plusieurs fois avec de l'eau d'œuf.
- Soulever le poisson à 3 - 5 jours après la fécondation (dpf) et les placer sous un microscope composé fluorescent. Tamiser les animaux pour l'expression de fluorophore approprié et sélectionnez le poisson brillamment marqué. Séparer les larves approprié dans un autre plat avec de l'eau d'œuf pour l'enrobage finr sur (stocker dans un 28 ° C incubateur).
- Préparer des solutions pour l'incorporation dans zebrafish agarose.
- Préparer une solution d'anesthésie en ajoutant 4 g / L MS222 (solution de tricaïne, pH 7,0)goutte à goutte à une boîte de Pétri contenant de l'eau d'oeuf. Une dose de 50 mg / L est un point de départ recommandée (Figure 1A).
- Préparer un stock de bas point de fusion d'agarose (0,8 à 1,5%) dans l'eau d'œuf et aliquoter dans des tubes de microcentrifugation de 1,5 ml. Placer une aliquote dans un bloc thermique préchauffé (38 - 40 ° C) et laisser équilibrer à la température de consigne (~ 30 min, figure 1B).
- Facultatif: Pour l' imagerie à plus long terme (> 4 h), préparer un petit cercle d' agarose dans le 35 mm boîte de Pétri à fond de verre et de lui permettre de fixer (figure supplémentaire 1).
REMARQUE: Cette étape supplémentaire a été efficace pour éviter tout mouvement de l'ensemble goutte d'agarose avec le poisson zèbre sur des délais plus longs.- Pour ce faire, le lieu ~ 300 pi d'agarose le long du cercle intérieur de la boîte à fond de verre pour préparer un cercle en forme de beignet avec une petite ouverture au milieu dans lequel placer le poisson (étape 1.5.3; complémentaire Figure 1) .
- Monter le zebrafish en agarose pour la microscopie.
- Sélectionner 1 - 3 de poisson pré-sélectionnés pour l' ablation et anesthésier les larves en les transférant ( à l' aide d' une pipette de transfert) dans un récipient avec la solution d'anesthésie (étape 1.4.1; figure 1C; environ 5 minutes).
NOTE: Les poissons sont anesthésiés quand ils montrent un mouvement des opercules peu profonde et une diminution du rythme cardiaque et de ne plus afficher une réaction de fuite tactile évoqué (TEER, à défaut de nager loin après doucement toucher leur queue avec une brosse). Assurer une anesthésie appropriée pour le traitement éthique des poissons et pour éviter des secousses lors d'un transfert en agarose ou exposition à la lumière fluorescente. - Après l'anesthésie est confirmée, aspirer une larve à l'aide d'une pipette réglable (avec un 200-pi pointe de coupure réglée sur ~ 30 pi) et laisser couler au fond de la pointe. Transférer la larve dans l'agarose préchauffé (étape 1.4.2) en libérant une goutte de liquide avec lelarve dans l'agarose (essayer de minimiser la quantité d'eau d'oeuf entrer dans l'agarose, la figure 1D).
- Aspirer le poisson entouré d'agarose. Distribuer rapidement dans le 35 mm plat à fond de verre préalablement préparé.
- Utiliser un microscope de dissection et un pinceau standard (long liner, taille 1) pour positionner l'animal dans l'agarose sur le côté (tête vers la gauche) , de sorte que le corps et la queue sont à plat (figure 1E). Si vous travaillez avec plusieurs poissons, aligner tous les poissons dans le plat de sorte qu'ils sont faciles à localiser à l'aide du microscope confocal plus tard.
REMARQUE: effectuer rapidement cette procédure de positionnement et d'alignement (il peut exiger une certaine pratique, comme l'agarose commence à mettre immédiatement après l'exposition à des températures plus froides). - Laissez le poisson d'agarose-embedded pendant 10 - 15 min jusqu'à ce que l'agarose est fixé fermement. Top soigneusement le 35 mm boîte de Pétri avec ~ 2 mL d'oeuf eau contenant tricaïne (figure 1F).
- Sélectionner 1 - 3 de poisson pré-sélectionnés pour l' ablation et anesthésier les larves en les transférant ( à l' aide d' une pipette de transfert) dans un récipient avec la solution d'anesthésie (étape 1.4.1; figure 1C; environ 5 minutes).
2. Mettre en place le microscope confocal et paramètres d'imagerie
- Placez la boîte de Pétri avec la larve embarquée sur la platine du microscope confocal et se concentrer sur la face dorsale de l'animal de la moelle épinière (utilisant un champ lumineux). Examiner l'animal sous le grossissement approprié (40X) et le réglage fluorescent et visualiser la structure d'intérêt (par exemple, l' intensité de fluorescence des neurones marqués ou mouvement microglie) pour confirmer que tous les paramètres d'imagerie sont aussi nécessaires pour l' ablation ultérieure (Figure 2). Nous utilisons régulièrement l'objectif 40X d'effectuer nos études time lapse.
- Facultatif: Pour effectuer une étude time-lapse pendant plusieurs heures, il est conseillé d'enregistrer un seul ou quelques points de temps avant l'ablation d'établir la réponse physiologique non perturbé de la cellule et son environnement (par exemple, le mouvement microgliale pour établir la vitesse de référence et la motilité).
- Déterminer l'épaisseur de la structure d'intérêt pour l'ablation par laser UV.
- Utilisation de la z-drive, vérifiez le haut et le bas de la structure d'intérêt (par exemple, le soma cellulaire) par mise au point manuelle de haut en bas. Notez le plan-z qui sera soumis à une ablation (par exemple, le centre de la cellule).
NOTE: De l' expérience, cette méthode était la plus efficace en ciblant les neurones de la moelle épinière qui ont été brillamment marqués (un rapport signal-bruit élevé qui permet facilement la visualisation time-lapse après l' ablation, par exemple, la figure 4) et par ablation du milieu de la soma cellulaire. fluorescence cellulaire noyau peut être avantageux pour assurer le ciblage correct et une grande efficacité de l'ablation.
- Utilisation de la z-drive, vérifiez le haut et le bas de la structure d'intérêt (par exemple, le soma cellulaire) par mise au point manuelle de haut en bas. Notez le plan-z qui sera soumis à une ablation (par exemple, le centre de la cellule).
3. Effectuer ciblée Laser Ablation des cellules individuelles dans la moelle épinière Zebrafish
NOTE: Pour que cette approche d'ablation et de visualisation, un microscope confocal (Leica SP5) a été utilisé. La procédure d'ablation en utilisant une diode de 405 nm pour dest spécifique à la celluleruction est détaillé en fonction du logiciel (Leica Application Suite, v2.7.3.9723). Cependant, tout microscope confocal classique qui est équipé d'un laser de 405 nm et une FRAP (récupération de fluorescence après photoblanchiment) ou d'un module de blanchiment va permettre l'exécution des mêmes manipulations cellulaires, mais éventuellement avec des paramètres légèrement différents, les paramètres et les noms.
- Lancez l'assistant de FRAP en cliquant sur le menu déroulant en haut du menu du logiciel (figure 3A, 1 et 2). Observer une nouvelle fenêtre avec les différentes étapes permettant la mise en place des paramètres spécifiques pour l'ablation laser (figure 3B, 3).
- Déterminer les paramètres de l' image pour l'approche d'ablation en sélectionnant le format, la vitesse de balayage (figure 3B, 4) et la moyenne (figure 3B, 5). Un format d'image de 1.024 x 1.024 à une vitesse de balayage de 400 Hz et une lignemoyenne de 4 était plus applicable.
NOTE: Il est généralement pas nécessaire de modifier la détection spectrale (tels que les paramètres d'excitation ou d'émission), comme ils l'ont été déterminées dans l'acquisition précédente.- Si le plan z pour l'ablation n'a pas déjà été sélectionné (tel que décrit à l'étape 2.4.), Appuyez sur le bouton "Live" et de se concentrer à travers l'échantillon jusqu'à ce que la structure fluorescente ou le z-plan désiré qui va être ablatée est au point.
- Une fois les paramètres d'image généraux sont définis, accéder à l'étape "Bleach" (figure 3C, 6) pour contrôler les composants spécifiques d'ablation.
NOTE: Une combinaison de l'intensité du laser (figure 3C, 8), la vitesse de balayage, et la moyenne qui a été défini à l' étape 3.2 (figure 3B, 4 et 5), ainsi que le nombre de répétitions qui sera mis en l' étape 3.5 (Figure 3E,12), détermine le temps de séjour global du laser UV à la ROI, et par conséquent, l'efficacité de blanchiment.- Engager le laser à 405 nm en l' activant pour le procédé de blanchiment (figure 3C, 8).
NOTE: La plupart de succès avec les paramètres mentionnés ci-dessus a été réalisée avec 405 nm intensités laser entre 60 - 80% dans notre dispositif expérimental. Soyez conscient que cette puissance de sortie de laser est spécifique à l'instrument et sera différent pour chaque configuration confocale. - Utilisez la fonction "zoom" l' option (figure 3C, 7) afin de maximiser l'intensité de blanchiment à la ROI sélectionnée en réduisant le champ de balayage, donc maximiser le temps de séjour. Vous pouvez également utiliser l'option «point de Bleach" du logiciel de choix pour ce processus.
- Engager le laser à 405 nm en l' activant pour le procédé de blanchiment (figure 3C, 8).
- Sélectionnez un ou plusieurs ROIs (Figure 3D, 10) pour l'ablation en utilisant l' un des outils de dessin dans le vent d'acquisition d'imageow (Figure 3D, 9). Cibler le tertre axone, par exemple, avec l'outil de dessin circulaire d'environ 4 à 8 pm.
REMARQUE: La zone d'ablation est ajustable à partir d'un pixel unique dans une zone plus large, en fonction de l'application. - Après avoir établi le retour sur investissement, sélectionnez le bouton "Course Time" (Figure 3E, 11) et confirmer le nombre de cycles ROIs sera numérisé / ablatée (Figure 3E, 12). Choisissez l'option "Pré-blanchiment" et cadres "Post-Bleach" comme souhaité pour permettre un aperçu de l'ensemble de l'image juste avant et immédiatement après le processus de blanchiment.
- Après avoir établi tous les paramètres d'ablation nécessaires, appuyez sur "Experiment Run" (Figure 3E, 13) et de surveiller l'efficacité de l'ablation.
NOTE: Dans notre configuration de FRAP, une seule image sera prise avant et après le cycle de FRAP avec le e laser appropriéXCitation (par exemple, 488 nm d' excitation pour les cellules exprimant EGFP). Ces images pré et post-ablation permettent un arrêt rapide de la façon satisfaisante le retour sur investissement a été blanchi et dans quelle mesure les paramètres d'ablation choisis étaient. - Répétez le processus en ajustant l'intensité du laser (figure 3C, 8), la vitesse de balayage et la moyenne (figure 3B, 4 et 5), et les répétitions (Figure 3E, 12) dans le cas où le ROI sélectionné montre encore à haute intensité de fluorescence après l' achèvement du cycle de FRAP.
4. Effectuez la procédure de suivi, y compris les poissons "Rescue" ou élimination
- Si l'expérience est terminal, euthanasier l'animal avec une surdose de tricaïne. Retirer l'eau d'œuf et le remplacer par la solution mère anesthésie pendant 10 min. Pour assurer l'euthanasie, vérifier sous le microscope pour l'arrêt des battements du cœur.
- Optionnel:Si l'expérience est non terminal, retirez le poisson soigneusement de l'agarose avec une pince fine et une brosse. Placer le poisson dans l'eau d'oeuf frais et de lui permettre de récupérer en observation pendant 15 min. Si le comportement de nage normale retourne, retournez le poisson dans l'incubateur.
- Evacuer les animaux transgéniques selon flux de déchets d'OGM approuvé de l'institution.
Résultats
La méthode décrite ici permet l'ablation des neurones moteurs de la moelle épinière zebrafish en utilisant le module de FRAP d'un microscope confocal commercial. Lignes de poisson zèbre transgénique exprimant une protéine fluorescente verte dans les neurones sous le contrôle de promoteurs spécifiques, tels que - 3mnx1, islet1 ou rencontrés, ont été utilisés. L'expression de la GFP dirigée par le promoteur du motoneurone (tel que -3mnx1 ou atteint) permet à haute résolution visualisation des corps cellulaires, les principaux axones et les branches périphériques s'étendant vers les muscles (Figure 4 et vidéo 1).
Neurones dans la moelle épinière de 3 à 5 jours-vieux poissons ont été ablatée avec succès, avec un temps de séjour global de 60 - 80 s à une puissance laser de ~ 70% et les paramètres généraux décrit à l'étape 3. ablation réussie est atteint lorsque la fluorescence disparaît immédiatement après l'ablationet ne recommence (Figure 5, C et D). Les tentatives d'ablation avec d'autres lignes laser (tels que la ligne laser 488-nm) n'a pas abouti à la décoloration permanente, et la fluorescence a été restauré dans les délais courts. Fait important, cette technique a démontré caractéristiques de la mort cellulaire apoptotique dans les neurones ablatée-UV, tels que la présence de l' annexine V, des changements morphologiques uniformes de la dégénérescence autosomique et bourgeonnement axonal des neurones 27 ablatée.
La spécificité de cette approche est confirmée dans les expériences utilisant le fluorophore photoconvertible Kaede (qui commute son émission du vert au rouge après l' exposition à la lumière UV), où un seul neurone ciblé a été converti (Figure 5, A et B) , sans signes de cellulaire destruction pendant plusieurs heures. L'utilisation d'un laser de puissance plus élevée conduit à la place de to extinction du neurone cible (pas photoconversion ou la réapparition de la fluorescence) et photoconversion (sans mort) des cellules situées à proximité (~ 20 um) sur le site d'ablation (Figure 5, C et D).
Un avantage important de cette technique d'ablation induite par laser est la dépendance de la dose de l'approche. Pour cibler les cellules avec différentes intensités, des couches multiples de réglage fin sont disponibles en réglant la puissance du laser (figure 3C, 8), la vitesse et la ligne moyenne de balayage (figure 3B, 4 et 5), la taille de la ROI à ablater (figure 3D, 10), et les répétitions (figure 3E, 12). En particulier, cette approche peut également être utilisée pour appliquer un stress cellulaire pour des cellules individuelles au lieu d'induire la mort cellulaire. Par exemple, de réglage fin a ététrès précieux pour évaluer les processus cellulaires lors de la mort d'un neurone. Les neurones moteurs avec de longues projections axonales qui ont été ablatée avec UV inférieur intensités laser révélé "bourgeonnement" caractéristique (la formation et la fragmentation des vésicules cellulaires), qui a débuté à la soma ciblée et a continué le long de l'axone au fil du temps (40-90 min; Figure 4 ; rendu 3D film de cette ablation dans la vidéo 1). Par conséquent, la modulation des différents paramètres d'ablation laser et par conséquent le niveau de stress cellulaire induite et au cours du temps de la mort permet aux chercheurs un niveau élevé de flexibilité expérimentale.
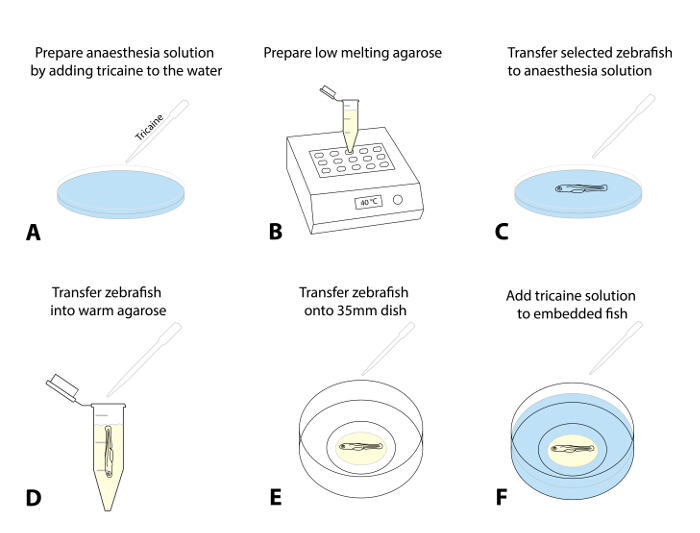
Figure 1: Embedding de poisson zèbre pour l' imagerie en direct. (AF) procédure d'imagerie en direct Incorporation: (A) Tricaine est ajouté à l' eau d'œuf pour anesthésier le poisson zèbre un ta dose initiale de 50 mg / L. (B) à faible point de fusion d' agarose (0,8 à 1,5%) est préparé et chauffé à 38-40 ° C. (C) A l' aide d' une pipette de transfert, le poisson zèbre examinés et sélectionnés sont transférés dans un plat avec une solution de tricaïne. Après la sédation réussie (mouvement des opercules peu profonde, une diminution de la fréquence cardiaque, le manque d'une réponse tactile évoquée), un poisson est transféré dans l'agarose préchauffé (D). Réduire au minimum la quantité d'eau de l'oeuf qui est transférée dans l'agarose afin d'éviter une dilution ultérieure. (E) Transfert une goutte d'agarose (~ 30 - 50 pi) contenant le poisson zèbre sur un 35 mm plat à fond de verre. Effectuez cette sous un microscope de dissection et utiliser une brosse pour aligner délicatement le poisson zèbre à son orientation préférée. Attendre 10 à 15 min jusqu'à ce que l'agarose est activé, et ajouter ~ 2 mL de solution de tricaïne à l'antenne (F).ank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
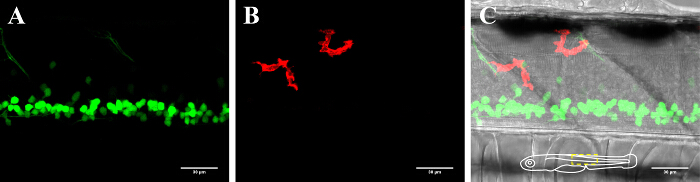
Figure 2: Visualisation des neurones et les microglies dans la moelle épinière d'un poisson zèbre 3 dpf. Visualisation des microglies et les neurones de la moelle épinière d'un 3-day-old zebrafish transgénique exprimant (A) neurones GFP-positives (islet1: GFP) et (B) mCherry positif microglie (MPEG1: GAL4, UAS: mCherry). (C) de l' image composite du canal de neurone et microglie avec l'image champ lumineux. L'insert schématique en (C) représente l'orientation du poisson et donne un aperçu de la zone présentée. Barre d'échelle = 30 pm. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3: Les étapes du processus d'ablation laser UV (comme indiqué dans le protocole, étape 3). Étapes pour contrôler le module logiciel FRAP dans le logiciel confocal (Leica Application Suite). (A) À partir du module de FRAP comme un outil pour effectuer l' ablation laser UV. (B) Mise en place du plan z pour ablation et d' autres FRAP paramètres tels que le format, la vitesse et la moyenne, ce qui permettra de déterminer le temps de séjour du laser. (C) Le contrôle de l'intensité du laser et le "zoom" option pour maximiser l' efficacité de blanchiment. (D) Sélection d'un ou de plusieurs régions d'intérêt (ROI) qui sera soumis à une ablation. (E) Réglage de l'évolution temporelle de blanchiment détermine les cycles de blanchiment et le temps total de séjour laser au ROIs. S'il vous plaît cliquez sur son e pour voir une version plus grande de cette figure.
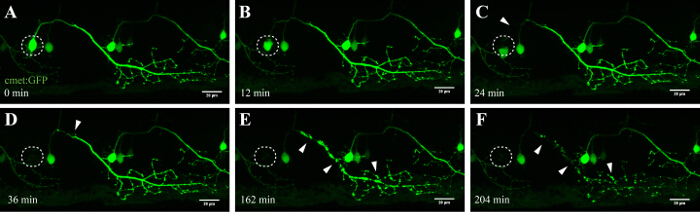
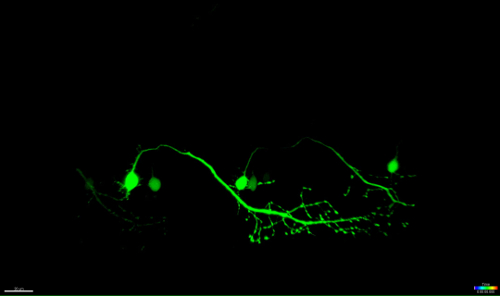
Figure 4: une dégénérescence antérograde d'un neurone ablatée UV. imagerie time-lapse de la neurodégénérescence d'un neurone spinal ablatée-UV. (AF) UV-irradiation d'un seul neurone spinal (rencontré: GAL4, UAS: EGFP; A; cercle) a abouti à la soma du neurone rétrécissement et arrondi au fil du temps (AC), suivie par la fragmentation axonale (CF; pointes de flèches) . La dégénérescence axonale a commencé au soma (site d'ablation) et a progressé antérograde vers l'extrémité distale de l'axone jusqu'à ce que finalement, la fluorescence dans le soma a disparu et l'ensemble de l' axone a montré "bourgeonnement" (DF). Les barres d'échelle = 20 pm. Le film time-lapse 3D-rendu de cette ablation est montré dans la vidéo 1.es / ftp_upload / 54983 / 54983fig4large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
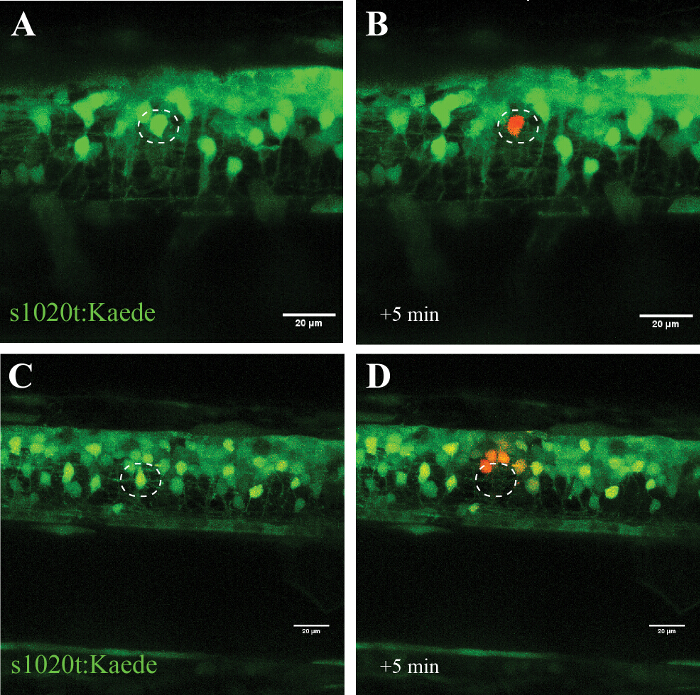
Figure 5: Confirmation de l'effet d' un rayonnement UV à cellule unique en utilisant un fluorophore photoconvertible (kaede) dans un neurone moteur. La validation de l'irradiation UV à cellule unique par l'activation du fluorophore photoconvertible kaede dans un neurone. (AD) irradiation UV des neurones marqués avec Kaede. (A) Photoconversion d'un seul neurone (cercle) avec une puissance laser de 30% pendant 10 s conduit à photoconversion de Kaede (du vert au rouge) que dans le neurone individuel ciblé (B). A noter que la cellule transformée a survécu pendant plusieurs heures et ne montrait aucun signe de détérioration visuelle, comme bourgeonnement ou arrondi vers le haut. Ablation d'un seul neurone (C ; cercle) avec une puissance laser plus élevée (95% pour 10 s) a conduit à une disparition immédiate de ce neurone (D) et photoconversion subséquente de kaede dans un petit nombre de neurones environnants dans un rayon d'environ 20 um. Les barres d'échelle = 20 pm. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Vidéo 1: le rendu de surface en 3D (Imaris) du neurone ablatée UV représenté sur la figure 4.
La vidéo time-lapse du neurone représenté sur la figure 4 est la surface rendue en utilisant un logiciel de visualisation (Imaris, Bitplane). Elle met en évidence le processus de rétrécissement du soma ablatée, suivi par une fragmentation axonale anterogradely vers l'extrémité distale de la cellule.euron_ablation-3D_rendered.mov "target =" _ blank "> S'il vous plaît cliquer ici pour télécharger ce fichier.
Figure supplémentaire 1: fonte d'agarose en option pour l' imagerie de longue date.
Pour éviter tout mouvement du poisson et de l'agarose lors de l'acquisition à long terme préparer un beignet cercle en forme d'agarose le long des bords dans le milieu de la boîte de 35 mm à fond de verre (A). Soit l'ensemble agarose pour ~ 10 min et transféré poissons dans le cercle intérieur avec une goutte d'agarose (B). Essayez de minimiser la quantité d'agarose pour l'enrobage (brosser l'excès d'agarose à l'extérieur après l'orientation des poissons). S'il vous plaît cliquer ici pour télécharger ce fichier.
Discussion
Approches Laser Ablation
techniques d'ablation laser assistée permettent un ciblage précis des groupes individuels ou petits de cellules. La combinaison de cette technique avec microscopie à haute résolution et des manipulations génétiques dans des modèles animaux tels que zebrafish permet aux chercheurs d'étudier systématiquement le sort d'une cellule individuelle et les interactions après une blessure.
L'UV (405 nm) protocole d'ablation laser décrit ici décrit comment les cellules individuelles peuvent être stressés ou tués sélectivement (d'une manière dose-dépendante), tandis que les neurones, les cellules gliales voisines, et les axones sont laissés indemnes. Nous avons utilisé avec succès cette approche dans des expériences de culture cellulaire et de décrire ici l'approche détaillée de la moelle épinière zebrafish. Nous montrons la mise en œuvre de cette approche dans la moelle épinière zebrafish en insistant sélectivement un neurone individuel au sein d' un réseau d'autres cellules (Figure 5, A et B), ou en tuant un seul neurone immédiatement et sans récupération (Figure 5, C et D).
Auparavant, les systèmes laser spécialisés, comme le laser pulsé azote ou systèmes laser à deux photons, ont été nécessaires pour induire des lésions tissulaires et transections 10, 11, 12, 13 du nerf moteur. Ces systèmes laser ont été utilisées avec succès pour causer des dommages aux cellules, telles que la thrombose dans les artères et les veines 6, lésions rénales aiguës 7, 8 lésions cardiaques, et d'étudier les ondes de calcium et de la réponse des microglies après lésion cérébrale 9. En outre, Soustelle et ses collègues ont utilisé une configuration confocale conventionnelle (351 nm et 364 nm lasers UV) pour induire des lésions épithéliales et des cellules gliales chez la drosophile 14 </ Sup>.
Pertinence des modèles Zebrafish pour la compréhension de la SLA (et d'autres maladies humaines)
Zebrafish sont un organisme modèle largement utilisé, en particulier pour les études sur le développement 28, 29, 30. Alors qu'ils ont certaines limites, leur potentiel pour modéliser les maladies humaines et donner une compréhension des mécanismes moléculaires pathogènes est énorme. Modèles Zebrafish ont été bien établi pour l'étude de la DMN et ont conduit à des informations importantes moléculaires 31, 32, 33, 34. des lignes de poisson-zèbre transgénique peuvent être générés rapidement (4 - 5 mois) et de permettre le suivi sélectif d'un type cellulaire spécifique, les caractéristiques qui en font un atout précieux pour les modèles animaux actuels font de la SLA. embryons de poisson zèbre / larves sont optiquement transparents et offrent expé uniquesmentaux avantages qui permettent à long terme d'imagerie en temps réel au niveau d'une seule cellule dans le cerveau ou la moelle épinière, ce qui ne peut être aisément obtenue dans des modèles de rongeurs (ou chez l'homme). Lorsqu'il est combiné avec des techniques moléculaires, telles que l' ablation de cellules isolées, cela fournit une plate - forme expérimentale unique pour étudier les mécanismes moléculaires précis in vivo.
Motoneurones peut être sélectivement ciblée utilisant UV Ablation Laser
Les neurones de la colonne vertébrale dans zebrafish commencent à se développer dans les 10 h après la naissance et sont établis après environ 48 h 35, 36. Ce développement rapide permet la visualisation de ces neurones dans des délais courts et avec un débit élevé. Les neurones moteurs constituent le lien essentiel entre le cerveau et les muscles et, dans la SLA, sont affectées au niveau du cortex moteur (neurones moteurs supérieurs), le tronc cérébral et la moelle épinière (les neurones moteurs inférieurs). La perte de ces neurones conduit inévitablement à muatrophie SCLE et de faiblesse. Les neurones moteurs de la moelle épinière du poisson zèbre peuvent être identifiés par leurs projections distinctes et par l'utilisation de promoteurs spécifiques des neurones moteurs comme -3MNX1. Le ciblage du corps cellulaire des neurones se projetant ces révélé la dégénérescence antérograde le long de la projection axonale dans le temps (figure 4 et vidéo 1). Résolution d' imagerie unique cellulaire des neurones moteurs spinaux a confirmé en outre phosphatidylsérine translocation et Annexin conséquente V-étiquetage après l' ablation laser (voir Figure 4 et complémentaire Video 3 dans la référence 27). Bien que nous rapportons l'activation de l'annexine V en mourant neurones après notre approche d'ablation laser UV, nous ne pouvons pas être certain que la cascade de la mort qui est déclenchée au cours de ce processus accéléré correspond exactement à la mort neuronale qui se produit pendant la neurodégénérescence ou l'homéostasie cellulaire normale.
Bien que cette approche d'ablation est hautement reproductibleet des stratégies d'incorporation spécifiques différentes peuvent également affecter l'efficacité de l'ablation UV. Dans notre expérience, il a été le plus efficace pour réduire au minimum la couche d'agarose nous avons intégré notre poisson. Des couches plus épaisses d'intégration moyenne avec une couche supplémentaire de l'eau d'œuf peut réduire la puissance UV finalement reçue par la cellule en raison de l'atténuation et des effets de diffusion qui se produisent le long du trajet du faisceau.
Dans l'avenir, le franchissement des différentes lignées de poissons transgéniques permettra la visualisation du court terme et immédiat (jusqu'à 12 h), les réponses des autres cellules affectées, telles que des cellules gliales, à la destruction cellulaire induite par laser. Par exemple, des astrocytes et la toxicité autonome non-cellulaire dans les maladies neurodégénératives telles que la SLA ont été à l'honneur de la recherche et sont fortement impliqués dans la pathogénicité de SLA sporadique et familiale 37, 38. Cependant, les mécanismes sous-tendant la toxicité des cellules gliales et la sélectivitévers le moteur neurones restent floues. Nous et d' autres récemment pris avantage de cette approche pour étudier l'engloutissement de la mort des neurones par la microglie et visualisé l'enlèvement des restes neuronales 27, 39, 40.
La combinaison de la technique d'ablation avec microscopie à haute résolution et des marqueurs pour neuroinflammation permettra aux chercheurs à l'avenir pour développer la compréhension de la fonction cellule unique et des systèmes de cellules interconnectées. La caractérisation de ces processus dans un cadre in vivo est essentiel non seulement dans les milieux du développement , mais aussi dans des modèles de maladies neurodégénératives, y compris la DMN, où les interactions cellulaires peuvent être altérées 3, 41.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
This work was supported by the MND Research Institute of Australia and the Cure for MND Foundation [GIA 1638], the Snow Foundation, and Macquarie University [MQRDG 9201401462]. Imaging was carried out at the Microscopy Facility in the Department of Biomedical Sciences, Macquarie University. Other members of the MND research center are thanked for their contributions to the development of these methods and fish lines.
matériels
| Name | Company | Catalog Number | Comments |
| Agarose low melting | Fisher-Scientific | Dissolve in egg water with tricaine (0.02%) at 0.8 - 1.5% | |
| Tricaine | Argent Labs | MS-222 | 0.02% |
| Harvard standard wall Borosilicate with filament Capillary Glass | World Precision Instruments, Inc. | GC100F-10 (short) GC100F-15 (long) | Pull to a resistance of 2 - 7 MΩ |
| Egg water | 0.6 g Instant Ocean sea salt, 4 mL of 1 mg/mL methylene blue in 10 L deionized water | ||
| 1-phenyl-2-thiourea (PTU) | Sigma | P7629 | |
| Pronase | Sigma | 10165921001 | |
| Heat block | Select BioProducts | Digital block heater (SBD110_) | |
| Microinjection apparatus | World Precision Instruments, Inc. | Microinjection was performed by hand under a steromicroscope (Leica) with a loaded glass needle and a Picospritzer II (General Valve corporation) | |
| Stereoscope | Leica | Bright field illumination microscopy was performed on a Leica M165FC stereo dissection microscope (Leica) | |
| Microscope | Leica | SP5 | |
| 35 mm glass bottom dish | MatTek Corporation | P35G-0-20-C |
Références
- Becker, T. S., Rinkwitz, S. Zebrafish as a genomics model for human neurological and polygenic disorders. Dev Neurobiol. 72 (3), 415-428 (2012).
- Wilt, B. A., et al. Advances in light microscopy for neuroscience. Annu Rev Neurosci. 32, 435-506 (2009).
- Philips, T., Robberecht, W. Neuroinflammation in amyotrophic lateral sclerosis: role of glial activation in motor neuron disease. Lancet Neurol. 10 (3), 253-263 (2011).
- Robberecht, W., Philips, T. The changing scene of amyotrophic lateral sclerosis. Nat Rev Neurosci. 14 (4), 248-264 (2013).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62 (3), 232-240 (2013).
- Jagadeeswaran, P., Paris, R., Rao, P. Laser-induced thrombosis in zebrafish larvae: a novel genetic screening method for thrombosis. Methods Mol Med. 129, 187-195 (2006).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845 (2011).
- Matrone, G., et al. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
- Sieger, D., Moritz, C., Ziegenhals, T., Prykhozhij, S., Peri, F. Long-range Ca2+ waves transmit brain-damage signals to microglia. Dev Cell. 22 (6), 1138-1148 (2012).
- Lewis, G. M., Kucenas, S. Motor nerve transection and time-lapse imaging of glial cell behaviors in live zebrafish. J Vis Exp. (76), (2013).
- Rosenberg, A. F., Wolman, M. A., Franzini-Armstrong, C., Granato, M. In vivo nerve-macrophage interactions following peripheral nerve injury. J Neurosci. 32 (11), 3898-3909 (2012).
- Villegas, R., et al. Dynamics of degeneration and regeneration in developing zebrafish peripheral axons reveals a requirement for extrinsic cell types. Neural Dev. 7, 19 (2012).
- O'Brien, G. S., et al. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. (24), (2009).
- Soustelle, L., Aigouy, B., Asensio, M. L., Giangrande, A. UV laser mediated cell selective destruction by confocal microscopy. Neural Dev. 3, 11 (2008).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), 1000412 (2010).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196 (2012).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio).Vol.4th ed. , (2000).
- Clark, K. J., Urban, M. D., Skuster, K. J., Ekker, S. C. Transgenic zebrafish using transposable elements. Methods Cell Biol. 104, 137-149 (2011).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), (2009).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20 (1), 206-218 (2000).
- Arkhipova, V., et al. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365 (1), 290-302 (2012).
- Flanagan-Steet, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132 (20), 4471-4481 (2005).
- Hall, T. E., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin alpha2-deficient congenital muscular dystrophy. Proc Natl Acad Sci U S A. 104 (17), 7092-7097 (2007).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Morsch, M., et al. In vivo characterization of microglial engulfment of dying neurons in the zebrafish spinal cord. Front. Cell. Neurosci. , (2015).
- Grunwald, D. J., Eisen, J. S. Headwaters of the zebrafish -- emergence of a new model vertebrate. Nat Rev Genet. 3 (9), 717-724 (2002).
- Lele, Z., Krone, P. H. The zebrafish as a model system in developmental, toxicological and transgenic research. Biotechnol Adv. 14 (1), 57-72 (1996).
- Veldman, M. B., Lin, S. Zebrafish as a developmental model organism for pediatric research. Pediatr Res. 64 (5), 470-476 (2008).
- Kabashi, E., et al. Gain and loss of function of ALS-related mutations of TARDBP (TDP-43) cause motor deficits in vivo. Hum Mol Genet. 19 (4), 671-683 (2010).
- Laird, A. S., et al. Progranulin is neurotrophic in vivo and protects against a mutant TDP-43 induced axonopathy. PLoS One. 5 (10), 13368 (2010).
- Lemmens, R., et al. Overexpression of mutant superoxide dismutase 1 causes a motor axonopathy in the zebrafish. Hum Mol Genet. 16 (19), 2359-2365 (2007).
- Ramesh, T., et al. A genetic model of amyotrophic lateral sclerosis in zebrafish displays phenotypic hallmarks of motoneuron disease. Dis Model Mech. 3 (9-10), 652-662 (2010).
- Hanneman, E., Trevarrow, B., Metcalfe, W. K., Kimmel, C. B., Westerfield, M. Segmental pattern of development of the hindbrain and spinal cord of the zebrafish embryo. Development. 103 (1), 49-58 (1988).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Prog Neurobiol. 69 (6), 419-449 (2003).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Philips, T., Rothstein, J. D. Glial cells in amyotrophic lateral sclerosis. Exp Neurol. 262, 111-120 (2014).
- Mazaheri, F., et al. Distinct roles for BAI1 and TIM-4 in the engulfment of dying neurons by microglia. Nat Commun. 5, 4046 (2014).
- van Ham, T. J., Kokel, D., Peterson, R. T. Apoptotic cells are cleared by directional migration and elmo1- dependent macrophage engulfment. Curr Biol. 22 (9), 830-836 (2012).
- Radford, R. A., et al. The established and emerging roles of astrocytes and microglia in amyotrophic lateral sclerosis and frontotemporal dementia. Front Cell Neurosci. 9, 414 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon