Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Traitement de la toxicomanie et
Dans cet article
Résumé
Small laboratory fish have become popular models for bone research on the mechanisms underlying human bone disorders and for the screening of bone-modulating drugs. In this report, we describe a protocol to assess the effect of alendronate on bone cells in medaka larvae with osteoporotic lesions.
Résumé
Formation osseuse d'ostéoblastes interagissent avec les ostéoclastes résorbent l'os afin de coordonner la rotation de la matrice osseuse, et pour contrôler l'homéostasie du squelette. Medaka et larves de poisson zèbre sont largement utilisés pour analyser le comportement des cellules osseuses lors de la formation osseuse, la dégénérescence et la réparation. Leur limpidité optique permet la visualisation de cellules marquées par fluorescence des os et des colorants fluorescents liés à la matrice osseuse minéralisée. Notre laboratoire a généré medaka transgénique poissons qui expriment le facteur de ostéoclastes induisant Activator Receptor du nucléaire facteur kB Ligand (RANKL) sous le contrôle d'un promoteur de choc inductible chaleur. L' expression ectopique des résultats de RANKL dans l'excès de la formation des ostéoclastes activés, qui peuvent être visualisés dans des lignées rapporteuses d'expression nlGFP sous le contrôle de la cathepsine K (ctsk) promoteur. induction de RANKL et la formation des ostéoclastes ectopique conduit à de graves phénotypes de l'ostéoporose comme. Composé transgénique médaka linda qui expriment ctsk: nlGFP dans les ostéoclastes, ainsi que mCherry sous le contrôle de l'osterix (osx) promoteur dans les ostéoblastes prématurés, peuvent être utilisés pour étudier l'interaction des deux types de cellules. Ceci facilite l'observation in vivo du comportement cellulaire dans des conditions de dégénérescence osseuse et la réparation. Ici, nous décrivons l'utilisation de ce système pour tester un médicament couramment utilisé dans le traitement de l'ostéoporose humaine et décrivent un protocole d'imagerie en temps réel. Le modèle de medaka complète les études de culture et de souris cellulaire, et offre un nouveau système pour l'analyse in vivo de l' action de la drogue dans le système squelettique.
Introduction
Le squelette vertébré fournit un support structurel et de protection des organes, permet la mobilité, et sert de source de calcium. Tout au long de la vie, la matrice osseuse extracellulaire est continuellement remis à maintenir la stabilité et la rigidité osseuse. Ce processus nécessite l'activité étroitement coordonnée et interaction des ostéoblastes osseuses formant et ostéoclastes résorption osseuse. Les ostéoblastes sont dérivées de progéniteurs mésenchymateuses multipotentes et produisent du collagène pour former le ostéoïde, la partie protéique de la matrice osseuse 10. Ostéoblastes interagissent avec les ostéoclastes pour parvenir à une activité équilibrée des deux types de cellules, ce qui est nécessaire pour contrôler l' homéostasie osseuse 7. Du fait de ces interactions régulatrices complexes, les réponses au traitement de la toxicomanie et de l' homéostasie osseuse ne peuvent être complètement examinés à l' aide des études in vitro. Par conséquent, il existe une forte demande pour des modèles animaux. En comparaison avec les paramètres de culture cellulaire, des modèles in vivo peut fournirdes informations précieuses sur les réseaux multicellulaires au sein de l'environnement de l'os.
De nombreux modèles de souris existent pour une variété de troubles osseux humains , y compris l' ostéoporose 16. Toutefois, la taille et l'accessibilité des embryons de souris représentent des limitations significatives pour l'imagerie en temps réel des processus squelettiques. Les petits poissons téléostéens, d'autre part, de servir comme une alternative intéressante pour l' imagerie in vivo. Zebrafish (Danio rerio) et medaka (Oryzias latipes) sont devenus des modèles animaux populaires pour la recherche du squelette au cours des deux dernières décennies 17, 19, 22, 24. Os dans les poissons téléostéens et chez les mammifères est très similaire, à la fois sur une structure et sur le plan physiologique, et la plupart des gènes régulateurs clés et les voies de signalisation sont conservés 3. Comme chez les mammifères, les poissons téléostéens réguler soigneusement l'activité des ostéoblastes et les ostéoclastes pour équilibrer la formation osseuse et la résorption 26. Plus important encore, la clarté optique de fiLes larves sh permet l'utilisation de rapporteurs fluorescents pour marquer les cellules osseuses et la matrice calcifiée squelettique 8, 9, 12, 21, 23, ce qui facilite l'observation des processus cellulaires chez l'animal vivant. En outre, une série d'outils génétiques a été généré pour faciliter la recherche biomédicale pertinente dans le poisson. Pour medaka en particulier, les méthodes pour la mutation du gène ciblé par CRISPR / cas9 2, cellule-lignage traçage 6, et transgénèse 14 ont été récemment mis en place et sont maintenant largement utilisées 15 spécifique au site.
Les larves de petite téléostéens ont été utilisés avec succès pour les écrans chimiques, qui ont conduit à la découverte de plusieurs médicaments pharmacologiquement pertinentes 1, 18.
Les larves de poissons sont tolérantes à de faibles concentrations de DMSO et sont capables d'absorber des composés à partir de leur environnement aquatique, que ce soit à travers la peau ou dans le tractus gastro - intestinal 1, 5. Notre laboratoire précédemment repdes lignes de medaka transgéniques qui expriment SOUTENUS reporters fluorescents dans les cellules osseuses sous le contrôle de divers osteoblast- et des promoteurs spécifiques des ostéoclastes. Ceux - ci comprennent les ostéoblastes prématurés (collagène 10a1, col10a1; osterix, osx) 20, 21, ostéoblastes matures (ostéocalcine, osc) 27, et les ostéoclastes (cathepsine K, ctsk) 24. Nous avons également généré une lignée transgénique qui exprime le facteur d'ostéoclastes induisant Activator Receptor du nucléaire facteur kB Ligand (RANKL) sous le contrôle d'un choc promoteur inductible de chaleur 24.
L'induction de RANKL dans ce système conduit à la formation ectopique des ostéoclastes actifs. Cela conduit à une augmentation de la résorption osseuse et un phénotype de l'ostéoporose comme sévère, avec considérablement réduit la minéralisation dans les corps vertébraux. Nous avons récemment montré que l'activité des ostéoclastes dans ce modèle peut être bloqué par le bisphosphonates étidronate et l'alendronate, two les médicaments couramment utilisés dans le traitement de l' ostéoporose humaine, validant ainsi médaka comme système de modèle approprié pour l' ostéoporose 27.
En raison de leur grande taille de la couvée, le développement rapide, et la petite taille des embryons, larves de medaka transgéniques sont particulièrement adaptés pour le criblage à grande échelle de médicaments contre l'ostéoporose et pour l'analyse in vivo du comportement des cellules osseuses. Des études en medaka peuvent donc compléter efficacement les expériences dans des cultures cellulaires et chez les souris qui sont destinées à la découverte de nouvelles cibles thérapeutiques et de nouvelles thérapies pour les troubles osseux humains.
Dans la présente étude, nous décrivons un protocole pour traiter medaka larves os reporter du médicament contre l'ostéoporose commune, alendronate. Nous décrivons également en détail comment les larves traitées sont montés et préparés pour l'imagerie en direct de la matrice osseuse et les cellules osseuses. Ces protocoles peuvent être facilement adaptés à d'autres petits composés chimiques qui travaillent soit comme anabolisant de l'os ou de la drogue antirésorptifs.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les expériences ont été réalisées conformément aux protocoles de l'Université nationale de Singapour (R14-293) Institutional Animal Care et utilisation Commission (IACUC) approuvés.
1. Les poissons Elevage et la collecte d'embryons
- Soulever WT, ctsk: nlGFP 24, RANKL: HSE: CFP 24 et osx: mCherry 21 simple ou medaka poisson composé transgénique à 26 ° C sous un cycle de lumière contrôlée (14 h de lumière, 10 h foncé) pour induire la ponte.
- frai Daily a lieu pendant les 30 premières minutes après le feu est allumé. Les œufs collent ensemble à travers des filaments et attachent à l'abdomen de la femelle pendant plusieurs heures. Utilisez un filet à mailles fines pour attraper un adulte de sexe féminin portant une grappe d'oeufs. Que le poisson se reposer brièvement dans le filet, puis masser doucement le ventre du poisson pour enlever soigneusement la grappe de l'ovule fécondé de l'abdomen de la femelle.
NOTE: Une femme saine medakapeut produire 10 - 20 oeufs par jour pendant environ 5 mois. - Placez les oeufs dans une boîte de Petri en plastique de 60 mm. Utiliser une pipette en plastique pour rincer les embryons avec 5 - Solution (poisson de milieu de 10 ml de 0,3 x Danieau; mM de NaCl 19,3 mM , KCl 0,23, 0,13 mM MgSO4, mM de Ca 0,2 (NO 3) 2 et 1,7 mM d' HEPES, pH 7.0). Ajouter 1 ml de 0,25% (p / v) de bleu de méthylène solution mère à 2,5 L de milieu de poissons pour empêcher la croissance fongique.
- Roulez doucement amas d'oeufs pour former un noeud de filaments de fixation. Utilisez une pince pour retirer soigneusement les filaments de fixation des grappes d'oeufs fertilisés pour obtenir des embryons individuels (Figure 1A).
- Stade , les embryons selon Iwamatsu 2004 13.
- Culture 20 - 30 embryons par 60 mm en plastique boîte de Pétri dans un incubateur à 28 °. Changer le support quotidien pour assurer le développement normal des embryons.
NOTE: Le temps autour de la scène de l'éclosion (8-9 d post-fécondation,DPF) est particulièrement critique pour la survie. Retirer chorions flottant librement à maintenir le milieu propre et pour assurer un bon taux de survie des larves.
2. Transgenic Embryo Screening
- Utilisez un stéréomicroscope équipé d'une lampe à mercure pour l'imagerie de fluorescence et la GFP, RFP, et les filtres de la PCP pour dépister les embryons transgéniques pour l'expression de rapporteur fluorescent en utilisant un grossissement de 40X.
- Visuellement identifier osx: mCherry embryons par mCherry journaliste expression au début de formation des os crâniens, comme le cleithrum, sur les deux côtés de la tête postérieure (figure 1B, flèche), et le parasphénoïde, dans une position centrale dans le crâne ventral ( Figure 1B, flèche).
NOTE: expression Reporter commence à partir de 5 DPF partir 21. - Identifier ctsk: nlGFP embryons par expression nlGFP forte dans la tête (figure 1C, flèche) et la queue (figure 1C, flèche), à partir de6 DPF.
NOTE: les ostéoclastes endogènes forment seulement après 21 DPF. cellules à ce stade précoce (6 DPF) nlGFP exprimant ne sont pas ostéoclastes , mais d' autres, jusqu'à présent non caractérisé, CTSK cellules -positifs 24. - Identifier RANKL: HSE: PCP embryons transgéniques par l' expression omniprésente PCP après un traitement à court choc thermique pendant 20 min à 39 ° C, menée à 2 DPF ou tard à des fins de dépistage.
NOTE: Le RANKL et CFP transgènes sont sous le contrôle du même bidirectionnel Element choc thermique (HSE). Expression PCP indique RANKL réussie induction 24. - Effectuer un 1,5 - traitement de choc thermique de 2 h à 9 DPF ou tard pour induire un grand nombre d'ostéoclastes ectopiques dans la région du tronc, ce qui entraîne par conséquent dans un phénotype de l' ostéoporose comme 24.
NOTE: L'expression de RANKL Transgenic induite à 9 résultats DPF dans une activation ectopique de cellules ostéoclastes progénitrices dormantes, qui ne se déclenche pas de façon endogèneavant le 21 DPF. Utilisez un bain d'eau pour obtenir la stabilité 39 ° C conditions. Laissez les embryons de medaka boîte de Pétri contenant flottent à la surface de l'eau. Assurez-vous que le couvercle de la boîte de Pétri est sec pour éviter le naufrage du plat. - Embryons d'écran à partir des lignes de composés, tels que RANKL: HSE: CFP / ctsk: nlGFP double transgénique et osx: mCherry / RANKL: HSE: CFP / ctsk: nlGFP triple transgénique, selon le modèle d'expression de chaque transgène individuel.
NOTE: Les embryons transgéniques hémizygotes et homozygotes ont été distingués par différents niveaux du transgène rapporteur de fluorescence. les embryons homozygotes avaient une intensité de fluorescence qui a été à peu près doublée par rapport à celle des plantes transgéniques hémizygotes. Lignes de composés qui étaient homozygotes pour les deux RANKL: HSE: PCP et ctsk: nlGFP ont été obtenus par incrossing répétée sur plusieurs générations. Pour triple transgénique osx: mCherry / RANKL: HSE: CFP / ctsk: nlGFP poissons, RANKL homozygote: HSE: CFP / ctsk: poissons nlGFP ont été croisés avec osx homozygote: transporteurs mCherry. La descendance triple transgénique hétérozygote résultant ont été soulevées et incrossed pour obtenir des embryons homozygotes pour RANKL: HSE: CFP. Le RANKL: HSE: CFP transgène doit être homozygote pour obtenir l'induction efficace des ostéoclastes ectopiques.
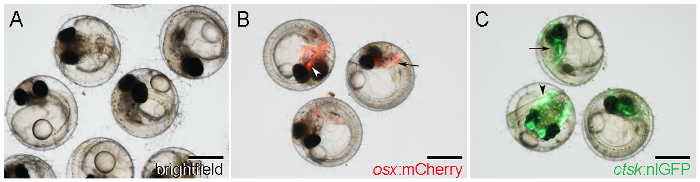
Figure 1: WT et Transgenic Medaka Embryons à 7 D post - fécondation (DPF). A. WT embryons observés avec un éclairage en fond clair. B. Embryons transgéniques montrant osx: mCherry expression autour de la cleithrum (flèche) et parasphénoïde (flèche). C. Embryons transgéniques montrant ctsk: expression nlGFP dans la tête (flèche) et la queue (flèche). Barres d'échelle: 500 um.025 / 55025fig1large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
3. Traitement des bisphosphonates Medaka Larves
- Préparer des solutions contenant différentes concentrations de bisphosphonates (BPS) pour des études dose-réponse.
NOTE: Le BP exemplaire utilisé dans ce protocole est alendronate.- Dissoudre l'alendronate dans le milieu de poisson à une concentration de 100 pg / mL pour préparer une solution de stock.
- Utilisez un mélangeur vortex pour assurer la dissolution complète. Conserver la solution mère à 4 ° C.
- Préparer des solutions différentes de travail en diluant la solution mère avec le milieu de poisson à une série de concentrations ( par exemple, 25, 37,5, 50, 62,5 et 75 ug / ml).
REMARQUE: Différents médicaments peuvent avoir différentes absorption, distribution, métabolisme et excrétion (ADME) les paramètres qui doivent être pris en compte lors des essais en utilisant ce système de larves de medaka. En outre, la solubilité et la stabilité médicaments peuvent varier quandappliqué sous forme de solution aqueuse. des composés solubles dans l'eau peuvent avoir besoin de moins d'abord être dissous dans des solvants organiques tels que le DMSO. Dans ce cas, une solution mère est préparée dans du DMSO, qui est ensuite diluée dans un milieu de poisson. Notez que les solutions de travail dans (milieu de poissons) de l'eau peuvent être stockés dans le réfrigérateur pendant plusieurs semaines. Cependant, les solutions contenant du DMSO doivent être stockés à température ambiante pour empêcher la cristallisation.
- Transfert medaka larves dans des plaques à six puits (six larves / puits) pour BP (alendronate) traitement ultérieur.
- Retirez le support de poissons soigneusement à l'aide d'une pipette en plastique propre et ajouter un petit volume (env. 0,5 mL) de solution alendronate à chaque puits.
- Évitez milieu de restes de poisson, comme la solution BP ajoutée pourrait être diluée, ce qui est particulièrement critique pour les solutions de alendronate moins concentrées.
- Retirer un petit volume de solution d'alendronate (jusqu'à 0,5 ml) de chaque puits avec une pipette en plastique propre et le remplacer par un plus grand volumoi (4 ml) de solution alendronate.
- Changer le milieu tous les jours pour assurer le développement d'embryons normaux.
4. Coloration en direct de la matrice minéralisée-os
- Dissoudre 0,5 g d'Alizarine complexone (ALC, l'acide 3-Alizarine-méthyliminodiacétique), soit 0,05 g de calcéine dans 50 ml de milieu de poisson pour préparer 1% et 0,1% des solutions mères, respectivement. Utilisez un mélangeur vortex pour assurer la dissolution complète.
REMARQUE: moyenne du poisson sans l'addition de bleu de méthylène est utilisé dans la présente et les étapes suivantes pour réduire l'autofluorescence dans les larves. - Utilisez un filtre de seringue et à usage unique (0,2 um) pour filtrer la solution de coloration. Conserver la solution filtrée dans l'obscurité à la température ambiante.
NOTE: La couleur de la solution filtrée de coloration ALC clair est jaune foncé à l'orange. La couleur de la solution de calcéine claire filtrée est jaune vif. Les solutions peuvent être utilisées pendant plusieurs mois. - Diluer la solution ALC ou calcéine stocks filtré 1:10 en milieu de poissonet incuber les larves de medaka pendant 1,5 - 2 h (solution ALC 0,1%) ou 2 - 2,5 heures (solution de calcéine 0,01%) dans un incubateur à 28 ° si les larves entre 9 et 17 DPF sont utilisés. Gardez les échantillons dans l'obscurité.
- Transfert des larves à un milieu de poisson frais à l'aide d'une pipette en plastique propre.
- Retirez le support de poisson avec une pipette en plastique propre et ajouter du milieu de poisson frais. Répétez cette étape pour 3 - 4 fois jusqu'à ce qu'aucune solution rouge- ou jaune teinté (ALC ou calcéine, respectivement) qui reste. Laisser les larves de poisson dans le milieu pendant 30 - 60 minutes avant de les monter pour l'imagerie afin d'éviter épifluorescence du milieu.
NOTE: 0,1% solution de coloration ALC est nocif pour les larves de medaka pour des temps d'exposition prolongée. Des temps d'incubation de plus de 2 h affectent la survie des larves. La concentration et le temps de coloration doivent donc être optimisés pour les différentes étapes pour atteindre la survie de l'embryon et de coloration des résultats optimaux.
5. direct Fluorescence Imaging p>
- Anesthetize les larves de medaka avec 0,01% Tricaine (éthyl méthanesulfonate 3-aminobenzoate) en milieu de poisson.
NOTE: anesthésiés larves deviennent immobilisées au bout de 5 - 10 min dans une solution Tricaine et habituellement sont couchés soit sur leurs côtés ou le dos. - Utiliser un microloader plastique pour orienter les larves en fonction de la région d'intérêt. L'orientation des larves utilisées dans ce protocole est latéral.
- Utilisez un stéréomicroscope avec fluorescence illumination pour l'imagerie. Utilisez un grossissement élevé lors de la prise d'images, en se concentrant sur les différentes parties des larves (tête, tronc antérieur, tronc postérieur, et la queue). Assemblez les images individuelles ensemble au chevauchement des régions en utilisant un logiciel de traitement d' image approprié (empiècements de la figure 3G).
NOTE: Cela contribue à améliorer la qualité d'image de toutes les parties du corps concernées dans le plan focal correct. - Retour les larves au milieu de poissons pour la récupération après l'imagerie.
- Anesthetize les larves avec 0,01% Tricaine en milieu de poisson pendant 5 - 10 min jusqu'à ce qu'ils deviennent immobilisés.
- Dissoudre l'agarose à faible point de fusion à 1,5% dans un milieu de poisson en le chauffant dans un four à micro-ondes. Refroidir cette solution à environ 30 ° C.
- Ajouter 0,5 - 1 ml de liquide de 1,5% à faible point de fusion d'agarose en milieu de poisson à une boîte de Pétri à fond de verre. Transférer les larves anesthésiés dans la solution à l'aide d'une pipette en plastique propre.
REMARQUE: Prenez des précautions particulières que la température du liquide à faible point de fusion d'agarose est suffisamment faible pour ne pas nuire aux larves. - Avant la solidification d'agarose, en utilisant une microloader plastique pour pousser les larves au fond de la boîte de Petri et orienter les larves en fonction de la région d'intérêt. L'orientation des larves utilisées dans ce protocole est latéral.
NOTE: Les échantillons sont prêts pour l'imagerie confocale en direct après l'agarose se solidifie complètement. - Utilisez un microscope confocal à Acqimages UIRE.
- Utilisez une ligne de laser 543 nm pour les analyses mCherry et ALC coloration. Utilisez une ligne laser à 488 nm pour nlGFP et analyse calcéine coloration.
- Après l'imagerie, ajouter du milieu de poisson à la boîte de Pétri et d'utiliser une paire de fines aiguilles de seringues (27 G x 1½ ") pour retirer soigneusement les larves de l'agarose. Transférer les larves avec résiduellement fixé agarose à une boîte de Pétri avec un milieu de poissons pour récupérer .
- Traiter les images à l' aide d' un logiciel d'analyse d'images 27.
Access restricted. Please log in or start a trial to view this content.
Résultats
nombre d'œufs abondantes, ainsi que la petite taille des larves, font medaka un excellent modèle pour le dépistage des drogues. Une plaque à six puits unique a été utilisé pour la culture jusqu'à 36 larves, ce qui est suffisant pour fournir des données statistiquement significatives. Un autre grand avantage de l'utilisation du poisson pour l'analyse du squelette est la possibilité de faire l'imagerie en direct. La transparence des larves de poisson permet d'utiliser des protéines fluor...
Access restricted. Please log in or start a trial to view this content.
Discussion
Étapes critiques dans le Protocole
Il est essentiel que les conditions pour le traitement de choc thermique sont cohérentes et stables lorsque l'on compare les différents échantillons. Des conditions de température stables assurent des niveaux similaires de RANKL induction dans les larves transgéniques et, par conséquent, la formation des ostéoclastes comparables, ce qui peut être confirmé par criblage ctsk: Expression nlGFP. En fin de compte, ce qui conduit à un degré ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun conflit d'intérêts ou financiers.
Remerciements
Ce projet a été financé par des subventions du ministère singapourien de l'Education (MOE, numéro de subvention 2013-T2-2-126) et l'Institut national de la santé, États-Unis (NIH, numéro 1R21AT008452-01A1 accorder). TY a reçu une bourse d'études supérieures du Département des sciences biologiques NUS. Nous remercions l'unité confocale du Centre NUS pour les sciences BioImaging (CBIS) pour leur soutien constant.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Alendronate | Sigma | A4978 | |
| alizarin-3-methyliminodiacetic acid, Alizarin Complexone | Sigma | A3882 | |
| Calcein | Sigma | C0875 | |
| ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma | A5040 | |
| ImageJ (1.4.3.67) | National Institute of Health (NIH) | https://imagej.nih.gov/ij/ | |
| LSM 510 Meta confocal | Zeiss | ||
| LSM Image Browser (4.2.0.121) | Zeiss | http://www.zeiss.com/microscopy/en_de/downloads/lsm-5-series.html | |
| Micro-loader | Eppendorf | 5242956003 | Eppendorf ep T.I.P.S 20 μL |
| NIS-Elements BR 3.0 software | Nikon | ||
| Photoshop CS6 (13.0.0.0) | Adobe | ||
| SMZ1000 stereomicroscope | Nikon |
Références
- Ablain, J., Zon, L. I. Of fish and men: using zebrafish to fight human diseases. Trends Cell Biol. 23 (12), 584-586 (2013).
- Ansai, S., Kinoshita, M. Targeted mutagenesis using CRISPR/Cas system in medaka. Biol Open. 3 (5), 362-371 (2014).
- Apschner, A., Schulte-Merker, S., Witten, P. E. Not all bones are created equal-using zebrafish and other teleost species in osteogenesis research. Methods Cell Biol. 105, 239-255 (2011).
- Bajoghli, B., Aghaallaei, N., Heimbucher, T., Czerny, T. An artificial promoter construct for heat-inducible misexpression during fish embryogenesis. Dev Biol. 271 (2), 416-430 (2004).
- Barrett, R., Chappell, C., Quick, M., Fleming, A. A rapid, high content, in vivo model of glucocorticoid-induced osteoporosis. Biotechnol J. 1 (6), 651-655 (2006).
- Centanin, L., Ander, J. J., Hoeckendorf, B., Lust, K., Kellner, T., Kraemer, I., Urbany, C., Hasel, E., Harris, W. A., Simons, B. D., et al. Exclusive multipotency and preferential asymmetric divisions in post-embryonic neural stem cells of the fish retina. Development. 141 (18), 3472-3482 (2014).
- Charles, J. F., Aliprantis, A. O. Osteoclasts: more than 'bone eaters. Trends Mol Med. 20 (8), 449-459 (2014).
- DeLaurier, A., Eames, B. F., Blanco-Sanchez, B., Peng, G., He, X., Swartz, M. E., Ullmann, B., Westerfield, M., Kimmel, C. B. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505-511 (2010).
- Du, S. J., Frenkel, V., Kindschi, G., Zohar, Y. Visualizing normal and defective bone development in zebrafish embryos using the fluorescent chromophore calcein. Dev Biol. 238 (2), 239-246 (2001).
- Eriksen, E. F. Cellular mechanisms of bone remodeling. Rev Endocr Metab Disord. 11 (4), 219-227 (2010).
- Hockendorf, B., Thumberger, T., Wittbrodt, J. Quantitative analysis of embryogenesis: a perspective for light sheet microscopy. Dev Cell. 23 (6), 1111-1120 (2012).
- Inohaya, K., Takano, Y., Kudo, A. The teleost intervertebral region acts as a growth center of the centrum: in vivo visualization of osteoblasts and their progenitors in transgenic fish. Dev Dyn. 236 (11), 3031-3046 (2007).
- Iwamatsu, T. Stages of normal development in the medaka Oryzias latipes. Mech Dev. 121 (7), 605-618 (2004).
- Kirchmaier, S., Hockendorf, B., Moller, E. K., Bornhorst, D., Spitz, F., Wittbrodt, J. Efficient site-specific transgenesis and enhancer activity tests in medaka using PhiC31 integrase. Development. 140 (20), 4287-4295 (2013).
- Kirchmaier, S., Naruse, K., Wittbrodt, J., Loosli, F. The genomic and genetic toolbox of the teleost medaka (Oryzias latipes). Genetics. 199 (4), 905-918 (2015).
- Komori, T. Animal models for osteoporosis. Eur J Pharmacol. 759, 287-294 (2015).
- Mackay, E. W., Apschner, A., Schulte-Merker, S. A bone to pick with zebrafish. Bonekey Rep. 2, 445(2013).
- MacRae, C. A., Peterson, R. T. Zebrafish as tools for drug discovery. Nat Rev Drug Discov. 14 (10), 721-731 (2015).
- Mitchell, R. E., Huitema, L. F., Skinner, R. E., Brunt, L. H., Severn, C., Schulte-Merker, S., Hammond, C. L. New tools for studying osteoarthritis genetics in zebrafish. Osteoarthritis Cartilage. 21 (2), 269-278 (2013).
- Renn, J., Buttner, A., To, T. T., Chan, S. J., Winkler, C. A col10a1:nlGFP transgenic line displays putative osteoblast precursors at the medaka notochordal sheath prior to mineralization. Dev Biol. 381 (1), 134-143 (2013).
- Renn, J., Winkler, C. Osterix-mCherry transgenic medaka for in vivo imaging of bone formation. Dev Dyn. 238 (1), 241-248 (2009).
- Schilling, T. F., Kimmel, C. B. Segment and cell type lineage restrictions during pharyngeal arch development in the zebrafish embryo. Development. 120 (3), 483-494 (1994).
- Spoorendonk, K. M., Peterson-Maduro, J., Renn, J., Trowe, T., Kranenbarg, S., Winkler, C., Schulte-Merker, S. Retinoic acid and Cyp26b1 are critical regulators of osteogenesis in the axial skeleton. Development. 135 (22), 3765-3774 (2008).
- To, T. T., Witten, P. E., Renn, J., Bhattacharya, D., Huysseune, A., Winkler, C. Rankl-induced osteoclastogenesis leads to loss of mineralization in a medaka osteoporosis model. Development. 139 (1), 141-150 (2012).
- Wakamatsu, Y., Pristyazhnyuk, S., Kinoshita, M., Tanaka, M., Ozato, K. The see-through medaka: a fish model that is transparent throughout life. Proc Natl Acad Sci USA. 98 (18), 10046-10050 (2001).
- Witten, P. E., Huysseune, A. A comparative view on mechanisms and functions of skeletal remodelling in teleost fish, with special emphasis on osteoclasts and their function. Biol Rev Camb Philos Soc. 84 (2), 315-346 (2009).
- Yu, T., Witten, P. E., Huysseune, A., Buettner, A., To, T. T., Winkler, C. Live imaging of osteoclast inhibition by bisphosphonates in a medaka osteoporosis model. Dis Model Mech. 9 (2), 155-163 (2016).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon