Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation et évaluation des
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Here, we describe a protocol for radiolabeling and in vivo testing of tridentate 99mTc(I) chelate-tetrazine derivatives for pre-targeting and bioorthogonal chemistry.
Résumé
Pre-targeting combined with bioorthogonal chemistry is emerging as an effective way to create new radiopharmaceuticals. Of the methods available, the inverse electron demand Diels-Alder (IEDDA) cycloaddition between a radiolabeled tetrazines and trans-cyclooctene (TCO) linked to a biomolecule has proven to be a highly effective bioorthogonal approach to imaging specific biological targets. Despite the fact that technetium-99m remains the most widely used isotope in diagnostic nuclear medicine, there is a scarcity of methods for preparing 99mTc-labeled tetrazines. Herein we report the preparation of a family of tridentate-chelate-tetrazine derivatives and their Tc(I) complexes. These hitherto unknown compounds were radiolabeled with 99mTc using a microwave-assisted method in 31% to 83% radiochemical yield. The products are stable in saline and PBS and react rapidly with TCO derivatives in vitro. Their in vivo pre-targeting abilities were demonstrated using a TCO-bisphosphonate (TCO-BP) derivative that localizes to regions of active bone metabolism or injury. In murine studies, the 99mTc-tetrazines showed high activity concentrations in knees and shoulder joints, which was not observed when experiments were performed in the absence of TCO-BP. The overall uptake in non-target organs and pharmacokinetics varied greatly depending on the nature of the linker and polarity of the chelate.
Introduction
99m Tc reste le radio - isotope dominant utilisé en médecine nucléaire diagnostique, avec plus de 50 millions de procédures d'imagerie effectuées par an dans le monde entier 1, 2, 3. La majorité des agents 99m Tc utilisés cliniquement sont radiopharmaceutiques de type perfusion. Il y a un nombre limité de composés activement ciblés dans lesquels 99m Tc est dirigé pour lier un biomarqueur spécifique à travers la ligature à une construction de ciblage. La création de 99m ciblée radiopharmaceutiques Tc est souvent entravée par l'influence de 99m complexes Tc-ligand sur la capacité de la molécule de ciblage pour lier le biomarqueur d'intérêt, ou les isotopes demi-vie est pas assez long pour une utilisation avec des biomolécules de poids moléculaire élevé telles que des anticorps. Ce dernier nécessite généralement plusieurs jours avant que les images sont acquises pour que la biomolécule pour effacer de la non-cible tiss ues. Pré-ciblage propose une approche alternative pour surmonter ces défis.
Pré-ciblage combinée avec la chimie bioorthogonal a été montré pour être un moyen efficace de développer de nouvelles sondes d'imagerie moléculaire à la fois pour la fluorescence et la radio-imagerie 4, 5, 6, 7, 8. La réaction de la demande d'électrons inverse de Diels-Alder (IEDDA) entre 1,2,4,5-tétrazine (Tz) et -cyclooctene trans (TCO) , ses dérivés, comme le montre la figure 1, a été montré comme étant particulièrement efficace 6. La réaction IEDDA avec ces composants peut présenter une cinétique rapide dans du PBS (k 2 ≈ 6.000 M -1 s -1) et une sélectivité élevée, le rendant idéal pour des applications in vivo pré-ciblage 9, 10.
e_content "> L'approche la plus couramment utilisée consiste à administrer un vecteur de ciblage TCO dérivés et à la suite d' une période de retard suffisant, un tétrazine radiomarqué est administré. tétrazines radiomarqués sur la base de 11 C, 18 F, 64 Cu, 89 Zr, et 111 en ont été rapporté 11, 12, 13, 14, 15. en revanche, il n'y a qu'un seul rapport d'une 99mTc marqué Tz, qui a été préparé en utilisant un ligand de type HYNIC nécessitant l'utilisation de co-ligands pour éviter la liaison aux protéines et à la dégradation in vivo , 16. a titre d'alternative, nous rapportons ici la synthèse de 99mTc (I) marqué tétrazines en utilisant une famille de ligands qui forment des complexes stables avec un tridentate [99mTc (CO) 3] + noyau. 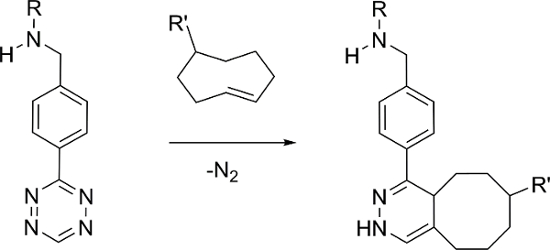
Figure 1: La réaction IEDDA bioorthogonal entre tétrazine et -cyclooctene trans. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
La famille de ligands préparés contiennent des chélates tridentés qui varient en polarité et de la nature du groupe de liaison entre la région de liaison métallique et la Tz (figure 2). L'objectif était d'identifier un 99m Tc-tétrazine construire qui pourrait efficacement localiser et de réagir avec des sites TCO marqués in vivo et rapidement clair lorsqu'ils ne sont pas liés, afin de produire une valeur cible élevée à non-cible ratios. Pour tester les ligands, un TCO-dérivé d'un bisphosphonate (TCO-BP) a été utilisé 17. Nous avons montré précédemment que le TCO-BP se localise dans les zones du métabolisme osseux actif et peut réagir avectétrazines radiomarqués in vivo 18. Il est un réactif commode pour tester de nouveaux tétrazines, car il peut être préparé en une seule étape et les expériences peuvent être effectuées chez des souris normales lorsque la localisation a lieu principalement au niveau des articulations (genoux et des épaules).
Access restricted. Please log in or start a trial to view this content.
Protocole
Les études animales ont été approuvées par le Comité d'éthique de la recherche animale à l'Université McMaster en conformité avec Conseil canadien de protection des animaux (CCPA) Lignes directrices.
1. Ligands de radiomarquage Tz-tridentate avec 99mTc
ATTENTION: Les procédures suivantes nécessitent l'utilisation de composés radioactifs. Le travail ne doit être effectué dans un laboratoire agréé par le respect des règles de sécurité et d'élimination. Les réactions à micro-ondes doivent être effectuées dans un four micro-ondes conçu spécifiquement pour la synthèse chimique.
- Synthèse du [99mTc (CO) 3 (H 2 O) 3] + 19, 20
- Dans un flacon à micro - ondes, mélanger 8 mg de K 2 [BH 3 CO 2], 15 mg de Na 2 CO 3, 20 mg de Na 2 B 4 O 7 · 10H 2 O et 25 mg KOCO [CH (OH)]2 COONa · 4H 2 O. Purge le flacon pendant 10 minutes avec du gaz argon.
- Ajouter 4 ml de 99m TcO 4 - (~ 1100 MBq, ~ 30 mCi) dans du sérum physiologique à 0,9% au flacon.
- Chauffer le mélange réactionnel dans un micro-ondes pendant 3,5 minutes à 110 ° C, après 10 s d'agitation pour assurer un mélange intime des réactifs.
- Ajuster le pH de la solution à 3,5-4 à l'aide ~ 400 ul de HCl 1 M. Vérifiez en utilisant du papier pH.
- Radiomarquage des ligands 1-5 tétrazine
- Dissoudre 2 mg de chaque ligand (composés 1-5) dans 250 ul de MeOH 21.
- Ajouter 250 ul de [99mTc (CO) 3 (H 2 O) 3] + (~ 74 MBq ~ 2 mCi) à chaque solution.
- Chauffer le mélange réactionnel à l'aide d'un four micro-ondes pendant 20 min à 60 ° C.
REMARQUE: Cette étape est identique pour tous les 5 tétrazines. - Pour les composés 2 à 5, évaporer le solvant et re-dissolve les produits obtenus dans 1 ml de 1: 1 v / v DCM: TFA.
- Chauffer les produits réactionnels dissous (2-5) à 60 ° C dans un four micro - ondes pendant 6 min (2-4) ou 10 min (5).
- Après refroidissement à température ambiante, évaporer le solvant en utilisant un évaporateur (36 ° C, de 8 mbar, 3 min, 6000 rpm) et on dissout le composé séché dans 1: 1 d' ACN: H 2 O ou 1: 1 MeOH: H 2 O, avant la purification par HPLC.
- Purifier les 99m Tc-composés marqués (1-5), y compris la séparation du produit marqué du ligand tétrazine non marqué, par HPLC (C 18 en phase inverse). Typiquement, en utilisant un gradient d'élution de 30:70 d' ACN: H 2 O (tous deux avec 0,1% de TFA) à 40:60 d' ACN: H 2 O de plus de 20 min (18 min) et une colonne 4,6 x 100 mm C 18 analytique. Utilisez les deux UV (254 nm) et la détection gamma.
- Prenez un petit échantillon de chaque produit étiqueté et de comparer son temps de rétention HPLC à celle d'un co-injète, non radioactif, norme réétiquetée (0,125 mg dans 20% de méthanol-H 2 O). La norme de Re-marqué est identifié dans la trace HPLC UV, et éluer en même temps que le 99m Tc composé marqué dans la trace γ-HPLC. Cette co-injection présente des pics aux temps de rétention comparable, ce qui confirme l'identité du composé 99m marqué par Tc.
- On évapore le solvant des fractions HPLC en utilisant un évaporateur (36 ° C, de 8 mbar, 3 min, 6000 rpm).
- Formuler le composé purifié à une concentration de 7,4 kBq / pl dans du PBS contenant 0,5% de BSA et 0,01% de Tween-80.
- Pour garantir que les composés marqués sont stables, effectuer une étude in vitro de la stabilité. Incuber le composé formulé à 37 ° C pendant 1, 4 et 6 h, en injectant une petite quantité (3,7 MBq) du mélange sur la HPLC à chaque point de temps pour évaluer la stabilité.
2. Les études Bio-distribution de pré-ciblés
- Préparation des animaux
- Utilisation de vieux 7-9 semaine souris Balb / c, femelles (n = 3), administrer TCO-BP formulé dans une solution saline (20 mg / kg) (5 ug / ul), par injection de queue veineuse.
- Placez la souris dans le dispositif de contrainte physique, et d'identifier les veines situées sur les surfaces latérales de la queue et essuyer avec un tampon imbibé d'alcool. À environ 2 cm de l'extrémité de la queue, à insérer une aiguille de calibre 30 à un angle faible, parallèlement à la veine. Appuyer lentement sur le piston pour injecter, retirer l'aiguille et appliquer éponge propre et de gaze sur le site d'injection avec une légère pression jusqu'à ce que le saignement cesse.
- À 1 h après l' injection de TCO-BP, administrer ~ 0,74 MBq (20 uCi) de 99mTc-tétrazine formulés dans 100 ul de 0,5% de BSA, 0,01% de Tween-80 dans du PBS, par injection de la veine de queue.
- Études Bio de distribution
- Au point de temps désiré (t = 6 h), anesthésier les souris en utilisant 3% d'isoflurane et le mélange de gaz d'oxygène de 2%. Démontrer àe pincée retrait sur la souris anesthésiée pour assurer qu'ils sont sous plan chirurgical de l'anesthésie.
- Recueillir du sang (1 ml) par ponction cardiaque en utilisant une seringue pré-traitée avec de l'héparine. Placez la souris sur le dos avec le nez dans le cône de nez pour l'anesthésie continue et de localiser le processus xiphoïde sur l'animal.
- Insérez une aiguille G 25, légèrement à gauche de la ligne médiane de l'animal dans le cadre du processus xiphoïde, à un angle de 20 °. Insérez complètement l'aiguille et tirez lentement sur le piston pour voir le sang dans le moyeu de l'aiguille si le cœur a été perforé. Légèrement réajuster l'aiguille tout en maintenant le piston si nécessaire, pour percer le cœur. Aspirez lentement le sang dans la seringue.
- Euthanasier l'animal par dislocation cervicale, alors que sous anesthésie.
- Placez chaque animal dans un sac en plastique et utiliser un calibrateur de dose (99m Tc de réglage) pour mesurer l'ensemble du niveau d'activité du corps.
- Recueillir les tissus et les fluides suivants en pré-peséeed compter tubes: le sang, les os (genou et de l'épaule), la vésicule biliaire, les reins, le foie, l'estomac (avec le contenu), l'intestin grêle (avec contenu), gros intestin et le caecum (avec contenu), de la thyroïde et de la trachée, de la vessie avec de l'urine , et la queue.
- Rincer les tissus appropriés (à l'exclusion du sang, de la vésicule biliaire et de la vessie) dans PBS pour éliminer le sang et le sécher avant de placer les tissus dans des tubes de comptage appropriés.
- Placez la carcasse de l'animal dans un sac en plastique et mesurer l'activité du corps entier résiduel en utilisant un calibrateur de dose.
- Peser chaque tube contenant un échantillon de tissu. Soustraire poids initial du tube pour obtenir la masse du tissu.
- Utiliser un calibreur de dose (99m de réglage Tc) pour mesurer la quantité d'activité dans un échantillon d'essai (100 ul) au moment de l' injection pour chaque souris.
REMARQUE: Cet échantillon d'essai est égal au volume d'injection, ce qui donne le compte de l'activité au moment de l'injection. - Au moment de la mesure de tissu, unliquot 5 ul de l'échantillon d'essai utilisé précédemment. Utilisez un compteur gamma multi-détecteur (99m de réglage Tc) et compter pour obtenir le nombre par minute (CPM) pour l'échantillon d'essai de 5 pi.
- Utilisez les deux valeurs obtenues en 2.2.9 et 2.2.10 pour calculer l'activité et la relation CPM en utilisant l' équation 1 pour obtenir un facteur de conversion (CPM uCi -1).
(1)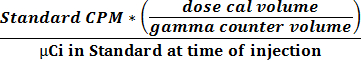
- Utiliser le compteur de rayons gamma pour mesurer la quantité de radioactivité dans chaque échantillon de tissu ou de fluide.
- Utiliser l'équation 1 pour calculer la quantité d'activité dans chaque tissu ou de liquide au moment de la mesure par rapport à la dose totale injectée. Cette valeur est ensuite normalisée en fonction du poids des organes et rapportée comme dose injectée par gramme pour cent ( par exemple,% ID / g) de tissu.
- Suivez les étapes 2.1.2 à 2.2.13 pour mener une expérience de contrôle négatif en utilisant les 99m Tc marqué ligands tétrazine dans le Absence du TCO-BP. Sacrifice des souris (n = 3) après l'injection de 0,5, 1, 4 et 6 h, et d'obtenir un tissu ou d'un fluide tel que décrit ci-dessus.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les ligands ont été synthétisés en utilisant différents agents de liaison et des chélateurs via une stratégie simple d'amination réductrice (figure 2), suivie par le couplage du produit à un tétrazine disponible dans le commerce 22, 23. Le radiomarquage a été réalisé en utilisant la même méthode que pour tous les composés et a été hautement reproductible. Le processus a été optimisé en f...
Access restricted. Please log in or start a trial to view this content.
Discussion
Une collection de tridentes chélates tétrazine liés de différentes polarités a été préparé, et l'utilité de leurs complexes 99m Tc dans la réaction IEDDA avec un dérivé TCO in vivo a été évaluée. Un procédé de marquage 99mTc efficace et reproductible a été développée pendant cinq tétrazine chelates, où la concentration de ligand était de 10 -3 M. L'étape de marquage est suivie par une déprotection des groupes butyle T- (pour les compo...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors declare they have no competing financial interests.
Remerciements
This work supported by research grant funding from the Natural Sciences and Engineering Research Council (NSERC) of Canada, the Ontario Institute for Cancer Research (OICR, #P.SI.015.8), and the Canadian Cancer Society (CCS, #703857). The authors acknowledge the contributions of Dr. Denis Snider who provided assistance in preparing the manuscript.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Argon gas | Alphagaz | --- | --- |
| Na2CO3 | EMD Millipore | 106395 | --- |
| Na2B4O7·10H2O | Anachemia | S9640 | --- |
| KNaC4H4O6·4H2O | Anachemia | 217255 | --- |
| Technelite 99mTc generator | Lantheus medical imaging | --- | Source of 99mTcO4- |
| 0.9% Saline | Lantheus medical imaging | --- | To elute generator |
| 1 M HCl | Lab Chem | --- | --- |
| MeOH | Caledon | --- | --- |
| ACN | Caledon | --- | HPLC grade |
| Millipore H2O | Thermo Fisher Scientific | Barnstead Nanopure | --- |
| DCM | Caledon | --- | --- |
| TFA | Caledon | --- | --- |
| PBS | Thermo Fisher Scientific | 10010023 | pH 7.4 1x |
| BSA | Sigma Aldrich | A7906 | --- |
| Tween80 | Sigma Aldrich | P8047 | --- |
| Isoflurane | CDMV | 108737 | Supplier: Fresenius Kabi Animal Health |
| HPLC | Waters | 1525 Binary Pump, 2998 Photodiodde Array Detector, E-SAT/IN, Bioscan Flowcount PMT detector (item # 15590) | --- |
| HPLC column for analysis and purification of compounds 2-4 | Phenomenex | 00G-4435-E0 | Gemini® 5 µm C18 110 Å, LC Column 250 x 4.6 mm |
| HPLC column for analysis and purification of compounds 1 and 5 | Waters | 186003115 | XBridge BEH C18 Column, 130 Å, 5 µm, 4.6 mm x 100 mm |
| Microwave Reactor | Biotage | Initiator 8 | --- |
| Biotage V10 Evaporator | Biotage | Serial # V1041 | --- |
| Dose calibrator | Capintec, Inc. | CRC-25R | --- |
| Gamma counter | Perkin Elmer | Wizard 1470 Automatic Gamma Counter | --- |
| Animal room scale | Mettler Toledo | XP105 Delta Range | --- |
| Microwave vials | Biotage | 355629 | 0.5-2 mL |
Références
- Jurisson, S. S., Lydon, J. D. Potential Technetium Small Molecule Radiopharmaceuticals. Chem. Rev. 99 (9), 2205-2218 (1999).
- Kluba, C. A., Mindt, T. L. Click-to-chelate: Development of Technetium and Rhenium-Tricarbonyl Labeled Radiopharmaceuticals. Molecules. 18, 3206-3226 (2013).
- Amato, I. Nuclear Medicines Conundrum. Chem. Eng. News. 87 (36), 58-70 (2009).
- Hnatowich, D. J., Virzi, F., Rusckowski, M. Investigations of Avidin and Biotin for Imaging Applications. J. Nucl. Med. 28 (8), 1294-1302 (1987).
- Blackman, M. L., Royzen, M., Fox, J. M. Tetrazine Ligation: Fast Bioconjugation Based on Inverse-Electron-Demand Diels-Alder Reactivity. J. Am. Chem. Soc. 130 (41), 13518-13519 (2008).
- Devaraj, N. K., Weissleder, R., Hilderbrand, S. A. Tetrazine-Based Cycloadditions: Application to Pretargeted Live Cell Imaging. Bioconjugate Chem. 19 (12), 2297-2299 (2008).
- Rossin, R., et al. In Vivo Chemistry for Pretargeted Tumor Imaging in Live Mice. Angew. Chem., Int. Ed. 49 (19), 3375-3378 (2010).
- Zeglis, B. M., et al. Optimization of a Pretargeted Strategy for the PET Imaging of Colorectal Carcinoma via the Modulation of Radioligand Pharmacokinetics. Mol. Pharmaceutics. 12 (10), 3575-3587 (2015).
- Rossin, R., et al. Highly Reactive trans-Cyclooctene Tags with Improved Stability for Diels-Alder Chemistry in Living Systems. Bioconjugate Chem. 24 (7), 1210-1217 (2013).
- Rossin, R., Robillard, M. S. Pretargeted Imaging Using Bioorthogonal Chemistry in Mice. Curr. Opin. Chem. Biol. 21, 161-169 (2014).
- Denk, C., et al. Development of a 18F-Labeled Tetrazine with Favorable Pharmacokinetics for Bioorthogonal PET Imaging. Angew. Chem., Int. Ed. 53 (36), 9655-9659 (2014).
- Herth, M. M., Andersen, V. L., Lehel, S., Madsen, J., Knudsen, G. M., Kristensen, J. L. Development of a 11C-labeled Tetrazine for Rapid Tetrazine-Trans-Cyclooctene Ligation. Chem. Commun. 49 (36), 3805-3807 (2013).
- Li, Z., et al. Tetrazine-Trans-Cyclooctene Ligation for the Rapid Construction of 18F Labeled Probes. Chem. Commun. 46 (42), 8043(2010).
- Nichols, B., Qin, Z., Yang, J., Vera, D. R., Devaraj, N. K. 68Ga Chelating Bioorthogonal Tetrazine Polymers for the Multistep Labeling of Cancer Biomarkers. Chem. Commun. 50 (40), 5215-5217 (2014).
- Zeglis, B. M., et al. A Pretargeted PET Imaging Strategy Based on Bioorthogonal Diels-Alder Click Chemistry. J. Nucl. Med. 54 (8), 1389-1396 (2013).
- García, M. F., et al. 99mTc-Bioorthogonal Click Chemistry Reagent for In Vivo Pretargeted Imaging. Bioorg. Med. Chem. 24 (6), 1209-1215 (2016).
- Russell, R. G. G. Bisphosphonates: The First 40 Years. Bone. 49 (1), 2-19 (2011).
- Yazdani, A., et al. A Bone-Seeking Trans-Cyclooctene for Pretargeting and Bioorthogonal Chemistry: A Proof of Concept Study Using 99mTc and 177Lu-Labeled Tetrazines. J. Med. Chem. , (2016).
- Alberto, R., et al. A Novel Organometallic Aqua Complex of Technetium for the Labeling of Biomolecules: Synthesis of [99mTc(OH2)3(CO)3]+ from [99mTcO4]- in Aqueous Solution and its Reaction with a Bifunctional Ligand. J. Am. Chem. Soc. 120 (31), 7987-7988 (1998).
- Alberto, R., Ortner, K., Wheatley, N., Schibli, R., Schubiger, A. P. Synthesis and properties of boranocarbonate: A convenient in situ CO source for the aqueous preparation of [99mTc(OH2)3(CO)3. J. Am. Chem. Soc. 123 (13), 3135-3136 (2001).
- Lu, G., et al. Synthesis and SAR of 99mTc/Re-labeled Small Molecule Prostate Specific Membrane Antigen Inhibitors with Novel Polar Chelates. Bioorg. Med. Chem. Lett. 23 (5), 1557-1563 (2013).
- Maresca, K. P., et al. Small Molecule Inhibitors of PSMA Incorporating Technetium-99m for Imaging Prostate Cancer: Effects of Chelate Design on Pharmacokinetics. Inorg. Chim. Acta. 389, 168-175 (2012).
- Bartholomä, M. D., et al. Insight into the Mode of Action of Re(CO)3 Thymidine Complexes. ChemMedChem. 5 (9), 1513-1529 (2010).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon