Method Article
Manipulation fonctionnelle du gène maternel Produits utilisant
Dans cet article
Résumé
Un protocole optimisé pour la maturation in vitro des ovocytes de poisson zèbre utilisés pour la manipulation de produits de gènes maternels est présenté ici.
Résumé
événements cellulaires qui ont lieu pendant les premiers stades du développement embryonnaire des animaux sont entraînés par des produits de gènes dérivés maternellement déposés dans l'ovocyte en développement. Parce que ces événements se fondent sur des produits maternels qui agissent généralement très rapidement après la fécondation qui préexistent à l'intérieur de l'œuf, les approches standard pour l'expression et la réduction fonctionnelle impliquant l'injection de réactifs dans l'œuf fécondé sont généralement inefficaces. Au lieu de cela, ces manipulations doivent être effectuées au cours de l'ovogenèse, avant ou pendant l'accumulation de produits maternels. Cet article décrit en détail un protocole pour la maturation in vitro d'ovocytes immatures et leur poisson zèbre fécondation in vitro ultérieure, ce qui donne des embryons viables qui survivent à l' âge adulte. Cette méthode permet la manipulation fonctionnelle des produits maternels au cours de l'ovogenèse, comme l'expression de produits pour le sauvetage phénotypiques et la visualisation de construction marquée, ainsi que d'uns la réduction de la fonction des gènes par des agents génétique inverse.
Introduction
Au cours du développement des animaux, les dépôts mère produits de gènes (par exemple, ARN, protéines et autres biomolécules) dans l'œuf; ces produits sont importants pour les processus cellulaires précoces immédiatement après la fécondation 1, 2. La manipulation de l'expression et la fonction des produits maternels est généralement inefficace lors de l' utilisation d' une approche standard pour l'injection de réactifs dans les œufs fécondés 3. En effet, la plupart des ARN et les protéines sont produites par l'ovocyte pendant oogenesis, afin que les produits maternels pré-chargés sont déjà présentes dans l'œuf mature. De tels produits préexistants sont imperméables à l'effet de choc fonctionnel avec des agents de ciblage de gènes, tels que les oligonucleotides antisens morpholino (MOS), car OM cible l'ARNm, la protéine non préexistante déjà présent dans l'oeuf lors de la fécondation. En outre, de nombreux premiers processus embryonnaires arrivent trop tôt après la fécondation à influenced par des produits protéiques dérivés de l'ARN injecté dans l'ovule fécondé, comme l'ARN ne peut pas être produit assez rapide pour influencer les premiers événements de l'embryogenèse. Pour la même raison, des protéines de fusion marquées exprimées par une injection d'ARNm dans l'ovule fécondé ne peut être produit à temps pour la visualisation au cours de leur rôle actif dans l'embryon précoce. L' injection dans des ovocytes matures extrudées avant l'activation des œufs est possible , mais est associée à des problèmes techniques similaires: ces oeufs matures sont déjà pré-chargés avec des protéines de la mère, et ils ne deviendront pas traductionnelle actifs (c. -à- produire des protéines à partir de transcrits exogènes) qu'après l' œuf Activation. Pour ces raisons, la manipulation des produits de gènes maternels qui agissent au début de l'embryogenèse doit généralement être réalisée au cours oogenesis dans la maturation ovocytaire.
Comme on approche de surmonter ces obstacles, dans les méthodes de maturation in vitro, qui permettent la maturation des OOCYTES de l'étape IV à la formation d'oeuf, ont été mis en place chez le poisson zèbre. Les premières méthodes ont permis la maturation in vitro, mais les ovules matures résultant ne sont pas compétents pour la fertilisation 4. Par la suite, la manipulation des conditions de culture de neutre à pH 9,0, imitant le pH alcalin du liquide ovarien trouvée dans les espèces de poissons 5, 6, a permis pour la fécondation in vitro fiable (FIV) , après maturation in vitro 7, 8. En effet, in vitro des ovocytes -matured peuvent produire des embryons viables qui survivent à l' âge adulte et qui sont fertiles 3, 8. Cette amélioration de la méthode a été adapté pour inclure la manipulation fonctionnelle des gènes maternels, l'expression des protéines marquées pendant l'ovogenèse zebrafish par l'expression exogène, et à médiation MO-cognement fonctionnelle dans matétape de urant IV oocytes 3 (figure 1).
Zebrafish ovogenèse présente un certain nombre d'étapes caractéristiques menant à la formation d'ovocytes matures 9 (voir le tableau 1 pour un guide rapide pour les différentes étapes de l' ovogenèse). En bref, le développement de l'ovocyte est initié par la phase I est arrêté et ovocytes au stade de diplotene de prophase I de la méiose. Ces ovocytes sont soumis à la croissance par transcription active (initié au cours des étapes IA et IB), la formation d'alvéoles corticales (également connu sous forme de granules corticales, initié lors de l'étape II), et vitellogénèse (initié lors de l'étape III). la croissance ovocytaire est achevée au cours de la phase IV, lorsque la méiose I reprend, entraînant le démontage du noyau de l'ovocyte, appelée la vésicule germinale (GV). , Méiose est ensuite à nouveau arrêté à la métaphase II. L'achèvement de la croissance de l'ovocyte et arrêt de la méiose durant la phase IV conduit à une phase de maturité V par exempleg 9. L'élimination de la membrane folliculaire se produit lors de la libération de l'ovocyte dans la lumière de l'ovaire 10 et est essentielle pour la fécondation et de l' activation de l' œuf approprié. Une fois que les œufs sont extrudées de la mère lors de l'accouplement naturel, ils sont activés. Chez le poisson zèbre, l' exposition à l' eau est suffisante pour l' activation de l' œuf plein, quelle que soit la présence de spermatozoïdes 11.
Dans des conditions in vitro permettent actuellement pour la maturation des oocytes de stade précoce IV, qui peuvent être reconnus par leur taille (690-730 pm), la présence d'un grand GV dans une position asymétrique, et une apparence totalement opaque en raison de l'accumulation de les protéines de jaune d'oeuf (figure 2B) -à l'œuf stade de maturité de V, caractérisé par un GV entièrement démonté et une apparence translucide due au jaune maturation de la protéine 12 (figure 2C). Dans cette approche, les ovaires entiers suiteovocytes Aining à différents stades de développement sont prélevés sur des femelles. Les ovocytes sont autorisés à se développer dans 17α-20β-dihydroxy-4 prégnène-3-one (DHP), une hormone de maturation efficace induisant 8. Au cours de cette période, les ovocytes de maturation peuvent être manipulées par l'injection d'expression (par exemple, coiffé in vitro -transcribed ARNm) ou des agents génétique inverse (par exemple, OM). La couche folliculaire ne jette pas spontanément vers la fin de la période de maturation, il doit donc être supprimé manuellement. Après defolliculation, la fécondation in vitro est obtenue en déclenchant l' activation de l' œuf par l'exposition des oeufs à l' eau (présent dans le milieu embryonnaire (E3)) 13 et une solution de sperme. Les zygotes résultant subissent le développement embryonnaire et permettent l'évaluation de la capacité des traitements à manipuler la fonction des gènes de la mère et pour la visualisation et l'analyse des produits maternels marqués ( La figure 3).
Protocole
Tous les zebrafish ont été traitées en stricte conformité avec les bonnes pratiques des animaux, tels que définis par les organismes de protection des animaux national et / ou local concerné, et tous les travaux des animaux a été approuvé par la commission compétente (numéro d'assurance Université du Wisconsin-Madison A3368-01). Les animaux ont été maintenus dans des conditions standard à 26,5 ° C.
1. Pré-sélection des femelles
NOTE: Les ovocytes chez les femelles adultes couvrent généralement une gamme de stades de développement, à partir de la phase I à V (figure 2). Purge les femelles des oocytes préexistantes à travers un accouplement naturel réussie augmente la synchronisation de la mise en scène de l' ovocyte, comme les oocytes en voie de développement apparaissent sous la forme d' une cohorte 3, 14. De post-purge environ 8 jours, la plupart des oocytes sont au début de la phase IV, qui est optimal pour l'initiation de la maturation in vitro. Une telle synchronisation augmente le rendement des ovocytes that peut passer par le processus complet de la maturation in vitro, ce qui facilite la manipulation expérimentale. Voir les descriptions précédentes 13 pour plus de détails sur la mise en place du poisson dans les accouplements par paires et sur la composition de l' eau du poisson (ici, 14 g de sel de mer et 150 g de NaHCO 3 par 1000 litres d'eau par osmose inverse, pH 6.5 à 8.5 (gamme préférée: 6,8 -7,5) et une conductivité de 180-360 pS). Voir Marque et al. 13 pour des recettes supplémentaires.
- Huit à dix jours avant la manipulation de la culture in vitro, l' utilisation d' un filet de poisson pour transférer un seul mâle et un seul poisson femelle de la souche souhaitée à un réservoir d'accouplement. Paire plusieurs ensembles. Laissez-les dans la nuit du réservoir d'accouplement. leur permettre de s'accoupler le soir et dans l'après-midi du jour suivant.
- Utilisez un filet de poisson pour séparer les femelles qui produisent des œufs lors de l'accouplement et les placer dans un réservoir séparé. Nourrir ces femelles deux fois par jour avec un mélange alimentaire containing environ une quantité égale de la crevette de saumure et de flocons alimentaires des poissons. La quantité de nourriture devrait être suffisant pour fournir environ 20 minutes, mais pas plus, du temps d'alimentation.
2. Préparation de Maturation moyen
NOTE: Préparer milieu de maturation sur le jour de l'expérience de maturation in vitro, en 1 h d'enlèvement des ovocytes de la femelle (voir section 3).
- Ajouter 20 ml de Leibovitz le milieu L-15 avec L-glutamine, pH 7,0, à un tube conique de 50 ml dans des conditions stériles. Porter à pH 9,0 avec du NaOH 10 N.
- Ajouter 9 ml de Leibovitz le milieu L-15, pH 9,0, à 2 séparés des tubes coniques de 50 ml. Tube étiquette 1 "+ DHP" et l'autre "-DHP."
- Dans le tube + DHP, ajouter 10 ul de 17α-20β-dihydroxy-4 prégnène-3-one (DHP), 490 ul de dH 2 O, et 500 ul de 10% d' albumine de sérum bovin (BSA).
- Dans le tube -DHP, ajouter 100 pi de 10 mg / mL gentamicine, 40081; L de dH 2 O, et 500 ul de 10% de BSA.
3. Dissection des ovocytes et initiation de la culture in vitro
NOTE: L'expérience de la culture in vitro est réalisée avec des femelles pré-sélectionnés 8-10 jours après la libération des ovules par accouplement naturel. Utilisez milieu de maturation fait le même jour (voir la section 2). Ovocytes matures de manière appropriée si la dissection est commencée à la fin du cycle diurne de poisson (déterminée en laboratoire par un éclairage artificiel pré-établi dans l'installation de poisson) 13, imitant éventuellement processus qui se produisent à travers l' accouplement naturel. Cela implique que la plupart des étapes du protocole doivent être effectués le soir si les poissons sont logés dans un établissement avec un cycle de lumière standard (par exemple, en commençant l' étape 3.2 à 18 heures dans un établissement avec une période de lumière 8 h à 10 h), bien que d'autres périodes de temps-travail sont possibles avec un cycle de lumière de manière appropriée décalée dans le temps.
- Préparer une solution mère de tricaïne 0,2% de dH 2 O, tamponnée à pH 7,0 avec 1 M Tris, pH 9,0, et de maintenir cette solution à 4 ° C. Cela peut être préparé à l'avance.
- Initier l'expérience 0-4 h avant la fin du cycle de lumière par jour dans l'établissement. Dans un bécher de 250 ml, ajouter 20 ml de solution à 0,2% d'actions de tricaïne, pH 7,0, à 80 ml d'eau de poisson et mélanger.
- Transférer les femelles pré-sélectionnés pour la solution de tricaïne et les euthanasier par une surexposition. Laissez les femmes dans la solution de tricaïne pendant 15 minutes après la cessation du mouvement maillant.
- Avec une cuillère, recueillir le poisson euthanasié de la solution de tricaïne et les rincer rapidement à l'eau du poisson. Placez le poisson sur une serviette en papier pour absorber l'excès d'eau.
- Utiliser une lame de rasoir propre à couper la tête du poisson euthanasiés au niveau de la nageoire pectorale. En utilisant des ciseaux de dissection, faire une incision longitudinale sur le côté ventral du poisson, étendant à partir de l'extrémité antérieure de la région anale.
- Placez le poisson sur un plat de Pétri sous un microscope à dissection avec une lumière incidente. En utilisant une paire de pinces de dissection, transférer des parties de l'ovaire à un 35 x 10 mm boîte de culture contenant 4 ml de Leibovitz de milieu L-15 + DHP.
NOTE: Les ovaires, qui contiennent en développement, des ovocytes apparaissent sous forme de structures opaques et clumpy dans la cavité interne du corps. - En utilisant des pinces à disséquer, dissocie doucement les ovocytes des masses folliculaires. Trier les premiers stades oocytes IV (Figure 2B; avant la rupture du GV, au format quasi-maximale et caractérisé par un cytoplasme sombre, opaque et un GV situé asymétriquement facilement apparent à l'intérieur de l'ovocyte). Jeter les ovocytes dans les premiers stades (Figure 2A) et translucides, des oeufs matures étape V (semblables à ceux de la figure 2C , mais présente dans les ovaires avant le traitement DHP).
NOTE: Les ovocytes sont sélectionnés pour la maturation au début de la phase IV, la première étape qui conduit à maturité, stade V oocytes après les conditions de culture in vitro (figure 2C et D) 3. Parce que les ovocytes de stade IV produisent activement des produits, la manipulation, à ce stade permet l'expression des produits exogènes par injection d'ARN ou pour la réduction de la fonction des gènes par l'intermédiaire d'OMs introduites. - Utilisation d'un verre pipette Pasteur pour transférer le stade précoce des ovocytes IV à une seconde 35 x 10 mm boîte de culture en plastique contenant 4 ml de Leibovitz de milieu L-15 + DHP. Transfert des quantités minimales de milieu -DHP au plat contenant la solution + DHP.
4. microinjection ovocyte
NOTE: stade IV isolé ovocytes soumis à la maturation in vitro peuvent être microinjection pour introduire des réactifs pour la manipulation ou l' expression fonctionnelle de protéine marquée. La micro - injection des réactifs, tels que l' ARNm et MOS (voir la section 4), est typiquement effectuée lorsque les ovocytes sont en cours in vitro maturation dans le milieu + DHP, avant defolliculation. Si vous le souhaitez, afin de permettre plus de temps pour effectuer des manipulations avant la maturation des ovocytes, les injections peuvent également être réalisées en milieu -DHP, avant la maturation, pendant au moins 2 h. Ils peuvent ensuite être transférées dans un milieu + DHP.
- Préparer à l'aide d'un kit mARN d'expression standard. les conserver à -80 ° C en tant que 100-500 pg / pl stock pour une injection à une concentration finale de 50 à 500 pg / pl (200 pg / pl est recommandée) dans l'eau de l'ARN de qualité. Préparer OMs à une concentration de 4 ng / ul dans de l'eau selon les instructions du fabricant. Injecter eux à des concentrations finales de 2 ng / uL (ou déterminée de manière empirique).
NOTE: Les injections sont généralement réalisées en milieu + DHP avant defolliculation (voir la note à la section 5). - Si l'injection d'ARNm, immédiatement avant l'injection, on dilue l'ARNm à l'aide de parvenir à une solution finale de KCl 0,1 M ARN de qualité de l'eau d'osmose inverse et 0,2 M de KCl.
- Si l'injection MOS, immédiatement avant l'injection, on dilue les OMs à la concentration désirée avec de l'eau par osmose inverse et KCl 0,2 M pour obtenir une solution finale de 0,1 M KCl.
- Tenir manuellement oocytes avec une pince fine et injecter environ 1 nL en phase de type sauvage oocytes IV en utilisant une aiguille faite avec une pipette capillaire tirée de verre.
- Préparer les aiguilles de verre en tirant des tubes capillaires en verre chauffé, chargement de la solution à injecter, et de briser la pointe d'aiguille avec une pince, comme précédemment décrit dans les protocoles pour l' injection dans des embryons précoces type de poisson zèbre 15.
NOTE: Il est utile si l'aiguille a un cône progressif plutôt qu'une brusque; ce qui permet une plus grande flexibilité en termes de l'emplacement de la rupture de la pointe de l'aiguille et aide également à éviter d'endommager l'embryon injecté. En utilisant la même solution que l'aiguille et pour l'injection d'embryons, ajuster le volume injecté par pré-détermination de lales paramètres micro-injecteur de pression qui produisent le volume souhaité. Ces paramètres peuvent être déterminés par simulation d'injection dans une goutte d'huile minérale sur une lame de calibrage de la platine du microscope (0,01 mm) et le réglage des paramètres de micro - injecteur pour obtenir le diamètre désiré dans le bolus de solution injectée, comme décrit précédemment 15.
- Préparer les aiguilles de verre en tirant des tubes capillaires en verre chauffé, chargement de la solution à injecter, et de briser la pointe d'aiguille avec une pince, comme précédemment décrit dans les protocoles pour l' injection dans des embryons précoces type de poisson zèbre 15.
5. ovocyte Maturation et Defolliculation
REMARQUE: Au cours de la maturation ovocytaire, les ovocytes deviendront progressivement translucide, qui permet l'évaluation des conditions de culture avec succès.
- Poursuivre l' incubation de l'immature (et, le cas échéant, injectés) ovocytes en milieu + DHP à 26,5 ° C, vérifier périodiquement (toutes les 30 minutes) pour faire en sorte que les ovocytes restent intacts et sont en cours de maturation appropriée en devenant progressivement translucide (voir la figure 2C) .
- Retirez tous les ovocytes avec une pipette lyser de Pasteur et de les jeterdans un bécher de déchets de laboratoire pour maintenir la qualité du milieu. Échanger le milieu de culture à environ un demi-volume de milieu frais + DHP pour maintenir une solution claire, en fonction de la quantité de lyse de l'ovocyte.
- Laisser la maturation in vitro de procéder jusqu'à ce que la majorité des ovocytes deviennent translucides et ont une GV qui est plus apparent (environ 2 h dans le traitement DHP, voir la figure 2C par rapport à D). les voir sous un microscope optique avec disséquant lumière transmise.
- Retirer la membrane folliculaire externe de chaque ovocyte est arrivée à échéance. Utiliser des pinces extra-fines pour faire une déchirure de la membrane folliculaire dans une région avec un espace accru entre l'ovocyte et la membrane. Décoller une partie de la membrane et rouler l'ovocyte de la membrane tout en maintenant la partie pelée.
NOTE: La membrane chorionique sous-jacente demeurera généralement en étroite association avec l'œuf au cours de ce processus; après acte d'oeufIvation, il se dilate pour former une couche de protection pour l'embryon. - Transférer les ovocytes défolliculés dans un volume minimal de milieu (en général, transférer environ 5-10 ovocytes matures en moins de 20 pi) à une boîte de Pétri avec quelques gouttes de la culture (+ DHP) moyenne et procéder à la fécondation.
6. La fécondation in vitro Cultured Ovocytes
REMARQUE: La solution de sperme sur la glace, préparé ci-dessous, maintiendra sa puissance pendant environ 2 h.
- Préparer une solution de sperme à la fin de l'étape de maturation de l' ovocyte et avant defolliculation à l' aide de testicules de cinq mâles dans 500 ul de la solution de Hanks, comme décrit précédemment 16, 17.
- Ajouter 10-50 pi de solution de sperme aux ovocytes défolliculés dans + DHP milieu de culture. Attendre 10 s.
- À l'aide d'une pipette, ajouter quelques gouttes de milieu embryonnaire (E3) aux ovocytes. Attendre 1 min, puis inonder le plmangé avec du milieu E3.
NOTE: La composition du milieu E3 est la suivante: 5 mM de NaCl, 0,17 mM de KCl, 0,33 mM de CaCl2, 0,33 mM de MgSO 4, et de 1,5% de bleu de méthylène 13. - Répétez les étapes 5.3, 6.2 et 6.3 pour obtenir un plus grand nombre d'embryons fécondés.
- Permettre aux embryons fécondés de se développer. Utiliser un microscope à dissection avec transmises optique de lumière pour observer la progression à travers les étapes de clivage pour assurer la fécondation, de la manière décrite précédemment pour la fécondation 17 et 18 la mise en scène.
Résultats
Pour déterminer si la procédure décrite ci - dessus est réussie, les embryons peuvent être observés au cours des étapes de clivage pour confirmer l'apparition du motif de clivage précoce embryonnaire stéréotypé 18, ainsi qu'à 24 h après la fécondation (HPF) pour confirmer le bon développement du plan de corps de base. Cette procédure permet la manipulation de produits maternels pour des études fonctionnelles grâce à l'injection de réactifs, tels que Mos mARN, au cours du développement de l'ovocyte.
La manipulation des produits maternels pour des études fonctionnelles:
codant pour l' ARNm de type sauvage et mutés produits peuvent être injectés dans des ovocytes de maturation in vitro pour tester l'effet de la manipulation de la fonction du gène de la mère au cours de la méiose et les premiers stades embryonnaires. Par exemple, des embryons de type sauvage peuvent être injectés avec wil' ARNm de type ld pour tester l'effet de la surexpression du produit, ou avec de l' ARN mutant pour tester dominants potentiels (par exemple, gain de fonction et antimorphic) les effets de ces processus. Les ovocytes en culture in vitro sont capables de produire des protéines à partir d' ARNm exogène au cours du développement de l' ovocyte, comme le montre l'expression de GFP à partir d' ARNm injecté, bien que seuls les ovocytes qui initient des conditions de culture au stade IV de l' ovogenèse peuvent se développer dans des ovocytes V de stade de maturité (figure 2B -2D, voir aussi Nair et al. 3). L'expression du produit de type sauvage par l' ARNm injecté joue également un rôle pour le sauvetage des mutations à effet maternel pour confirmer l' identité du gène pendant le clonage de position 3, 24. Dans ce cas, l'ARNm de type sauvage est injecté dans des ovocytes de mutants femelles homozygotes pour vérifier si les produits de type sauvage peuvent sauver le phénotype mutant. Ce sauvetage génétique est illustré dans Figure 3A-3C, où l' ARNm injecté AurB est signalée pour sauver les effets phénotypiques d'une mutation dans son gène correspondant, île cellulaire (CEI) (Figure 3A-3C). Les embryons d'un groupe de contrôle sont également autorisés à développer pour montrer le phénotype mutant correspondant 3. ARN mutant peut également être injecté dans des ovocytes de mutants pour tester si le produit mutée conserve la fonction partielle en comparant la mesure de sauvetage à celle causée par le produit de type sauvage.
L'expression des protéines à partir d'ARNm injecté dans le développement des ovocytes semble se produire avec peu ou pas de retard. Une forte expression de la GFP est observée dans les 2 heures de l'injection de l'ARNm, quel que soit le stade de développement de l'ovocyte 3 correspondant (figure 2B-2D; voir également Nair et al 3.). Les produits tels que mCherry:SAS6 et Birc5b (Môtley): GFP peut être observée immédiatement après la fécondation et pendant le premier cycle cellulaire embryonnaire 3, 25. L'injection de l' ARNm au cours de l' ovogenèse conduit également à la production de protéines qui, quel que soit le fragment étiqueté condensé, est fonctionnel immédiatement après la fécondation, comme indiqué dans le cas des produits maternels pour île cellulaire / aurB 3, cycle futile / PGRT 24, et bigarrée / bir5b 25. Traduction-blocage ont également un OMs effet immédiatement après la fécondation, comme indiqué pour le cycle futile / LRMP 3 et à des stades ultérieurs de l' embryogenèse, comme dans le cas de la mission impossible / dhx16 3. Splice bloquant OMs, lorsqu'il est injecté dans la maturation des ovocytes, ne peut pas avoir un effet sur la fonction maternelle, probablement en raison de relevés de notes déjà présentes maternelles matures au stade des ovocytes IV 3.
Génération de morphants:
Lorsque vous utilisez un MO correspondant à un gène avec une mutation déjà identifiée, le phénotype morphant devrait imiter le phénotype mutant. Morphants sont comparées à des embryons non injectés et ceux injectés avec un standard, contrôler MO. L'injection d'un morpholino-blocage en translation peut phénocopie avec succès le phénotype mutant connu 3, comme représenté par l'injection de PGRT MO dans des ovocytes, qui imite le phénotype mutant de la mutation correspondante, cycle futile (Figure 3D-F). La spécificité de OMs peut être déterminée par les mêmes approches utilisées lors de l' injection dans des embryons (OMs examinés précédemment) 19, 20.
Expression de protéines de fusion marquées par fluorescence:
ARNm codant pour des produits géniques d'intérêt fusionnée à des protéines fluorescentes (par exemple, GFP et mCherry) peut également être injecté dans une ou l' autre de type sauvage ou des ovocytes de mutants pour visualiser les produits correspondants à l'intérieur de l'embryon précoce ( par exemple, en raison d' un motif de localisation subcellulaire, la figure 3G et 3H). ARNm codant pour similaires, mais impliquant des fusions de l'allèle mutant peut être exprimé de façon similaire pour vérifier si la mutation affecte les localisations subcellulaires potentiels.
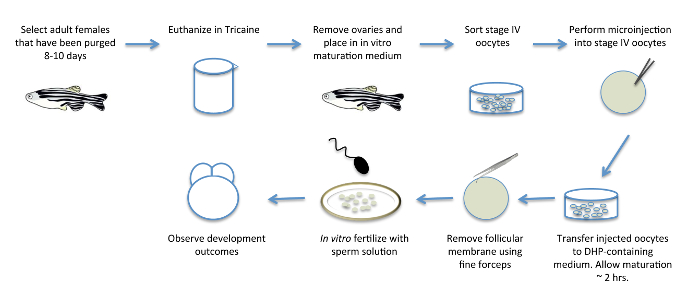
Figure 1: in vitro ovocyte Maturation. Schéma montrant les différentes étapes de la maturation in vitro des ovocytes. Les femelles adultes sont pré-sélectionnés pour la ponte 8 jours avant la procédure, afin de les purger des œufs qui ont déjà arrivés à échéance et à proMote le développement de nouveaux ovocyte. Les ovaires, contenant en développement des ovocytes, sont retirés de femelles et transférées dans un milieu contenant l'hormone DHP pour induire la maturation des ovocytes in vitro. Après élimination des femelles et immédiatement avant ou pendant la maturation des ovocytes, les ovocytes peuvent être injectées avec des produits d'ARN et d'autres réactifs pour la manipulation fonctionnelle des facteurs maternels. Les ovocytes matures sont manuellement défolliculés et fertilisés in vitro avec une solution de sperme pour obtenir des embryons fertilisés, viables. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
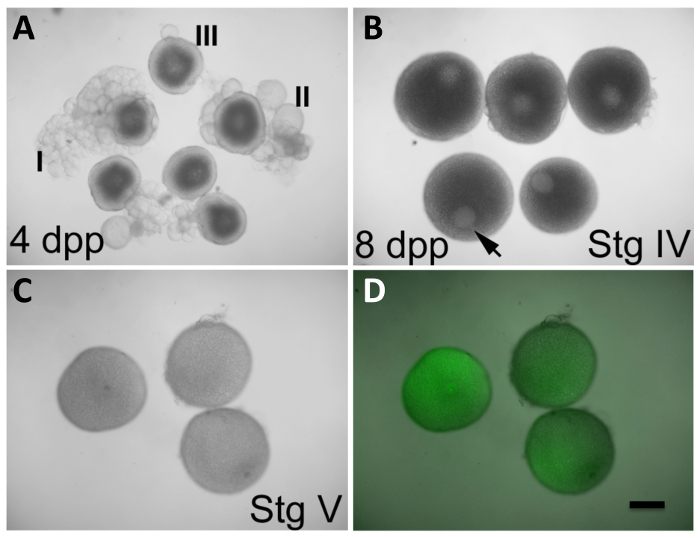
Figure 2: in vitro ovocyte Maturation et d' expression des produits à partir d' ARNm Injecté. (A) oocytes à des stades I-III, observées dans les ovaires defemelles 4 jours après la purge (dpp). (B) les ovocytes au stade IV, observée dans les ovaires des femelles 8 dpp. La vésicule germinale (GV, pointe de flèche) est clairement visible et occupe une position excentrée. Les ovocytes de stade III en (A) présentent également une GV facilement apparent, mais il se trouve centré dans l'ovocyte. Ovocytes stade IV (B) ont une taille qui est presque maximale par rapport à celle des ovocytes matures dans (C). (C et D) les ovocytes au stade V (maturation des ovocytes) après 2 h dans des conditions de maturation in vitro initiée à l' étape IV, comme dans (B), et injecté lors de la maturation avec le codage de la GFP, in vitro l' ARNm transcrit (C, la lumière visible seulement; D, la superposition de la lumière visible et la fluorescence de la GFP). Le GV n'est plus apparent dans les ovocytes de stade V, qui sont aussi moins opaques que le stade IV ovocytes. Ovocytes injectés expriment la protéine GFP (D). Defolliculation d'ovocytes stade IV matures est described dans la section de protocole. Barre d'échelle = 300 pm. Tous les panneaux ont été reproduits, avec la permission, de Nair et al 3. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
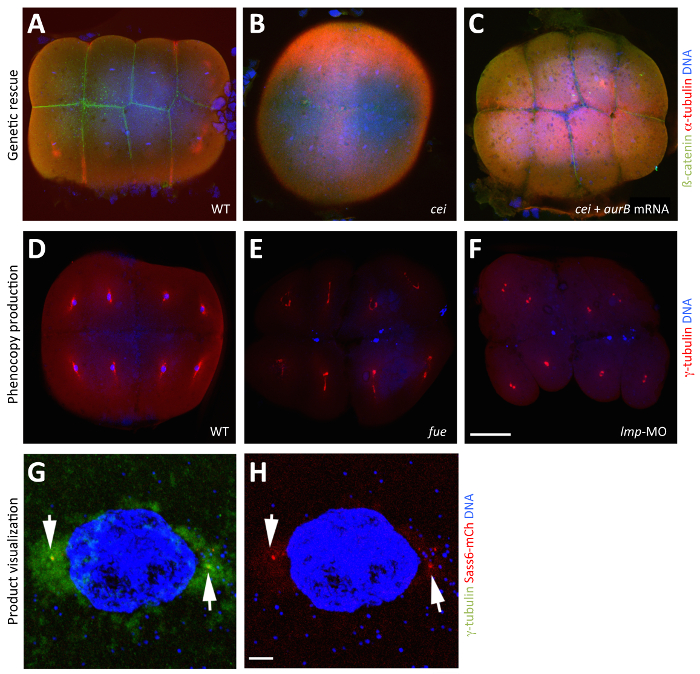
Figure 3: Manipulation et visualisation des produits maternels par in vitro ovocyte Maturation. (A - C) sauvetage du phénotype à effet maternel provoquée par une mutation dans l' île cellulaire / Aurora B grâce à l'injection d'ARNm aurB de type sauvage dans l' étape IV ovocytes CEI / aurB. images fusionnées montrant des vues d'animaux de 65 blastodisques fixes MPF, visualisées avec des anticorps anti-ß-catenine de mettre en évidence les membranes (vert), les anticorps anti-alpha-tubuline pour indiquer microtubules (rouge) et DAPI pour désigner l'ADN (bleu). (A) l' accumulation β-caténine dans les embryons de type sauvage, indiquant une maturation de sillon normal. (B) A cei / d'embryons aurB à partir d' un ovocyte stade cei / aurB IV montre non injecté sillons partiels, rudimentaires qui n'accumulent pas β-caténine. (C) A sauvé cei / aurB embryon à partir d' un ovocyte cei / aurB injectés avec de l' ARNm de type sauvage aurB montrant l' accumulation β-caténine robuste au niveau des sillons. (D - F) phénocopie de l'effet maternel causée par une mutation dans le cycle / PGRT futile de l'injection de PGRT morpholino dans des ovocytes de stade IV. images fusionnées montrant des vues animaux de 70 blastodisques fixes MPF, visualisées avec des anticorps anti-gamma-tubuline pour indiquer centrosomes (rouge) et DAPI pour désigner l'ADN (bleu). (D) Dans les embryons de type sauvage, chacun associés à noyau avec γ-tubuline, un marqueur de matériau centrosomale. (E) Dans les mutants de FUE à effet maternel, fusion pronucléaire échoue, résultant en deux ou trois plaques d'étiquettes d'ADN correspondant aux pro-noyaux parentales non fusionnées et le corps polaire pour la méiose II. (F) Dans morphants PGRT, où la fonction PGRT maternelle est inhibée, les noyaux ne parviennent pas à se diviser de manière similaire et, en outre, ne parviennent pas à associer à γ-tubuline. (G et H) Visualisation du produit maternellement produit dans l'embryon précoce. protéine Sass6-mCherry à partir d'ARNm exogène injecté dans des ovocytes de stade IV se localise dans les centrioles. images fusionnées montrant des vues animaux de 40 blastodisques fixes MPF, visualisées avec des anticorps anti-gamma-tubuline pour mettre en surbrillance centrosomes (vert), la fluorescence mCherry pour indiquer Sass6 (rouge), et DAPI pour désigner l'ADN (bleu). (G) exprimée protéine Sass6-mCherry se localise dans des foyers marqué par le marqueur centrosome γ-tubuline aux sites flanquant le noyau (flèches). (H ) La même image, montrant que Sass6-mCherry et DAPI pour plus de clarté. Les embryons en (G et H) sont fixés, mais la fluorescence des produits exprimés, tels que mCherry fusions, peuvent également être observés dans les embryons vivants (non représentés). Barre d'échelle = 100 um et 10 um AF en G et H. Tous les panneaux ont été reproduits avec l' autorisation, à partir de Nair et al 3. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
| Les étapes de Ovogenèse | Diamètre des ovocytes (um) | Repère clé (s) |
| 1A - Prefollicle | 7 à 20 | Initiation de la transcription actif, l'accumulation de nucléoles |
| 1B - Follicule | 20 à 140 | Décondensation des chromosomes |
| II - cortical alveolus | 140-340 | production cortical alvéoles pulmonaires |
| III - vitellogenèse | 340-690 | Assombrissement de cytoplasme par l'accumulation de la protéine précurseur de jaune et de lipides |
| Début IV - maturation ovocytaire | 690-730 (plage inférieure) | localisation asymétrique de la vésicule germinale |
| Début IV - maturation ovocytaire | 690-730 (limite supérieure) | disparaît vésicule germinale, arrêt à la métaphase II |
| V - ovocyte mature | ~ 750 | Ooplasme / jaune devient translucide |
Tableau 1: Repères de développement ovocytaire dans Zebrapoisson.
Discussion
Le protocole ci-dessus est pour la manipulation de produits de gènes avant la fécondation, permettant ainsi l'étude des produits de gènes maternels au début embryon de poisson zèbre. Des études antérieures ont pu ovocytes matures in vitro 4; ce protocole a été modifié afin de permettre la fertilisation ultérieure d' une maturation in vitro des ovocytes 8. Cela permet l'injection de réactifs pour la manipulation fonctionnelle et la visualisation des produits hérités du maternellement embryon précoce 3. Embryons résultant de cette méthode peut être viable et peuvent survivre à devenir des adultes fertiles. Dans des expériences préliminaires, environ la moitié des embryons fécondés issus de cette procédure étaient viables au jour 5 du développement, évaluée par l'inflation de la vessie natatoire à ce stade, dont environ la moitié est devenu adultes en bonne santé, fertiles (observations non publiées).
Il y a un certain nombredes étapes critiques à prendre en compte dans le protocole. Oocytes au stade d'initier la maturation appropriée (stade précoce IV) peut être enrichi si la femelle a été accouplées récemment, mais pas avant 8 dpp. L' utilisation du poisson qui ont peut - être pas accouplées récemment entraîner des œufs dégénérant 14, qui ne sera pas subir une maturation. Les femelles fécondées en moins de 8 jours auront la majorité des œufs au stade III ou moins, et donc, les œufs ne mûriront pas correctement in vitro. Ovaires chez les femmes qui accouplées 8 jours seront avant ont une fraction optimale des ovocytes au début de stade IV. Ceux - ci peuvent être reconnus par leur opacité et la présence du GV dans une position excentrée (figure 2B). Ovocyte détermination du stade peut également être facilité par la mesure de la taille, avec des oocytes placées sur une lame de micromètre gradué sous un microscope et par rapport aux lignes directrices d'arrêt standard (tableau 1). Cependant, à un stade précoce des ovocytes IV ont une taille quasi maximale par rapport à la maturité(ovocytes reconnus par leur transparence relative et l' absence de GV, la figure 2C) et sont faciles à reconnaître, comme décrit ci - dessus, qui évite généralement la nécessité d'une mesure de la taille de l' ovocyte directe.
La maturation in vitro doit débuter dans quelques heures de la fin du cycle de la lumière du jour auquel les donneurs d'ovocytes féminins sont acclimatés. Oocytes ne mûriront pas correctement, reflétée dans les taux de fécondation pauvres, si cultivés pendant la période du matin du cycle de lumière. La raison de la dépendance circadien de la méthode de la maturation ovocytaire in vitro n'est pas comprise , mais reflète probablement les préjugés sous - jacents circadiens in vivo la maturation des œufs impliquant un cycle d' expression des gènes au cours oogenesis 21. Une cause commune pour défaut d' ovocytes à subir avec succès dans la maturation in vitro malgré la mise en scène appropriée ovocytaire est que le DHP est arrivé à expiration. hormone DHP expire généralement après un an, et pour assurer l'effetmaturation ive, le lot de travail doit être remplacée dans un délai de 9 mois d'utilisation.
L'injection d'oocytes est une autre étape essentielle lorsque le but de la méthode est la manipulation fonctionnelle des produits maternels. Cette procédure a des exigences qui diffèrent de celles des injections standard dans l'œuf fécondé à 0-30 FPM. Un facteur clé dans l' injection de ovocyte est la nécessité d'effectuer les injections dans des conditions qui ne conduisent pas à l' activation des œufs prématurés, comme dans Leibovitz le milieu L-15 22, 23. Parce qu'ils sont intégrés dans les ovaires, la maturation des ovocytes posent des problèmes particuliers à injection. Le protocole ci-dessus suggère dissociant premier ovocytes à partir des ovaires, puis en maintenant chaque ovocyte dissocié séparément avec une pince pendant l'injection. Cette technique a bien fonctionné et permet ovocytes de pré-tri au stade approprié avec un minimum de manipulation. Des méthodes alternatives peuvent également être utilisées,en tant que: i) placer oocytes dans injection standard auges agarose 15, dans lequel les parois verticales du support de goulotte du ovocytaire lors de l' injection (dans cette variante de procédé, les ovocytes ont besoin d'être transférées à des plaques d'injection tout en étant maintenue in vitro milieu de maturation) et ii ) permettant aux ovocytes de rester attachés à la masse de l'ovaire, qui peut être maintenu avec une pince pendant l'injection pour éviter tout contact avec l'ovocyte injecté (dans cette approche, les ovocytes doivent être dissociées après l'injection à la fois faciliter l'exposition DHP et de permettre leur defolliculation , elle-même indispensable pour la fécondation in vitro). Malgré ce défi particulier, le stade IV ovocytes peuvent être pénétrées facilement avec une aiguille d'injection, probablement parce que la membrane chorionique à ce stade n'est pas complètement développé 9.
Une limitation du protocole de maturation actuelle est que dans des conditions de maturation in vitro qui favorisent le développement de l' ovocyte appropriéne peut pas être créé lors de la maturation ovocytaire est initiée aux premiers stades de stade IV. Les ovocytes deviennent compétents pour répondre aux DHP en subissant une maturation quand ils atteignent un diamètre de 520 um, ce qui se produit lors de l' étape III (vitellogénèse, correspondant à la gamme 340 à 690 pm) 9. Cependant, la culture des ovocytes de stade III des résultats dans les ovocytes qui ne sont pas compétentes pour la fertilisation 3. Ovocytes dont la culture ne in vitro est initiée au stade IV (figure 2B) peut se développer dans des ovocytes, stade V matures (figure 2C et D). Cela peut être lié au fait que le stade III est essentiel pour la croissance et vitellogénèse ovocyte 9. Ainsi, la procédure de maturation ovocytaire in vitro présentées dans cet article ne doit être utilisé avec une population à partir d'ovocytes stade IV (B), et non avec des ovocytes à des stades précoces (stades I - III; Figur e 2A). Pour la même raison, cette procédure est limitée à des gènes qui sont exprimés au stade IV ou plus tard. La manipulation fonctionnelle des gènes dont les produits sont exprimés plus tôt peut plutôt compter sur des méthodes génétiques (voir ci-dessous). Des améliorations à des méthodes in vitro de maturation de la culture pourraient à l'avenir permettre l'initiation de la culture de l' ovocyte à des stades précoces, élargissant ainsi la puissance de l'approche de la maturation in vitro.
Une autre limitation de la méthode présentée est que defolliculation, ce qui est essentiel pour les étapes ultérieures impliquant la fécondation, est actuellement une étape limitante dans la procédure. La membrane folliculaire est une couche transparente qui entoure l'ovocyte en développement, et le retrait peut être fastidieux. Si cette membrane est pas complètement enlevée, l'œuf ne deviendra pas complètement activé et fécondé. Ceci est rendu évident par l'échec du chorion d'étendre et le développement de façon irrégulière placé, sillon comme structures (pseudocleavages), caractéristique d'embryons non fécondés 11. Méthodes de defolliculation Enzymatic telles que la collagénase, tel qu'il est utilisé dans Xenopus, ont été essayés. Cependant, dans nos mains, cette technique n'a pas été couronnée de succès, et nous comptons donc sur defolliculation manuel. Parce que defolliculation manuel de main-d'œuvre et de temps, il est difficile d'obtenir de grands lots d'œufs fécondés in vitro après la maturation ovocytaire. En raison de la limitation dans le temps imposé par defolliculation manuel, nous fertiliser actuellement quelques œufs défolliculés, matures à la fois, en petits lots de 5-10 œufs. L'incorporation de defolliculation enzymatique avec cette procédure augmenterait probablement considérablement son rendement et la facilité d'utilisation.
Bien que les embryons produits après la fécondation des ovocytes -matured in vitro peuvent devenir des adultes viables, nous notons que , après fécondation in vitro, une fraction d'embryons faire pas diviser normalement ou en temps opportun. Nous sélectionnons actuellement pour les lignes dont la propagation comprend cycles de maturation in vitro des ovocytes, ce qui peut entraîner des modèles plus robustes de développement dans les embryons obtenus par cette méthode.
La procédure a permis le sauvetage ou la visualisation claire de la localisation des protéines pour un certain nombre de mutations 24, 25. Cependant, pour certains gènes, la régulation de l' expression du produit peut être cruciale, de sorte que les produits exprimés par l' ARNm injecté peuvent conduire à des résultats variables 26. Il est également important de garder à l' esprit de tous les contrôles (par exemple, des embryons injectés avec des réactifs qui ont des propriétés similaires à celles utilisées dans l'expérience encore sont prévus pour ne pas produire un effet, comme mos contrôle ou ARN codant pour des protéines inertes que, par exemple comme GFP), la variabilité sous-jacente peut conduire à des conclusions incorrectes.
nt "> Une approche impliquant la manipulation in vitro suivie par la fécondation est particulièrement utile dans le cas des produits déposés maternellement, où la méthode standard d'injection d' ARN, mos ou de protéines dans l'ovule fécondé ne peut pas réduire efficacement les produits déjà accumulés dans l'œuf. d' autres méthodes récemment mises au point, comme la production d'CRISPR-mutant, sont également efficaces pour générer des conditions mutantes pour les gènes maternellement exprimés 26. Cependant, cette méthode nécessite la croissance de plusieurs générations de poissons. la technique de maturation ovocytaire in vitro permet la manipulation fonctionnelle rapide à étudier la fonction des gènes exprimés maternellement, y compris le sauvetage et phénocopies de mutations à effet maternel, ainsi que l'expression de l'ARN et des protéines dans l'embryon précoce.Déclarations de divulgation
Les auteurs ont aucun intérêt financier concurrents.
Remerciements
Nous tenons à remercier les membres de l'installation laboratoire et poissons Pelegri personnel d'encadrement, qui ont joué un rôle dans la facilitation de ce projet. Le support de ce projet a été fourni par le NIH et le NIH R56 GM065303 2 T32 GM007133 à ELW, NIH 5 F31 GM108449-02 et NIH 2 T32 GM007133 à CCE, et NIH RO1 GM065303 à FP
matériels
| Name | Company | Catalog Number | Comments |
| Zebrafish mating boxes | Aqua Schwarz | SpawningBox1 | |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| Na2HPO4 | Sigma | S3264 | |
| KH2PO4 | Sigma | P9791 | |
| CaCl2 | Sigma | C7902 | |
| MgSO2-7H2O | Sigma | 63138 | |
| NaHCO2 | Sigma | S5761 | |
| Tricaine | Western Chemical | Tricaine-D (MS 222) | FDA approved (ANADA 200-226) |
| Tris base | Sigma | 77-86-1 | to prepare 1 M Tris pH 9.0 |
| HCl | Sigma | 920-1 | to prepare 1 M Tris pH 9.0 |
| Fish net (fine mesh) (4 - 5 in) | PennPlax | (ThatFishThatPlace # 212370) | available in ThatFishThatPlace |
| Plastic spoon | available in most standard stores | ||
| Dissecting scissors | Fine Science Tools | 14091-09 | |
| Dissecting forceps | Dumont | SS | available from Fine Science Tools |
| Dissecting stereoscope (with transmitted light source) | Nikon | SMZ645 | or equivalent |
| Reflective light source (LED arms) | Fostec | KL1600 LED | or equivalent |
| Petri plates 10 cm diameter | any maker | ||
| Eppendorf tubes 1.5 mL | any maker | ||
| Ice bucket | any maker | ||
| Narrow spatula | Fisher | 14-374 | |
| Depression glass plate | Corning Inc | 722085 (Fisher cat. No 13-748B) | available from Fisher Scientific |
| Paper towels | any maker | ||
| Kimwipes | Kimberly-Clark | 06-666-11 | available from Fisher Scientific |
| Timer stop watch | any maker | ||
| Wash bottle | Thermo Scientific | 24020500 | available from Fisher Scientific |
| beakers, 250 mL (2) | Corning Inc. | 1000250 | available from Fisher Scientific |
| Leibovitz'z L-15 medium | Thermofisher | 11415064 | |
| NaOH | Sigma | 221465 | for pH'ing |
| BSA | Sigma | A2058 | |
| 17alph-20beta-dihyroxy-4-pregnen-3-one (DHP) | Sigma | P6285 | |
| gentamicin | Sigma | G1272 | |
| Injection Apparatus | Eppendorf | FemtoJet | or equivalent |
| Capillary Tubing for injection needles | FHC | 30-30-1 | or equivalent, Borosil 1.0 mm OD x 0.5 mm ID with fiber, 100 mm |
| Needle puller | Sutter Instruments | Model P-87 | any maker |
| Micropipetor (1 - 20 µL range) with tips | any maker | ||
| Micropipetor (20 - 200 µL range) with tips | any maker | ||
| Micropipetor (100 - 1000 µL range) with tips | any maker | ||
| Conical tubes 15 mL | any maker | ||
| Conical tubes 50 mL | any maker | ||
| plastic pipette 10 mL with bulb | any maker | ||
| plastic pipette 20 mL with bulb | any maker | ||
| Microscope stage Calibration Slide 0.01 mm | AmScope | MR095 | or equivalent |
| Reagents for fish water: | |||
| Instant Ocean Salt | Drs. Foster & Smith | CD-116528 | |
| Sodium bicarbonate (cell culture tested) | Sigma | S5761-1KG | |
| Reagents for E3 medium: | |||
| NaCl | Sigma | S5886-1KG | |
| KCl | Sigma | P5405-500G | |
| CaCl2, dihydrate | Sigma | C7902-500G | |
| MgSO4, heptahydrate | Sigma | 63138-250G | |
| Methylene Blue | Sigma | M9140-25G | |
| Fish Food: | |||
| Frozen brine shrimp | Brine Shrimp Direct | FBSFKG50 | |
| Tetramin Flakes | Drs. Foster & Smith | 16623 |
Références
- Lindeman, R., Pelegri, F. Vertebrate maternal-effect genes: insights into fertilization, early cleavage divisions, and germ cell determinant localization from studies in the zebrafish. Mol Rep Dev. 77 (4), 299-313 (2010).
- Abrams, E. W., Mullins, M. C. Early zebrafish development: it's in the maternal genes. Curr Opin Genet Dev. 19 (4), 396-403 (2009).
- Nair, S., Lindeman, R. E., Pelegri, F. In vitro oocyte culture-based manipulation of zebrafish maternal genes. Dev Dyn. 242 (1), 44-52 (2013).
- Selman, K., Petrino, T. R., Wallace, R. A. Experimental conditions for oocyte maturation in the zebrafish, Brachydanio rerio. J Exp Zool. 269 (6), 538-550 (1994).
- Fauvel, C., Omnes, M. H., Suquet, M., Normant, Y. Reliable assessment of overripening in turbot (Scophtalmus maximus) by a simple pH measurement. Aquaculture. 117 (1-2), 107-113 (1993).
- Lahnsteiner, F., Weismann, T., Patzner, R. A. Composition of the ovarian fluid in 4 salmonid speices: Onchorhynchus mykiss, Salmo trutta flacustris, Salvelinus alpinus and Husho hucho. Reprod Nutr Dev. 35 (5), 465-474 (1995).
- Patiño, R., Bolamba, D., Thomas, P., Kumakura, N. Effects of external pH on hormonally regulated ovarian follicle maturation and ovulation in Atlantic croaker. Gen Comp Endocrinol. 141 (2), 126-134 (2005).
- Seki, S., et al. Development of a reliable in vitro maturation system for zebrafish oocytes. Reproduction. 135 (3), 285-292 (2008).
- Selman, K., Wallace, R. A., Sarka, A., Qi, X. Stages of oocyte development in the zebrafish, Brachydanio rerio. J Morphol. 218 (2), 203-224 (1993).
- Clelland, E., Peng, C. Endocrine/paracrine control of zebrafish ovarian development. Mol Cell Endocrinol. 312 (1-2), 42-52 (2009).
- Kane, D. A., Kimmel, C. B. The zebrafish midblastula transition. Development. 119 (2), 447-456 (1993).
- Kanagaraj, P., et al. Souffle/Spastizin controls secretory vesicle maturation during zebrafish oogenesis. PLoS Genet. 10 (6), e1004449 (2014).
- Brand, M., Granato, M., Nüsslein-Volhard, C., Nüsslein-Volhard, C., Dahm, R. . Keeping and raising zebrafish,Zebrafish - A Practical Approach. , 7-37 (2002).
- Connoly, M. H., Dutkosky, R. M., Heah, T. P., Sayler, G. S., Henry, T. B. Temporal dynamics of oocyte growth and vitellogenin gene expression in zebrafish (Danio rerio). Zebrafish. 11 (2), 107-114 (2014).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), e1115 (2009).
- Pelegri, F., Mullins, M. Genetic screens for mutations affecting adult traits and parental-effect genes. Meth Cell Biol. 104, 83-120 (2011).
- Baars, D. L., Takle, K. A., Heier, J., Pelegri, F. Ploidy manipulation of zebrafish embryos with Heat Shock 2 treatment. J Vis Exp. , (2016).
- Kimmel, C., Ballard, W. W., Kimmel, S. R., Ullman, B., Schilling, T. F. Stages of embryonic development in the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Eisen, J. S., Smith, J. C. Controlling morpholino experiments: don't stop making antisense. Development. 135 (10), 1735-1743 (2008).
- Schulte-Merker, S., Stainier, D. Y. R. Out with the old, in with the new: reassessing morpholino knockdowns in light of genome editing technology. Development. 141 (16), 3103-3104 (2014).
- Dekens, M. P. S., Santoriello, C., Vallone, D., Frassi, G., Whitmore, D., Foulkes, N. S. Light regulates the cell cycle in zebrafish. Curr Biol. 13 (23), 2051-2057 (2003).
- Sakai, N., Burgess, S., Hopkins, N. Delayed in vitro fertilization of zebrafish eggs in Hank's saline containing bovine serum albumin. Mol Mar Biotechnol. 6 (2), 84-87 (1997).
- Pelegri, F., Mullins, M. C. Genetic screens for mutations affecting adult traits and parental-effect genes. Meth Cell Biol. 135, (2016).
- Lindeman, R. E., Pelegri, F. Localized products of futile cycle/lrmp promote centrosome-nucleus attachment in the zebrafish zygote. Curr Biol. 22 (10), 843-851 (2012).
- Nair, S., Marlow, F., Abrams, E., Kapp, L., Mullins, M., Pelegri, F. The chromosomal passenger protein Birc5b organizes microfilaments and germ plasm in the zebrafish embryo. PLoS Genetics. 9 (4), e1003448 (2013).
- Eno, C., Solanki, B., Pelegri, F. aura (mid1ip1l) regulates the cytoskeleton at the zebrafish egg-to-embryo transition. Development. 143 (9), 1585-1599 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon