Method Article
Examen environnemental préalable d’Aeromonas hydrophila, Mycobacterium spp. et Pseudocapillaria tomentosa dans les systèmes de poisson-zèbre
Dans cet article
Résumé
Ce protocole décrit l’utilisation d’écouvillons de puisard et les analyses de boues des systèmes de poisson-zèbre, qui conduit à la détection accrue par rapport à l’usage exclusif des sentinelles pour détecter des agents pathogènes comme Aeromonas hydrophila, Mycobacterium spp. et Pseudocapillaria tomentosa. Un système de surveillance des œufs P. tomentosa en quarantaine est également proposé.
Résumé
Systèmes de surveillance de la santé sont développés et utilisés dans les installations de recherche de poisson-zèbre parce que les agents pathogènes des Danio rerio comme Aeromonas hydrophila, Mycobacterium spp. et Pseudocapillaria tomentosa ont le potentiel de entraver la recherche et le bien-être animal. Les poissons sont généralement analysés post-mortem pour détecter les microbes. L’utilisation d’animaux sentinelles est un moyen proposé pour améliorer la sensibilité de la surveillance et de réduire le nombre d’animaux à échantillonner. Le réglage d’un réservoir de préfiltration sentinelles d’un système de recirculation est décrite. La technique est développée pour prévenir la pollution des eaux et de représenter la population de poissons par une sélection rigoureuse de l’âge, le sexe et les souches. Afin d’utiliser le nombre minimal d’animaux, techniques de l’environnement de l’écran sont également détaillés. Réaction en chaîne de la polymérase (PCR) sur écouvillons puisard surface sert à améliorer significativement la détection de certaines espèces de mycobactéries pathogènes et répandu comme Mycobacterium fortuitum, Mycobacterium haemophilumet Mycobacterium chelonae. Une autre méthode environnementale se compose de traitement des boues au fond d’un réservoir d’eaux noires ou un puisard pour chercher des oeufs P. tomentosa . Il s’agit d’une technique rapide et bon marchée qui peut être appliquée en quarantaine où un dispositif de reproduction est immergé dans le réservoir d’animaux importés. Enfin, la PCR est appliquée à l’échantillon de boues et a. hydrophila est détecté au fond de la fosse et la surface. En règle générale, ces techniques d’examen environnemental préalable appliquées à ces pathogènes spécifiques ont conduit à une sensibilité accrue par rapport aux essais des sentinelles de préfiltration.
Introduction
Afin de protéger la recherche et le bien-être des animaux1,2, la présence d’agents pathogènes est surveillée dans les animaleries. Dans le cas du poisson-zèbre,3,4,5,6,7,8,9,10,11 de contrôle d’intégrité s’appuie souvent sur animaux analysé post-mortem par histopathologie, la culture de la bactériologie ou des méthodes moléculaires. Seule colonie d’animaux n’est pas la méthode recommandée en raison du nombre des poissons et des dépenses qui seraient nécessaires pour détecter les agents pathogènes de faible prévalence. Par conséquent, la méthode recommandée consiste à exposer un petit groupe d’animaux à une charge plus élevée de contaminants. Ces poissons sont aussi appelés sentinelles avant la filtration. Cette exposition dure pendant des mois et il s’agit d’une augmentation de la charge de travail pour le soignant animale et/ou une solution d’ingénierie construite à cet effet. Un autre défi est la projection de lignes importées en quarantaine où les animaux fertiles sont à être maintenue en vie, et ce n’est pas compatible avec des tests de routine sur les carcasses.
Nous décrivons ici quelques méthodes pour détecter certains agents pathogènes du poisson-zèbre (a. hydrophila, Mycobacterium spp. et P. tomentosa) en projetant d’environnement du système aquatique. L’objectif est de réduire le nombre de poissons utilisés pour la surveillance de la santé et à optimiser le chiffre d’affaires, coût et la sensibilité de la détection. Ces méthodes sont une alternative à l’utilisation des animaux et certaines techniques peuvent être appliquées aux importations de dépistage en quarantaine. Par exemple, Mocho9 a permis d’identifier plusieurs espèces de mycobactéries pathogènes en effectuant la PCR sur écouvillons puisard plutôt que le poisson-zèbre (y compris les sentinelles), et cela a été obtenue avec moins d’échantillons. Dans ce même étude, P. tomentosa oeufs ont été détectés avec plus de sensibilité en projetant les boues de réservoir à l’aide de microscopes et flottation plutôt que test poissons par PCR et l’histopathologie.
Le tableau 1 résume les différentes caractéristiques des sentinelles programmes3,4,5,6,7,8,9,10 utilisé par un certain nombre d’installations de poisson-zèbre. Après filtration sentinelles reçoivent de l’eau de la même manière que n’importe quel poisson de la colonie alors que sentinelles de préfiltration reçoivent de l’eau une fois qu’il a distribué à travers les aquariums colonie tout d’abord. Par exemple, préfiltration sentinelles peuvent être mis en place sur le système de recirculation en recevant en permanence l’eau Carter. C’est peut-être pas une option quand il y a beaucoup de systèmes indépendants dans la même pièce. Dans ce cas, un réservoir de préfiltration sentinelles peut être utilisé pour dépister toute la salle. Les sentinelles sont dans un réservoir statique, hors du système de recirculation, et leur eau est changée régulièrement, utilisant uniquement l’eau avant la filtration c'est-à-dire, eau de carter de vidange de tous les systèmes dans la salle. Cette technique est décrite ci-dessous comme point de référence pour la comparaison avec l’efficacité de l’examen environnemental préalable. L’aménagement proposé est conçu pour contrôler les problèmes de qualité de l’eau comme une diminution de pH ou une pollution par l’azote.
Le concept de l’examen préalable bactérienne s’appuie sur l’hypothèse que les bactéries sont détectables dans le biofilm tel que celui trouvé sur le mur de puisard à la surface de l’eau ou dans la boue au fond d’un réservoir. Le puisard semble un point de prélèvement idéal dans un système à recirculation aquaculture puisqu’il recueille les déchets (eau, matières fécales, aliments pour animaux et autres matières organiques) de tous les réservoirs avant la filtration. La surface de la fosse est souvent facilement accessible, le pistonnage est rapide, et elle peut être réalisée de façon aseptique pour éviter la contamination croisée de l’échantillon (à partir de gants par exemple). Le concept sert à identifier répandue pathogènes Mycobacterium spp. du poisson-zèbre systèmes9,12. La technique est décrite ci-dessous, et nous rendons compte également la détection d’a. hydrophila dans le poisson-zèbre puisard surface écouvillons et boues.
L’examen environnemental préalable pour les oeufs de parasite est basé sur la détection de Murray et al. 13 et la technique de flottation est utilisé systématiquement pour la parasitologie et dépistage microscopique des oeufs de parasite dans les selles,14. Mocho9 propose une alternative au processus d’échantillonnage et a montré que la technique pourrait être utilisée pour détecter les autres espèces du biotope poissons. Infectés d. rerio passer P. tomentosa oeufs avec leurs excréments et les œufs de parasites restent au fond de la citerne, dans la boue. Ils peuvent être récoltés là en raison de leur densité étant supérieure à l’eau. La densité des oeufs est utilisée pour traiter l’échantillon environnemental trop. Une première émission avec centrifugation sépare l’eau et les débris légers de matière plus lourd. Une seconde centrifugation s’appuie sur la solution saturée de sucre (avec une densité supérieure à la densité des oeufs P. tomentosa ) afin de permettre les oeufs du parasite à émerger à la surface du tube.
Le dépistage de bactéries présentes dans le biofilm et de P. tomentosa du fond de la citerne peut être combiné en effectuant des PCR pour tous ces agents pathogènes sur les sédiments d’échantillon de boues obtenues après la première centrifugation. Cela optimise le temps d’échantillonnage. La méthode est décrite ci-dessous. Nous proposons également d’utiliser ces techniques dans un contexte de mise en quarantaine. Pour importé poisson-zèbre adulte nécessitant d’être maintenu en vie de l’écran, un appareil de reproduction est inséré dans le réservoir de la quarantaine. Après une semaine, excréments et autres déchets dans l’appareil de reproduction sont recueillies et examinées par microscopie ou PCR. La technique est décrite ci-dessous et quelques oeufs P. tomentosa ont été détectés par microscopie dans ce contexte.
Protocole
1. exposition de préfiltration sentinelles d’un système de recirculation
-
Définissez un réservoir de 8 L propre d’un système de recirculation. Remplissez-le avec de l’eau en venant les puisards. Ajouter 2 perles en céramique ou l’éponge cubes de bio-media des systèmes à l’écran (Figure 1). Ajoutez 1-2 d.rerio/l (c.-à-d., 12 poissons). Utiliser des poissons de type sauvage du fond génétique dominant dans l’installation, par exemple AB.
- Sélectionnez au moins 6 poissons comme suit : au moins une femelle et un mâle moins de 6 mois d’âge, une femelle et un mâle entre 6 et 18 mois et une femelle et un mâle au-dessus de 18 mois.
-
Nourrir une fois par jour. Varier l’alimentation (p. ex., régime sec, artémia) pour s’assurer que les sentinelles sont exposés à tous les régimes utilisés dans l’installation de poisson-zèbre. Changer l’eau sur les lundi, mercredi et vendredi, c'est-à-diretrois fois par semaine pendant 4 mois.
- Pour effectuer le changement d’eau, les sentinelles de transfert et les bio-médias dans un réservoir temporaire. Vider complètement le réservoir de la sentinelle et le nettoyer. Remplissez le réservoir de sentinelles avec de l’eau Carter. Replacez les sentinelles et les bio-médias.
- Exposez les sentinelles pendant 4 mois à l’eau du puisard. Euthanasier le poisson par une méthode approuvée comme une immersion dans une solution de surdosage du 2-phénoxyéthanol (3 mL/L).
-
Pour confirmer la mort, attendre 10 min après l’arrêt du mouvement d’opercules.
- Prenez le cadavre avec une pince et congeler à-80 ° C dans un contenant identifié. Cela servira pour PCR12,15.
- Sinon, couper le tailat le pédoncule caudal, nick la paroi abdominale et mis dans du formol de 4 %.
ATTENTION : Utilisez des gants et fumées du cabinet pour l’histopathologie. Étiqueter le contenant d’échantillon.
2. Carter écouvillons
- Utiliser un écouvillon stérile sèche avec un manche en plastique. Porter des gants. Localiser la surface à l’écouvillon (mur de puisard à la surface de l’eau) et supprimer tout élément empêchant l’accès facile à la surface. Choisissez une surface de puisard avec faible débit.
-
Unsheathe l’écouvillon en enlevant l’emballage extérieur et exposer la pointe coton stérile à l’air. Éviter la contamination croisée de l’écouvillon en prenant soin de ne pas toucher aux surfaces non testés.
- Tamponner le mur de puisard plus de 5 à 10 cm pour absorber l’eau et le biofilm au niveau surface puisard d’eau.
- Gaine en retour, l’écouvillon ou casser la pointe dans un tube à centrifuger stérile. L’échantillon de l’étiquette et envoyer pour test de PCR ou congeler à-80 ° C.
3. détection des oeufs P. tomentosa au fond d’un réservoir
-
Analyse de boues par microscopie
- Utiliser une seringue de 60 mL9 pour aspirer les boues au fond d’un puisard ou n’importe quel réservoir détenant des poissons, y compris les sentinelles. Diviser l’échantillon en tubes de 15 mL. Fermer les tubes avec leur bouchon et étiquette les tubes.
- Préparer la solution de sucre saturé (densité = 1,27) en mélangeant 227 g de sucre en poudre dans 177 mL d’eau chaude avec un agitateur magnétique14.
- Centrifuger les tubes de 15 mL à 175-250 x g pendant 10 min dans une centrifugeuse avec des seaux de swing. Décanter les tubes et garder le sédiment dans leur tube.
- Remplir les tubes à moitié avec la solution de sucre saturé. Fermer les tubes avec leur couvercle à vis et mélanger soigneusement le sédiment avec la solution.
- Placer les tubes dans les centrifugeuse swing seaux et les remplir avec une solution saturée de sucre vers le haut. Mettre un couvercle en verre doucement sur le dessus de chaque tube et en contact avec la solution de sucre saturé.
- Centrifuger à 175-250 x g pendant 10 min. à noter qu’une lamelle couvre-objet peut tomber et briser lors de la centrifugation c’est pourquoi il y a 4 tubes pour chaque échantillon de 60 mL. Soulevez le couvercle en verre et placez-le sur une lame de verre. Étiquetez la diapositive avec un stylo crayon ou marqueur.
- En cas de trop nombreuses ruptures de couvercle en verre, remplir la plus grande partie du tube avec la solution de sucre saturé, centrifuger à 175-250 x g pendant 10 min, remplir vers le haut avec la solution de sucre saturé et déposez doucement le couvercle en verre. Attendez 30 min.
- Chercher les œufs P. tomentosa avec le microscope13 (Figure 2 et 1 vidéo). Identifier les prises bipolaires à grossissement 400 X6.
Remarque : La taille des oeufs est 57-78 µm de longueur et 27-39 µm de diamètre16,17. Notez qu’une diapositive positive est suffisant pour l’échantillon de 60 mL à être déclaré positif.
-
Dépistage importé des animaux en quarantaine pour les oeufs P. tomentosa
- La valeur de mâles et femelles d. rerio dans un réservoir. Ajouter dans le réservoir, un dispositif utilisé normalement pour récolter et préserver les oeufs pondus mais utilisez-le ici pour recueillir les excréments (Figure 3).
NOTE : par exemple, un réservoir plein de reproduction 1 L (réservoir extérieur et réservoir intérieur avec fond râpé) soit totalement immergé dans un réservoir de 13 L, permettant le libre accès pour les poissons à se déplacer dans et hors de l’appareil de reproduction. - Retirez l’appareil de reproduction après une semaine et récolter les boues collectées dans l’appareil de reproduction tel que décrit dans l’étape 3.1 « boues analyse au microscope ».
- La valeur de mâles et femelles d. rerio dans un réservoir. Ajouter dans le réservoir, un dispositif utilisé normalement pour récolter et préserver les oeufs pondus mais utilisez-le ici pour recueillir les excréments (Figure 3).
4. la PCR sur des sédiments de boues
- Aspirer les boues au fond d’une citerne ou un puisard avec une seringue de 60 mL9 et transférer l’échantillon dans un tube de 60 mL. Fermer le tube avec son couvercle à vis et l’étiquette du tube. Jeter la seringue.
- Agiter le tube de 60 mL et transférer 15 mL dans un tube de 15 mL. Fermer le tube avec son couvercle à vis et l’étiquette du tube.
- Centrifuger le tube de 15 mL à 175-250 x g pendant 10 min dans une centrifugeuse avec des seaux de swing. Décanter les tubes et garder le sédiment dans le tube.
-
Unsheathe un écouvillon en enlevant l’emballage extérieur et exposer la pointe coton stérile à l’air. Éviter la contamination croisée de l’écouvillon en prenant soin de ne pas toucher aux surfaces non testés.
- Tamponner le sédiment dans le tube pendant 15 s.
- Gaine en retour, l’écouvillon ou casser la pointe dans un tube à centrifuger stérile. Étiqueter les échantillons, congeler à-80 ° C et envoyer pour test de PCR.
Remarque : 45 mL reste dans le tube de 60 mL. Ce peut stocké pour la détection des oeufs P. tomentosa par analyse de boues par microscopie comme indiqué au point 3.1, par exemple, pour confirmer le résultat de la PCR. La PCR dans les boues peut être essayé pour le dépistage des animaux importés après étape 3.2.
Résultats
Les avantages des écouvillonnages puisard pour identifier répandue Mycobacterium spp., par rapport à des échantillons de poissons sont pris en charge par les résultats de la Figure 4. De 115 poissons testés, M. chelonae et M. haemophilum ont été détectés respectivement 5 % et 3 % des échantillons. Aucune autre espèce mycobactérienne pathogène a été identifié. Depuis les mêmes systèmes, 49 tampons Carter a révélé la présence de 5 espèces de mycobactéries. Rapport de cotes sont calculées conformément à l’hypothèse que M. chelonae et M. fortuitum sont détectés plus fréquemment par PCR dans les écouvillons de puisard de surface que dans l’échantillon de poisson. C’est statistiquement significative avec le rapport de cotes respectives de 11 (IC à 95 % : 4 à 29 ; p < 0,0001) et 306 (IC à 95 % : 18 à 5208 ; p = 0,0001). Les résultats montrent que la technique de prélèvement de puisard de surface est une alternative intéressante à l’usage exclusif de sentinelles à l’écran l’installation de poisson zèbre pour Mycobacterium spp. Les échantillons environnementaux ont également été utilisés pour le dépistage a. hydrophila. Ces bactéries ont été détectées dans les poissons, les boues et les échantillons de surface (Figure 4). Il prend également en charge la capacité des techniques proposées pour cribler le biotope des poissons.
Concernant l’analyse de boues pour détecter les oeufs P. tomentosa , Mocho9 détecté le parasite dans 27 % des échantillons de poissons par PCR et histopathologie tandis que les œufs ont été détectés chez 93 % des boues analysées du même système. Ici, la technique a été mis au défi de reproduire la quarantaine préalable. Dans ce contexte, les animaux importés ne peuvent pas être échantillonnés, et évaluer leur état de santé de façon opportune aide à la gestion de la biosécurité. Poissons de l’état de santé inconnu provenant d’une installation de positif de P. tomentosa ont été mis dans 8 réservoirs avec dispositifs de reproduction : maximum de 16 poissons/13 L réservoir, 7 transgéniques et ligne 1 de type sauvage, mélangé entre les sexes, âgés de 4 à 24 mois. La boue a été récoltée par les appareils après une semaine et analysée par microscopie. Oeufs P. tomentosa ont été vus dans 7 échantillons (88 %). Enfin, la détection par PCR du parasite a été testée sur écouvillons de puisard et sédiments de boues. 4 des 6 échantillons de boues étaient PCR positive et tous les résultats étaient négatifs pour les écouvillons de surface. Ce n’est pas surprenant puisque la projection de boues s’appuie sur la capacité des oeufs de tomber au fond de la cuve. Cela montre que les techniques d’analyse de boues peuvent servir à filtrer les aquariums d. rerio P. tomentosa infestation et que les méthodes peuvent être adaptées pour le dépistage des animaux importés.

Figure 1 : pré-filtration sentinel réservoir hors du système de recirculation. Un réservoir de 8 L est rempli avec l’eau bio-médias et des puisards des systèmes à l’écran. Les deux perles blanc céramique bio-médias s’asseoir au fond de la citerne (milieu de l’image). 12 poissons sont choisis en fonction de leur âge, souche et le sexe, et ils sont ajoutés au réservoir de sentinelle. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
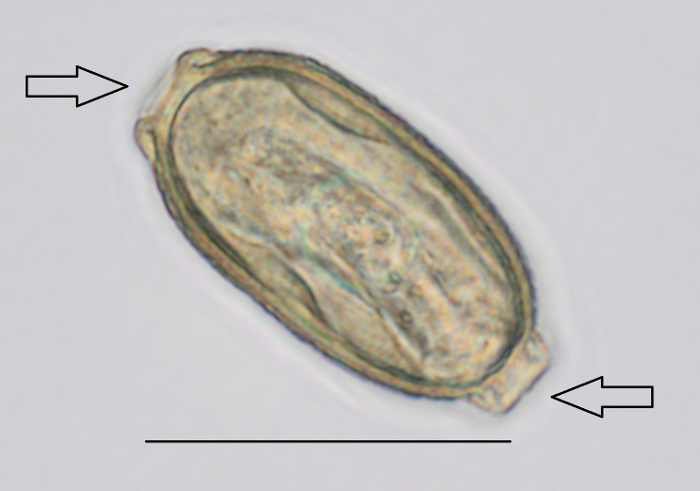
Figure 2 : oeufs P. tomentosa détecté pendant l’analyse de boues par microscopie. Grossissement utilisé était 400 X. Les flèches indiquent les prises bipolaires. Echelle = 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : dispositif de reproduction immergé dans un réservoir de poissons pour recueillir les boues pour analyse. Ce réservoir se situe sur un banc dans le but de l’image ; dans le cas contraire, elle est définie dans le système de recirculation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
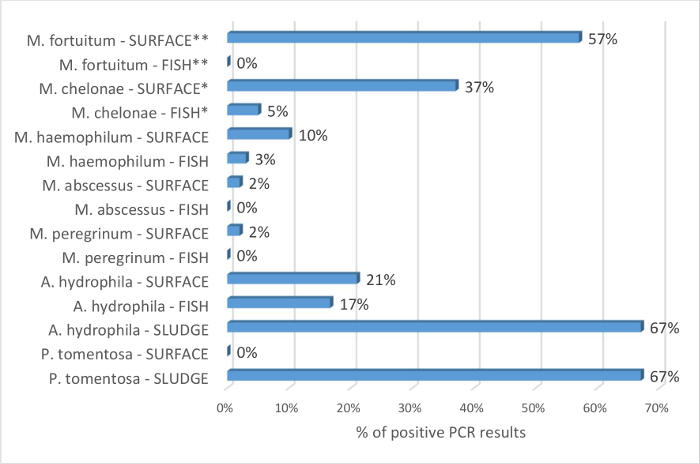
Figure 4 : Pourcentage d’identification de Mycobacterium spp., a. hydrophilaet P. tomentosa par PCR sur les poissons, la surface écouvillons de puisard et boues puisard. Pourcentage est obtenu en divisant le nombre de résultats positifs pour chaque espèce pathogène par le nombre d’échantillons analysés. Le pourcentage de résultats positifs est compte tenu par exemple de type poisson, SURFACE ou boues et indiqué après le nom de la bactérie. poisson de 115 et 49 écouvillons de puisard de surface ont été testés par PCR pour l’identification de Mycobacterium spp. Les données sont compilées avec des résultats de Mocho9 étant donné que c’est une extension de cette étude. Les poissons sont principalement de préfiltration sentinelles conformément au protocole 1 de l’article. Rarement, quand les sentinelles n’étaient pas disponibles, évadés et ancienne colonie de poisson (> 18 mois) ont été échantillonnés. Tous les systèmes testés pour Mycobacterium spp. ont été testés sur écouvillons poissons et puisard. Rapport de cotes sont calculées conformément à l’hypothèse que M. chelonae et M. fortuitum sont détectés plus fréquemment par PCR dans les écouvillons de puisard de surface que dans l’échantillon de poisson. C’est statistiquement significative avec le rapport de cotes respectives de 11 (IC à 95 % : 4 à 29 ; p < 0,0001) et 306 (IC à 95 % : 18 à 5208 ; p = 0,0001). Mycobacterium marinum PCR a été négatif pour tous les échantillons et il est donc considéré comme de ces installations et non inclus dans l’analyse. 12 poissons, 14 écouvillons de puisard de surface et des boues de puisard 6 ont été testés par PCR pour la présence d’a. hydrophila. 6 puisards ont été testés pour la présence de P. tomentosa sur la surface et dans les boues. PCR = Polymerase Chain Reaction. IC = intervalle de confiance. * et ** indiquer la signification statistique ; d’autres comparaisons n’étaient pas statistiquement significatives. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Vidéo 1 : balayage pour un oeuf de P. tomentosa au microscope à. La diapositive est obtenue à partir de l’analyse des boues comme indiqué au point 3.1. Le domaine est analysé afin de détecter un oeuf de P. tomentosa. Une fois qu’une structure est reconnue, elle est agrandie pour confirmer l’identification à une résolution plus élevée. S’il vous plaît cliquez ici pour voir cette vidéo. (Clic droit pour télécharger.)
| Auteurs | L’âge au début de l’exposition | Durée de l’exposition | Ans d’échantillonnage | Pré ou Post filtration | Entre les sexes | Souche (s) |
| Barton et al. 3 | 4 mois | 6 mois | 10 mois | Préfiltration | N/A | N/A |
| Borges et al. 4 | 6 mois | 6 mois | 12 mois | Préfiltration | N/A | Type sauvage AB |
| Collymore et al. 5 | Aussi jeune que possible | 3 mois | < 6 mois | Préfiltration | N/A | N/A |
| Geisler et al. 6 | 4 mois | 4 mois | 8 mois | Pré et post filtration | N/A | Type sauvage AB |
| Liu et al. 7 | 3 mois | 1-6 mois | 4-9 mois | Pré et post filtration | N/A | Type sauvage |
| Martins et al. 8 | 3 mois | 3 mois | 6 mois | Préfiltration | N/A | Type sauvage |
| Mocho9 | < 6 mois, 6 - 12 mois, > 18 mois | 4 mois | 7 - 24 mois | Préfiltration | 1 femelle et 1 mâle de chaque groupe d’âge | Type sauvage AB |
| Murray et al. 10 | 3-4 mois | 3 mois, 6 mois, 1 an | 7, 10 et 16 mois | Pré et post filtration | N/A | Type sauvage AB |
Tableau 1 : comparaison des paramètres de sentinelle dans les installations de poisson-zèbre. Les poissons de sentinelles peuvent être choisis selon leur âge, le sexe ou la souche. Ils sont exposés pendant une période définie et qu’ils reçoivent l’eau système de pré- ou post-filtration. Les données sont compilées à partir du numéro spécial 2016 sur la santé du poisson-zèbre journal3,4,5,6,7,8,9, 10.
Discussion
Limites des Techniques, des étapes critiques et le dépannage :
L’âge, le sexe, souche et durée de l’exposition des sentinelles ne sont pas normalisées. Ceci est illustré dans le tableau 1. Il y a très peu de projection du poisson au-dessous de 6 mois d’âge ou de poissons âgés. Il peut y avoir certains pathogènes qui affectent les jeunes poissons, étant donné que certains agents pathogènes qui sont plus répandus dans les populations âgées10,18,19,20. De même, le sexe n’est pas considéré dans le choix de certains groupes de sentinelle malgré certaines disent qu’il y a un parti pris sexiste pour certains agents pathogènes21. La technique proposée tente de résoudre ces problèmes, bien que le choix de la souche pourrait être fait selon un agent pathogène spécifique pour surveiller. Par exemple, TU pourrait aider à la détection de Mycobacterium spp.12,22, mais il existe un risque que les sentinelles puis agirait comme un réservoir ou affichage des signes cliniques. Quant à la durée d’exposition, l’approche du poisson-zèbre International Resource Center10 augmente les chances pour détecter les agents pathogènes qui pourraient manquer avec une période de contamination inadéquate. La nécessité d’une exposition prolongée implique que les sentinelles ne sont pas facilement disponibles. L’inscription des échantillons environnementaux permet une certaine souplesse et la multiplication des événements dépistage. Par exemple, le prélèvement peut avoir lieu tous les deux mois à 4 mois d’intervalle entre chaque méthode de dépistage. Cela peut réduire le laps de temps avant un nouveau pathogène est détecté.
Les techniques d’examen environnemental préalable s’appuient sur la détection de pathogènes dans l’environnement. Les agents pathogènes sont répandus par les poissons et donc dilués dans l’eau du système. La possibilité de capturer les agents pathogènes par filtration de l’eau23 n’a pas explorée. Les méthodes que nous décrivons sont efficaces seulement si les agents pathogènes sont donnés assez de temps pour se multiplier dans les poissons et le biofilm pour atteindre un seuil de contamination permettant la détection. Cette limitation des techniques est minimisée par une sélection critique des sites d’échantillonnage : la boue contenue dans le réservoir est échantillonnée plutôt que de la boue de Carter, et l’eau et le biofilm sont échantillonnés à la surface du bac, plutôt que dans un réservoir ou après filtration. Néanmoins, tous les échantillons provenant du même système sont peu susceptibles de donner les mêmes résultats. Des résultats positifs pour P. tomentosa peuvent être confirmées en utilisant un autre dosage (histopathologie, PCR ou analyse de boues). Mycobactéries résultats positifs de la PCR peuvent être confirmés par culture ou par un autre laboratoire de diagnostic. Cependant, lorsqu’il établit un état de santé, autres échantillons sont recommandés pour confirmer les résultats négatifs de toute technique d’examen environnemental préalable.
Importance de la Technique en ce qui concerne les méthodes existantes/Alternative :
Mycobacterium spp sont communs dans l’environnement et leur présence dans le carter ne prédit pas leur pathogénicité12. Mocho9 a montré que la surveillance des taux de mortalité est clé pour étudier l’évolution des problèmes de santé. L’utilisation d’échantillons de l’animales demeure indispensable à toute enquête vétérinaire. Surveillance de la santé implique la détection de tous les pathogènes répandues dans un établissement et cela ne peut être atteint avec l’utilisation exclusive de techniques d’examen environnemental préalable. Néanmoins, un manque de sensibilité des outils de diagnostic peut retarder ou empêcher une description précise de l’état de santé. Tandis que l’utilisation d’animaux sentinelles réduit le nombre de poissons pour détecter un microbe répandu dans la population, le manque de sensibilité ajoute du poids à l’aide d’une combinaison de méthodes, y compris l’examen environnemental préalable5,23. En effet le statut d’agent pathogène spécifique gratuit est généralement défini comme l’absence d’une espèce dans l’installation telles que les échantillons de l’environnementales et des animaux doivent tester négatif24,25.
Les résultats d’écouvillon puisard pour identifier Mycobacterium spp. montrent qu’en s’appuyant sur les poissons des échantillons peuvent conduire à un statut de faux négatifs sur la santé. Les 6 espèces de mycobactéries testés sont décrits comme pathogène ou potentiel pathogène chez le poisson zèbre15 et certains ne serait pas éliminée par la désinfection des surfaces oeuf avec chlore26 aussi assurée en quarantaine. Par conséquent, le faux négatif peut avoir des conséquences pour les collaborateurs qui importent des lignes. Par exemple, M. fortuitum n’est pas respectée par la PCR sur des échantillons de poisson mais plus de la moitié de l’écouvillon de puisard PCR détecté. Considérant que ces mycobactéries sont plus résistants au chlore que d’autres et leur aptitude à croître dans les réseaux d’aqueduc27, c’est un risque pour l’installation d’importation non contaminé. Pour permettre l’importation de lignes, les gestionnaires doivent faire confiance et de comparer les rapports sur la santé du Fonds pour l’exportation avec les leurs. L' ICLAS Performance Evaluation Program28 est essentielle à ce processus chez les rongeurs. Le réseau RESAMA rapporte la détection de M. gordonae et M. mucogenicum en Français d. rerio11. Ces mycobactéries ne sont pas proposées dans les panneaux des laboratoires commerciaux que nous utilisons. Il serait utile de prolonger le programme de l’ICLAS et d’harmoniser les épreuves diagnostiques ainsi que la liste des espèces pathogènes29.
A. hydrophila est aussi un pathogène qui a le potentiel pour être présenté lors de l’importation d’animaux, bien que sa sensibilité au chlore30 rend son élimination plus probable au cours de la désinfection des surfaces oeuf systématique. Le puisard, écouvillon et boues résultats montrent que l’examen environnemental préalable peut être utilisé pour détecter ce pathogène. Autres bactéries comme Mycobacterium spp. ont été détectés dans la boue par PCR23. Ce type d’échantillon est particulièrement pertinent car il permet la détection de pathogènes de hangar. Par exemple, une nouvelle application est l’analyse de boues pour dépister les poissons importés en quarantaine P. tomentosa. Le parasite est une menace pour la santé d’animal13 et néoplasie de modèles16. Par ailleurs, les concentrations de chlore utilisées dans la désinfection des surfaces courantes de poisson-zèbre oeuf ne sont pas efficace31. La capacité à l’écran les animaux importés avec un chiffre d’affaires d’une semaine et sans aucune euthanasie poissons semble donc très attrayante. Cette technique peut influencer les règles de quarantaine et de la biosécurité en permettant à un triage des importations. Un processus décisionnel est alors conçu selon les pathogènes répandues dans l’installation de l’exportateur, les pathogènes détectés dans les échantillons provenant du poisson importé et le risque de compromettre l’état sanitaire de l’importateur installation10.
Les Applications futures ou Directions après la maîtrise de ces Techniques :
Même si le traitement de quarantaine systématique est l’option choisie, l’efficacité de ces médicaments32,33,34,35,36 pouvant être évaluée par l’analyse de boues de dispositif de reproduction. Plus généralement, l’examen environnemental préalable pourrait servir à tester les composés contre les bactéries et les parasites éradication, notamment dans le biotope des poissons. Une autre application de niche de l’examen environnemental préalable consiste à surveiller la population du pathogène dans le live feed37,38. Bien que le principal de l’application de ces techniques est comme un atout précieux pour la boîte à outils de diagnostic pour la surveillance dans les établissements de poisson-zèbre de la santé. Grâce à un coût et un temps plus précis, définition efficace du statut sanitaire, écouvillons de puisard et analyse de boues sont complémentaires de la surveillance sentinelle et la pratique systématique de quarantaine. En effet, l’avenir de ces techniques est d’être une partie intégrante de tout rapport de santé laboratoire aquatique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à remercier l’équipe de natation de BRF de L¿Institut Francis Crick pour leur aide technique et l’apport critique. Ce travail a été soutenu par l’Institut de Crick Francis qui reçoit son financement de base du Cancer Research UK (FC001999), le Medical Research Council du Royaume-Uni (FC001999) et le Wellcome Trust (FC001999).
matériels
| Name | Company | Catalog Number | Comments |
| Aqua-Sed 250 mL | Vetark | 2-phenoxyethanol | |
| Tubed Sterile Dryswab Tip | mwe | MW100 | Sump surface |
| BD Plastipak Disposable Syringe 50mL Eccentric | Becton Dickinson | 300866 | They are actually graduated to 60 ml |
| Centrifuge tube 15 mL Corning | Corning | 430766 | |
| Centaur 2 benchtop centrifuge with 4 x 200 mL Swing–Out Rotor (unsealed) | Sanyo | MSB020.CX1.5 | |
| Cover Glass 22 mm x22 mm | Menzel-Glaser | MNJ-350-020H | |
| Plain Swab Sterile Plastic Applicator Rayon Tipped White Cap | Sterilin Ltd Thermo Fisher Scientific | F155CA | Swab sediment from sludge |
| 50 mL Self-Standing Centrifuge Tube CentriStar Cap | Corning | 430921 | |
| In-Tank Spawning Tray Set | MBK Installations Ltd |
Références
- Schroeder, P., Mocho, J. P. A veterinary perspective on laboratory zebrafish welfare. Fish Veterinary Journal. 14, 37-46 (2014).
- Mason, T., et al. Strategies to Mitigate a Mycobacterium marinum Outbreak in a Zebrafish Research Facility. Zebrafish. 13, 77-87 (2016).
- Barton, C. L., Johnson, E. W., Tanguay, R. L. Facility Design and Health Management Program at the Sinnhuber Aquatic Research Laboratory. Zebrafish. 13, 39-43 (2016).
- Borges, A. C., et al. Implementation of a Zebrafish Health Program in a Research Facility: A 4-Year Retrospective Study. Zebrafish. 13, 115-126 (2016).
- Collymore, C., Crim, M. J., Lieggi, C. Recommendations for Health Monitoring and Reporting for Zebrafish Research Facilities. Zebrafish. 13, 138-148 (2016).
- Geisler, R., Borel, N., Ferg, M., Maier, J. V., Strähle, U. Maintenance of Zebrafish Lines at the European Zebrafish Resource Center. Zebrafish. 13, 19-23 (2016).
- Liu, L., Pan, L., Li, K., Zhang, Y., Zhu, Z., Sun, Y. Zebrafish Health Conditions in the China Zebrafish Resource Center and 20 Major Chinese Zebrafish Laboratories. Zebrafish. 13, 8-18 (2016).
- Martins, S., Monteiro, J. F., Vito, M., Weintraub, D., Almeida, J., Certal, A. C. Toward an Integrated Zebrafish Health Management Program Supporting Cancer and Neuroscience Research. Zebrafish. 13, 47-55 (2016).
- Mocho, J. -. P. Three-Dimensional Screen: A Comprehensive Approach to the Health Monitoring of Zebrafish. Zebrafish. 13, 132-137 (2016).
- Murray, K. N., Varga, Z. M., Kent, M. L. Biosecurity and Health Monitoring at the Zebrafish International Resource Center. Zebrafish. 13, 30-38 (2016).
- Legendre, L., et al. RESAMA: A Network for Monitoring Health and Husbandry Practices in Aquatic Research Facilities. Zebrafish. 13, 56-65 (2016).
- Whipps, C. M., Matthews, J. L., Kent, M. L. Distribution and genetic characterization of Mycobacterium chelonae in laboratory zebrafish Danio rerio. Dis Aquat Organ. 82 (1), 45-54 (2008).
- Murray, K. N., Peterson, T. S. Pathology in practice. P. tomentosa infection in zebrafish. J Am Vet Med Assoc. 246 (2), 201-203 (2015).
- Foreyt, W. J. . Veterinary Parasitology Reference Manual. , (2001).
- Whipps, C. M., Lieggi, C., Wagner, R. Mycobacteriosis in zebrafish colonies. ILAR J. 53 (2), 95-105 (2012).
- Kent, M. L., Bishop-Stewart, J. K., Matthews, J. L., Spitsbergen, J. M. Pseudocapillaria tomentosa, a nematode pathogen, and associated neoplasms of zebrafish (Danio rerio) kept in research colonies. Comp Med. 52 (4), 354-358 (2002).
- Moravec, F. Observations on the bionomy of the nematode Pseudocapillaria brevispicula (Linstow, 1873). Folia Parasitol. 30, 229-241 (1983).
- Ramsay, J. M., Watral, V., Schreck, C. B., Kent, M. L. Pseudoloma neurophilia infections in zebrafish Danio rerio: effects of stress on survival, growth, and reproduction. Dis Aquat Organ. 88 (1), 69-84 (2009).
- Watral, V., Kent, M. L. Pathogenesis of Mycobacterium spp. in zebrafish (Danio rerio) from research facilities. Comp Biochem Physiol C Toxicol Pharmacol. 145, 55-60 (2007).
- Whipps, C. M., Dougan, S. T., Kent, M. L. Mycobacterium haemophilum infections of zebrafish (Danio rerio) in research facilities. FEMS Microbiol Lett. 270, 21-26 (2007).
- Chow, F. W., Xue, L., Kent, M. L. Retrospective study of the prevalence of Pseudoloma neurophilia shows male sex bias in zebrafish Danio rerio (Hamilton-Buchanan). J Fish Dis. 39 (3), 367-370 (2016).
- Murray, K. N., Bauer, J., Tallen, A., Matthews, J. L., Westerfield, M., Varga, Z. M. Characterization and management of asymptomatic Mycobacterium infections at the Zebrafish International Resource Center. J Am Assoc Lab Anim Sci. 50 (5), 675-679 (2011).
- Crim, M. J., Lawrence, C., Livingston, R. S., Rakitin, A., Hurley, S. J., Riley, L. K. Comparison of Antemortem and Environmental Samples for Zebrafish Health Monitoring and Quarantine. J Am Assoc Lab Anim Sci. , (2017).
- Jensen, E. S., Allen, K. P., Henderson, K. S., Szabo, A., Thulin, J. D. PCR testing of a ventilated caging system to detect murine fur mites. J Am Assoc Lab Anim Sci. 52 (1), 28-33 (2013).
- . Commission Regulation (EC) No 1168/2006 of 31 July 2006 implementing Regulation (EC) No 2160/2003 as regards a Community target for the reduction of the prevalence of certain salmonella serotypes in laying hens of Gallus gallus and amending Regulation (EC) No 1003/2005 (Text with EEA relevance). OJ. L. 211, 4-8 (2006).
- Chang, C. T., Colicino, E. G., DiPaola, E. J., Al-Hasnawi, H. J., Whipps, C. M. Evaluating the effectiveness of common disinfectants at preventing the propagation of Mycobacterium spp. isolated from zebrafish. Comp Biochem Physiol C Toxicol Pharmacol. 178, 45-50 (2015).
- Le Dantec, C., Duguet, J. P., Montiel, A., Dumoutier, N., Dubrou, S., Vincent, V. Chlorine disinfection of atypical mycobacteria isolated from a water distribution system. Appl Environ Microbiol. 68 (3), 1025-1032 (2002).
- Goto, K., Hayashimoto, N., Ishida, T., Takakura, A., Kagiyama, N. First trial in the developmental phase of the "performance evaluation program" based on the ICLAS animal quality network program: self-assessment of microbiological monitoring methods using test samples supplied by ICLAS. Exp Anim. 58 (1), 47-52 (2009).
- Nogueira, C. L., et al. Mycobacterium saopaulense sp. nov., a rapidly growing mycobacterium closely related to members of the Mycobacterium chelonae--Mycobacterium abscessus group. Int J Syst Evol Microbiol. 65 (12), 4403-4409 (2015).
- Massa, S., Armuzzi, R., Tosques, M., Canganella, F., Trovatelli, L. D. Note: susceptibility to chlorine of Aeromonas hydrophila strains. J Appl Microbiol. 86 (1), 168-173 (1999).
- Martins, M. L., Watral, V., Rodrigues-Soares, J. P., Kent, M. L. A method for collecting eggs of Pseudocapillaria tomentosa (Nematoda: Capillariidae) from zebrafish Danio rerio and efficacy of heat and chlorine for killing the nematode's eggs. J Fish Dis. 40 (2), 169-182 (2017).
- Maley, D., Laird, A. S., Rinkwitz, S., Becker, T. S. A simple and efficient protocol for the treatment of zebrafish colonies infected with parasitic nematodes. Zebrafish. 10 (3), 447-450 (2013).
- Samaee, S. M. Experimental Assessment of the Efficacy of Five Veterinary Broad-Spectrum Anthelmintics to Control the Intestinal Capillariasis in Zebrafish (Danio rerio). Zebrafish. 12 (3), 255-267 (2015).
- Collymore, C., et al. Tolerance and Efficacy of Emamectin Benzoate and Ivermectin for the Treatment of Pseudocapillaria tomentosa in Laboratory Zebrafish (Danio rerio). Zebrafish. 11 (5), 490-497 (2014).
- Chang, C. T., Whipps, C. M. Activity of Antibiotics against Mycobacterium Species Commonly Found in Laboratory Zebrafish. Journal of Aquatic Animal Health. 27 (2), 88-95 (2015).
- Chang, C. T., Doerr, K. M., Whipps, C. M. Antibiotic treatment of zebrafish mycobacteriosis: tolerance and efficacy of treatments with tigecycline and clarithromycin. J Fish Dis. , (2017).
- Peterson, T. S., Ferguson, J. A., Watral, V. G., Mutoji, K. N., Ennis, D. G., Kent, M. L. Paramecium caudatum enhances transmission and infectivity of Mycobacterium marinum and M. chelonae in zebrafish Danio rerio. Dis Aquat Organ. 106 (3), 229-239 (2013).
- Watts, S. A., Lawrence, C., Powell, M., D'Abramo, L. R. The Vital Relationship Between Nutrition and Health in Zebrafish. Zebrafish. 13, 72-76 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon