Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Détermination de la puissance Relative d’un anticorps Monoclonal Anti-TNF (mAb) de neutralisants TNF en utilisant une méthode de Bioanalytical In Vitro
Dans cet article
Résumé
Un protocole pour la détermination de l’activité anti-apoptotique relative d’un anti-TNFα mAb en utilisant un mécanisme de neutralisation avec cellules WEHI 164 est présenté ici. Ce protocole est utile pour comparer la force de la neutralisation des molécules différentes avec les mêmes fonctionnalités biologiques.
Résumé
Ce protocole indique la mesure de la neutralisation de l’activité apoptotique de TNFα dans un modèle murin de cellulaire des fibroblastes (WEHI 164) à l’aide d’un ACM anti-TNFα. En outre, ce protocole peut être utilisé pour évaluer les autres molécules anti-TNFα, telles que les protéines de fusion. Le modèle cellulaire utilisé ici est sensible à l’apoptose induite par le TNFα lorsqu’un facteur de stress supplémentaire est induit dans des conditions de culture cellulaire (p. ex., privation de sérum). Cette procédure illustre comment exécuter cet essai analytique, mettant en évidence les opérations clées concernant la préparation des échantillons, dilution de la cellule, induction de l’apoptose et des mesures spectrophotométriques qui sont essentielles pour assurer des résultats positifs. Ce protocole révèle les conditions de meilleur performances relatives à l’induction de l’apoptose et efficace signal enregistrement, conduisant à des valeurs d’incertitude faible.
Introduction
Activité biologique est la mesure quantitative de l’activité biologique basée sur les attributs de produit dosé qui sont liés aux propriétés biologiques pertinentes, alors que la quantité (exprimée en masse) est une mesure physico-chimiques de la teneur en protéines. Tests d’activité, ainsi que d’autres méthodes d’analyse, sont effectuées dans le cadre de conformité de produit, la stabilité et des études de comparabilité. En ce sens, les mesures de puissance sont utilisées afin de démontrer que les lots de produit respectent les attributs qualité critiques (CQA) ou les critères d’acceptation pendant toutes les phases des essais cliniques et après approbation du marché.
L’apoptose est mort cellulaire programmée, naturellement lorsque les cellules sont infectées par un virus, ou quand les cellules sont stressées par l’environnement facteur que compromis cellulaires la viabilité et la fonction1,2. Entre autres, l’inhibition de l’apoptose, ou la neutralisation biologique, est l’un des mécanismes thérapeutiques principalement connues du mAbs, particulièrement dans le traitement des maladies chroniques comme les maladies inflammatoires à médiation immunitaire. Molécules anti-TNFα exercent leurs propriétés thérapeutiques en bloquant l’interaction du facteur de nécrose tumorale alpha (TNFα) avec le p55 et p75 cellule récepteurs de surface3, empêchant ainsi les voies de signaux qui conduisent finalement à l’apoptose cellulaire.
TNFα peut produire une inflammation dans certaines maladies chroniques4. TNFα est faussement sécrétée dans le milieu extracellulaire par les macrophages, qui sont les sentinelles du système immunitaire inné et les principaux acteurs dans ce genre de maladie5. Comme un chemin d’accès commun, déréglementation de TNFα est associée à la pathogenèse de ces maladies. Sans contrôle et sous induction constante et stress cellulaire, TNFα induit la dégénérescence des cellules mort et tissus, conduisant finalement à la polyarthrite rhumatoïde, maladie de Crohn et autres profils pathologiques6.
Antagonistes du TNF qui bloquent l’interaction entre TNF et ses récepteurs ont servi plus en plus comme un traitement efficace pour réduire les symptômes et entraver la progression de ces maladies. De nos jours, les médicaments anti-TNFα sont largement utilisés pour contrôler la concentration systémique de cette cytokine, empêchant ainsi davantage de la dégénérescence des tissus impliqués. En ce sens, il est impératif de fournir un bioessai fiable et reproductible pour décrire la capacité spécifique d’un médicament d’atteindre son effet biologique.
Dans ce protocole, critique étapes identifiées lors de l’élaboration d’un test de neutralisation-pour la mesure de succès de l’activité biologique sont mises en évidence, avec un accent particulier sur les compétences nécessaires pour exécuter la méthode bio-analytique. Cette méthode bio-analytique fournit des informations utiles de comparabilité entre les différents lots ou anti-TNFα médicaments par rapport à une substance de référence testé cliniquement.
Protocole
1. préparation des supports et des Solutions
- préparer le milieu de culture : RPMI-1640 avec 10 % FBS, pH 7.4.
- Milieu de culture pour le dosage Prepare : RPMI 1640-sans rouge de phénol, mais avec 1 % FBS, pH 7.4.
- Préparer la solution de lavage de cellule : solution de SPD Mg et Ca-sans EDTA de 0,02 %, pH 7,4.
- Préparer la solution de détachement cellulaire : 0,125 % trypsine avec 1 mM EDTA.
- Décongeler 100 mL d’une solution de 0,25 % de trypsine-EDTA et transférer dans un ballon jaugé de 500 mL stérile.
- Mix avec 100 mL de cellule solution de lavage et diluer les aliquotes de 15 mL dans des tubes stériles 15 mL. Magasin à -70 à-80 ° C jusqu'à l’utilisation.
- Filtrer ces solutions au travers d’une membrane de 0,22 µm et réchauffer jusqu'à 37 ° C avant de les utiliser au moins 30 min.
- Préparer la solution mère de l’induction de l’apoptose solution TNFα à 3,3 µg/mL.
- Dissoudre 20 µg de TNFα avec 500 µL d’eau stérilisée par filtration dans son conteneur primaire et mélanger jusqu'à dissolution complète.
- Transvaser dans un tube stérile de 15 mL et ajouter 5,5 mL de solution de Mg et Ca-sans SPD dans ce tube. Mélanger délicatement à l’aide d’un agitateur Vortex.
- Partie aliquote de la solution en 70 portions µL. Diluer chaque aliquote dans des microtubes 0,5 mL et les conserver à -80 ° C.
- Préparer l’apoptose solution induction : solution TNFα à 40 ng/mL.
- Décongeler une partie aliquote de la solution mère d’induction apoptose, incubation dans un bain d’eau à 25 ° c pendant 10 min.
- Diluer la solution mère de l’induction de l’apoptose à 40 ng/mL en ajoutant 61 µL de solution TNFα 3,3 µg/mL à 4,939 mL de milieu de culture d’essai dans un tube stérile de 15 mL.
- Mix par mélangeur vortex pour 10 s ; cette solution doit être fraîchement préparée avant utilisation.
- Chauffer la solution à 37 ° C pendant au moins de 30 min avant de les utiliser dans essai d’eneutralization de th.
- Préparez la solution de substrat : caspase 3/7 Glo solution 7 , 8.
- Décongeler la solution tampon de caspase (tampon de Glo caspase 3/7) 12 h avant utilisation.
- Laissez la solution tampon de caspase et le substrat (substrat de Glo caspase 3/7) siègent séparément à 25 ± 5 ° C pendant 30 min avant mélange.
- Transférer 10 mL de la solution tampon de caspase au substrat flacon et mélanger par inversion.
- Garder à 25 ± 5 ° C, lumière protégée jusqu'à utilisation.
Remarque : La solution est stable pendant 6 h à température ambiante.
2. Culturing et comptage des cellules
- cellule de décongélation et de la sous-culture première.
- Retirer un flacon avec 164 WEHI cellules 9 un congélateur à-80 ° c et de les transférer à un bain de glace.
- Pipette en haut et en bas avec 1 mL de milieu de culture pré chauffé jusqu'à ce que les cellules congelées décongeler complètement.
- Distribuer 9 mL de milieu de culture pré chauffé dans un tube stérile de 15 mL.
- Transférer la suspension cellulaire dans le tube stérile de 15 mL et mélanger doucement cinq fois par inversion.
- Centrifuger la suspension cellulaire à 125 x g pendant 3 min. jeter le surnageant et ventiler le culot cellulaire.
- Ajouter 5 mL de milieu de culture dans le tube. Mélanger jusqu'à ce que les cellules sont complètement resuspendues.
- Pour le comptage des cellules, transférer 50 µL de la suspension cellulaire à un 500 µL microtube et mélanger avec 50 µL de 0,4 % le bleu trypan. Compter les cellules et ajuster à 0,5 x 10 6 cellules/mL. Voir l’étape 2.2, au-dessous de.
- Ajouter 13 mL de milieu de culture pré chauffé à un flacon de culture cellulaire 75 mL.
- Distribuer suffisamment volume de suspension cellulaire de l’étape 2.1.6 pour atteindre 0,5 x 10 6 cellules/mL dans le flacon de culture cellulaire et incuber à 37 ° C et 5 % de CO 2 pendant la nuit.
- Comptage cellules.
NOTE : Voir référence 10.- à l’aide de la solution de l’étape 2.1.6, transfert 0,05 mL d’un hémocytomètre et déterminer la densité des cellules au microscope à l’aide d’exclusion bleu trypan.
- Quantifier le nombre total de cellules et les cellules viables.
- Régler les suspensions cellulaires à 0,5 x 10 6 cellules/mL.
Équation 1
V, milieu de culture (mL) =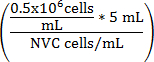
V milieu de culture (mL) = (5 mL - V suspension cellulaire)
V milieu de culture (mL) = volume ajusté de WEHI 164 suspension de cellules
NVC = nombre de cellules/mL de viable WEHI 164
V milieu de culture (mL) = volume de milieu de culture de dosage ajouté à la suspension de cellules pour atteindre 0,5 x 10 6 cellules/mL
0,5 x 10 6 = densité cellulaire cible
- Cellule détachement et la sous-culture de deuxième et troisième.
NOTE : Un système de vide peut servir à supprimer les solutions de ces flacons. Pipettes stériles jetables ou en verre peuvent être utilisés. Si la pipette a un sabot de coton en haut, il doit être enlevé avant toute utilisation.- Retirer le milieu de culture de la culture de cellules T-flacon à l’aide d’une pipette stérile de 1 mL et un vide. Solution
- verser 5 mL de lavage des cellules dans la culture de T-flacon, mélanger doucement et jetez la solution. Répéter cette étape deux fois.
Remarque : La suppression totale du milieu de culture est essentielle pour le détachement cellulaire efficace. - Ajouter 15 mL de solution de détachement cellulaire à la T-fiole et laisser reposer pendant 3 min dans un incubateur à 37 ° C et 5 % de CO 2.
- Vérifier l’absence de cellules attachées à la paroi intérieure du ballon sous le microscope. Supprimer les cellules de la T-flacon à l’aide d’une pipette stérile de 20 mL de la culture et de leur verser l’échantillon dans un tube stérile de 50 mL.
- Centrifuger la suspension cellulaire à 125 x g pendant 3 min. jeter le surnageant et Resuspendre le culot avec un autre 5 mL de milieu de culture.
- Compter les cellules et ajouter assez milieu de culture pour atteindre la concentration de la cellule souhaitée selon l’équation 1.
- Ajouter cette suspension à 72 cm 2 T-fiole et incuber une nuit à 37 ° C et 5 % de CO 2.
- Repiquer les cellules au moins deux fois avant de les utiliser dans la neutralisation assay. Répétez les étapes 2.3.1-2.3.8 pour les deux prochains jours.
- Assay suspension cellulaire.
- Sélectionner un 164 WEHI sous-culture qui a au moins trois passages. Reportez-vous à l’étape 2.1.
- Détacher et compter les cellules suivant étapes 2.2 et 2.3 du présent protocole.
- Diluer la suspension cellulaire selon l’équation 1 à 0,5 x 10 6 cellules/mL.
- Utiliser cette suspension cellulaire pour le test de neutralisation. Mélanger toutes les suspensions cellulaires par vortex mixer avant toute utilisation.
3. Préparation d’anticorps et de Dilutions
- dosage des mAbs.
- Déterminer la concentration de la substance de référence, témoin et échantillon d’analyse par absorption UV à 280 nm à l’aide de leur extinction massive coefficient (1,39) 11.
NOTE : Les concentrations originales pourraient être prises des étiquettes de produits pharmaceutiques. Toutefois, cela doit être vérifiée par absorption UV.
- Déterminer la concentration de la substance de référence, témoin et échantillon d’analyse par absorption UV à 280 nm à l’aide de leur extinction massive coefficient (1,39) 11.
- mAb dilutions.
- Diluer tous les échantillons indépendamment en trois exemplaires, avec la solution de SPD exempts de Ca et de Mg dans 2 mL microtubes, jusqu'à 2 mg/mL. Confirmer cette concentration par absorption UV en trois exemplaires, en utilisant comme le blanc SPD exempts de Ca et de Mg solution.
- Mélanger les solutions protéiques stock pendant 5 s à l’aide d’un agitateur Vortex.
- Diluer 100 µL de chaque solution de mAb 2 mg/mL avec 0,9 mL le dosage du milieu de culture.
- Mix pour 5 s de mélangeur vortex.
Remarque : Ces solutions ont une concentration de 200 µg/mL. Les dilutions doivent être faites pour chaque triplicata. - Diluer 10 & #181 ; L de chaque solution de mAb de 200 µg/mL avec 0,99 mL le dosage du milieu de culture. Mélange de 5 s à l’aide d’un agitateur Vortex. Ces solutions ont une concentration de 2 µg/mL. Effectuer des dilutions pour chaque trois exemplaires avant de les utiliser dans l’épreuve de séroneutralisation.
- Faites par les anti-TNFα mAb dilutions à trois plaques de microtitration indépendants. Faire un double de chaque triplicata indépendant et leur dispenser dans une microplaque, comme il est indiqué dans le tableau 1. Substance de référence < tableau fo:keep-together.within-page = « 1 » fo:keep-avec-next.within-page = « toujours » fo:text-align = « center » > 1 plaque Plate 2 plaque de 3 Puits échantillon puits échantillon puits échantillon B2:B11 Substance de référence B2:B11 témoin B2:B11 échantillon analytique C2:C11 C2:C11 C2:C11 D2:D11 échantillon analytique D2:D11 Substance de référence D2:D11 témoin E2:E11 E2:E11 E2:E11 F2:F11 exemple de contrôle F2:F11 échantillon analytique F2:F11 Substance de référence G2:G11 G2:G11 G2:G11 Tableau 1 : baies d’échantillon de microplaque. Un test de neutralisation complète doit être exécuté en trois plaques de microtitration dans coordonnées B2 pour G11. Aléatoires de distribution de référence, analytique et les échantillons de contrôle permettent aux chercheurs de vérifier tout biais dans l’analyse.
- Effectuer des dilutions de mAb de chaque référence, goûter ou un contrôle, comme illustré dans le tableau 2.
Remarque : Les concentrations de mAb anti-TNFα décrites dans ce tableau ne sont pas les concentrations finales dans le test de neutralisation. < td > 250
T mesure 2 : les dilutions de mAb Anti-TNFα. Des dilutions successives du mAbs anti-TNFα sont illustrées dans ce tableau. La concentration finale décrite dans ce tableau n’est pas les concentrations dans l’essai, où l’ACM anti-TNFα ont été dilués par un facteur 3 (milieu de culture, mAb dilution + suspension de cellules). Lignes en gras représentent les dilutions venant des lignes 3, 5, 7, 9 et 10 ; les lignes non-gras représentent dilution des lignes 3, 4 et 6. Ces dilutions successives sont faites juste avant d’effectuer le test de neutralisation. Il faut faire attention à la composition de pipetage de haut en bas trois fois avant de distribuer les dilutions.Colonne plaque de milieu de culture de Volume de dosage (μL) Volume de la Substance de référence, échantillon d’analyse ou de contrôle Échantillon (uL) Concentration dans la plaque de test (ng/mL) 2 0 230 2000 3 150 150 de la ligne 2 1000 4 75 75 de la ligne 3 500 5 100 50 de la ligne 3 333 6 75 75 de la ligne 4 7 75 75 de la ligne 5 166 8 75 75 de la ligne 6 125 9 75 75 BOF ligne m 7 83 10 75 75 de la ligne 9 41 11 150 75 de la ligne 10 13 - Garder les plaques à 25 ± 5 ° C jusqu'à l’utilisation.
4. Test de neutralisation avec des cellules WEHI 164
- Mix au vortex toutes suspensions (0,5 x 10 6 cellules/mL) de cellules avant de distribuer à n’importe quelle étape du présent protocole.
Remarque : Dans cette section, réchauffer chaque solution à 37 ° C pendant 30 min avant de l’utiliser. - Transférer 50 µL de la suspension cellulaire à chacun des 60 puits de la microplaque, passant de 2 à 11 de colonne et ligne B à G.
- Transférer 50 µL de référence mAb, échantillon et contrôle les dilutions en microplaques. Suivent le schéma représenté à la Figure 1.
- Ajouter 50 µL de la solution d’induction de l’apoptose dans chaque cupule.
- Utiliser les contrôles cellulaires de 50 µL de 164 WEHI cellules, dispensés dans trois puits. Mettre chaque puits pour un volume final de 150 µL avec le milieu culture.
- Utiliser un contrôle de la cytotoxicité d’un mélange de 50 µL de cellules WEHI 164 plus 50 µL de solution d’induction de l’apoptose. Mettre chaque puits pour un volume final de 150 µL avec le milieu culture.
- Control pour le TNFα, utilisez 50 µL de la solution de l’induction de l’apoptose et l’amener à 150 µL avec le milieu de culture test.
- Pour l’essai à blanc, utilisez 150 µL de l’analyse du milieu de culture seul.
- Remplir les puits restants avec 150 µL de milieu de culture pour éviter les effets d’évaporation plaque. 4.1.1-4.1.9
- , répétez les étapes deux fois dans deux autres plaques de microtitration.
Remarque : Les concentrations finales mAb dans les microplaques sont : 0,666, 0,333, 0,167, 0.111, 0,083, 0,056, 0.042, 0,028, 0,014 et de 0,004 µg/mL. - Charger les échantillons en microplaques, comme il est indiqué dans la Figure 1.
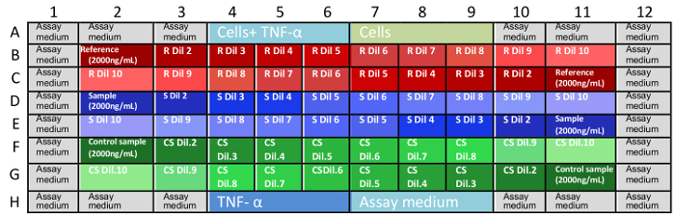
figure 1 : destination des échantillons dans les plaques de dosage. B1 à G11 sont bien coordonnées dans les microplaques et décrire les positions où les dilutions de l’échantillon sont placées. Coordonnées manquantes sont puits remplis de contrôles et de milieu de culture de dosage (A1-A12 et H1-H12). Cette distribution aléatoire d’échantillons (dilutions et inverses dans les microplaques) permet d’éliminer les biais dans les résultats, en raison de l’évaporation, de milieu ou d’autres variables. Il est préférable que chaque microplaque est effectué par un analyste à la fois. R : référence, S: échantillon, CS : échantillon de contrôle, Dil : dilution. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure. - Incuber les trois plaques à 37 ° C et 5 % de CO 2 pour 16 ± 2 h.
- Laisser le réactif de Glo caspase 3/7 à 25 ± 5 ° C pendant 30 min avant utilisation.
- Ajouter 100 µL de ce réactif dans toutes les loges, y compris les échantillons et les contrôles.
- Secouer les plaques à l’aide d’un mélangeur de vortex de microplaque pendant 3 min à 25 ± 5 ° C immédiatement après la distribution dans les puits.
- Incuber les boîtes pendant 2,5 ± 0,5 h à 25 ± 5 ° C, abri de la lumière.
- Insérer le microplates dans le luminomètre et remplissez la section suivante.
5. Analyse des résultats
- à l’aide d’un logiciel pour la détection de la luminescence, sélectionner la fonction de mode et de point de terminaison de luminescence.
- Plaque de sélectionner un fond clair 96 puits et ses 80 puits internes, à l’exclusion des colonnes 1 et 12.
- Choisir un temps d’intégration de 1 250 ms et 10 s pour le mélange de la microplaque avant lecture.
- Sélectionner les puits où substance de référence, substance analytique et échantillon de contrôle seront placés et identifier avec leurs concentrations correspondantes.
- Lire les échantillons placés dans les microplaques avec le luminomètre.
- Utiliser une quatrième équation de paramètres pour l’analyse des résultats. Graphique d’une courbe dose-réponse, comme illustré à la Figure 2.
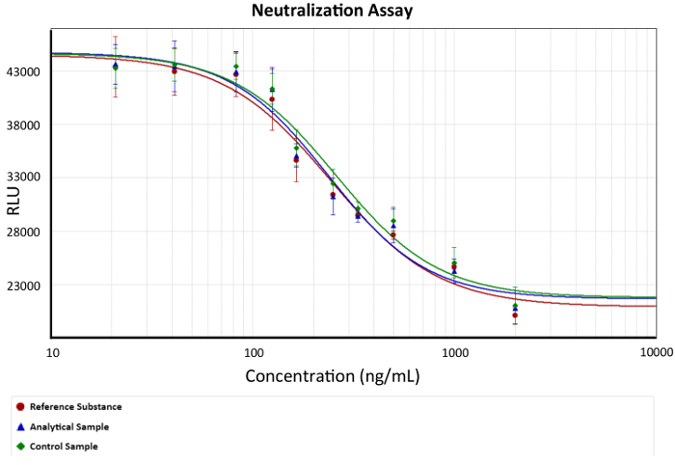
figure 2 : courbe Dose-réponse. Concentration en ACM anti-TNFα fonction luminescence (viabilité cellulaire) est représentée. Une quatrième équation de paramètres décrivant la protection anti-TNFα du mAbs a été utilisée comme modèle. CE50 est la concentration de mAb capable de neutraliser la quantité de TNFα qui provoquent la mort cellulaire de 50 % dans chaque essai, illustrée dans le graphique comme le changement de pente. Barres de décrivent l’écart de la luminescence pour chaque concentration de mAb. x représente la concentration de Ab par les anti-TNFα et est dépeinte comme une fonction logarithmique en ng/mL, alors qu’y représente la réponse de luminescence en unités arbitraires de luminescence. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Remarque : Dans la quatrième équation de paramètre, C est la concentration efficace 50 (CE50). Cette valeur sera utilisée pour comparer la substance de référence, échantillon analytique et échantillon de contrôle au moyen de la fonction effectrice. - Pour le calcul de la puissance relative de Difficulté la substance de référence à 100 % et de calculer les puissances de l’échantillon et de contrôle en conséquence.
Remarque : Ces valeurs sont représentées dans la Figure 3.
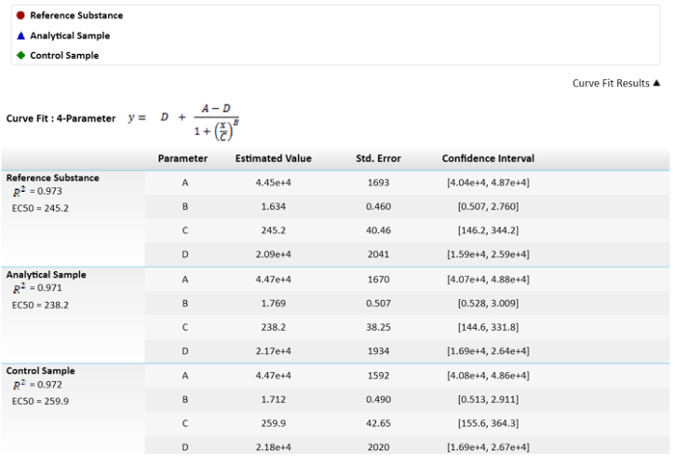
figure 3 : équation mathématique utilisée pour le calcul de leurs valeurs et la EC50s. Les valeurs de CE50 ou C paramètres, ont leur incertitude dépeint comme l’écart-type. Une comparaison des EC50s entre les résultats de référence et des échantillons de puissance relative est également représentée. L’intervalle de confiance est calculé avec un α = 0,05. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Résultats
Graphique de la relation dose-effet (avec contrôles)
La figure 1 représente la réponse de luminescence versus la concentration du mAb. Cette fonction sigmoïde exemplifie la caspase 3 et 7 rejets dans le milieu de culture de dosage en raison de la lyse cellulaire. La mort cellulaire est renforcée par la privation de sérum ainsi TNFα induction de signalisation. Par conséquent, la molécule anti-TNFα (mAb) interagit avec la cytokine...
Discussion
Cette caractérisation permet de déterminer a priori le comportement biologique d’une molécule en cours d’élaboration avant et coûteux essais cliniques sont menés. Il est également utile pour la libération de lot d’un médicament approuvé. Il est à noter que ces tests sont utiles pour déterminer si une molécule possède un effet biologique adéquat concernant son mécanisme d’action. La méthode bio-analytique présentée dans ce tutoriel est cruciale à la comparaison de molécules différent...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer
Remerciements
Ce travail a été soutenu par le Conseil National de la Science et technologie (CONACYT), le Mexique accorde le PEI CONACYT 2015 220333, sans participation à la conception de l’étude.
matériels
| Name | Company | Catalog Number | Comments |
| WEHI 164 | ATCC | CRL-1751 | Fibrosarcoma cells from Mus musculus |
| RPMI-1640 Medium | ATCC | 30-2001 | Store medium at 2 °C to 8 °C |
| RPMI 1640 Medium, no phenol red | GIBCO | 11835-030 | Store medium at 2 °C to 8 °C |
| Trypsin-EDTA(0.25%),phenol red | GIBCO | 25200-056 | Store medium at -10 °C to -20 °C |
| DPBS, no calcium, no magnesium | GIBCO | 14190-136 | Store medium at 2 °C to 8 °C |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | Store at -20 °C to -70 °C |
| Fetal Bovine Serum (U.S), Super Low IgG | HyClone | SH3089803 | Store at -10 °C to -20 °C |
| Fetal Bovine Serum (U.S.), Characterized | HyClone | SH3007103 | Store at -10 °C to -20 °C |
| Caspase-Glo 3/7 Assay kit | Promega | G8093 | Store the Caspase-Glo. 3/7 Substrate and Caspase-Glo. 3/7 Buffer at –20 ºC protected fromLight |
| EDTA, Disodium Salt, Dihydrate, Crystal, A.C.S. Reagent | J.T.Baker | 8993-01 | -- |
| Sample mAb Adalimumab | Probiomed | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Reference and Control mAb Adalimumab | Abbvie | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Microplate Reader | Molecular Devices | 89429-536 | SpectraMax M3 Multi-Mode |
| Microplate reader Software | Molecular Devices | -- | SoftMax Pro 6.3 GxP |
| Incubator | Revco | 30482 | Revco RNW3000TABB Forced-Air CO2 |
| Laminar Flow Hood | The Baker Company | 200256 | Baker SG603A-HE | High Efficiency, Class II Type A2 |
Références
- Elmore, S. Apoptosis: A Review of programmed cell death. Toxicol Patho. 35 (4), 495-516 (2007).
- Darwish, R. S. Regulatory mechanisms of apoptosis in regularly dividing cells. Cell Health Cytoskelet. 2 (1), 59-68 (2010).
- Tracey, D., et al. Tumor necrosis factor antagonist mechanism of action: A comprehensive review. Pharmacol Ther. 117 (2), 244-279 (2008).
- Körner, H., Sedgwick, J. Tumour necrosis factor and lymphotoxin: Molecular aspects and role in tissue-specific autoimmunity. Immunol Cell Biol. 74 (5), 465-472 (1996).
- Wong, M., et al. TNFa blockade in human diseases: Mechanisms and future directions. Clin Immunol. 126 (2), 121-136 (2008).
- Furst, D. E., Wallis, R., Broder, M., Beenhouwer, D. O. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Semin Arthritis Rheum. 36 (3), 159-167 (2006).
- Karvinen, J., et al. Homogeneous time-resolved fluorescence quenching assay (LANCE) for caspase-3. J Biomol Screen. 7 (3), 223-231 (2002).
- Ren, Y. G., et al. Differential regulation of the TRAIL death receptors DR4 and DR5 by the signal recognition particle. Mol Biol Cell. 15 (11), 5064-5074 (2004).
- Sud, D., Bigbee, C., Flynn, J. L., Kirschner, D. E. Contribution of CD8+ T cells to control of Mycobacterium tuberculosis infection. J Immunol. 176 (7), 4296-4314 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. Apendix 3, 3 (2001).
- Ramasubramanyan, N., et al. . Low acidic species compositions and methods for producing and using the same. 1, (2014).
- Masters, J. R., Stacey, G. N. Changing medium and passaging cell lines. Nat Protoc. 2 (9), 2276-2284 (2007).
- Eskandari, M. K., Nguyen, D. T., Kunkel, S. L., Remick, D. G. WEHI 164 subclone 13 assay for TNF: sensitivity, specificity, and reliability. Immunol Invest. 19 (1), 69-79 (1990).
- Hora, M. S., Rana, R. K., Smith, F. W. Lyophilized formulations of recombinant tumor necrosis factor. Pharm Res. 9 (1), 33-36 (1992).
- Ponnappan, S., Ponnappan, U. Aging and immune function: molecular mechanisms to interventions. Antiox Redox Signal. 14 (8), 1551-1585 (2011).
- Matsumaru, K., Ji, C., Kaplowitz, N. Mechanisms for sensitization to TNF-induced apoptosis by acute glutathione depletion in murine hepatocytes. Hepatology. 37 (6), 1425-1434 (2003).
- Camacho-Villegas, T., Mata-Gonzalez, T., Paniagua-Solis, J., Sanchez, E., Licea, A. Human TNF cytokine neutralization with a vNAR from Heterodontus francisci shark: a potential therapeutic use. mAbs. 5 (1), 80-85 (2013).
- Männel, D. N., Falk, W. Optimal induction of tumor necrosis factor production in human monocytes requires complete S-form lipopolysaccharide. Infect Immun. 57 (7), 1953-1958 (1989).
- Lis, K., Kuzawińska, O., Bałkowiec-Iskra, E. Tumor necrosis factor inhibitors-state of knowledge. Arch Med Sci. 10 (6), 1175-1185 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon