Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Le modèle WinCF - Un microcosme peu coûteux et abordable d'une menthe bronchée à mousqueton pour étudier la microbiologie des infections pulmonaires
Dans cet article
Résumé
Les voies respiratoires du mucus des patients atteints de fibrose kystique (CF) sont un environnement idéal pour que les agents pathogènes microbiens puissent prospérer. Le manuscrit décrit une nouvelle méthode pour étudier le microbiome des poumons des FC dans un environnement qui imite où ils causent des maladies et comment les altérations des conditions chimiques peuvent entraîner une dynamique microbienne.
Résumé
Beaucoup de maladies chroniques des voies respiratoires entraînent une bouchage de mucus des voies respiratoires. Les poumons d'un individu atteints de fibrose kystique sont un cas exemplaire où leurs bronchioles bouchées de mucus créent un habitat favorable pour la colonisation microbienne. Divers agents pathogènes se développent dans cet environnement en interaction entre eux et entraînent une grande partie des symptômes associés à la maladie des FC. Comme toute communauté microbienne, les conditions chimiques de leur habitat ont un impact significatif sur la structure et la dynamique de la communauté. Par exemple, différents microorganismes se développent dans différents niveaux d'oxygène ou d'autres concentrations de soluté. Ceci est également vrai dans le poumon des FC, où les concentrations d'oxygène sont censées conduire la physiologie et la structure de la communauté. Les méthodes décrites ici sont conçues pour imiter l'environnement pulmonaire et cultiver des agents pathogènes d'une manière plus similaire à celle d'où ils causent une maladie. La manipulation de l'environnement chimique de ces microbes est ensuite utilisée pour étudier comment le chemiDes infections pulmonaires régit son écologie microbienne. La méthode, appelée système WinCF, est basée sur des tubes artificiels à l'épi et des tubes capillaires étroits destinés à fournir un gradient d'oxygène similaire à celui qui existe dans les bronchioles bouchées de mucus. La manipulation des conditions chimiques, telles que le pH du média de la pression des crachats ou des antibiotiques, permet de visualiser les différences microbiologiques dans ces échantillons en utilisant des indicateurs colorés, en surveillant la production de gaz ou de biofilms, ou en extrayant et séquençant le contenu en acide nucléique de chaque échantillon.
Introduction
La méthode décrite dans ce manuscrit s'appelle le système WinCF 1 . L'objectif global de WinCF est de fournir une configuration expérimentale capable de simuler l'environnement d'une bronchole pulmonaire remplie de mucus. Cela permettra à un système traçable d'étudier les agents pathogènes microbiens des maladies pulmonaires avec un phénotype de l'hypersécrétion du mucus incluant la fibrose kystique (FC), la maladie pulmonaire obstructive chronique (MPOC), l'asthme et d'autres. La procédure a été conçue spécifiquement pour l'étude de la FC, qui se caractérise par des mutations qui font que les sécrétions pulmonaires deviennent épaisses et difficiles à nettoyer, finissant par remplir les bronchioles et d'autres petits passages avec le mucus 2 . De tels blocages dans les poumons inhibent l'échange de gaz parce que l'air inhalé n'est plus capable d'atteindre de nombreux alvéoles et fournit également un habitat pour la colonisation bactérienne 3 , 4 . L'incapacité à prévenir la croissance microbiennemucus pulmonaire excessive conduit finalement au développement d'infections chroniques complexes des voies respiratoires. Ces communautés contiennent une variété d'organismes, y compris les virus, les champignons et les bactéries comme Pseudomonas aeruginosa, toutes les composantes interagissent entre eux 5, 6, 7, 8. On croit que l'activité du microbiome pulmonaire des FC à participer à des poussées de symptômes appelés exacerbations pulmonaires 1, 9, 10, 11. WinCF permet d'étudier le comportement de la communauté microbienne autour de ces exacerbations et est maintenant étendu à agir en tant que système expérimental de base pour étudier l'écologie microbienne du poumon. Traditionnellement, les exacerbations ont été étudiés par l'analyse directe des échantillons prélevés dans les poumons. De nombreux facteurs de confusion rendent l'analyse directe de b microbienneehavior dans les poumons difficiles, avec le système WinCF, bon nombre de ces facteurs sont retirés et le comportement du microbiome pulmonaire peuvent être étudiés plus directement, ce qui permet une analyse plus fine de l'activité bactérienne dans un bronchioles branché mucus.
Le système WinCF fournit une méthode pour développer et analyser les bactéries d'une manière qui imite efficacement l'environnement pulmonaire. Les méthodes traditionnelles pour la culture des bactéries pulmonaires échantillons de culture souvent impliqués sur des plaques d'agar traditionnelles. Ces méthodes laissent les échantillons ouverts à l' oxygène atmosphérique, en négligeant de tenir compte du hypoxique et des conditions souvent anoxiques trouvées dans les bronchioles pulmonaires bouchés avec du mucus 12, 13. Agar sur la culture dans des conditions aérobies est rien comme l'environnement du poumon CF et peut induire en erreur les cliniciens et les chercheurs concernant le comportement des agents pathogènes qu'ils essaient de traiter. De plus, les éléments nutritifs aux bactéries sur des plaques de géloseSont différents de ceux disponibles dans l'expectoration réelle, qui est comptabilisé dans WinCF en utilisant des mousses artificielles (ASM). Comme le montrent les cultures de Pseudomonas dans Sriramulu et al. 14 , ASM comprend un ensemble spécifique de composants qui imite les ressources disponibles pour les microbes de crachats et réplique également la consistance physique des expectorations. Étant donné qu'un poumon malade possède un microbiome spécifique, l'étude de ces microorganismes devrait également se faire dans les conditions spécifiques du poumon.
Le système WinCF permet une analyse rapide et une manipulation facile des conditions expérimentales pour observer des changements microbiens semblables à la façon dont ils se produiraient dans une bronchole pulmonaire réelle. Cette technique permet l'inoculation d'une myriade de types d'échantillons apparentés, y compris les expectorations, la salive, les autres sécrétions corporelles et les cultures bactériennes pures ou mélangées. La nature de l'installation expérimentale permet une interprétation visuelle immédiate dele comportement de la communauté microbienne et est conçu pour permettre l'application en aval facile d'une multitude de procédés microbiologiques et omiques. De telles études sont importantes parce que les changements de composition de la communauté bactérienne sur la base des conditions physico-chimiques de leur environnement. Avec WinCF les conditions chimiques des médias peuvent être manipulés pour analyser les effets sur l'activité bactérienne. Par exemple, peut être modifié l'acidité des médias avant l'inoculation d'un échantillon. Après incubation, l'activité bactérienne dans chacune de ces conditions peut être comparé directement et conclusions peuvent être tirées sur la façon dont les bactéries dans les échantillons de crachats se comportent en réponse à un pH variable. Ici, nous présentons les modalités d'application du système WinCF et des exemples de la façon dont la chimie des médias peut être manipulé pour étudier les effets sur le microbiome pulmonaire.
Protocole
1. Préparation des stocks pour l'expectoration artificielle médias
- Créer une solution de 5% de mucine. Ajouter 1,0 g d'estomac de porc déshydraté mucine à 20 ml d'eau déminéralisée. Autoclaver la solution résultante.
REMARQUE: La stérilisation mucine détruira sa structure inhérente; d'autres méthodes pour stériliser les mucine sous sa forme sèche comprennent la stérilisation UV et irradiation. Ces méthodes ne sont pas largement utilisées pour le système WinCF cependant. - Ajouter 2,2 g de KCI à 50 ml d'eau déminéralisée et permettre la dissolution. Ajouter 5,0 g de NaCl à 50 ml d'eau déminéralisée et permettre la dissolution. Ces deux solutions autoclaver.
- Ajouter 100 mg d'ADN de sperme de saumon à 10 ml d'eau déminéralisée stérile. Chauffer cette solution à environ 85 ° C dans un bain d'eau pendant quelques heures pour assurer la dissolution.
- Ajouter 5,0 mg de ferritine à 5,0 ml d'eau déminéralisée stérile.
2. Préparation de l'expectoration artificielle moyen
- Combinerles composants suivants: 16 ml de mucine solution mère, 2,0 mL de solution mère de KCl, 2,0 ml de solution mère de NaCl, 200 pl de l'émulsion de jaune d'oeuf, 5,6 ml d'ADN de la solution mère, 120 uL de solution mère ferritine, 5,78 ml d'essentiel solution d'acides aminés, 5,78 ml d'une solution d'acides aminés non essentiels, et 2,44 mL d'eau stérile.
- Si de petites quantités de sédiments apparaissent, mélanger délicatement.
- Pipeter 5,0 ml de milieu dans huit tubes de centrifugation stériles de 15 mL.
REMARQUE: peut être manipulé comme on le souhaite, les conditions chimiques de chaque tube. Par exemple, des solutions tampons et des indicateurs de pH peuvent être ajoutés à chaque tube dans le but de comparer le comportement microbien à des niveaux de pH distincts. Une démonstration de ceci est montré dans la section des résultats représentatifs avec 8 niveaux de pH différents, de 5,0 à 8,5 en incréments de 0,5 de pH.
- Une fois que les conditions chimiques des médias sont manipulés avec succès, gel pour une utilisation ultérieure. Les médias demeurera stable FROZen à -20 ° C pendant plusieurs mois. Vortex lors de la décongélation.
3. Préparation d'une course de contrôle des tubes capillaires
- Dans une bio-vie stérile, remplissez huit tubes microcentrifuges stériles avec 250 μL de milieu chacun.
- Acquérir huit tubes stériles de centrifugation 15 mL, chaque tube correspondant à un tube de microcentrifugeuse mentionné à l'étape 3.1.
- Stériliser une serviette en papier avec une solution d'éthanol à 70% et laisser sécher. Une fois sec, déchirez la serviette en morceaux d'environ quatre pouces carrés chacun, et froisser chaque pièce dans le fond d'un tube de centrifugation de 15 mL. Pour des tubes supplémentaires, vaporiser et sécher des serviettes en papier supplémentaires au besoin.
- Avec un morceau de papier au bas de chaque tube de centrifugation, humectez légèrement chaque groupe de papier avec environ 1,0 ml d'eau stérile pour créer un environnement humide.
- Obtenez trois tubes capillaires en verre pour chaque tube de microcentrifugeuse préparé à l'étape 3.1 et un bloc de mastic de tube capillaire sealaNT.
- Pour chaque tube de microcentrifugeuse, remplissez trois tubes capillaires avec un support à environ 5 mm du marqueur bleu près du haut du tube.
- Remplissez en tenant une extrémité du tube dans le tube de microcentrifugeuse et basculant vers l'orientation horizontale, ce qui permet une action capillaire pour guider le milieu dans le tube (voir la figure 1 ).
- Arrêtez le remplissage en plaçant doucement un doigt ganté sur l'extrémité ouverte du tube, puis scellez l'autre extrémité du tube en le pressant vers le bas dans le bloc d'étanchéité.

Figure 1: Exemple de dégradé du pH, remplissage du tube capillaire avec un mélange de sputum artificiel. Le milieu est ajouté en insérant une extrémité du tube dans le liquide et en basculant pour faciliter l'action capillaire. La coloration moyenne dans cet exemple est due à l'ajout d'un indicateur de pH pour aider le démonStrate des changements potentiels d'acidité après incubation. Cliquez ici pour voir une version plus grande de ce chiffre.
- Placez chaque ensemble de trois tubes capillaires dans des tubes de centrifugation de 15 mL remplis de papier absorbant complètement avec de l'eau stérile, avec un joint étanche au mastic vers le bas. Capter le tube et l'étiquette. Ces trois tubes capillaires sont destinés à la replication de chaque condition de contrôle.
- Lorsque tous les tubes de centrifugation de 15 ml sont remplis avec leurs tubes capillaires désignés, placez les tubes dans un support. Placez la crémaillère pour que les tubes soient incubés horizontalement (pour attraper les bulles de gaz) (voir la figure 2 ). Incuber les tubes capillaires à l'intérieur des tubes de centrifugation (contenant les agglomérats humidifiés) à 37 ° C pendant 48 h.
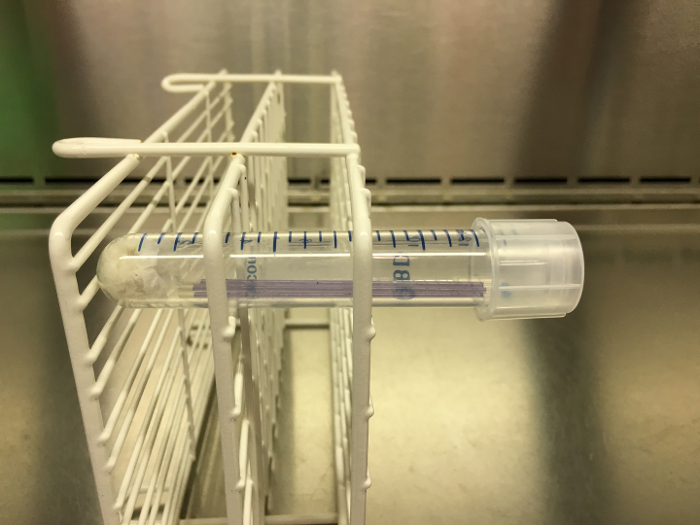
Figure 2: Exemple de gradient de pH, tubes capillaires prêts à être incubés. Une fois que trois tubes capillaires ont été remplis et scellés, ils sont placés dans un tube centrifuge avec une serviette en papier humide en bas. Ce tube est ensuite plafonné et mis dans un rack. La crémaillère doit être orientée latéralement pendant l'incubation, telle que représentée ici, de sorte que la production de gaz puisse être observée une fois l'incubation terminée. Cliquez ici pour voir une version plus grande de ce chiffre.
4. Imagerie des tubes capillaires de contrôle après incubation
- Retirez la crémaillère des tubes centrifuges de l'incubateur, en vous assurant de garder les tubes à l'horizontale. Faites glisser avec précaution les tubes capillaires hors des tubes centrifuges, en gardant chaque ensemble séparé des autres ensembles.
- Disposez les tubes capillaires l'un à côté de l'autre sur une boîte à lumière, tous alignés afin que le contenu des tubes soit visIble et éclairé. Laissez un espace tous les trois tubes pour séparer différentes conditions chimiques.
- Avec les tubes alignés et la boîte lumineuse allumée, photographiez directement depuis. (Voir la figure 3 )

Figure 3: Exemple de gradient de pH, contrôle, pré-incubation, absence de Sputum. Méthode de crachat artificiel après avoir été ajoutée à des tubes capillaires dans des ensembles de trois, augmentant de pH de gauche à droite. La combinaison d'indicateurs ajoutés au milieu entraîne l'apparition de plus de tubes acides, tandis que les tubes moins acides deviennent plus violet. Les tubes sont disposés horizontalement et sont éclairés par le bas, photographiés par le haut. Cliquez ici pour voir une version plus grande de ce chiffre.
- Éliminer leles matériaux de contrôle de déchets biologiques.
5. inoculer le Tubes Capillaire WinCF avec un échantillon d'expectoration
- Dans un biohood stérile, remplir huit tubes de microcentrifugation stériles avec 225 pl de chaque support.
- Homogénéiser l'échantillon de crachat par le retrait et l'éjection de l'expectoration à plusieurs reprises avec une seringue de 3 ml (une seringue en plastique sans l'aiguille). Pour ce faire, jusqu'à ce que le crachat est de consistance lisse.
- Ajouter 25 pl de crachat homogénéisé à chaque tube de microcentrifugation (1/10 de dilution dans ASM médias) préparé à l'étape 5.1. Ensuite, les tubes vortex pendant 30 s pour mélanger suffisamment.
- Ajouter le support à tubes capillaires selon la même procédure que les étapes 3.2 à 3.5.
6. L'imagerie de l'échantillon Capillary Tubes après incubation
- Après le temps d'incubation de 48 h, retirer l'image et les tubes capillaires suivant la même procédure que les étapes 4.1 à 4.3.
- Si des bulles sont présentes dans les tubes, faireBien sûr, les photographies prises représentent clairement la délimitation entre les bulles et les milieux dans les tubes. Si le biofilm est présent, assurez-vous que les photographies peuvent clairement représenter sa présence ainsi.
7. Suppression des supports pour les applications en aval
- Pour faciliter l'analyse en aval, retirez le support des tubes capillaires après l'imagerie. Les applications potentielles comprennent la culture et le séquençage ADN / ARN et le profil métabolomique.
Attention: Les tubes capillaires en verre remplis de pathogènes sont un danger biologique important, ces étapes doivent donc être faites avec beaucoup d'attention avec des équipements spécifiques. Si les tubes capillaires se cassent, jetez le contenant approprié. - Utilisez des aiguilles à extrémités émoussées de calibre 25 et 0,5 pouce de longueur pour enlever le support. Insérez l'aiguille à extrémités émoussées dans l'extrémité bouchée du tube pour briser le joint.
- Après avoir cassé le joint d'étanchéité, tournez le tube capillaire à l'envers et le support tombera de la partie supérieure. jeSi les médias ne s'égouttent pas facilement, utilisez une pipette avec une pointe de 200 μL et expulsez le support du tube en appuyant sur le piston de la pipette lorsqu'il est inséré dans l'extrémité du tube capillaire. Recueillir le milieu du tube expulsé dans un récipient approprié (tube de centrifugation de 1,5 ml).
REMARQUE: pour les analyses transcriptomiques ou d'autres ARN, les médias peuvent être expulsés directement dans des tampons de stabilisation d'ARN.
8. Le système WinFF FLUD
REMARQUE: Le système WinFF Fluid Load Utility Device (FLUD) est une suite optionnelle de périphériques complémentaires conçus pour optimiser le débit du système WinCF. Le système WinCF FLUD comprend principalement des matériaux imprimables en 3D. La fabrication imprimée 3D permet un remplacement rapide et facile des matériaux pour assurer un temps d'arrêt minimal pour les chercheurs ainsi que des exigences de fabrication minimales. Les dessins, les fichiers stl, les instructions d'impression 3D et le manuel WinCF FLUD sont disponibles dans le souplé en ligneNT.
- Préparation des supports pour le chargement du tube capillaire
- Dans une bioité stérile, remplissez huit tubes stériles de microcentrifugeuse de 2 mL avec 900 μL de milieu chacun.
- Homogénéiser tous les échantillons de crachats en retirant et en éjectant plusieurs fois l'éprouvette avec une seringue de 3 mL (une seringue plastique sans aiguille). Faites ceci jusqu'à ce que l'expectoration soit de consistance lisse.
- Ajouter 100 μl d'expectoration homogénéisée à chaque tube de microcentrifugeuse (dilution 1/10 dans le milieu) préparé à l'étape 8.1.1. Ensuite, tourbillonner les tubes pendant 30 s pour mélanger suffisamment.
- Branchez les tubes de microcentrifugeuse remplis et ouverts dans le support du tube rotatif orientés de sorte que les tubes soient verticaux.
- Placement de tubes capillaires
- Récupérer trois tubes capillaires pour chaque tube de microcentrifugeuse à l'étape 8.1.
- Branchez trois tubes dans le berceau en caoutchouc afin qu'ils soient alignés avec les tubes à microcentrifuges à l'autre extrémité de l'appareil.Assurez-vous que les extrémités marquées des tubes sont éloignées des tubes de microcentrifugeuse. Monter les trois trous sur le fond du berceau correctement sur les trois goujons sur le support du berceau.
- Avec les tubes capillaires placés reposant dans leurs canaux de guidage sur l'appareil, placez le tampon en caoutchouc sur leurs sections de sécurité de manière sécurisée pour éviter tout déplacement. (Voir la figure 4 )

Figure 4: Le système FLUD entièrement chargé avec des tubes capillaires sécurisés par le caoutchouc en caoutchouc au dessus de leurs socles. Cliquez ici pour voir une version plus grande de ce chiffre.
- Chargement des médias dans les tubes capillaires
- Utilisez avec soin une main pour saisir la fin de l'appareil où les tubes capillaires sontADED, et utiliser l'autre main pour tenir la crémaillère des rotateurs dans lequel les tubes de microcentrifugeuse sont chargés.
- Délicatement tourner la crémaillère de microcentrifugation de sorte que les tubes de microcentrifugeuse sont à peu près horizontal et procéder à pousser lentement la crémaillère vers les tubes capillaires. (Voir la figure 5)
- Lorsque les extrémités des tubes capillaires en contact avec les médias dans les microtubes, assurez-vous que l'action capillaire commence immédiatement le remplissage des tubes capillaires. Pour régler le taux de remplissage et le niveau de remplissage, tourner doucement l'appareil dans son ensemble. Tout en faisant cela, faites attention à ne pas renverser les médias sur des microtubes. (Voir la figure 6)
- Lorsque les tubes capillaires sont remplis à des niveaux souhaités, placer le niveau de l'appareil sur une surface et soigneusement encore rapidement tirer la grille des tubes de microcentrifugation les extrémités des tubes capillaires pour faire cesser le remplissage. Les microtubes peuvent maintenant être rétractés tout le chemin du retour à la position verticale et fermée.
- Sceller les extrémités en saillie des tubes capillaires en appuyant sur un bloc d'étanchéité sur chaque ensemble triplé, en scellant un ensemble à la fois jusqu'à ce que tous les ensembles soient scellés. Pour réduire le risque de contamination, appuyez sur une partie différente du bloc d'étanchéité sur chaque ensemble triplé (voir Figure 7 ).

Figure 5: Le système FLUD avec des tubes moyens déployés dans une orientation horizontale, prêt à prendre contact avec des tubes capillaires. Cliquez ici pour voir une version plus grande de ce chiffre.
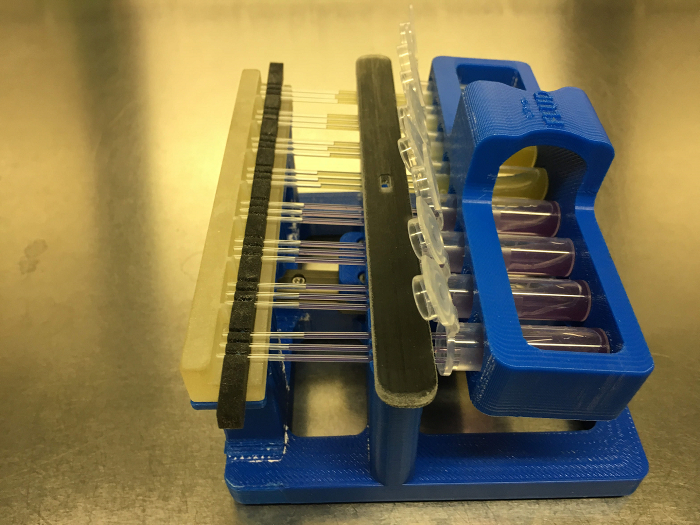
Figure 6: Le système FLUD avec les tubes capillaires Chargement avec les médias via l' action capillaire. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 7: étanchéité des tubes capillaires remplis sur le système FLUD Un ensemble triplé à la fois à l'aide d'un bloc scellant. Ce bloc d'étanchéité avait du plastique le long des bords qui a été coupé afin d'éviter tout contact avec les ensembles de tri triés voisins pendant l'étanchéité. Cliquez ici pour voir une version plus grande de ce chiffre.
- Incubation
- Retirez le tampon en caoutchouc sur les socles du tube et soulevez le berceau en caoutchouc de l'appareil principal. Cela devrait prendre tous les tubes capillaires avec elle. Réglez maintenant le berceau et les tubes sur le support d'image. Ce raCk a trois talons qui s'insèrent dans le berceau, ainsi que de petits canaux de guidage pour mettre les tubes en place.
- Réglez la grille d'imagerie dans son ensemble dans la boîte d'incubation en plastique transparent. Faire tremper de petites quantités de serviettes en papier stérile dans de l'eau stérile et placer le long des deux côtés plus courts de la boîte pour assurer l'humidité pendant l'incubation. (Voir la figure 8 )
- Fermez complètement la boîte et placez-la dans un incubateur de 37 ° C, en vous assurant de garder les tubes horizontaux. Incuber pendant 48 h.
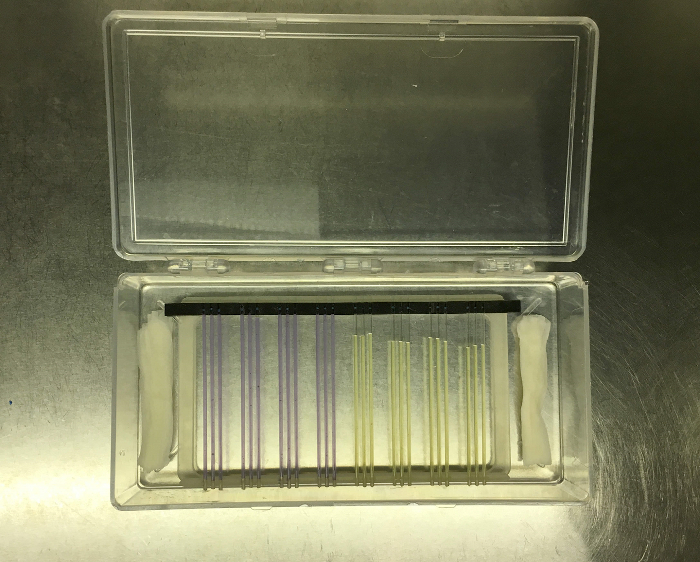
Figure 8: Tubes capillaires en berceau en caoutchouc transférés du système FLUD à un rack d'imagerie, qui a été placé dans une boîte d'incubation claire à côté des serviettes en papier humide pour fournir de l'humidité. Cliquez ici pour voir une plus grande version deEst une figure.
- Imagerie et extraction
- Retirez la grille d'imagerie qui retient les tubes de la boîte d'incubation et mettez-la sur une boîte à lumière, éclairée par le bas. Avec les tubes déjà dans la grille d'imagerie, les ensembles triplicés seront correctement espacés et prêts à l'image immédiatement.
- Concentrez la caméra sur les tubes de sorte que tous soient visibles dans le champ de vision et que la lumière provenant de la boîte lumineuse offre un contraste et une visualisation suffisants de la couleur dans les colorants du tube. Photo de directement ci-dessus.
- Pour extraire le contenu des tubes, retirer les tubes capillaires du berceau en caoutchouc d'un ensemble de triplicats à la fois. Soulevez doucement les tubes et sortez du berceau ou glissez-les.
- Pour chaque ensemble de triplés, suivre la procédure d'extraction détaillée aux étapes 7.1 à 7.3.
Résultats
la croissance microbiologique dans les différentes conditions chimiques induites dans les échantillons variait considérablement dans certains cas, et plus subtilement dans d'autres. De nombreux changements dans l'activité étaient de nature visuelle, étant évident que dès que la période d'incubation est terminée. Dans l'exemple de la manipulation du pH, les échantillons à travers le spectre de pH varient considérablement, comme indiqué par des facteurs multip...
Discussion
Le maquillage microbiologique d'un poumon avec CF contient une grande variété d'organismes, mais les conditions dans le poumon ont vraisemblablement une influence importante sur les types de microbes qui peuvent survivre et prospérer 13 , 15 . Les mécanismes spécifiques par lesquels ces conditions changent et les effets exacts qu'elles ont sur le microbiome pulmonaire sont généralement peu clairs actuellement. Dans cette méthode expérimental...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs souhaitent remercier Vertex Pharmaceuticals et le Cystic Fibrosis Research Innovation Award pour le financement de R. Quinn et du NIH / NIAID pour le financement de la subvention 1 U01 AI124316-01, une approche de la biologie des systèmes pour le traitement des agents pathogènes résistant aux multiples médicaments. Nous tenons également à remercier le Département de l'ingénierie mécanique et aérospatiale du cours de conception senior de génie mécanique de premier cycle de l'UCSD pour faciliter la collaboration avec les aspects techniques de ce travail.
matériels
| Name | Company | Catalog Number | Comments |
| Color-Coded Capillary Tubes | Fisher Scientific | 22-260943 | |
| Cha-seal Tube Sealing Compound | Kimble-Chase | 43510 | |
| Mucin from porcine stomach | Sigma | M1778 | |
| Ferritin, cationized from horse spleen | Sigma | F7879 | |
| Salmon sperm DNA Sodium salt (sonified) | AppliChem Panreac | A2159 | |
| MEM Nonessential Amino Acids | Corning cellgro | 25-025-CI | |
| MEM Amino Acids | Cellgro | 25-030-CI | |
| Egg Yolk Emulsion, 50% | Dalynn Biologicals | VE30-100 | |
| Potassium Chloride | Fisher Scientific | P2157500 | |
| Sodium Chloride | Fisher Scientific | S271500 | |
| 15 mL centriguge tubes with Printed Graduations and Flat Caps | VWR | 89039-666 | |
| 50 mL centrifuge tubes with Printed Graduations and Flat Caps | VWR | 89039-656 | |
| 1.5 mL microcentrifuge tubes | Corning | MCT-150-R | |
| 2.0 mL microcentrifuge tubes | Corning | MCT-200-C |
Références
- Quinn, R. A., et al. A Winogradsky-based culture system shows an association between microbial fermentation and cystic fibrosis exacerbation. ISME J . 9, 1024-1038 (2015).
- Quinton, P. M. Cystic fibrosis: impaired bicarbonate secretion and mucoviscidosis. Lancet. 372 (9636), 415-417 (2008).
- Harrison, F. Microbial ecology of the cystic fibrosis lung. Microbiology. 153 (Pt 4), 917-923 (2007).
- Caverly, L. J., Zhao, J., LiPuma, J. J. Cystic fibrosis lung microbiome: Opportunities to reconsider management of airway infection. Pediatr pulmonol. 50, S31-S38 (2015).
- Blainey, P. C., Milla, C. E., Cornfield, D. N., Quake, S. R. Quantitative analysis of the human airway microbial ecology reveals a pervasive signature for cystic fibrosis. Sci Transl Med. 4 (153), 153ra130 (2012).
- Willner, D., et al. Spatial distribution of microbial communities in the cystic fibrosis lung. ISME J. 6 (2), 471-474 (2012).
- Delhaes, L., et al. The airway microbiota in cystic fibrosis: a complex fungal and bacterial community--implications for therapeutic management. PloS one. 7 (4), e36313 (2012).
- Rogers, G. B., et al. D. Bacterial diversity in cases of lung infection in cystic fibrosis patients: 16S ribosomal DNA (rDNA) length heterogeneity PCR and 16S rDNA terminal restriction fragment length polymorphism profiling. J clin microbiol. 41 (8), 3548-3558 (2003).
- Stenbit, A. E., Flume, P. A. Pulmonary exacerbations in cystic fibrosis. Curr Opin Pulm Med. 17 (6), 442-447 (2011).
- Twomey, K. B., et al. Microbiota and metabolite profiling reveal specific alterations in bacterial community structure and environment in the cystic fibrosis airway during exacerbation. PloS one. 8 (12), e82432 (2013).
- Carmody, L. A., et al. Changes in cystic fibrosis airway microbiota at pulmonary exacerbation. Ann. Am. Thorac. Soc. 10 (3), 179-187 (2013).
- Worlitzsch, D., et al. Effects of reduced mucus oxygen concentration in airway Pseudomonas infections of cystic fibrosis patients. J. Clin. Invest. 109 (3), 317-325 (2002).
- Cowley, E. S., Kopf, S. H., LaRiviere, A., Ziebis, W., Newman, D. K. Pediatric Cystic Fibrosis Sputum Can Be Chemically Dynamic, Anoxic, and Extremely Reduced Due to Hydrogen Sulfide Formation. mBio. 6 (4), e00767-e00715 (2015).
- Sriramulu, D. D., Lünsdorf, H., Lam, J. S., Römling, U. Microcolony formation: a novel biofilm model of Pseudomonas aeruginosa for the cystic fibrosis lung. J. Med. Microbiol. 54 (Pt 7), 667-676 (2005).
- Quinn, R. A., et al. Biogeochemical forces shape the composition and physiology of polymicrobial communities in the cystic fibrosis lung. mBio. 5 (2), (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon