Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un
Dans cet article
Résumé
Nous décrivons ici une méthode de dialyse à l'équilibre rapide (RED) pour mesurer la liaison du médicament à la caséine à partir de lésions et cavités de la tuberculose pulmonaire. Le protocole est également utilisé avec une matrice dérivée de macrophages en mousse qui est un substitut efficace à la casée.
Résumé
L'éradication de la maladie de la tuberculose nécessite des schémas thérapeutiques qui peuvent pénétrer dans les couches multiples de lésions pulmonaires complexes. La distribution des médicaments dans les noyaux caséeuses des cavités et des lésions est particulièrement crucial car ils abritent des bactéries sous-populations tolérantes médicaments communément appelés persisters. Les procédés existants pour la mesure de la pénétration du médicament dans les lésions de la tuberculose comportent in vivo coûteuses et longues études pharmacocinétiques couplés à des techniques de bioanalyse ou d' imagerie. A été proposé La mesure in vitro du médicament se liant à des macromolécules caseum comme une alternative à ces techniques étant donné que cette liaison entrave la diffusion passive de molécules de médicament à travers caseum. dialyse d'équilibre rapide est un système rapide et fiable pour effectuer des protéines plasmatiques et des études de liaison de tissus. Dans ce protocole, nous avons utilisé un dispositif de dialyse d'équilibre rapide (RED) pour mesurer la liaison à la drogue broyats de caseum qui est EXCISDes lésions et des caries des lapins infectés par la tuberculose. Le protocole décrit également comment générer une matrice de substitution à partir de macrophages THP-1 chargés de lipides à utiliser à la place du caséum. Cet essai de liaison caseum / substitution est un outil important dans la découverte de médicaments contre la tuberculose et peut être adapté pour aider à étudier la distribution de médicaments dans des lésions ou des abcès causés par d'autres maladies.
Introduction
Le traitement de la maladie de la tuberculose pulmonaire exige une distribution efficace des médicaments dans différents types de lésions. des lésions nécrotiques et les cavités contiennent des centres caséeux qui abritent des sous-populations de bactéries tolérantes à la drogue ou « persistant ». 1, 2 La maladie cavitaire est associée à des taux de guérison inférieurs et un mauvais pronostic. 3, 4 études antérieures ont montré, en utilisant des techniques quantitatives et d' imagerie, que la capacité de pénétrer caseum varie considérablement d'une classe de médicaments à l' autre. 5, 6 Ces méthodes nécessitent cependant l'utilisation de modèles d'infection des animaux qui sont lents et fastidieux. Un dosage in vitro qui mesure la liaison au médicament ex vivo caseum a été conçu. Cette liaison a été trouvé en corrélation inverse avec la pénétration des médicaments dans les granulomes caséeux et, par conséquent, estutilisé comme un outil de prédiction. 7
dialyse d'équilibre est considéré comme l'approche standard de l'or à des études de liaison aux protéines plasmatiques. Le dispositif de dialyse d'équilibre rapide (RED) offre un moyen rapide, facile à utiliser et système fiable pour effectuer ces tests. 8 Le dispositif est constitué de deux composants: à usage unique, jetable , comprenant des inserts 2 chambres séparées par un cylindre vertical de la membrane semi-perméable; et les plaques de base réutilisable qui peut contenir jusqu'à 48 inserts à la fois. La membrane de dialyse a un qui est idéal pour des études de liaison à la drogue macromolécule de coupure 8 kDa de poids moléculaire (MWCO). Le rapport des volumes zone superficielle élevée du compartiment de membrane permet une dialyse rapide et équilibration. Les deux inserts et la plaque de base ont été validés pour une liaison non spécifique minimale. La combinaison du dispositif RED avec des techniques bioanalytiques fournit des estimations précises des fractions non liées de médicaments en pLasma. 8, 9
Bien que conçu à l'origine pour mesurer liaison aux protéines plasmatiques, le dispositif RED a été utilisé dans plusieurs études de liaison de tissus en utilisant broyats. 10, 11 Dans ce protocole, on mesure la drogue se liant à caseum, les débris nécrotiques excisée des lésions nécrotiques et des cavités de lapins infectés par la tuberculose. Le acellulaire et la nature non-vasculaire caséeuse le rend facile à homogénéise en une suspension homogène qui est compatible avec le dosage.
Étant donné que caseum est fastidieux à produire et difficiles à trouver, le protocole a été validé pour une utilisation avec une matrice de substitution qui est préparé à partir de macrophages spumeux. macrophages dérivés de monocytes THP-1 sont induits par l'acide oléique pour accumuler plusieurs corps lipidiques qui leur donnent leur aspect « mousseuse ». Ces cellules chargées de lipides sont récoltées etTraité pour produire une matrice que nous utilisons comme substitut au caséum. Cette étude a montré que la liaison du médicament à cette matrice de substitution est bien corrélée à la liaison avec le caséum, imitant efficacement le processus in vivo qui entrave la pénétration du médicament dans le noyau caséo de granulomes et de cavités.
Protocole
Toutes les études sur les animaux ont été effectuées conformément au Guide pour la prise en charge et l'utilisation des animaux de laboratoire des Instituts nationaux de santé avec l'approbation du Comité de soins et de soins pour animaux institutionnels du NIAID (NIH), Bethesda, MD. Toutes les études impliquant M. tuberculosis ont été effectuées dans un laboratoire avec un niveau de confinement de biosécurité 3 (BSL-3).
1. Modèle d'infection de lapin et collection Caseum
- Infecte les lapins blancs de Nouvelle-Zélande avec M. tuberculosis en utilisant un système d'exposition aux aérosols sans nez comme décrit précédemment. 12 , 13 Permettre à l'infection de progresser pendant 12 à 16 semaines. Saisissez les lapins avec 35 mg / kg de kétamine et 5 mg / kg de xylazine par voie intramusculaire, euthanasiez les lapins avec 0,22 ml / kg de pentobarbital de sodium et de phénytoïne sodique par voie intraveineuse et poursuivez les nécropsies.
- À l'aide de pincettes et d'un scalpel, retirez les poumons du coffre caVité. De chaque lobe pulmonaire, disséquer les cavités individuelles et les grands granulomes nécrotiques à l'aide d'un scalpel. Rassurer soigneusement le caséum des parois de la cavité et du granulome. Peser, enregistrer et stocker les échantillons dans des tubes à vis de 2 mL à -20 ° C jusqu'à ce qu'ils soient prêts à l'emploi.
- Rayons gamma des échantillons infectieux de caséum à 3 MegaRad sur de la glace carbonique pour les rendre inutilisables et sans danger pour l'utilisation dans un laboratoire BSL-2.
2. Génération in vitro de la substitution de casée à partir de cellules THP-1
- Cultiver des monocytes THP-1 dans du milieu RPMI 1640 (L-glutamine 2 mM et 10% de sérum bovin fœtal) dans des flacons de culture cellulaire T175 (80 ml / flacon). Incuber les flacons dans une atmosphère de CO2 à 5% à 37 ° C pendant 3 à 4 jours.
- Centrifuger la culture d'un flacon T175 dans deux tubes coniques de 50 ml à 150 xg pendant 5 min. Jeter le surnageant et suspendre la pastille dans 10 mL de média RPMI 1640.
- Pipetter 5 μL de cette culture dans un tube de 1,5 mL contenant 45 μL de tRypan bleu. Bien mélanger en pipettant. Transférer 10 μL à un hémocytomètre et compter le nombre de monocytes THP-1 viables (non colorés) à l'aide d'un microscope optique (grossissement 10X). Calculer le nombre de cellules viables par ml de la culture. Diluez-le avec du milieu RPMI jusqu'à la densité finale de 1,25 x 10 6 cellules / mL.
- Chargez 40 mL de la culture sur une grande plaque de culture cellulaire (50 x 10 6 cellules / plaque). Ajouter 40 μL de PMA 100 μM (acétate de 12-myristate-13 de phorbol préparé dans l'éthanol) et permettre aux cellules d'adhérer pendant la nuit dans l'incubateur.
NOTE: La concentration finale de PMA est de 100 nM. - Diluer l'acide oléique pur (OA) (0,89 g / mL) dans de l'éthanol à la concentration de 0,1 M ( c'est-à-dire 31,7 μL d'OA dans 968,3 μl d'éthanol). Diluer cette solution dans des milieux RMPI préchauffés frais à une concentration de 10 mM. Diluer cette suspension OA à 0,4 mM (concentration finale de travail) en milieu RPMI préchauffé à 37 ° C.
- Supprimez les médias existants et non-adhered cellules provenant des plaques de culture de cellules et ajouter doucement 40 ml de 0,4 mM OA pour les macrophages THP-1 (THP-M). Incuber à 37 ° C dans l'incubateur pendant une nuit.
- Utilisez un microscope optique à un grossissement de 40x pour confirmer visuellement la présence de nombreuses inclusions de corps lipidiques dans chaque THP-M. Retirer tout le milieu RPMI à partir des plaques de culture de cellules et laver délicatement les cellules adhérentes deux fois avec une solution saline tamponnée au phosphate (PBS) en utilisant une pipette sérologique de 50 ml.
REMARQUE: les corps Lipid apparaissent sous la forme de petites structures claires, sphériques dans le cytoplasme de la THP-M. - Ajouter 40 ml de 5 mM d'acide éthylènediaminetétraacétique (EDTA) dans du PBS à chaque plaque. Incuber pendant 15 min à 37 ° C.
- Détacher les macrophages spumeux (FM) en pipetant à plusieurs reprises de haut en bas sur la surface de toute la plaque en utilisant une pipette sérologique de 10 ml. Transférer la suspension cellulaire à un tube conique de 50 ml et centrifuger à 150 g pendant 5 min.
- Remettre en suspension le culot cellulaire dans 10 ml de PBS (troisième lavage PBS) unEt transfert à un tube conique pré-pesé de 15 ml. Retournez à 150 xg pendant 5 min. Aspirer soigneusement le surnageant à l'aide d'une pipette sérologique et jeter.
- Suivez les pastilles de FM à 3 cycles de congélation-décongélation pour lyser les cellules et les incuber à 75 ° C pendant 20-30 minutes pour dénaturer les protéines dans la matrice. Conservez les granulés à -20 ° C jusqu'à ce qu'ils soient prêts à l'emploi.
3. Essai de dialyse à équilibrage rapide (ROUGE)
- Préparer des solutions stock 10 mM de tous les composés d'essai dans le diméthylsulfoxyde (DMSO). Diluer à 500 μM de solutions de travail dans le DMSO avant chaque dosage.
- Pesez le tube contenant la pastille de substitution Caseum. Soustraire le poids du tube vide pour obtenir le poids de la pastille seule. Ajouter 2-3 grains de métal par tube et, en utilisant un homogénéisateur de tissu à 1200 coups / min pendant 1 min, perturber le caséum ou la matrice de substitution dans le PBS (1: 9 w / v) pour obtenir une suspension 10x diluée de chaque matrice.
- Spike 6,5 μL des 500uM solution du composé d'essai dans 643,5 ul de l'homogénat pour obtenir la concentration finale de 5 uM (≤1% de DMSO) et vortex.
- Placez les inserts rouges dans la plaque de base. Ajouter 200 ul de la matrice de médicament-dopés dans la chambre de donneur (anneau rouge) de chaque insert RED et 350 ul de PBS dans chaque chambre de récepteur. Préparer 3 inserts pour chaque composé d'essai (échantillons en triple). plaque d'étanchéité avec un joint d'étanchéité de plaque adhésif et incuber à 37 ° C sur le Thermomixer à 200 tours par minute (1 xg) pendant 4 h.
- Après l'incubation, mélanger doucement le contenu des chambres de donneur et receveur par pipetage vers le haut et vers le bas 2-3 fois. Pipeter 20 uL à des aliquotes d'homogénat à partir des chambres de donneur et ajouter à 20 pl de PBS pur dans un tube de 1,5 ml (1: 1). De même, à partir des chambres de réception et ajouter à 20 pl d'homogénat propre (adaptation de la matrice) sur la pipette des aliquotes de 20 pi d'échantillons de PBS. 8
REMARQUE: la matrice de correspondance élimine le neced 2 courbes d'étalonnage séparées (dans l'homogénat et PBS) à effectuer une analyse quantitative. Contenu de la chambre de donneur peuvent sédimenter au cours du temps. Mélanger délicatement le contenu par pipetage avant de retirer aliquotes.
4. LC-MS Quantification et analyse des données
- Ajouter 160 ul de 1: 1 methanol: acétonitrile contenant 500 ng / mL de diclofénac ou 10 ng / mL verapamil (étalon interne) à chaque tube et vortexer pour précipiter les protéines. Centrifuger à 10 000 xg pendant 5 minutes pour sédimenter le précipité et on surnageants transfert en plaques de 96 puits à puits profonds pour l'analyse de Chromatographie spectrométrie de masse liquide (LCMS). 7
- Construire des courbes d'étalonnage à partir de 1-1,000 nM pour chaque composé d'essai tout en maintenant la même composition de matrice que les échantillons ci-dessus. Quantifier la concentration du composé d'essai dans les échantillons provenant des chambres de donneur et receveur au moyen d'un procédé LC-MS.
- Calculer la fraction non liée (f u) oF le médicament dans la matrice diluée en utilisant l'équation 1. Calculer le f u dans la matrice non diluée en utilisant l'équation 2 ( D = facteur de dilution de 10). 14
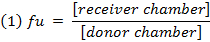
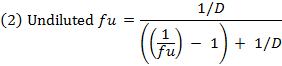
- Vérifier la récupération (masse) de chaque composé en utilisant l'équation 3 pour identifier les composés avec des problèmes de stabilité / métabolisme / liaison non spécifique.
NOTE: Le recouvrement tombe généralement entre 70% et 130%. 15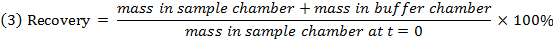
Résultats
À l'aide de ce protocole, nous avons testé des centaines de composés de développement de médicaments contre la tuberculose pour leur efficacité prédite à la casée pénétrante. La figure 1 permet de visualiser les concepts de base du dosage RED. La membrane de dialyse des inserts RED permet aux petites molécules non liées de se diffuser du puits du donneur au bien récepteur, atteignant finalement un équilibre entre les deux compartiments. Les petites mol...
Discussion
Les lésions et les cavités nécrotiques pulmonaires chez les patients infectés par la tuberculose contiennent des sous-populations de bactéries qui sont récalcitrantes au traitement médicamenteux. Les carottes caséoises de ces structures sont particulièrement responsables d'abriter ces persisters dans un environnement extracellulaire. 16 La répartition favorable des agents anti-bactériens dans ces endroits éloignés est considérée comme un déterminant important de l'efficaci...
Déclarations de divulgation
Il n'y a pas d'intérêts financiers concurrents.
Remerciements
Nous souhaitons remercier Johnson & Johnson, la TB Alliance, Astra Zeneca, Rib-X et Trius Therapeutics pour fournir bedaquiline, PA-824 (prétomanide), AZD5847, radezolid et tedizolid, respectivement. Brendan Prideaux, Matthew Zimmerman, Stephen Juzwin, Emma Rey-Jurado, Nancy Ruel, Leyan Li et Danielle Weiner ont soutenu l'analyse MALDI, les méthodes bioanalytiques, la préparation du substitut de la casum, la synthèse chimique et l'isolement de la casée de lapin. Ce travail a été mené avec le financement de la Fondation Bill et Melinda Gates, le prix # OPP1044966 et OPP1024050 à V. Dartois, Subvention d'instrumentation partagée NIH S10OD018072, ainsi que le financement conjoint de la Fondation Bill et Melinda Gates et Wellcome Trust pour un Centre d'excellence Pour l'optimisation du plomb pour les maladies du monde en développement à P. Wyatt.
matériels
| Name | Company | Catalog Number | Comments |
| New Zealand White Rabbits | Covance | - | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| THP-1 monocytic cell line | ATCC | ATCC TIB-202 | |
| 175 cm² TC-Treated Flask (T175) | Fisher Scientific | T-3400-175 | |
| RPMI 1640 media w/o glutamine | Fisher Scientific | MT-15-040-CV | |
| Hyclone Fetal Bovine Serum, Gamma irradiated | Fisher Scientific | SH3091003IR | |
| Hyclone L-glutamine, 200 mM | Fisher Scientific | SH3003401 | |
| Cellstar TC dish, 145 mm x 20 mm, vented | Fisher Scientific | T-2881-1 | |
| Phorbol 12-myristate 13-acetate (PMA) | Fisher Scientific | BP685-1 | |
| Ethylenediaminetetraacetic acid | Sigma | E6758 | |
| Oleic acid | Fisher Scientific | ICN15178101 | |
| Pierce RED Device Reusable Base Plate | Fisher Scientific | PI-89811 | |
| Pierce RED Device Inserts, 50/box | Fisher Scientific | PI-89809 | |
| Pierce RED insert removal tool | Fisher Scientific | 89812 | |
| Adhesive plate seal | Fisher Scientific | 08-408-240 | |
| PBS, pH 7.4, 10x 500 mL (Gibco) | Life Technologies | 10010-049 | |
| DMSO | Sigma | 472301 | |
| Acetonitrile | Sigma | 34998 | |
| Methanol | Sigma | 34860 | |
| Verapamil hydrochloride | Sigma | V4629 | |
| Diclofenac sodium salt | Sigma | 93484 | |
| Trypan Blue Solution, 0.4% | Fisher Scientific | 15-250-061 | |
| Ethanol, 200 proof | Fisher Scientific | 04-355-451 | |
| 2010 Geno/Grinder | SPEX SamplePrep | 2010 | |
| Bead Mill Homogenizer Accessory, Metal Bulk Beads | Fisher Scientific | 15-340-158 | |
| 484R Cobalt 60 Irradiator | JL Shepard | 7810-484-1 | |
| INCYTO C-Chip Disposable Hemacytometers | Fisher Scientific | 22-600-100 | |
| Upright Light Microscope | Leica | DM1000 | |
| Binary Liquid Chromatography system | Agilent | 1260 | Multi-compenent |
| Mass spectrometer | AB Sciex | 4000 |
Références
- Sacchettini, J. C., Rubin, E. J., Freundlich, J. S. Drugs versus bugs: in pursuit of the persistent predator Mycobacterium tuberculosis. Nat Rev Microbiol. 6 (1), 41-52 (2008).
- Zhang, Y. Persistent and dormant tubercle bacilli and latent tuberculosis. Front Biosci. 1 (9), 1136-1156 (2004).
- Aber, V. R., Nunn, A. J. Short term chemotherapy of tuberculosis. Factors affecting relapse following short term chemotherapy. Bull Int Union Tuberc. 53 (4), 276-280 (1978).
- Chang, K. C., Leung, C. C., Yew, W. W., Ho, S. C., Tam, C. M. A nested case-control study on treatment-related risk factors for early relapse of tuberculosis. Am J Respir Crit Care Med. 170 (10), 1124-1130 (2004).
- Dartois, V. The path of anti-tuberculosis drugs: from blood to lesions to mycobacterial cells. Nature Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Sarathy, J. P., et al. Prediction of Drug Penetration in Tuberculosis Lesions. ACS Infect Dis. 2 (8), 552-563 (2016).
- Waters, N. J., Jones, R., Williams, G., Sohal, B. Validation of a rapid equilibrium dialysis approach for the measurement of plasma protein binding. J Pharm Sci. 97 (10), 4586-4595 (2008).
- Singh, J. K., Solanki, A., Maniyar, R. C., Banerjee, D., Shirsath, V. S. Rapid Equilibrium Dialysis (RED): an In-vitro High-Throughput Screening Technique for Plasma Protein Binding using Human and Rat Plasma. J Bioequiv Availab. 14, 1-4 (2012).
- Liu, X., et al. Unbound drug concentration in brain homogenate and cerebral spinal fluid at steady state as a surrogate for unbound concentration in brain interstitial fluid. Drug Metab Dispos. 37 (4), 787-793 (2009).
- Able, S. L., et al. Receptor localization, native tissue binding and ex vivo occupancy for centrally penetrant P2X7 antagonists in the rat. Br J Pharmacol. 162 (2), 405-414 (2011).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: a failed host immune response. Open Biol. 1 (4), 1-14 (2011).
- Via, L. E., et al. Tuberculous Granulomas are Hypoxic in Guinea pigs, Rabbits, and Non-Human Primates. Infect Immun. 76 (6), 2333-2340 (2008).
- Kalvass, J. C., Maurer, T. S. Influence of nonspecific brain and plasma binding on CNS exposure: implications for rational drug discovery. Biopharm Drug Dispos. 23 (8), 327-338 (2002).
- Di, L., Umland, J. P., Trapa, P. E., Maurer, T. S. Impact of recovery on fraction unbound using equilibrium dialysis. J Pharm Sci. 101 (3), 1327-1335 (2012).
- Lenaerts, A. J., et al. Location of persisting mycobacteria in a Guinea pig model of tuberculosis revealed by r207910. Antimicrob Agents Chemother. 51 (9), 3338-3345 (2007).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon